肺内和肺外源性急性呼吸窘迫综合征血清炎症因子的比较
蒋金萍,张慧娟,陈 群,曹迎亚,鲁卫华
(皖南医学院第一附属医院 弋矶山医院 重症医学科,安徽 芜湖 241001)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种由多种致病因素损伤肺毛细血管内皮和肺泡上皮细胞,从而引起以呼吸窘迫和难治性低氧血症为主要表现的临床综合征[1]。近年来尽管对其病理生理认识及治疗方法不断进步,一项较新的研究调查显示ICU的ARDS患者的病死率仍可高达47%[2]。Gattinoni等[3]于1998年提出不同病因导致的ARDS在病理改变及机械通气治疗的疗效方面存在明显差异,对ARDS的治疗应分为肺内源性和肺外源性区别对待。肺内源性ARDS常由感染、误吸、肺挫伤等肺源性因素引起;而肺外源性ARDS多由脓毒症、急性重症胰腺炎、大量输血输液等肺外因素所致[4-5]。大量研究发现炎症介质大量释放引起肺呼吸膜破坏是ARDS发生发展的重要环节,本研究通过流式微球技术测定血清炎症因子水平在肺内源性和外源性ARDS中的差异,为临床诊治提供参考。
1 资料与方法
1.1 一般资料 选择2015年2月~2017年10月在我院重症监护病房接受机械通气的ARDS患者21例,记录患者临床诊断、性别、年龄等一般资料,并根据原发病因的不同分为肺内源性ARDS组(ARDSp组,11例)和外源性ARDS组(ARDSexp组,10例)。纳入标准:①研究方案经医院医学伦理委员会批准,所有患者签署研究知情同意书;②符合2012年ARDS诊断柏林标准[6],且需行机械通气治疗的患者。排除标准:①拒绝参与研究的患者;②存在影响肺脏功能的慢性疾病,如:结构性肺病、间质性肺病、心功能不全、风湿免疫性疾病及长期应用糖皮质激素药物史等。
1.2 方法 患者确诊ARDS后,立即采集静脉血5 mL置于-80℃保存直到检测。经离心后取上清液使用流式微球技术(CBA)测定血清中IL-8、IL-6、IL-1β、IL-10、TNF-α、IL-12p70的浓度。

2 结果
两组患者的性别、年龄等一般资料差异无统计学意义(P>0.05);两组血清中IL-6、IL-1β、IL-10、IL-12p70、TNF-α水平差异无统计学意义(P>0.05);ARDSexp组血清IL-8水平高于ARDSp组(P<0.05)。见表1、2。
表1 两组患者的一般资料

组别n性别(男/女)年龄/岁ARDSp组119/269.9±12.7ARDSexp组107/370.2±11.7t0.054P0.6350.957
表2 两组患者血清中各炎症因子水平 ng/L
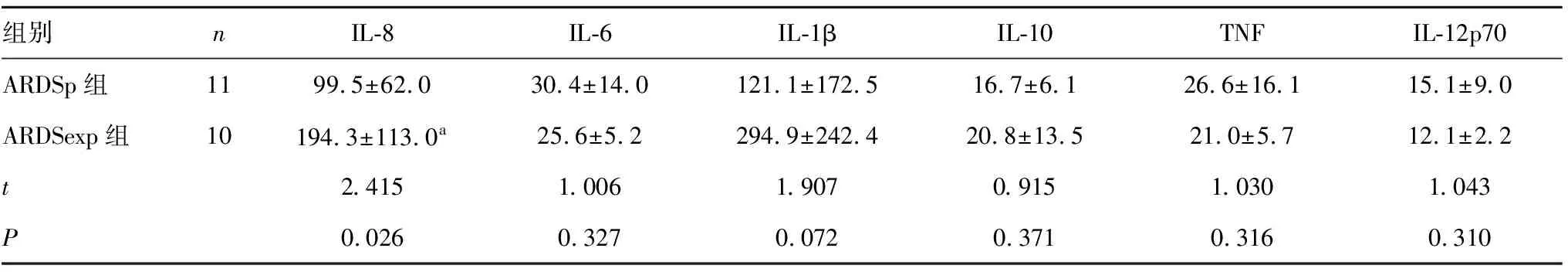
组别nIL-8IL-6IL-1βIL-10TNFIL-12p70ARDSp组1199.5±62.030.4±14.0121.1±172.516.7±6.126.6±16.115.1±9.0ARDSexp组10194.3±113.0a25.6±5.2294.9±242.420.8±13.521.0±5.712.1±2.2t2.4151.0061.9070.9151.0301.043P0.0260.3270.0720.3710.3160.310
注:与ARDSp组比较,aP<0.05。
3 讨论
近年来大多数学者认为ARDS的发生发展与细胞炎症因子密切相关,感染、创伤等因素诱发的全身炎症反应综合征(SIRS)是ARDS产生的本质原因[7]。炎症因子损伤肺泡Ⅱ型上皮细胞,导致肺泡内透明膜形成和肺不张,同时肺泡毛细血管损伤,通透性增加和微血栓形成,液体和蛋白渗出至肺间质和肺泡腔内,形成非心源性肺水肿[8-9],从而导致顽固性低氧血症。由于促炎细胞因子TNF-α、IL-1、IL-6等大量释放,抗炎细胞因子IL-4、IL-10等过度抑制,形成瀑布式级联反应,而肺是主要的靶器官,使机体的损伤信号进一步增大和加强,因此抗炎因子与促炎因子失衡是促使ARDS发生发展的主要原因[10-11]。有研究表明,ARDSp患者的支气管肺泡灌洗液中炎症因子水平高于ARDSexp患者的水平,而ARDSexp患者的血清中炎症因子水平则高于ARDSp[12]。据此认为肺内源性ARDS病理特征是肺泡上皮最先受到损伤,并激活肺泡巨噬细胞炎症反应链,导致肺内炎症反应加剧,病理变化以肺泡腔改变为主。而肺外源性ARDS首先表现为全身的炎症反应,肺外炎症介质通过循环系统进入肺内,损伤全身其他器官同时损伤肺组织,病理变化以肺间质水肿为主[13]。此外,研究也发现肺内源性和外源性ARDS的炎症因子水平可能与病情严重程度密切相关,且随着病情进展会处于动态变化之中[14-15]。
本研究提示IL-8在ARDS发生发展中发挥着重要作用。多项研究表明ARDS患者中IL-8水平越高,病情越重,预后越差[14,16]。IL-8属趋化因子家族,是巨噬细胞和上皮细胞等分泌的一类细胞因子,通过对中性粒细胞强大的激活和趋化作用而实现对炎症反应的调节,其能使中性粒细胞黏附于血管内皮细胞,大量向肺内聚集、激活并释放氧自由基、蛋白酶和多种炎症介质,引起肺毛细血管内皮细胞和肺泡上皮细胞损伤。有研究在动物实验中发现,IL-8浓度和中性粒细胞数量在ARDS组肺组织和血清中明显增加[17],表明IL-8可能激活中性粒细胞聚集并趋化中性粒细胞移行至肺内,引起肺部炎症反应。相关研究显示IL-8是通过与抗IL-8自身抗体相结合形成复合物发挥作用并受其调控,该复合物与免疫球蛋白IgG受体 FcγRⅡa结合抑制中性粒细胞凋亡,从而加剧肺部炎症反应[18]。最近有研究报道抗IL-8自身抗体/IL-8免疫复合物可作为预测和治疗ARDS的新指标[19]。也有研究显示IL-8主要通过趋化因子受体CXCR2产生作用,该受体可促进中性粒细胞迁移并穿透肺内皮细胞,导致肺泡毛细血管膜的损伤[20]。本研究并未采集不同时间段的血液标本,所以不能判断不同病情阶段ARDSp和ARDSexp患者外周血中炎症因子是否有变化及如何变化。
本试验通过炎症因子测定进一步揭示了ARDSp和ARDSexp之间不同病生阶段机制,有利于临床针对性治疗。研究结果显示ARDSexp组患者血清中IL-8浓度高于ARDSp组,原因可能为:ARDSexp首先表现为全身炎症反应,大量肺外的炎症因子通过血液循环进入肺内导致肺损伤,所以外周血中炎症因子在早期明显增高;ARDSp炎症反应主要发生在肺内,炎症因子还局限在肺内释放,ARDS产生时还尚未发生全身炎症反应综合征,外周血中炎症因子变化不明显。本研究的不足点在于:①收集的样本量较少。②由于血清标本较易获取,因此本研究只测量了外周血中的炎症因子浓度,未对两组患者的支气管肺泡灌洗液中各炎症因子的水平进行检测。③ 本研究只检测了ARDS患者一个阶段的炎症因子水平,动态监测这些指标对于发现问题可能更有意义。
综上所述,本研究结果表明肺内外源性ARDS病理生理特征存在差异。肺外源性ARDS患者血清中IL-8浓度高于肺内源性患者,监测血清IL-8水平对指导ARDS患者的治疗和预后有一定指导意义。

