蒙脱土-稻壳炭复合材料对Pb(Ⅱ)吸附特性研究
谢 厦,罗文文,王 农,徐应明,孙约兵 *
(1.农业部环境保护科研监测所,农业部产地环境污染防控重点实验室,天津 300191;2.农业部环境保护科研监测所,天津市农业环境与农产品安全重点实验室,天津 300191)
铅(Pb)是一种对环境和人体危害性极大的重金属,极难被生物降解而在食物链内不断积累,不仅损害生物体的肾脏、肌肉、骨骼、神经、血液循环系统,而且对生态系统产生巨大危害[1-2]。其来源主要包括自然风化过程以及矿山开采、蓄电池产业、粉末冶金、化学试剂等人为活动[2-3]。目前,Pb等重金属污染土壤的修复治理技术主要包括物化修复(土壤置换、电动修复、淋洗和钝化等),农艺生态修复(间作套作、有机肥或水分调节等)和生物修复(植物修复、土壤动物修复和微生物修复)[4-6]。其中,钝化修复法因效果好、成本低、操作简便、绿色环保等优点而逐渐被广泛应用[7]。常用的钝化吸附剂种类包括无机、有机以及新型有机-无机复合材料等,近年来,研究者们对一些价格低廉、储量丰富的吸附剂如一些生物质材料及海泡石、蒙脱石等黏土矿物进行了大量研究,发现它们能有效钝化土壤重金属,降低其生物有效性。
生物质材料来源广泛,包括农业副产物及废弃物(稻壳、锯末、秸秆等),微生物类(菌类、藻类等),动物粪便及改性材料[8-11]。我国每年稻壳的产量巨大,且其具有多孔性、密度小、质地粗糙等优点[12-13]。利用稻壳或改性稻壳做吸附剂修复重金属污染可实现巨大的经济效益和生态效益。车晓冬等[14]用微波加热以及硝酸氧化活化来改性稻壳基生物质炭,测得其对浓度为25 mg·L-1的Pb2+吸附量为0.13 mmol·g-1;耿勤等[15]以稻壳为原料制备的生物质炭,投加量为0.2~0.5 g时对25 mg·L-1Cd2+溶液中Cd2+的去除率达82.89%~90.79%。
蒙脱石为2∶1型黏土矿物,晶体结构是两个硅氧四面体夹一层铝氧八面体,层间阳离子多为Ca2+、Na2+、Mg2+等水化离子,比表面积较大,且离子交换及同晶置换能力强,吸附周期短、生化稳定性好,这些特性使其对重金属离子有良好的吸附性能[16],而且易于进行插层反应。史明明等[17]研究认为蒙脱石对重金属离子的吸附主要由层间离子交换和表面离子吸附两部分组成;某些情况下重金属离子还可能在其表面发生沉淀吸附。李芳蓉等[18]利用黄原酸化膨润土吸附Cu2+的研究表明,Cu2+起始浓度为80 mg·L-1、pH=6、膨润土用量2 g·L-1时,其对Cu2+的去除率最高达99.9%;Akpomie等[19]将酸改性的蒙脱土用于汽车废水中重金属的吸附研究,发现酸改性后蒙脱石表面结构得到极大改善,其对Pb、Cd等重金属的吸附量显著增加。
近几年,国内外已有一些将生物炭与黏土矿物进行复合制备用于水中污染物去除的实验研究,Fosso-Kankeu等[20]将膨润土与高粱渣生物炭复合,发现其对Cr(Ⅵ)吸附量有所增加;Zhang等[21]制备蒙脱石-麦秸生物炭复合材料,发现该材料比表面积和孔体积大幅增加,对诺氟沙星的饱和吸附量从10.58 mg·g-1增加到25.53 mg·g-1,证明了该吸附过程的主要吸附机制是静电作用、氢键和孔隙填充;Yao等[22]开发出一种新型工程生物炭,将蒙脱土或高岭石颗粒分布在生物炭基质中的炭表面上,结果表明,炭表面上黏土颗粒的存在显著增加了生物炭对亚甲基蓝的吸附能力,吸附过程主要为离子交换(黏土)和静电作用(生物炭)。这些研究都可说明黏土与生物炭制备的复合材料可作为一种有潜力的吸附剂来去除水溶液中的污染物。
本文以蒙脱土-稻壳生物炭为Pb2+吸附材料,研究了该吸附材料对Pb2+的吸附动力学和热力学特性,讨论了不同影响因素(吸附剂用量、离子强度及pH)对该复合材料吸附Pb2+的影响,以期为Pb污染土壤修复提供关键材料储备。
1 材料与方法
1.1 材料及制备
实验用稻壳经水洗、烘干后备用,蒙脱土为浙江丰虹公司生产的DK2型蒙脱土,硝酸铅、硝酸镁均为天津市光复精细化工研究所生产的分析纯试剂,硝酸钙为山东西亚化学股份有限公司生产的分析纯试剂,实验用水为自制超纯水。
稻壳炭的制备:将稻壳与质量分数为55%的ZnCl2溶液1∶1(m/V)均匀混合,放入105 ℃恒温干燥箱中干燥和初步炭化,然后将其置于马弗炉以10℃·min-1速率升温至500℃,保持60 min,之后以200 mL·min-1的流量通入保护气N2使冷却至室温,最后用超纯水冲洗,干燥,过筛备用。
插层:按1∶30(m/V)将蒙脱土加入到蒸馏水中搅拌2 h,将相同质量的稻壳炭加入到浓度为6%的NaOH溶液中1∶30(m/V),搅拌30 min形成均匀悬浊液,将稻壳炭悬浊液缓慢加入蒙脱土悬浊液中,60℃反应6 h,离心水洗至中性,烘干,研磨细化过100目筛备用。
1.2 吸附实验
1.2.1 吸附动力学实验
称取1 g蒙脱土-稻壳生物炭置于1 L初始Pb2+浓度为50 mg·L-1Pb(NO3)2溶液中,室温(25 ℃)下,用磁力搅拌器以750 r·min-1连续搅拌24 h,在不同时间用针筒注射器取样,过0.45 μm滤膜后用火焰原子吸收光谱分析仪(2EEnit7009)测定溶液中Pb2+浓度。
1.2.2 吸附热力学实验
称取0.05 g复合材料分别置于一系列50 mL不同浓度(50、100、150、300、500 mg·L-1)的Pb2+溶液中,在180 r·min-1,温度分别为20、25、40 ℃的恒温培养振荡箱中振荡4 h,过0.45 μm滤膜后用火焰原子吸收光谱分析仪(2EEnit7009)测定上清液中Pb2+浓度,并计算相应的吸附量,用于吸附平衡等温线的拟合。
1.2.3 吸附影响因素实验
分别称取不同质量(0.006、0.010、0.025、0.050、0.100 g)复合材料置入50 mL初始Pb2+浓度为50 mg·L-1的Pb(NO3)2溶液中,室温(25 ℃)、180 r·min-1条件下,恒温培养振荡箱中振荡4 h,过0.45 μm滤膜后测定溶液中Pb2+浓度。
称取0.050 g复合材料置于50 mL初始Pb2+浓度为 50 mg·L-1的Pb(NO3)2溶液中,分别用稀硝酸和稀氢氧化钠调节pH为设定值(2.0~6.0),室温(25℃)、180 r·min-1条件下,在恒温培养振荡箱中振荡4 h,过0.45 μm滤膜后测定溶液中Pb2+浓度。同时以不加复合材料,只调节了溶液pH的处理作为对照实验。
将0.050 g复合材料置于50 mL初始Pb2+浓度为50 mg·L-1的 Pb(NO3)2溶液中,分别在不同 Ca2+、Mg2+离子浓度(20、50、100、150和200 mg·L-1)时,在室温(25℃)、180 r·min-1条件下,用恒温培养振荡箱振荡4 h,过0.45 μm滤膜后测定溶液中Pb2+浓度。
1.3 数据处理
蒙脱土-稻壳生物炭复合材料对溶液中的Pb2+吸附量和去除率分别为:
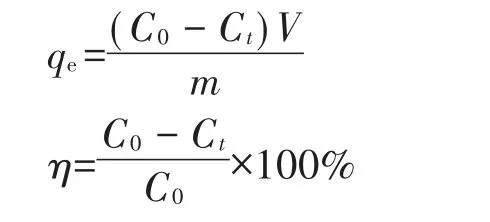
式中:m为吸附剂用量,g;V为溶液总体积,L;C0和Ct分别为初始Pb2+浓度及t(min)时刻溶液中Pb2+的剩余浓度,mg·L-1。
实验均进行3次平行,数据处理均独立重复3次,以其平均值作为测定结果,Microsoft Excel 2007进行数据计算,OriginPro8作图。
2 结果与讨论
2.1 复合材料对Pb2+的吸附动力学
为研究复合材料吸附溶液中Pb2+的吸附机制,通常采用准一级动力学模型(Pseudo-first-order)和准二级动力学模型(Pseudo-second-order)进行实验数据的拟合,两种动力学方程分别为:
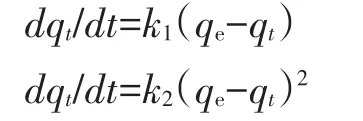
式中:t为吸附时间,min;k1为准一级动力学模型速率常数,min-1;k2为准二级动力学模型速率常数,g·mg-1·min-1;qt、qe分别为复合材料在 t时刻、吸附平衡时每单位质量复合材料吸附Pb2+的量,mg·g-1。

图1 复合材料对Pb2+的吸附动力学Figure1 Adsorption kinetics of Pb2+by composites
吸附过程中,接触时间是影响吸附能力的重要因素,由图1可知,复合材料对Pb2+的生物吸附分为两个阶段:快速吸附阶段和吸附平衡稳定阶段。开始随着时间的增加复合材料对Pb2+的吸附量迅速增加,2 h内吸附已完成平衡吸附量的80%,4 h后吸附逐渐趋于稳定。继续延长反应时间,蒙脱土-稻壳炭复合材料对Pb2+的吸附量及吸附速率变化不大,说明达到吸附平衡,此时最大吸附量为27.17 mg·g-1,也可知该复合材料吸附去除水中Pb2+的最佳时间是4 h。快速吸附过程主要是吸附质Pb2+附着于材料外表面和部分微孔内表面形成单分子层或多分子层的过程,此过程速度快,主要为离子交换和物理吸附。慢速吸附阶段是由于吸附时间延长,Pb2+占据吸附剂表层大部分吸附位点,溶液中游离Pb2+开始向吸附剂内部扩散,且此过程中吸附质受到的传质阻力逐渐变大,相应的吸附速率会逐渐降低,且主要由扩散速率控制[14]。
吸附过程中的动力学研究可用来描述吸附剂对吸附质吸附的速率快慢,探究吸附机制。准一级动力学方程假设吸附速率主要由扩散过程控制,准二级动力学方程假设吸附速率受化学吸附控制。由表1的相关参数可知,准二级动力学方程的数据对复合材料吸附Pb2+过程拟合出的R2达到0.949 5,且初始浓度为50 mg·L-1的Pb2+溶液得到的理论平衡吸附量qe值(27.51 mg·g-1由动力学方程拟合得出)和实验测定的qe值(27.17 mg·g-1)很接近,说明准二级动力学模型更能准确描述复合材料对Pb2+的吸附过程。由准二级动力学方程建立的机理,也可推测出复合材料吸附Pb2+的反应是化学吸附与物理扩散共存的复杂的吸附过程,但以化学吸附为主[23-24]。吸附过程中吸附速率与吸附驱动力的平方值成正比,复合材料和吸附质Pb2+之间可能是由于共用或交换电子而形成共价键或离子交换而发生吸附[25]。

表1 复合材料对Pb2+吸附动力学相关参数Table1 Kinetic and thermodynamic parameters of Pb2+adsorption
2.2 复合材料对Pb2+吸附等温方程
本实验分别采用Langmuir、Freundlich两种等温式进行不同温度(10、25、40℃)下吸附等温线拟合:

式中:qe为平衡吸附量,mg·g-1;Qm为饱和吸附量,mg·g-1;Ce为平衡浓度,mg·L-1;KL为 Langmuir吸附常数,L·mg-1;KF为Freundlich吸附常数,mg·g-1·(L·mg-1)1/n;1/n为吸附强度或吸附剂表面的不均匀程度。
两种吸附等温线方程对实验数据进行拟合的结果见图2。两种热力学模型拟合的相关参数如表2和表3所示。
Langmuir吸附等温模型的吸附机理主要包括:吸附反应为单分子层吸附过程;固体吸附剂表面均匀分布着吸附能力相同的吸附位点,每个位点只吸附一个分子且被吸附分子间无相互作用力;吸附热是温度的函数,不随覆盖程度而改变;吸附平衡指吸附速率与解吸速率相等时的动态平衡,由Langmuir吸附等温模型可知,最大吸附量为吸附剂表面吸附的吸附质达到饱和时的吸附量[26],由表2可看出,该复合材料常温下对Pb2+饱和吸附量可达到92.51 mg·g-1。
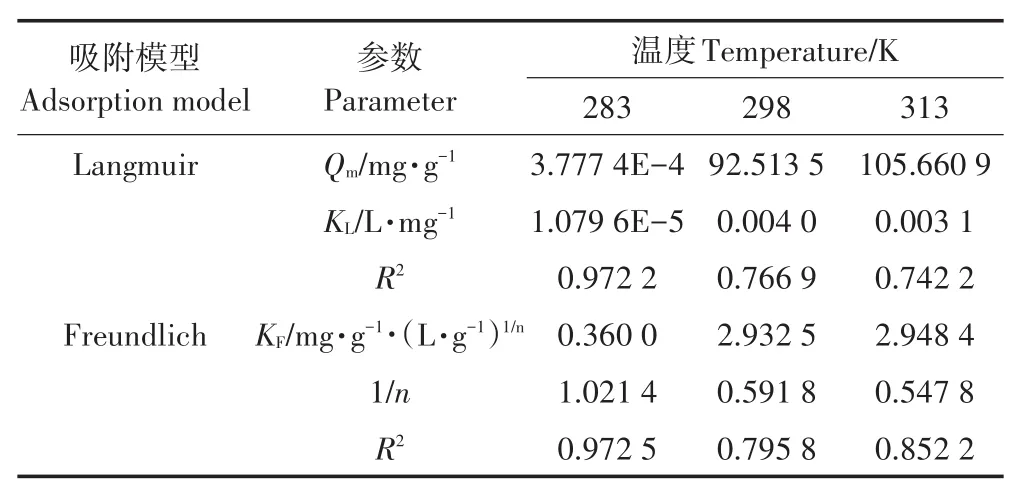
表2 Langmuir和Freundlich吸附等温式相关参数Table2 Parameters of Langmuir,Freundlich isotherm equation fitting for Pb2+
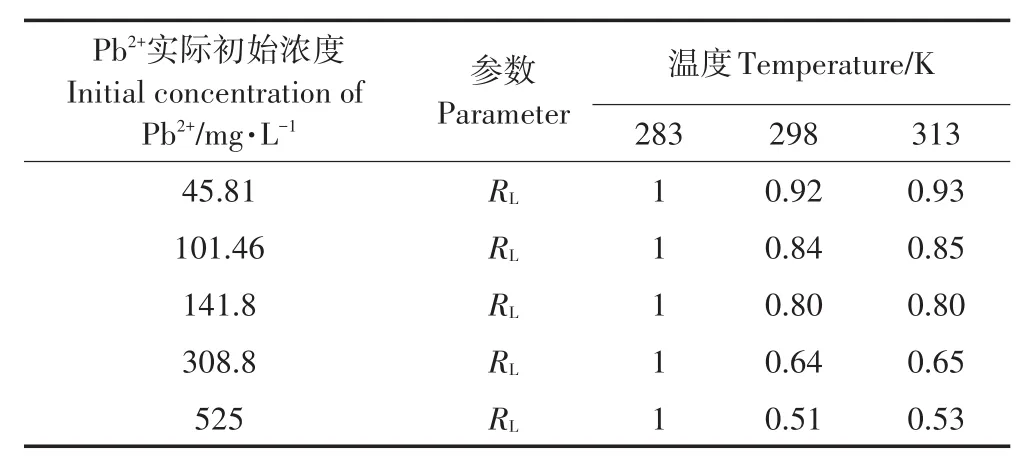
表3 Langmuir吸附等温式分离系数Table3 Separation factor of Langmuir isotherm equation fitting for Pb2+
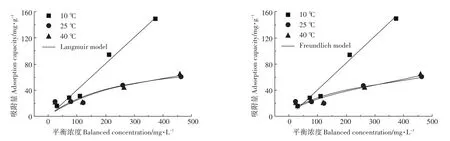
图2 复合材料对Pb2+的吸附等温线Figure2 Isotherm fitting of Pb2+on composites
在Langmuir等温式拟合计算时,吸附是否有利的主要判断依据就是RL(方程的无因次分离因子):
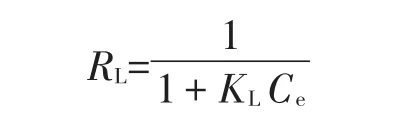
式中:KL为吸附等温特性的吸附参数,L·mg-1,Ce为金属离子初始浓度,mg·L-1。RL>1时,表示吸附过程为不利吸附;RL=1表示该吸附过程为线性吸附;0<RL<1表示该吸附过程为有利吸附[27]。由表3数据可知,本研究中283 K时RL=1,298 K和313 K时0<RL<1,说明蒙脱土-稻壳炭复合材料对Pb2+吸附过程低温时接近线性吸附,但常温与高温时主要为有利吸附,且高温时比低温时拟合得到饱和吸附量更大一些,可能是温度的升高有利于分子热运动,使重金属离子与吸附剂表面活性位点的接触几率增大而更易被吸附。
Freundlich吸附等温方程主要用来描述非均匀表面吸附体系的多层吸附经验模型,吸附平衡常数的值一定程度上取决于吸附剂表面覆盖程度(1/n),由Freundlich吸附等温方程拟合得到的1/n>1说明吸附反应不易发生;1/n若在0~1之间则说明该吸附反应易于发生[12,28]。
由表2可知,相比之下,该吸附过程能更好地以Freundlich等温吸附方程进行拟合,表明复合材料对溶液中Pb2+吸附为多层吸附,且蒙脱土-稻壳炭复合材料为异质表面,具有分布不均匀的吸附位点,这可能是由稻壳炭与蒙脱土的表面结构不一致所导致。本实验得出的1/n<1,表明复合材料对溶液中的Pb2+的吸附易于发生。由表2还可看出,KF随温度的升高而增大,表明吸附量随温度的升高而增大;1/n随着温度的升高而减小,表明随温度的升高,吸附过程的推动力在增大。
在与天然或改性的相关吸附材料(表4)进行吸附量比较后,可以看出本研究制备的蒙脱土-稻壳炭复合材料对Pb2+的吸附容量要大于天然蒙脱土、稻壳灰、膨化稻壳等,表明蒙脱土与稻壳炭的插层改善了单一材料的吸附性能,该复合材料可以作为一种有潜力的重金属吸附材料。
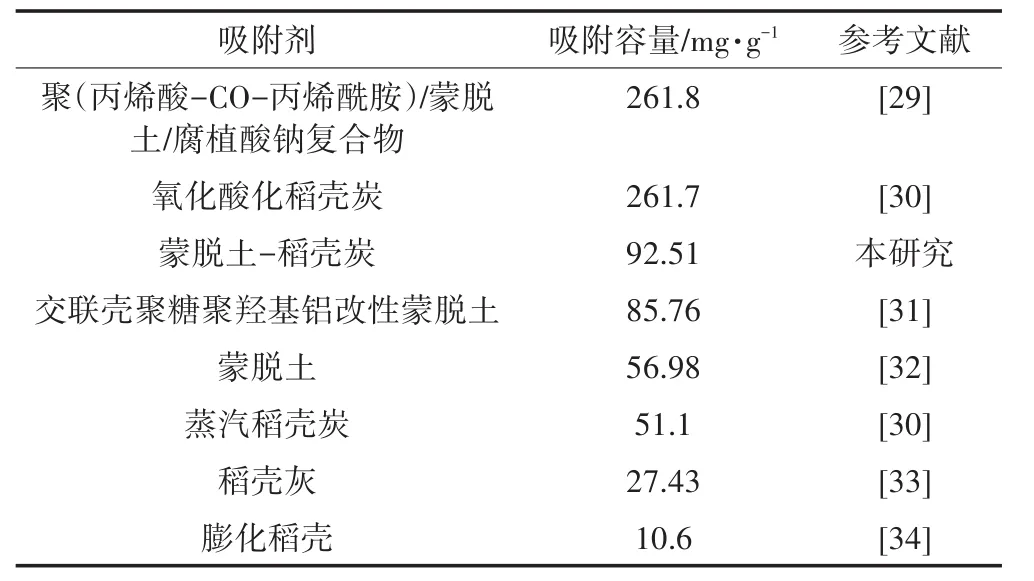
表4 稻壳、蒙脱土及其复合材料对Pb2+的吸附容量Table4 Adsorption capacity of Pb2+on rice hull,montmorillonite and related composites

表5 复合材料对Pb2+吸附热力学相关参数Table5 Thermodynamic parameters of Pb2+adsorption by composites
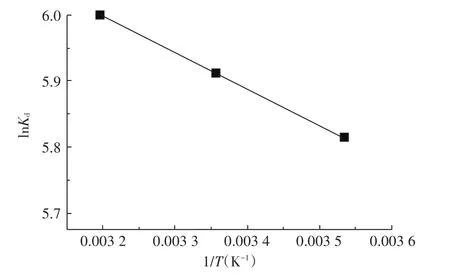
图3 不同温度对平衡吸附系数的影响Figure3 Effect of temperature on equilibrium adsorption coefficients
2.3 复合材料对Pb2+的吸附热力学
吸附反应的热效应是吸附过程中的重要热力学参数,由吸附热大小可以判断吸附反应的强弱,一般通过吸附反应的3个参数[吉布斯自由能变化(ΔG)、焓变(ΔH)、熵变(ΔS)]对吸附过程进行热力学分析。
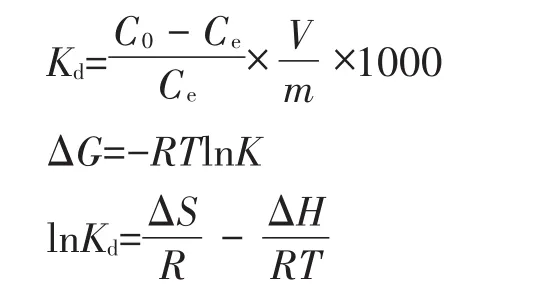
式中:Kd为分配系数,mL·g-1;C0为初始浓度,mg·L-1;Ce为平衡浓度,mg·L-1;V为溶液体积,L;m为物料质量,g;R为气体常数,8.314 J·mol-1K-1;T为开氏温度,K。根据上式,以lnKd对1/T作图(图3),根据线性回归分析得到的截距和斜率的数值可分别算出ΔS和ΔH的值;ΔG的值由公式直接计算。计算所得的热力学参数见表5。
由表5可知,3个不同温度下ln Kd值变化不大,说明温度的小幅度改变对该吸附过程影响不大;ΔG<0,且随温度升高ΔG值变小,说明蒙脱土-稻壳炭复合材料对Pb2+的吸附反应是自发过程,且升高温度有利于复合材料对Pb2+的吸附,与动力学分析结果一致。有研究[35-36]表明,通过吉布斯自由能变化值可推断吸附机制:ΔG在-80~-400 kJ·mol-1范围时,吸附过程主要是化学性吸附,ΔG在-20~0 kJ·mol-1范围时,吸附过程主要是物理性吸附。本实验中3个温度下的ΔG都在-20~0 kJ·mol-1范围内,可判断该吸附反应主要为非专性吸附,吸附机制主要为静电引力作用与孔隙填充。从表中数据看出,焓变值ΔH>0,表明该吸附过程在自然条件下是吸热反应,吸附量随温度的升高而增加,该判断也与吸附等温线的拟合结果一致。熵变值ΔS>0,表明该复合材料与Pb2+溶液构成的固-液体系吸附过程无序度增大,为熵增的自发反应过程。
2.4 复合材料对Pb2+吸附性能的影响因素分析
2.4.1 复合材料投加量对Pb2+吸附性能的影响
由图4可看出,在50 mL初始Pb2+浓度为50 mg·L-1溶液中,随着复合材料投加量的增加,其对Pb2+的去除率总体上呈现逐渐上升的趋势,在复合材料加入2.0 g时,其对Pb2+的去除率达到最大值72%;但是复合材料对Pb2+的单位吸附量(吸附离子量/吸附剂加入量)则呈逐渐下降的趋势,当加入复合材料0.006 g时吸附量最高为40.91 mg·g-1。这表明吸附剂投加量的增加可以提高其对Pb2+的吸附率,但随着溶液中Pb2+浓度的相对减少,吸附剂对金属离子的单位吸附量也会相对减少。原因可能是随着吸附剂投加量的增大,蒙脱土-稻壳炭复合材料的相对比表面积和吸附位点数量增加,其对Pb2+吸附量的绝对值也增大,因此其对Pb2+的去除率相对增大。同时,随复合材料投加量的增加,溶液中Pb2+的浓度相对下降,吸附剂的一些吸附位点未达到吸附饱和而表现为其对Pb2+单位吸附量减少[37]。
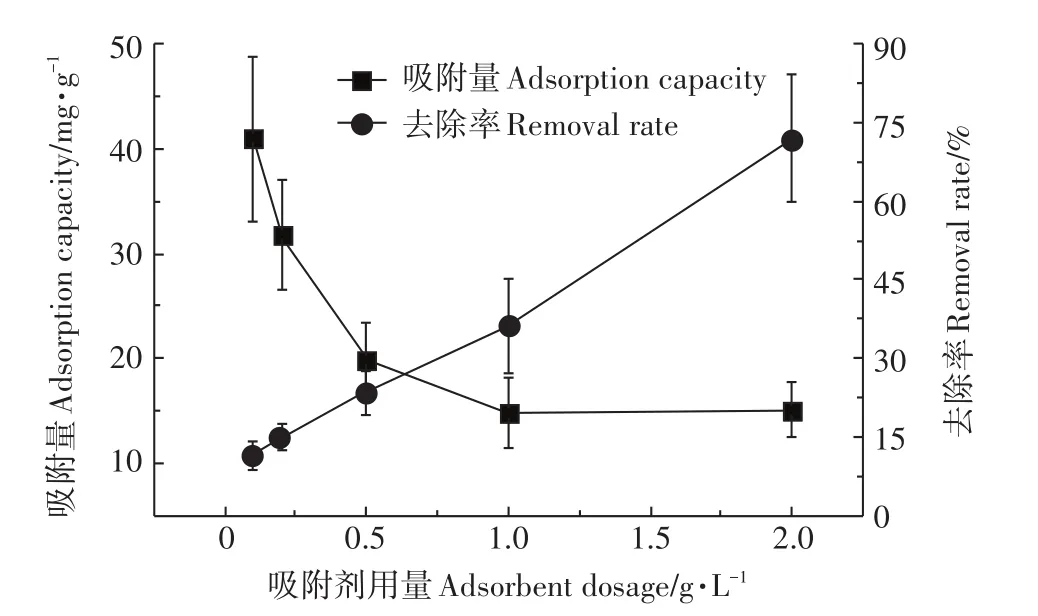
图4 不同吸附剂用量对Pb2+吸附性能的影响Figure4 Influence of different dosage of adsorbent on Pb2+adsorption

图5 pH对Pb2+吸附性能的影响Figure5 Effect of different pH on Pb2+adsorption
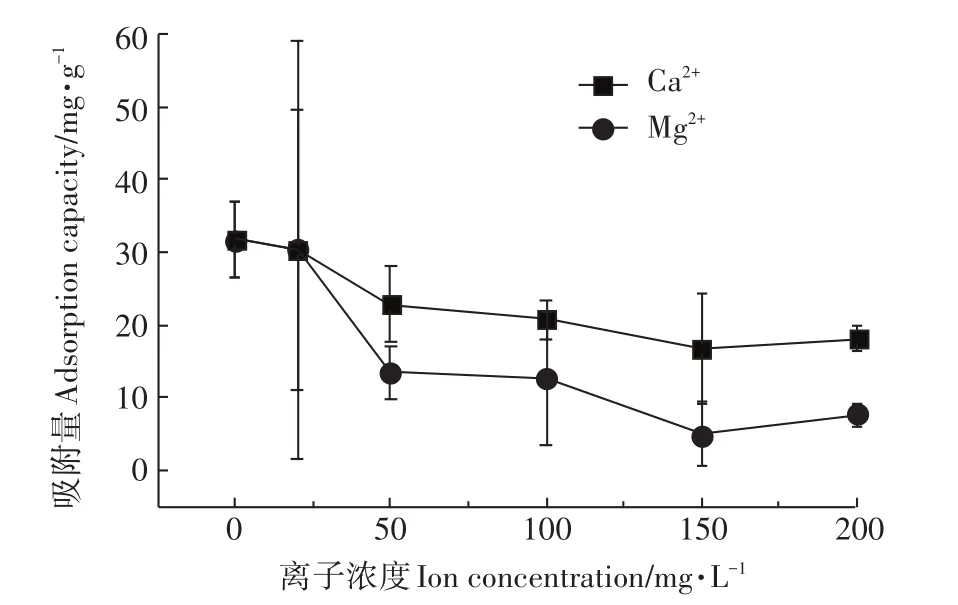
图6 共存离子对Pb2+吸附性能的影响Figure6 Effect of different co-existing ions on Pb2+adsorption
2.4.2 pH改变对Pb2+吸附性能的影响
溶液中Pb的形态在pH小于6范围几乎只以游离Pb2+形式存在,为了避免Pb2+形态的损失[38],实验pH范围定为2~6。由图5可看出,在50 mL初始Pb2+浓度为50 mg·L-1溶液中,当溶液pH值由2增加到5时,复合材料对Pb2+吸附量随着pH值的增大整体呈缓慢增加的趋势,但pH由5增加到6时复合材料对Pb2+吸附量略有下降,其中未作酸碱处理的Pb2+溶液中(pH=5时),吸附剂对Pb2+有较大吸附量达到52.79 mg·g-1,可见强酸条件并不利于复合物对Pb2+的吸附,即说明复合材料对Pb2+吸附的最佳pH为5。这可能是因为:在pH值较低时,溶液中存在着大量的H+,这些H+占据吸附剂表面的活性位点而与Pb2+竞争吸附导致吸附量降低,随着pH值上升,溶液中H+浓度降低,吸附剂周围OH-增多,Zeta电位的负值增大,复合材料与Pb2+之间的静电作用力增强,H+的竞争吸附能力下降,致使复合材料对Pb2+的吸附量有所增加[39]。
2.4.3 共存离子对Pb2+吸附性能的影响
如图6所示,溶液中未加入Ca2+、Mg2+时,蒙脱土-稻壳炭复合材料对Pb2+的平衡吸附量为31.80 mg·L-1,当分别加入不同质量的Ca2+、Mg2+之后,复合材料对Pb2+的吸附量均呈现降低趋势,所以可得出不同浓度Ca2+或Mg2+的存在均会对Pb2+的吸附过程产生抑制作用,且相比之下Mg2+存在时吸附剂对Pb2+吸附量减小得更显著,说明Ca2+、Mg2+在浓度相同情况下,Mg2+的存在对Pb2+吸附的抑制作用更强,主要因为金属离子间的竞争吸附能力与金属离子电荷、水合离子半径有关[40-41]。一般金属离子所带电荷数相同时,水合离子半径较小者更易被吸附。同为二价阳离子,水合离子半径Mg2+远小于Ca2+,因此Mg2+竞争吸附能力更强,对吸附剂吸附Pb2+的抑制作用也就更强。当Ca2+或 Mg2+浓度在 0~150 mg·L-1范围时,二者对 Pb2+吸附过程的抑制作用均会随其浓度的增加而增强,导致Pb2+吸附量逐渐减少;但 Ca2+或 Mg2+在 150~200 mg·L-1浓度范围时,随着浓度的增加,其对Pb2+吸附过程的抑制作用有所减弱,所以复合材料对Pb2+的吸附量有所提高。
3 结论
(1)蒙脱土-稻壳炭吸附等温方程和动力学方程的拟合结果分别符合Freundlich吸附等温线和准二级动力学模型,且该吸附反应为有利吸附,比较容易发生。
(2)热力学参数ΔG<0、ΔH>0、ΔS>0,是自发吸热的多层非专性吸附过程。
(3)复合材料对Pb2+的去除率随投加量的增加而增大,但对Pb2+的单位吸附量则呈逐渐下降的趋势;复合材料对水溶液中Pb2+的吸附性能最佳pH为5,此时吸附量达到52.79 mg·g-1;溶液中不同浓度Ca2+、Mg2+的存在均会抑制吸附剂对Pb2+的吸附,且Mg2+的抑制作用更强。

