外泌体形成分泌调控及其在肿瘤发生发展中的作用
翁新宪,周 转,张治宝,2,廖朝亮,杨力芳*
(1.中南大学肿瘤研究所,中国湖南长沙410078;2.中南大学湘雅医院,中国湖南长沙410008)
外泌体(exosome)是具有双层膜结构的胞外膜性囊泡,直径范围30~200 nm,电镜下呈现杯托样结构[1,2]。近年来的研究表明,肿瘤微环境与肿瘤的发生发展密切相关。肿瘤细胞不仅可以通过细胞与细胞直接接触或释放可溶性细胞因子的方式发挥功能,还可以通过分泌外泌体实现与肿瘤微环境中其他细胞之间的联系,介导多种生物学效应。外泌体载有特异性生物学物质,其中脂质成分包含有鞘脂、胆固醇、神经酰胺以及花生四烯酸和前列腺素等信号分子;常见的蛋白质包括膜转运和融合蛋白(GTP酶,膜联蛋白,flotillin)、四跨膜蛋白(CD9,CD63,CD81,CD82)、伴侣分子(Hsp70,Hsp90)、多囊内体合成蛋白(Alix,TSG101)、细胞骨架蛋白(Actin,Tubulin)和脂质相关蛋白质;此外,还涉及DNA、mRNA、microRNA、中间代谢产物等。这些物质不仅能反映其来源细胞类型,更重要的是,还与其来源细胞的生理功能或病理改变密切相关。外泌体与受体细胞融合,传递信息分子,诱发相关的信号通路,执行多种重要的生物学功能[3,4]。外泌体不仅具有细胞间物质转运和信息传递的生理功能,还具有促进肿瘤发生进展、免疫逃≥、血管生成、药物及放射抵抗等功能[5]。本文着重探究外泌体的形成、分泌机制及其在肿瘤发生发展研究中的进展。
1 外泌体形成机制
1.1 外泌体的形成
目前,对外泌体形成的机制已有比较充分的认识。首先,胞膜通过内吞作用形成小囊泡即内吞室,内吞室相互融合形成早期内体(early endosome,EE)并进入内体循环。随后,早期内体进一步成熟,转化为晚期内体(late endosome,LE),此时,内体膜返褶逆出芽形成腔内囊泡(intraluminal vesicle,ILV)[6,7]。富含ILV的内体称为多囊内体(multivesicular body,MVB)。含有 CD63、LAMP1、LAMP2以及晚期内体标志的MVB与细胞质膜融合,释放其内ILV至胞外,形成外泌体[8,9](图1)。外泌体形成机制主要有内体运输分选复合物(endosomal sorting complex required for transport,ESCRT)依赖和ESCRT非依赖两种形式(图2)。
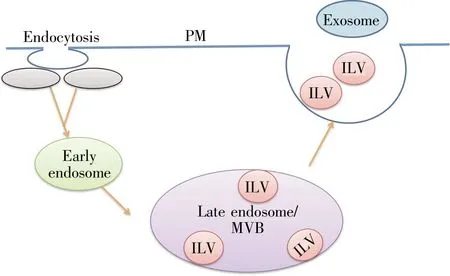
图1 外泌体形成与分泌过程PM:细胞膜;ILV:腔内囊泡;MVB:多囊内体。Fig.1 Exosome biogenesis and secretionPM:Plasma membrane;ILV:Intraluminal vesicle;MVB:Mul-tivesicular body.
1.2 ESCRT依赖的形成机制
外泌体形成过程中ESCRT募集泛素化的蛋白质到质膜上,促使MVB释放其内ILV至胞外。ESCRT在外泌体形成过程中的功能最初是从蛋白质组学的研究中提出[10]。ESCRT包含4种复合体及相关辅助蛋白质,ESCRT-0识别并募集大多数蛋白质,ESCRT-Ⅰ和ESCRT-域诱导出芽,ESCRT-Ⅲ促使囊泡分离,而辅助蛋白质(VTA1、ALIX、VPS4等)尤其是VPS4,r促使ESCRT之间发生不断分离和再结合的循环过程。这些物质在外泌体形成的过程中各显其能[11]。
相关研究发现,ESCRT-0的成员Hrs(hepatocyte growth factor-regulated tyrosine kinase substrate)能识别被泛素标记的蛋白质,并与ESCRT-0的另一组分信号转导配适分子(signal transducing adaptor molecule,STAM)相互作用。抑制Hrs表达[12~14],或者敲除STAM1[15],均能使外泌体的形成减少。此外,ESCRT-Ⅰ成员肿瘤易感基因101(tumor susceptibility gene 101,TSG101)的缺失也能使外泌体的形成量减少[16]。人们在乳腺癌中发现,ESCRT-Ⅲ成员CHMP4的缺失会使外泌体的形成减少[17]。这些研究充分说明了ESCRT在外泌体形成中的关键作用。
有研究报道,辅助蛋白质ALIX可促进内体出芽形成腔内囊泡从而增加外泌体的形成量[17]。但在HeLa-CIITA细胞中,敲除ALIX能够增加MHC class域在胞质中的积累,对外泌体的形成没有影响[15]。VPS4参与腔内囊泡形成的最后一步,促使膜或ESCRT-Ⅲ复合体的分离[18]。在HeLa-CIITA细胞中抑制VPS4B的功能可使外泌体的形成增多[15],然而,在乳腺癌细胞中同时沉默VPS4A和VPS4B之后exosome的形成增加,沉默VPS4A、VPS4B两者中任何一个,对exosome的形成没有太大影响[17]。在RPE1细胞中同时抑制VPS4A、VPS4B能抑制exosome的分泌[16]。这些研究提示以不同细胞为实验模型其外泌体生成存在异质性。
1.3 ESCRT非依赖的形成机制
近年来,研究者发现除了经典的ESCRT依赖机制,细胞还可以通过ESCRT非依赖机制辅助生成ILV及MVB,包括脂质、四跨膜蛋白家族分子或热休克蛋白(heat-shock protein,HSP)。Trajkovic等[19]首次证实了外泌体形成的ESCRT非依赖机制。他们在实验模型中敲降ESCRT,发现含有脂质蛋白(proteolipid protein,PLP)的外泌体能正常形成。中性鞘磷脂酶(neutral sphingomyelinase,nSMase)水解鞘磷脂生成神经酰胺(ceramide),进一步的研究发现抑制该酶的作用可减少神经酰胺的生成,进而降低MVB膜的内向生芽作用,减少外泌体的形成,提示神经酰胺以不依赖ESCRT的作用而形成外泌体。Kosakan和Chairoungdua团队应用nSMase抑制剂GW4869作用于HEK293细胞可减少内含PLP外泌体的分泌,其过程不依赖于ESCRT,而需要神经酰胺的合成[20,21]。胆固醇是MVB的一个重要组成成分[22],同时也富含于外泌体外膜[23]。在少突胶质细胞中,通过药物或基因诱导胆固醇在晚期MVB中累积,能促进包含flotillin-2、ALIX、CD63和胆固醇的外泌体分泌,这个过程依赖于flotillin-2[24]。磷脂酶D2(phospholipases D2,PLD2)能将磷脂酰胆碱水解成磷脂酸,研究报道外泌体的形成需要PLD2的参与[25,26]。
研究发现,四跨膜蛋白家族与外泌体内含物的分选有关。人们应用nSMase抑制剂GW4869作用肿瘤细胞系,观察到多种典型的外泌体蛋白质(CD63、CD81 或 TSG101)和 miRNA 的分泌减少[12,27]。在人黑色素瘤细胞中,CD63能分选黑色素蛋白使其进入ILV,这个过程既不依赖神经酰胺途径也不依赖 ESCRT 途径[28]。TSPAN8[29]和 CD81[30]也可分选一系列配体等进入外泌体。在HEK293细胞中,过表达CD9或CD82能促进外泌体形成[21]。
此外,分子伴侣HSP70可募集转铁蛋白受体(transferrin receptor,TFR)到外泌体中[31],并结合胞浆蛋白KFERQ,进一步将胞浆蛋白转运到ILV[32]。
以上信息提示,外泌体形成与ESCRT非依赖机制的关系是生命科学的热点之一,随着研究的深入,ESCRT非依赖机制辅助生成外泌体还需更多的实验来充分证实其功能效应。
2 外泌体的分泌调节
除了外泌体形成的调控机制外,外泌体分泌的调节也是一个重要的科学问题。研究发现,细胞内形成MVBs后,不同亚群的MVBs有不同的降解途径,分泌型MVB与细胞质膜融合释放外泌体;降解型MVB与溶酶体融合,导致MVB及其内含物降解[8]。近年来,对外泌体分泌至胞外过程的研究逐渐增多,其主要依赖Rab家族[33]和SNARE家族的协助作用(图2)。
2.1 Rab家族与外泌体分泌
Rab蛋白是存在于质膜和细胞器膜中的一类调节型的小分子,是鸟苷酸三磷酸酶(GTPase)结合蛋白Ras超家族中最大的亚家族,能调控囊泡转运的不同阶段,比如囊泡的出芽、囊泡和细胞内细胞器的运动、囊泡的衔接,从而促进膜的融合。Rab蛋白作为胞内的运输蛋白质,在调控胞吞和胞吐过程中发挥重要作用[34]。
蛋白质组学分析发现外泌体中含有Rab家族蛋白[10]。第一个报道与外泌体分泌相关的Rab蛋白是Rab11,在白血病研究中发现,Rab11能调控外泌体分泌[35],过表达Rab11突变质粒,外泌体分泌减少[36]。在中性粒细胞[37]和原代少突胶质细胞[38]中,人们发现抑制Rab35的表达能减少外泌体分泌。后续在人RPE1细胞中也证实外泌体分泌需要Rab11或Rab35的参与[16]。在HeLa细胞中,沉默 Rab2B、Rab5A、Rab9A、Rab27A、Rab27B均能减少外泌体分泌,其中Rab27A和Rab27B的缺失减少效应更明显,而Rab11A或Rab7的缺失对外泌体分泌无影响[39]。但是在MCF-7细胞中,包含同线蛋白和ALIX的外泌体分泌却需要Rab7 的参与[17]。在黑色素瘤[40]、乳腺癌[41]中沉默Rab27A,外泌体分泌减少。而在人乳腺癌细胞MDA-MB-231中,Rab27A的缺失并不会减少外泌体分泌,但是同时敲除Rab27A和Rab27B会减少外泌体分泌[42]。大量研究证实Rab家族在外泌体膜融合过程中起重要作用,这为后续探索外泌体分泌的研究者们提供了思路。
2.2 SNARE家族与外泌体分泌
可溶性NSF附着蛋白受体(soluble NSF-attachment protein receptor,SNARE)家族是外泌体分泌中另一个重要的调节分子,是由多种蛋白质组成的复合体。两个负载不同成分的细胞进行精准对接之后,SNARE有助于脂质双分子层融合[43]。在不同类型的细胞中,SNARE蛋白SNAP-23、VAMP-7和VAMP-8参与钙离子调控的溶酶体分泌物与细胞膜的融合[44~46]。在HEK293细胞中,SNARE蛋白复合体中的Ykt6促进装载成形素WNT3A的外泌体分泌[13]。在果蝇MVB中,人们也检测到Ykt6蛋白的存在[47]。研究报道,突触融合蛋白1A(syntaxin 1A,STX1A)也能作用于外泌体分泌机制[48]。由于SNARE介导细胞器膜融合的异质性,其作用还需在多个模型中验证。
2.3 其他
Hyenne等[49]在秀丽隐杆线虫和乳腺癌细胞中发现,Ral-1(Ras-related GTPase)定位于MVB膜表面,与MVB的形成、MVB和细胞膜的融合有关。该课题组还发现Ral-1的下游蛋白质——突触融合蛋白5(syntaxin 5,STX5)在MVB膜与细胞膜融合的过程中也同样发挥重要的作用,敲除STX5之后,MVB外膜不再与细胞膜融合,使得MVB在细胞内累积,与此同时,该过程需要RalA、RalB的参与。Yang等[50]在MCF-7细胞中发现,Rab3D能促进外泌体分泌。在T细胞中过表达甘油二酯激酶α(diacylglycerol kinaseα,DGKα)能抑制外泌体分泌,而遏阻DGKα的表达r能促进外泌体分泌[51],提示DGKα是MVB形成的负调控因子。总之,细胞中可能还存在许多效应分子与外泌体分泌调控有关,更深入探讨跨膜分泌、细胞外分泌等途径机制,将有助于对外泌体的全面认识。
3 受体细胞摄取外泌体的机制
外泌体形成分泌至胞外后被受体细胞摄取的过程也涉及到多种调节机制。外泌体表面分子与受体细胞质膜表面分子特异性结合介导了其与受体细胞的融合。研究证明,连接蛋白如整合素蛋白、细胞黏附分子能调控外泌体与受体细胞膜融合。比如:树突状细胞膜上LFA-1分子可与外泌体表面的ICAM-1特异结合[52],肿瘤细胞来源的外泌体表面表达的TSPAN8可与内皮细胞或前列腺癌细胞的ICAM-1结合[52],受体细胞表面CD169可与外泌体中高水平配体α2,3连接的唾液酸结合[53],肿瘤细胞产生的外泌体所表达的硫酸肝素糖蛋白可被受体细胞识别[54],巨噬细胞膜上的半凝素-5可识别红细胞来源的外泌体[55]。此外,受体细胞内化外泌体同样需要众多分子参与。研究发现,受体细胞内化外泌体通过dynamin、PI3-kinase和actin聚合3种方式进行[38,56]。外泌体是细胞间重要的交流方式之一,在受体细胞摄取外泌体的机制研究中,除了通过分子间特异性结合介导的外泌体摄取外,更多其他作用方式还有待进一步的探索。
4 外泌体在肿瘤发生发展中的作用
4.1 外泌体影响肿瘤细胞增殖和转移
近年来,大量研究发现外泌体通过转运不同的内含物调控受体肿瘤细胞的增殖和转移。黑色素瘤相关研究发现,高侵袭性的黑色素瘤细胞通过外泌体分泌MET蛋白使骨髓祖细胞向表达c-Kit、Tie2和Met的表型转化,并促进了肿瘤转移前龛的形成,从而增加黑色素瘤的转移[57]。鼻咽癌相关研究发现,LMP1阳性鼻咽癌细胞与阴性的细胞相比能够产生更多的外泌体,转运HIF1α蛋白至受体细胞,从而将高侵袭性的特性转运到受体细胞,促进鼻咽癌的侵袭转移[58]。KRAS是重要的致瘤蛋白[59],近期研究发现,大肠癌细胞可以通过外泌体在细胞间转运KRAS蛋白,从而加速受体细胞增殖[60]。外泌体外膜蛋白参与介导肿瘤细胞的转移倾向性。比如:乳腺癌细胞分泌的外泌体中富含整合素α6β4、α6β1 和αvβ5,分别作用于基质细胞、肺巨噬细胞和肝脏库普佛细胞,可促进Src活化和促炎症S100基因表达,从而促进乳腺癌细胞的肺和肝脏的倾向性转移[61]。
外泌体转运RNA促进肿瘤细胞的增殖和转移。乳腺癌细胞摄取星型角质细胞,分泌含有PTEN-targeted-miRNAs的外泌体,促使PTEN表达下降,继而引起CCL2分泌升高,CCL2招募IBA1型骨髓细胞,后者能够促进转移肿瘤细胞增殖和抑制凋亡,最终促使乳腺癌细胞发生脑转移[62]。研究证明外泌体不仅可以转运成熟的miRNA还可以促进miRNA成熟,乳腺癌细胞分泌的外泌体具有自主促进前体miRNA成熟的能力,刺激周围非致瘤性上皮细胞形成肿瘤[63]。此外,外泌体也可转运lncRNA,肝癌细胞通过外泌体分泌携带lncTUC339转运至受体细胞,促进周围受体细胞增殖、克隆形成等,进而促进肝癌的进展[64]。HeLa和MCF-7细胞分泌的外泌体富含有lncRNA(MALAT1、HOTHAI和GAS5),它们作用于受体细胞后,可以诱导其肿瘤表型[65,66]。
外泌体转运代谢产物促进肿瘤细胞的增殖和转移。肿瘤成纤维细胞是大多数实体肿瘤微环境中主要的细胞成分,前列腺癌研究发现,病人组织来源的肿瘤相关成纤维细胞分泌的外泌体可以引起受体肿瘤细胞发生代谢重编程,抑制肿瘤细胞线粒体氧化磷酸化而促进糖酵解和谷氨酰胺依赖性还原羧化。进一步通过代谢组学分析发现,外泌体转运氨基酸、脂质、三羧酸循环中间代谢产物至受体肿瘤细胞,促进其在营养缺乏条件下的生长[67~69]。这些研究明确了外泌体在肿瘤增殖、转移中的作用。不断发现新的外泌体转运内含物在肿瘤发生发展中的作用与分子机制,是目前肿瘤研究的热点领域之一。
4.2 外泌体参与免疫系统的调节
肿瘤细胞产生的外泌体具有影响免疫系统从而促进肿瘤演进的作用。肿瘤细胞产生的外泌体富含CD95L、TRAIL和galectin9等分子,这些分子被受体T细胞摄取后,导致T细胞发生凋亡[70]。此外,肿瘤细胞来源的外泌体可影响抗原提呈细胞的功能,肿瘤细胞产生的外泌体富含PGE2、TGFβ、HSP72和miRNA等成分,被单核细胞摄取后,可以诱导其向骨髓来源的抑制性细胞(myeloidderived suppressor cells,MDSCs)表型转化[71]。肿瘤细胞来源的外泌体可以阻断树突细胞(dendritic cell,DC)的成熟,该效应是通过TGF-β途径实现的[72]。肺癌的相关研究报道,巨噬细胞摄取肺癌细胞分泌的含有miRNA的外泌体,靶向结合Toll样受体mRNA并使其降解,从而减少Toll样受体的表达,促进巨噬细胞分泌促炎症因子,最终导致肿瘤的全身转移[53]。大肠癌细胞分泌的外泌体中含有诱导凋亡、坏死的Fas蛋白,可以诱导受体T细胞发生凋亡[73]。研究还发现肿瘤细胞来源的外泌体转运EGFR至巨噬细胞,诱导巨噬细胞抑制表型,具体机制是EGFR激活MEKK2,继而磷酸化IRF3抑制IFN-Ⅰ产生,最终使得巨噬细胞抗肿瘤免疫应答减弱[74]。这些研究以外泌体为切入点,为深入探讨肿瘤免疫和逃≥机制开创了新的视角。
4.3 外泌体参与肿瘤药物抵抗
肿瘤药物治疗特别是靶向个体化治疗是目前肿瘤治疗的新手段,而了解肿瘤药物抵抗r是提高治疗疗效的关键问题之一。近年来,随着外泌体研究进展,人们发现外泌体参与了肿瘤药物治疗抵抗。外泌体介导发生药物抵抗的机制主要分为3种(图3):第一种是肿瘤细胞通过外泌体介导药物排出,从而降低胞内药物浓度,诱发药物抵抗。如:卵巢癌的药物抵抗研究发现,顺铂抵抗的卵巢癌细胞与敏感细胞相比,外泌体的分泌量提升2.6倍,并且富含顺铂,这提示顺铂抵抗的卵巢癌细胞利用外泌体向胞外排除药物[75]。前列腺癌细胞对docetaxel的抵抗机制研究发现,外泌体通过转运多药抵抗蛋白(MDR-1)至敏感肿瘤细胞,而MDR-1分子可以将药物泵至胞外,从而发挥药物抵抗作用[76,77]。除了抵抗细胞来源的外泌体,肿瘤微环境中间质干细胞分泌的外泌体也可作用于大肠癌细胞,通过CaM-Ks/Raf/MEK/ERK通路使外泌体高表达MDR-1、肺抵抗蛋白(LRP),从而促进大肠癌细胞对化疗药物5-fluorouracil的抵抗[78]。
第二种机制是肿瘤细胞可以通过外泌体分泌蛋白质,中和胞外的蛋白质抗体药物。乳腺癌细胞对HER2抗体trastuzumab抵抗的研究发现,抵抗的肿瘤细胞通过外泌体向胞外分泌HER2,HER2与抗体药物结合,减少抗体药物与肿瘤细胞作用的药物浓度,从而促进乳腺癌的药物抵抗[79]。
第三种机制是细胞之间通过外泌体交流,赋予了敏感肿瘤细胞抗药特性。舒尼替尼抵抗是导致肾细胞癌治疗失败的重要原因,研究发现舒尼替尼抵抗的细胞产生的外泌体与敏感细胞相比表现出lncARSR高表达。进一步研究发现,外泌体可以将lncARSR传递至受体敏感肿瘤细胞,致使癌细胞产生舒尼替尼抵抗,具体机制是lncARSR被受体细胞摄取后,可以充当miR-34/miR-449的ceRNA,减弱miR-34/miR-449对AXL和c-MET的调控,促进细胞AXL和c-MET的表达[80]。肿瘤细胞休眠有助于其抵抗化疗药物的作用,乳腺癌细胞诱导肿瘤相关成纤维细胞释放富含miR-222/miR223的外泌体,促进乳腺癌细胞休眠,并提升其药物抗性[81]。
4.4 外泌体参与肿瘤的放射抵抗
电离辐射损伤细胞DNA是治疗肿瘤的有效方式之一[83]。尽管放射治疗方法普遍使用,但是放射抵抗一直限制着肿瘤的治疗效果。最新的研究发现,外泌体促进细胞间信息交流,参与肿瘤的放射抵抗。例如在肺癌研究中,照射处理组肿瘤细胞与未照射组相比,其产生的外泌体中miR1246含量更高。采用miR1246类似物或阻断剂处理表明,细胞外miR1246增强肺癌细胞的增殖,并产生放射抵抗;进一步萤光素酶报告基因活性实验确定miR1246是通过抑制靶标DR5表达发挥作用[84]。乳腺癌相关研究发现,肿瘤间质细胞可以产生富含非编码RNA的外泌体,其通过识别乳腺癌细胞膜表面模式识别受体RIG-1而激活受体细胞的STAT1抗病毒信号通路,从而使乳腺癌细胞具有放射抵抗[85]。头颈部肿瘤的研究中,来源于照射处理细胞的外泌体增强受体细胞的放射抵抗,这可能是由于受体细胞DNA双链断裂修复增强的存活效应[78]。这些研究充分证明了外泌体介导的细胞间分子交流在肿瘤放疗抵抗中的重要性。
5 总结与展望
细胞分泌产生外泌体,不仅是细胞排除物质的一种方式,更是肿瘤微环境中细胞之间交流的途径。本文阐述了外泌体形成与分泌调节的相关机制,以及外泌体作为细胞间通讯的重要介质,参与肿瘤微环境中多种细胞之间的生物信号传递及肿瘤发生和发展过程。
外泌体除了在肿瘤进展中发挥重要作用之外,还可作为肿瘤诊断和治疗的潜在工具。通过液体活检技术[86]在血浆、血清及腹水等人体体液中获取外泌体,能反映其来源细胞的特征改变。Chen等[87]报道,膀胱癌患者和非癌症患者尿液中分离出的外泌体有24个差异表达蛋白质,其中外泌体来源的肿瘤相关钙信号转导因子2(tumor-associated calcium signal transducer 2,TACSTD2)是一种在许多癌症中过表达的细胞表面糖蛋白,可作为诊断膀胱癌的生物标志物,膀胱癌患者分泌的外泌体中TACSTD2水平高于对照组病例。从不同体液中分离富集外泌体及其内含物,有利于识别生物标志物的信号,是一种非侵入性的肿瘤诊断手段。而且,基于外泌体的靶向疗法和抑制外泌体分泌更是一种新型治疗策略,抑制外泌体分泌可阻止致癌分子转运到肿瘤微环境,进而减少血管生成和肿瘤转移。目前,将外泌体设计为药物递送载体装载递送治疗性抗癌药物以及将树突细胞衍生的外泌体作为免疫疗法的疫苗等研究均已进入临床试验。
尽管已有研究阐述了与外泌体形成分泌相关的分子,但由于该过程依赖于实验模型以及机体的特性,同时需经历一个多阶段多层次的调控过程,因而其具体机制仍未得到阐明。鉴于目前研
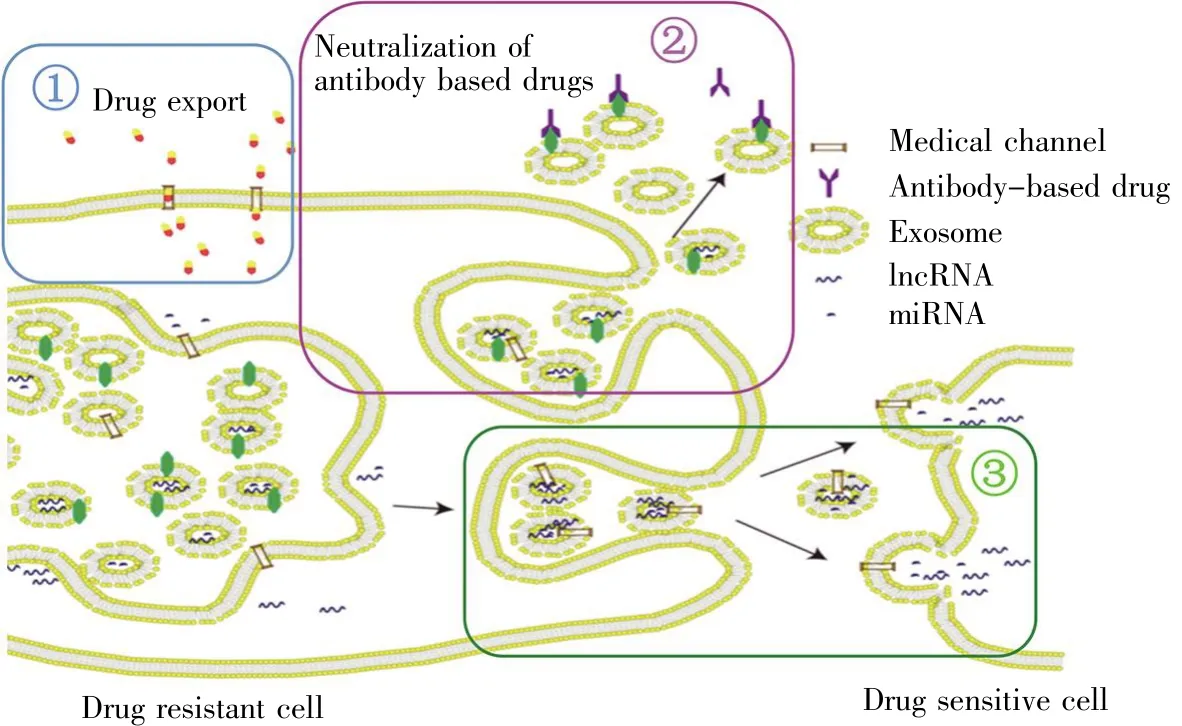
图3 外泌体参与肿瘤药物抵抗的途径(改编自文献[82])Fig.3 Exosomes involved in cancer drug resistance(Adapted from reference[82])
究外泌体的作用机制均在体外实验体系中完成,且细胞培养上清抽取与定量外泌体的实验方法尚未得到一致的定论,因而对外泌体相关功能的研究只是模拟一个近乎体内的环境,况且个体差异性也会导致外泌体的功能呈现异质性。外泌体作为目前研究的热门领域,其形成与分泌机制还需更进一步的深入探索,可以预期的是如果体内实验体系应用于外泌体功能研究中,将更透彻地了解其在机体内发挥功能的形式,为肿瘤治疗提供更有利的理论依据。

