纤毛与人体左右不对称发育研究进展
原壮壮,黄 皓,杨一峰,谭志平
(中南大学湘雅二医院,中国湖南长沙410011)
左右不对称发育现象在自然界中普遍存在,如招潮蟹、比目鱼、独角鲸等。然而,大多数脊椎动物的不对称隐藏在皮肤之下。人体内脏器官在位置和模式上呈明显的左右不对称分布,心脏在发育过程中不对称的环化,最终定位在胸腔左侧;左右肺叶数量也不尽相同;腹腔中,胃和胰脏位于左侧,而肝脏位于右侧,消化道r呈不对称卷曲;大脑也存在形态学及功能上的左右不对称。
纤毛是一类位于细胞表面的毛发状结构,在发育中起重要作用,并与多种疾病(如内脏异位)密切相关。临床资料及动物模型研究证实纤毛参与左右发育过程,左右不对称(L-R asymmetry)发育异常的患者及实验动物往往伴有纤毛缺陷。左右不对称发育异常又称偏侧发育缺陷(laterality defect),是一类以内脏器官沿身体垂直轴异常排列为主要特征的疾病,它包括内脏反位和镜面右位心等。流行病学调查表明其在新生儿发病率约为1/10 000[1]。左右不对称发育异常患者中先天性心脏病发病率显著增加,单心室、单心房、大动脉转位和室间隔缺损尤为普遍;同时还包括多脾症、中位肝、肝外胆管闭锁等心外畸形[1,2]。原发性纤毛运动障碍(primary ciliary dyskinesia,PCD)患者常并发反复呼吸道感染、鼻窦炎、支气管扩张和内脏反位等疾病。
1 纤毛的结构和分布
纤毛可分为轴丝、纤毛基质和纤毛膜三部分[3,4]。轴丝由环形排列的9组二联微管及多种附属蛋白质构成,中心可能存在一对中心微管,而纤毛膜均匀地包裹在轴丝外围,在轴丝和纤毛膜之间填充着纤毛基质[5,6]。
根据纤毛运动性和是否具有中心微管,可以将其分为 3 种类型:“9+2”运动型、“9+0”运动型和“9+0”不动型[7](图1)。运动型纤毛的二联管上有动力蛋白臂,动力蛋白臂之间相互滑动产生驱动力使纤毛弯曲[8,9]。动力蛋白臂有两种类型:外动力蛋白臂和内动力蛋白臂,由动力蛋白的重链、中链、轻链以及辅助蛋白质构成[10]。“9+2”运动型纤毛主要包括呼吸道上皮细胞纤毛、脑室室管膜细胞纤毛、生殖道上皮细胞纤毛以及精子的鞭毛等,呈平面摆动并产生定向液流。“9+0”运动型纤毛仅包括胚胎节点纤毛,和“9+2”运动型纤毛结构相似,包含双头外动力蛋白臂,但没有中心微管和辐条[10~13]。“9+0”不动型纤毛的9组二联管没有动力蛋白臂,没有中心微管和轮辐结构,包括肾小管、胆管、胰管上皮纤毛以及骨细胞/软骨细胞纤毛等。此外,视网膜感受器细胞的外段存在一种特殊的“9+0”不动纤毛[7,11,13~15]。有学者还提出可能存在一类“9+2”不动型纤毛,主要包括内耳的动纤毛、静纤毛等[14]。
2 纤毛与左右不对称发育
在脊椎动物中,左右不对称起源于早期出现在脊索末端的短暂结构-LROs(left right organizers),如小鼠的节点(node)、斑马鱼的库氏泡(Kupffer’s vesicle,KV)等。尽管脊椎动物的LROs结构不同,但破坏左右对称的生物学机制是保守的[16]。LROs中每个细胞表面存在一根“9+0”运动型纤毛。这些纤毛旋转运动,在LROs腔中产生左右不对称的液流,然后驱动LROs周围的基因不对称表达[17,18]。
综合来看,脊椎动物左右不对称模式的发生大致需要四步:1)LROs纤毛旋转,产生液流打破对称;2)LROs及其周围产生的不对称信号分子传递到侧板中胚层;3)左侧板中胚层Nodal基因及其反馈抑制基因Lefty2不对称表达;4)Pitx2不对称表达,Nodal信号分子诱导其编码转录因子,使器官发生在特定位置[19,20]。
2.1 纤毛的运动性
发育初始阶段胚胎是左右对称的,这种对称的打破依赖纤毛运动所产生的节点液流[15,21,22]。早期研究发现,小鼠内脏反位(inversus viscerum,iv)基因编码动纤毛外动力蛋白臂的重链蛋白Lrd(left-right dynein heavy chain),其突变会l成节点纤毛运动性丧失[23,24],进而导致左右不对称发育异常[25]。利用原位S交和免疫荧光染色等技术,在鸡胚、非洲爪蟾和斑马鱼中均发现了Lrd表达,但其时空表达存在物种差异[26,27]。
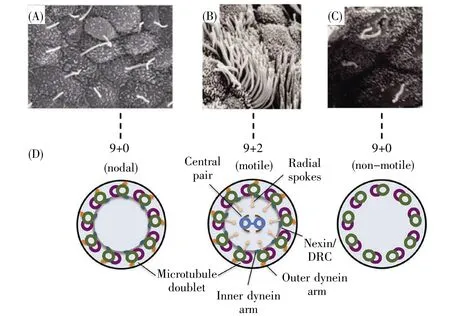
图1 纤毛结构模式图(修改自文献[130])(A)小鼠节点纤毛扫描电镜图像;(B)哺乳动物气管细胞运动纤毛扫描电镜图像;(C)肾小管上皮细胞的初级纤毛;(D)9+0运动纤毛(节点纤毛)、9+2运动纤毛、9+0不动纤毛(初级纤毛)结构模式图。DRC,动力蛋白调控复合体。Fig.1 Ciliary structure pattern(cited from the ref.[130]with some modifications)(A)Scanning electron micrograph of mouse nodal cilia;(B)Motile cilia are usually found at a density of several hundred per cell,as shown in this scanning electron micrograph of the mammalian trachea;(C)Primary cilia are typically one per cell,as exemplified by primary cilia in renal tubule epithelia;(D)Schematic representation of a cilium,with cross sections at the distal end showing the microtubule arrangements in the nodal,motile and non-motile(primary)cilia.DRC,dynein regulatory complex.
人类DNAH11基因编码纤毛轴丝动力蛋白臂的β链蛋白质。此基因突变患者常发生内脏异位[28]。利用基因敲除技术,去除小鼠DNAH11的同源基因,发现发育早期左向液流消失。其可能的原因是DNAH11基因突变导致纤毛动力不足,不能产生液体流动[29]。此外,鉴定到的第一个人类PCD致病基因DNAI1,它也编码一种动力臂蛋白[30,31]。
2.2 纤毛决定液流方向
小鼠节点纤毛向后倾斜及其顺时针旋转模式共同决定了液流的方向。节点细胞表面向后倾斜的纤毛顺时针旋转产生向左的有效划动和向右的恢复划动,在凹陷的节点中产生向左的快速液流,在细胞表面产生向右的缓慢液流[32]。
在小鼠和爪蟾中,LRO纤毛极化导致其定位在细胞后部并向后倾斜,这一过程依赖于平面细胞极性。有研究表明小鼠节点纤毛极化是由沿前后轴分布的Wnt5活性梯度导致的[33,34]。二联管环状规r排列对节点纤毛稳定的旋转运动是必要的[13]。此外,辐条对节点纤毛的旋转运动也很重要,在Rsph4a(Rsp4同源基因)敲除小鼠中,呼吸道纤毛可以像节点纤毛一样顺时针旋转,表明辐条缺失可能是纤毛运动模式转化的关键[13,35,36]。
在人工液体流动环境中培养小鼠细胞的研究表明,快速右向流动可以使胚胎正常的节点液流方向逆转,导致心脏反位;而慢速右向流动、慢速左向流动和快速左向流动均表现为左右发育正常[37]。
斑马鱼的库氏泡液流情况略有不同。KV是一个内表面分布纤毛细胞且内部充满液体的球体,腔内的流体呈2形的逆时针流动。KV前端更多的是柱状细胞,纤毛密度更高,这一排列导致液体流速不对称,其中KV腔内左前部分的流动速度最大[38,39]。
2.3 静纤毛与液流感知
产生液流的动纤毛主要分布在小鼠节点中央,而静纤毛存在于节点的边缘[18,40]。静纤毛细胞又被称为冠细胞,它表达左右不对称模式正确形成所必需的3个信号分子Nodal、Gdf1和Cerl2。静纤毛可以感知液流,纤毛发育障碍的Kif3a-/-小鼠胚胎不能对液流作出反应;挽救冠细胞中Kif3a的表达后,胚胎重新获得对液流信号的反应[18]。
静纤毛感知液流信号的细节尚不十分清楚,目前存在两种主要的科学观点:1)感知液流产生的机械力[22,41];2)液流中的某种化学因子,或携带该化学因子的囊泡,随液流不对称分布后被感知到[42]。
不对称发生需要钙离子(Ca2+)通道蛋白Pkd1l1和Pkd2的作用,二者可共定位在LRO纤毛上,并且都是Nodal-Pitx2通路建立所必需的[43~45]。通常,Pkd1l1表达相对局限在LROs,而Pkd2表达范围更广一些[18,44]。小鼠实验发现,Pkd1l1在Pkd2上游,发挥抑制Pkd2的作用,而Pkd2的下游靶基因是Cerl2(编码一种Nodal拮抗物)[46]。Pkd2响应液流中的信号从而激发纤毛内的Ca2+信号,而后者扩散到细胞内激活下游的通路;在小鼠胚胎的节点和斑马鱼胚胎的库氏泡中,直接检测到Ca2+浓度的左右不对称[47],以上信息表明Ca2+可能参与感知液流的通路。此外,Ca2+信号抑制剂处理小鼠胚胎会扰乱节点的左右不对称发育[40]。抑制非洲爪蟾胚胎的IP3信号,会导致左右模式随机化[48]。
2.4 不对称信号的传导
起源于LROs的不对称信号被传导到侧板中胚层(lateral plate mesoderm,LPM),激活Nodal表达,并进一步激活Pitx2的表达[49]。小鼠胚胎上的Ca2+(L>R)信号由节点向两侧扩散,可能是通过缝隙连接的内胚层细胞到达LPM[41,50]。LRO到LPM的信号转导需要硫酸化糖胺聚糖(sulfated glycosaminoglycans,sGAGs)参与[51]。sGAGs位于内胚层和中胚层之间的一层基底膜中,Ca2+通过内胚层细胞之间的缝隙连接传播,引起sGAGs的分泌增加,从而促进Nodal蛋白的转移[52,53]。但斑马鱼中的情况并不完全一致,缺少LRO-spaw表达或spaw基因突变的斑马鱼LPM仍然表达Spaw[54,55]。
Nodal信号终止后,Pitx2在左侧板中胚层的表达仍持续数个小时,最初曾认为Pitx2是Nodal信号下游驱动器官不对称形态发生的关键基因。虽然在侧板中胚层Pitx2表达缺失的小鼠模型中大多数器官都表现出左右异常,例如心血管系统和肺的结构;但仍有一些不对称发生并未被Pitx2缺失所影响,例如心脏环化和胃的偏侧性,这表明不依赖于Pitx2的Nodal下游信号通路对某些器官不对称形态的发生也很重要[56]。
Nodal-Pitx2通路在调控心脏的不对称发育中也发挥重要作用。心脏发育过程中,在对称的心锥阶段,左侧心脏祖细胞收到来自左侧板中胚层前部的Nodal信号,该信号驱使左侧的细胞更快速的迁移[57,58]。在缺乏Southpaw/Spaw(Nodal同源物)的斑马鱼胚胎,其两侧的心脏祖细胞都迁移缓慢[59]。目前有关Nodal信号增加细胞迁移速率的机制还不清楚,但已经鉴定出一些心脏祖细胞Spaw靶标[58,60]。其中一种靶标是透明质酸合成酶2(hyaluronan synthase 2,Has2),是一种细胞外基质修饰酶,其在左侧心脏祖细胞的表达水平高于右侧,可能抑制BMP活性;另一种是非肌细胞肌球蛋白II(nonmuscle myosin II)亚基,其表达被Nodal活性所抑制[60]。
3 左右不对称发育与先天性心脏病
研究表明,约有80%的左右不对称发育异常患者合并复杂先天性心脏病(congenital heart disease,CHD)[61],这可能是由心脏环化异常所致。从生物进化角度来看,心脏环化过程保守,原始心管通过弯曲形成左右不对称的扭曲结构。心管首先向腹侧弯曲,然后向右螺旋扭转,称为“右袢(DLoop)”(图2)[62]。心脏环化依赖于相关基因表达和机械力的协调作用。抑制斑马鱼spaw基因的表达,其中70%的心脏仍正常右旋环化,这提示在Nodal信号缺失时,心脏的正确环化可能由另一种尚未探明的机制所控制[54,57]。同样,有研究表明Pitx2不是斑马鱼和小鼠心脏环化所必需的,提示Nodal可不依赖于Pitx2而单独作用[63]。
动脉弓也存在左右不对称发育的过程。哺乳动物胚胎有5对动脉弓。小鼠胚胎在E10.5到E11.5的24 h内,或人类胚胎在大约5 d内,动脉弓系统经历了复杂而广泛的不对称重构。左侧的第四和第六动脉形成主动脉和肺动脉干,而右侧r退化。在Pitx2突变体中,右侧的第六弓动脉没有退化,说明Nodal-Pitx2通路参与动脉弓的左-右不对称发育[64]。然而,对于不存在于弓动脉中的Pitx2是如何影响前者的左右不对称重构仍不清楚。一个可能的原因是Pitx2支配着第二生心区的形态发生[65]。正常情况下,流出道(outflow tract,OFT)螺旋旋转约180。,然后在动脉极旋转的驱动下回旋90。,使右侧第六弓动脉的入口与主动脉相邻,且右侧第六弓动脉相比于左侧更狭窄、更长,这导致流经其中的血流量减少,进而减少血小板源生长因子和血管内皮生长因子,最终导致右侧的第六弓动脉退化[64]。这些结果表明Pitx2驱动OFT手性旋转导致血流左右不对称分布。
4 与左右不对称发育相关的重要疾病基因
临床观察发现左右不对称发育异常多见于内脏异位和PCD病人。PCD是一类罕见的因“9+2”运动型纤毛结构缺陷和/或功能障碍,累及多器官的隐性遗传病。在一项包括305例典型PCD患者的研究中,143(46.9%)例患者内脏正位(situs solitus,SS);125(41.0%)例镜面异位(situs inversus totalis,SI/SIT);37(12.1%)例内脏反位(situs ambiguus,SA),其中SA合并复杂CHD占2.6%,合并简单CHD占2.3%,不合并CHD占4.6%[66,67]。考虑到节点纤毛(“9+0”运动型)和呼吸道纤毛(“9+2”运动型)的结构和分布并不一样,因此我们推测PCD与内脏异位合并复杂CHD可能是两种不同亚型的纤毛病,其致病基因不尽相同,但也应该存在重叠部分。
迄今为止,得℃于高通量测序和人类遗传学技术的快速发展,17种单纯参与左右不对称发育基因(表1)[68~84]和41种PCD致病基因得以鉴定(表2)[30,85~129]。此外,利用化学诱变技术在模式动物小鼠中进行正向遗传学筛选,鉴定到一系列的导致左右不对称发育异常和CHD的基因,如Pkd1l1、Mmp21、Gm572、Tbc1d32、Cc2d2a、C2orf74 等[130],前两个重要候选基因(Pkd1l1、Mmp21)已在内脏异位等病人中证实[73,74],而其他候选基因r有待更多的人类遗传学证据。
一般而言,已鉴定的这些致病基因按照生物学功能分为以下四大类:1)与纤毛结构和组装及其运动性相关,该类基因突变通常不能形成功能性的纤毛,多为PCD致病基因,如DNAI1、DNAH5、DNAH11等;2)与胚胎中轴线(midline)形成有关,如ZIC3、LEFTYA等;3)LPM中效应分子的编码基因,如NODAL、PITX2等;4)参与节点和LPM之间的信号传导过程,如PKD1L1、PKD2等[131]。
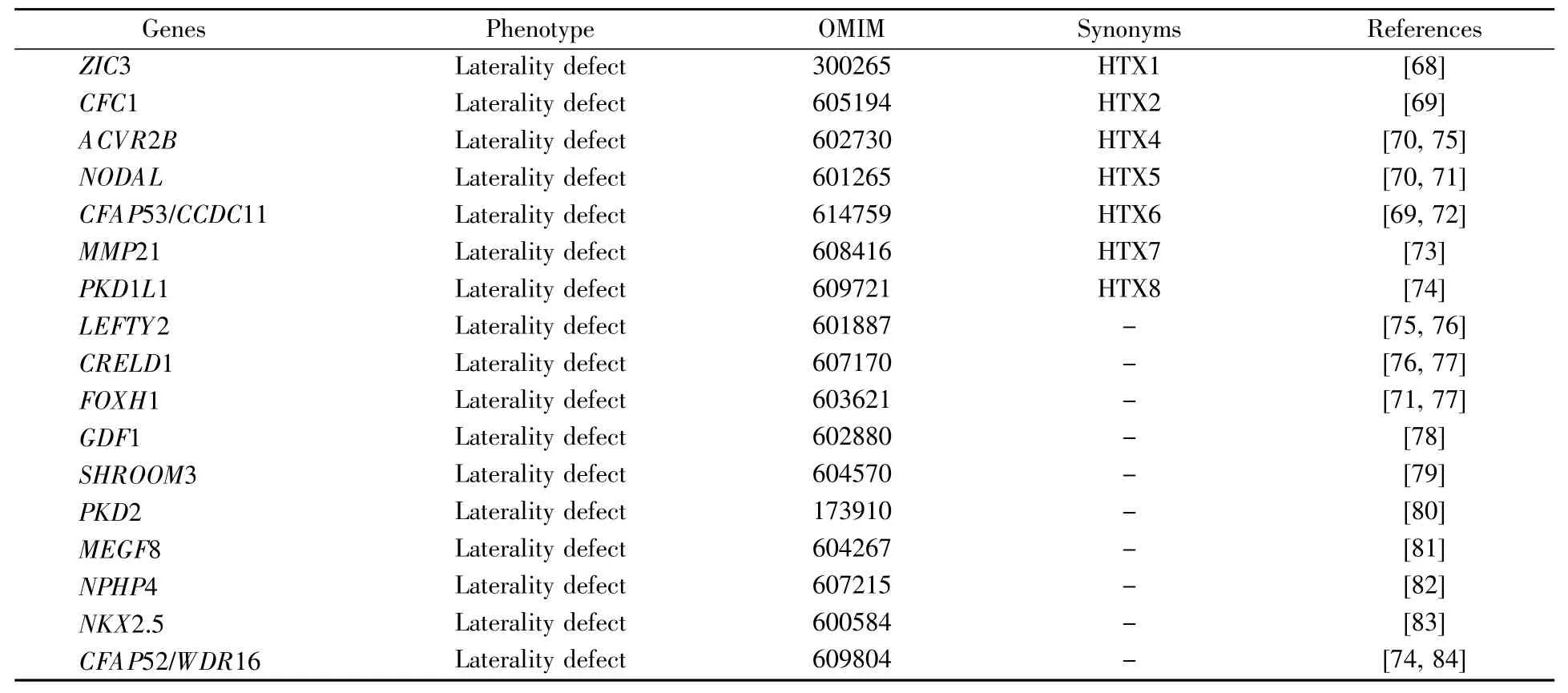
ZIC3 CFC1 ACVR2B NODAL CFAP53/CCDC11 MMP21 PKD1L1 LEFTY2 CRELD1 FOXH1 GDF1 SHROOM3 PKD2 MEGF8 NPHP4 NKX2.5 CFAP52/WDR16 Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect Laterality defect 300265 605194 602730 601265 614759 608416 609721 601887 607170 603621 602880 604570 173910 604267 607215 600584 609804 HTX1 HTX2 HTX4 HTX5 HTX6 HTX7 HTX8----------[68][69][70,75][70,71][69,72][73][74][75,76][76,77][71,77][78][79][80][81][82][83][74,84]
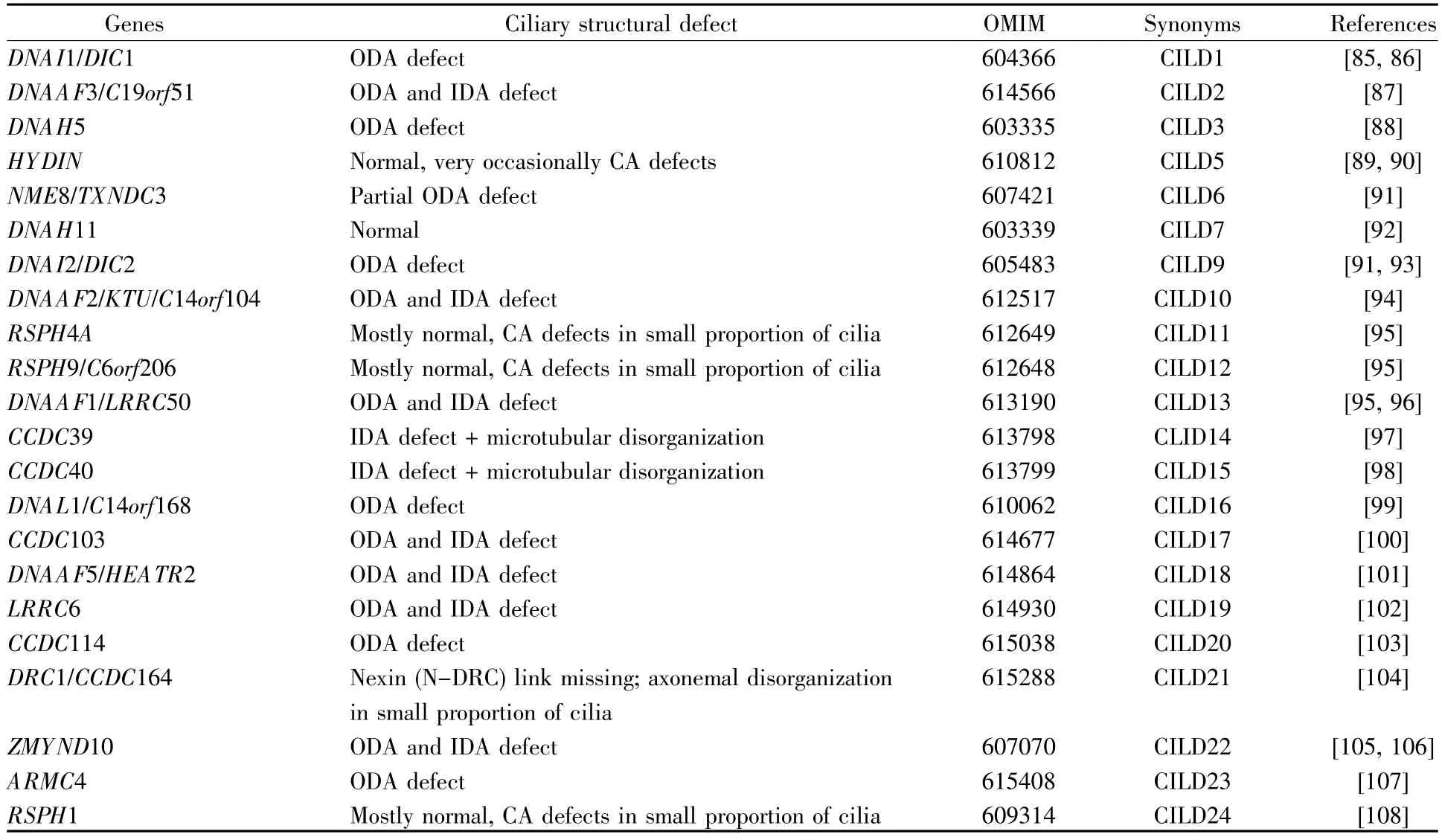
表2 PCD致病基因Table 2 The PCD disease-causing genes
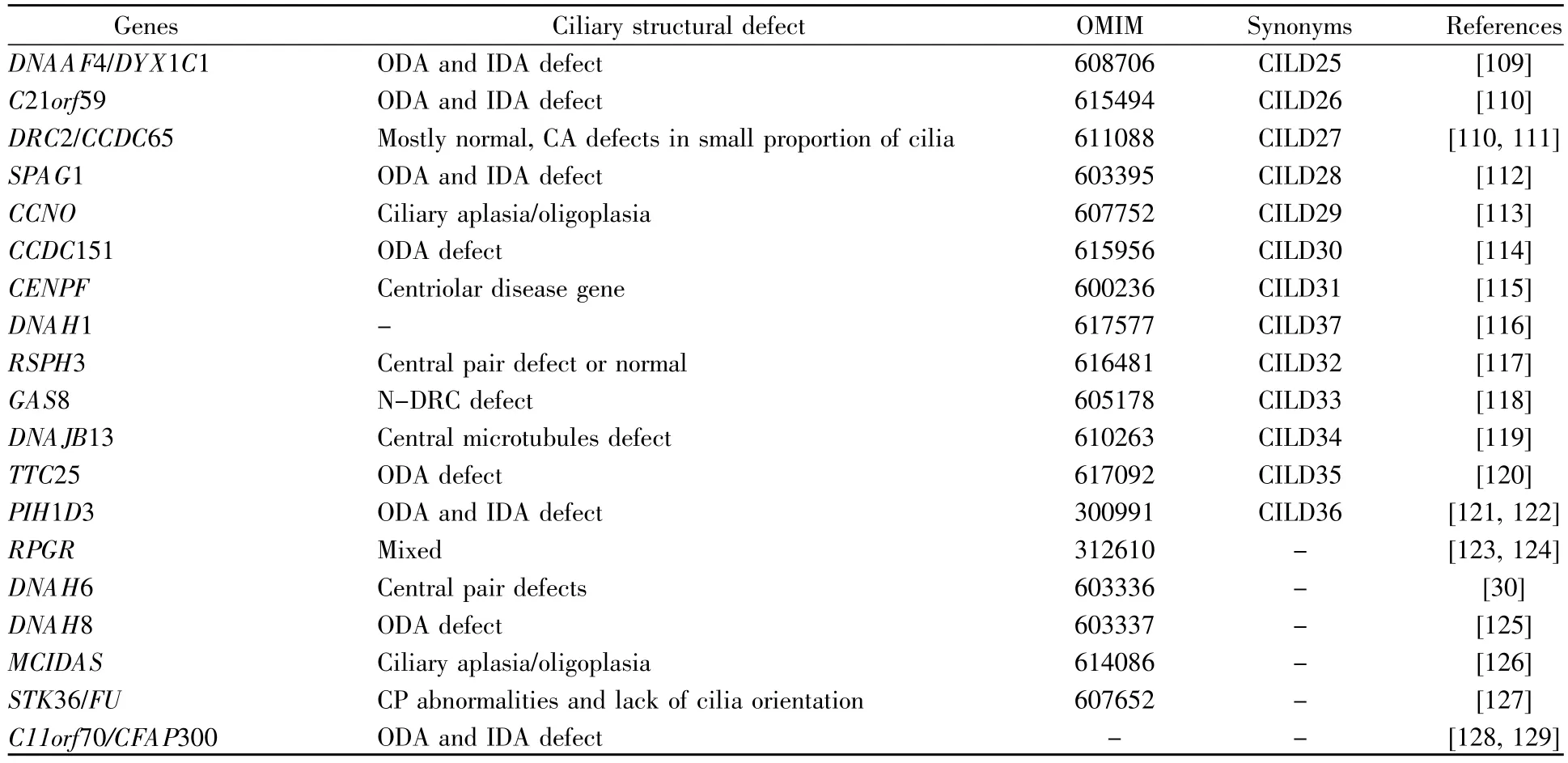
(接上表)
5 展望
已有研究结果表明纤毛参与胚胎早期发育及内脏器官的不对称分布,但其中的复杂调控机制仍不清楚。本团队对前期收集到的50余例右位心合并CHD患者样本进行全外显子测序等探索性研究,结果显示仅10.2%的患者鉴定到已知基因的突变,这其中包括ZIC3、NKX2.5、NODAL、CCDC151、MMP21等,仍有高达约90%表型特异的患者暂时缺乏分子遗传学解释。同时,新近鉴定的MMP21、MEGF8、C11orf70等致病基因的生物学功能知之甚少[73,81,128],这提示纤毛与左右不对称发育的关系仍存在较多空白地带。随着细胞和分子生物学技术的进一步发展,我们期待诸如Nodal信号启动和维持的过程、静纤毛感知液流具体细节、心脏环化调控机制以及人类内脏异位分子机制等问题将有一个更清晰的答案。
当前国际上纤毛及其相关疾病的研究竞争激烈,我国在此领域的原创性研究较少,临床医学研究多以病例报道为主。鉴于我国人口基数大、南方同姓氏族群聚集以及部分地区医疗水平不足等客观现象的存在,已确诊或潜在的纤毛相关疾病患者数量较为庞大。随着先进的分子遗传学技术的快速推广,临床上对该类疾病认识不足所l成的漏诊误诊现象逐渐减少,因此我们乐观期待国内纤毛相关疾病的临床诊断和研究有一个快速的发展。

