干旱胁迫下平邑甜茶叶片差异表达蛋白分析
杨小妮,王俊花,杨剑锋,祁香宁,段宇敏,韩明玉,张林森
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
干旱是影响全世界农业生产最普遍的一种环境胁迫[1],其会加速植物叶片衰老,减少作物产量,降低经济效益[2]。植物在长期进化过程中为了适应干旱胁迫形成了一套防御机制,当受到干旱胁迫时,植物体内会发生生理生化反应以响应胁迫。在干旱胁迫下,植物感受系统在感受到化学信号后会将信号进一步传递给转录调控因子,诱导信号传导相关的基因表达(调节基因),利用高通量方法可识别关键调控过程的步骤和基因[3-5]。然而,越来越多的证据表明,由于蛋白质丰度调节的复杂性,转录组通常与蛋白质组表现不一致[6],这是因为转录后调控会导致转录与其同源蛋白相关性变差[7]。由于蛋白质组分析可提供数百到数千蛋白质的综合定性和定量信息,因此它成为研究各种生物过程的重要工具,不仅可以补充转录组调查,还能更直接地了解与特定试验条件相关的代谢过程[8]。因此,蛋白质组学被证明是探索生物化学途径和植物对各种非生物胁迫的复杂响应机制的有力工具[9]。
西北黄土高原是世界上苹果连片种植面积最大的区域,其苹果栽种面积居我国第一,为8.193万hm2,总产量达700.32万t,面积和产量分别占全国的39%和35%[10]。但是该地区降雨少而蒸发强,水资源亏缺严重限制了苹果产业的可持续发展。为适应干旱环境,生产中一般采用抗性砧木嫁接繁殖,平邑甜茶即是常用的一种重要砧木,其具有无融合生产特性,苗木生长高度一致,非常适合用于逆境处理研究。目前对果树的抗旱研究主要集中在生理生化方面[11-12],而关于果树在干旱胁迫下的分子机理,尤其是在蛋白组水平反应变化的研究鲜见报道。所以,本研究采用同位素标记相对和绝对定量方法(iTRAQ-based),评估苹果砧木在干旱胁迫下的蛋白质应激反应,分析差异蛋白及其参与的生化途径,以理解苹果砧木应答干旱胁迫的分子调控机制,为今后苹果砧木的抗旱分子改良提供基础信息。
1 材料与方法
1.1 试验材料及处理
2016年3月从西北农林科技大学国家苹果产业技术体系示范苗圃基地(34°20′N,108°24′E),挑选生长势基本一致的2年生健康平邑甜茶(Malushupehensis)砧木平茬,移栽到直径25 cm、高30 cm的盆中,将土、沙和基质按质量比3∶1∶1拌匀,每盆装12 kg。每个盆用黑色塑料膜和反光膜包裹以避免土壤蒸发和温度过高的影响。置于防雨棚中培养。试验前给予标准的园艺病虫害管理。
同年8月份,随机选取长势一致的平邑甜茶盆栽苗,设置2个水分处理(对照Mh-CK和逐渐干旱Mh-GD),随机区组排列,3次重复。试验前即2016-08-02之前每天充分灌溉所有试验材料,开始试验后,Mh-GD处理不再浇水,一直保持干旱;Mh-CK处理通过每天称重,补充灌溉其蒸散量,始终保持土壤湿润。13 d后,Mh-GD处理植株叶片出现萎蔫情况时采样。轻轻擦洗干净植株顶部叶片,采集后迅速用锡箔纸包好放进液氮速冻,带回存入超低温冰箱备用。
1.2 土壤水势、黎明前叶水势、叶片相对含水量及光合作用的测定
2016-07-28,将连接在CR1000数据采集器(Campbell Scientific Inc,USA)上的4个MPS-6土壤水势传感器(Decagon,USA),分别埋入2株平邑甜茶Mh-CK处理和2株Mh-GD处理盆栽苗土中,每0.5 h自动采集1次数据,实时监测土壤水势的变化,从而抓住植株失水临界点,然后用Campbell公司提供的Loggernet 4.0软件输出数据,由于埋入的传感器需要土壤沉降才能准确读数,故开始记录数据的日期为2016-08-02。
预试验发现,当土壤水势低于-700 kPa时叶片会出现轻微萎蔫现象。试验开始第13天,天气晴朗,Mh-GD处理的土壤水势达到-753.9 kPa,叶片出现了萎蔫现象。当天06:00左右,用压力室(MODEL-1000,PMS Instrument,Corvallis,OH,USA)测定黎明前叶水势(ψleaf)。同天上午09:00-11:00,每株平邑甜茶选取相同部位的4片功能叶片,用便携式光合仪(Ciras-2,PPS,England)测定不同处理植株的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)等光合作用指标。
试验结束时采集不同处理平邑甜茶叶片,每株6片,测定叶片相对含水量(RWC)。
RWC=(FM-DM)/(TM-DM)×100%。
式中:FM、DM和TM分别表示叶片鲜质量、干质量及饱和水下叶片质量。
1.3 叶绿素荧光诱导动力学曲线参数的测定
干旱胁迫第11天,即2016-08-12,在晴朗的上午09:00-10:00,从不同处理的每株平邑甜茶上选择5片成熟叶片,利用便携式叶绿素荧光仪(PPEA,Hansatech instruments LTD,king’s Lynn,Norfolk,UK)测定其叶绿素荧光诱导动力学曲线(OJIP)相关参数,即单位反应中心吸收光能(ABS/RC)、性能指标(PI)、PSⅡ潜在活性(Fv/F0)和PSⅡ最大光合效率(Fv/Fm)。测量前用暗适应夹子使叶片暗适应至少20 min,采用3 500 μmol/(m2·s)的饱和光诱导OJIP曲线,荧光信号记录10 μs开始,3 s结束。用PEA Plus软件(Hansatech instruments for Handy PEA & Pocket PEA ChlorophyⅡ Fluorimeters)传输数据导出荧光参数。
1.4 叶片蛋白质的iTRAQ标记
2个处理的平邑甜茶叶片蛋白质采用丙酮沉淀法提取。蛋白质经过还原,封闭胰蛋白酶酶切后,用iTRAQ 113/114 和iTRAQ 115/116分别标记Mh-CK、Mh-GD处理的叶片蛋白,建成两个比对组(113/114,115/116)。采用考马斯亮蓝(Bradford)法蛋白浓度测定试剂盒测定蛋白质浓度,根据iTRAQ试剂盒的操作步骤进行蛋白还原烷基化、酶解及标记。应用强阳离子交换色谱方法对混合后的肽段进行HPLC分离,然后再进行反向色谱-Triple TOF 检测和分析。采用 Protein Pilot Software V.5.0(SCIEX,SA)软件分析试验数据,数据库来源于转录组测序数据(Uniprot 蛋白库),筛选出标准为FDR<1%、Unused>1.3、肽段数(peptides (95%))≥1的可信蛋白。
1.5 差异表达蛋白的筛选
以可信蛋白筛选结果为基础筛选差异表达蛋白,本试验的挑选标准是将差异倍数>1.5(上调)或<0.67(下调),且P<0.05的蛋白作为显著差异表达蛋白。
1.6 差异表达蛋白的生物信息学分析
筛选出可信蛋白和差异表达蛋白后,根据差异表达蛋白的ID及其在各组处理间的差异倍数(Fold change)进行后续的生物信息学分析。即应用基因本体(GeneOntology, GO)数据库(http://www.geneontology.org/)计算每个term的差异蛋白数目,然后应用超几何检验,与整个蛋白质背景相比,找出在差异表达蛋白中显著富集的GO条目。差异表达蛋白的Pathway显著分析同GO功能显著富集分析相近,以差异表达蛋白在京都基因与基因组百科全书数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG)Pathway为单位,运用超几何检验,与整个蛋白质的背景相比来确定差异表达蛋白主要富集的Pathway。
2 结果与分析
2.1 干旱胁迫对平邑甜茶土壤水势、黎明前叶水势的影响
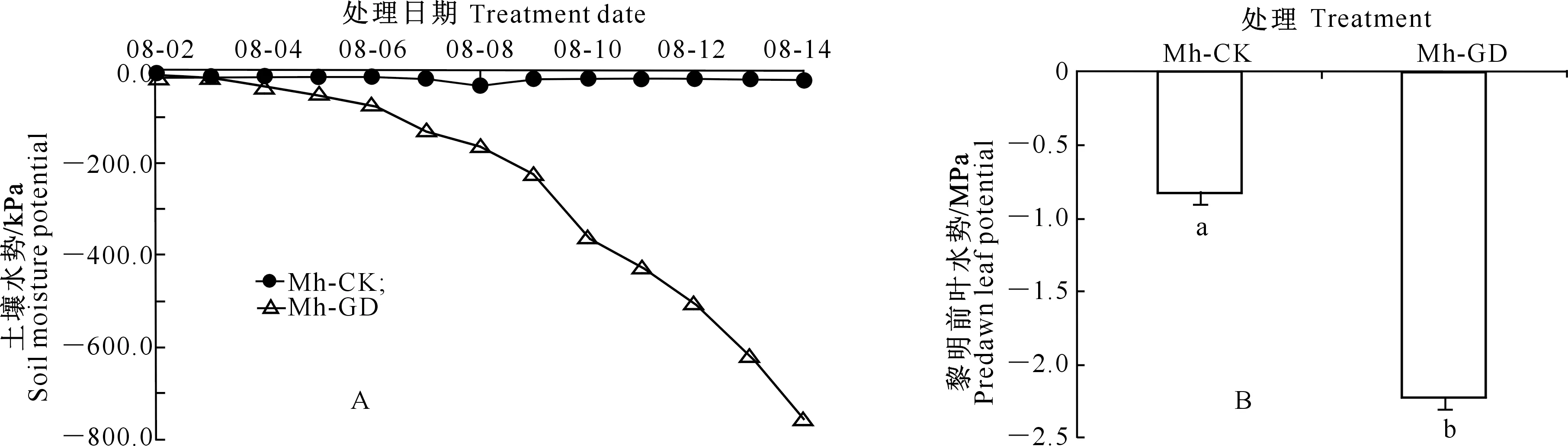
由图1可见,随着时间推移,平邑甜茶Mh-CK处理的土壤水势一直保持在-35.0 kPa内。而Mh-GD处理的土壤水势逐渐下降,且下降速率由小变大,第13天土壤水势由最初的-10.4 kPa下降到-753.9 kPa,故在当天采样。干旱第13天即2016-08-14,平邑甜茶Mh-GD处理植株叶片出现了萎蔫现象,其黎明前叶水势(ψleaf)显著低于Mh-CK处理。
柱上标不同小写字母表示不同处理间差异显著(P<0.05)。下图同
Different lowercase letters show significant difference between treatments (P<0.05).The same below
图1 不同处理下土壤水势(A)和平邑甜茶黎明前叶水势(ψleaf)(B)的变化
Fig.1 Soil moisture potential (A) and change of predawn leaf potential (B) ofMalushupehensisunder different treatments
2.2 干旱胁迫对平邑甜茶光合作用和叶片相对含水量的影响
由图2可见,Mh-CK处理平邑甜茶的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)、叶片相对含水量(RWC)均显著高于Mh-GD处理,分别高出130%,170%,360%,13%,说明在干旱胁迫下, Mh-GD处理平邑甜茶通过降低叶片含水量、Pn、Gs及Tr来抵御胁迫。
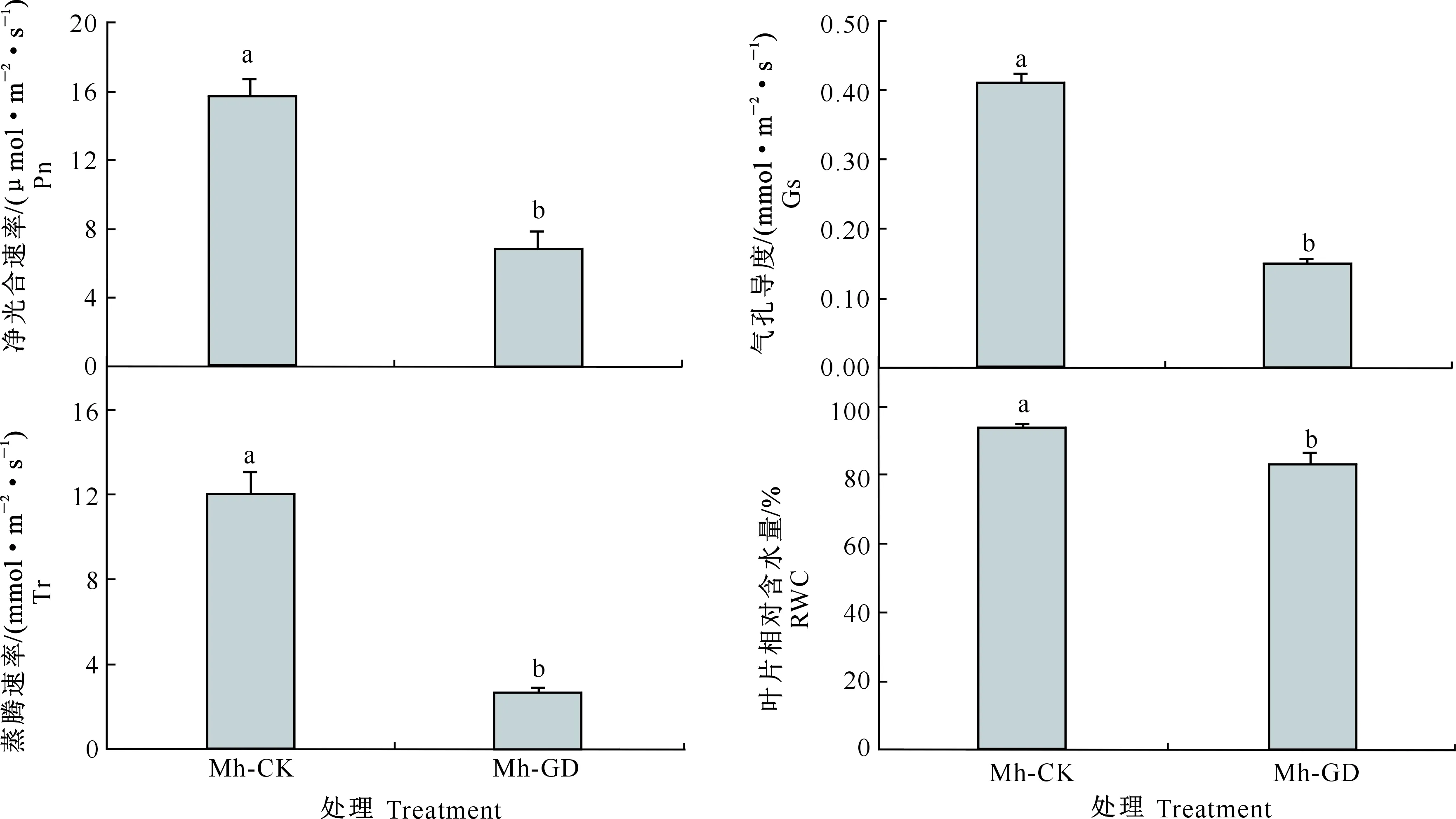
图2 干旱胁迫对平邑甜茶光合作用及叶片相对含水量的影响
Fig.2 Effect of drought treatments on photosynthesis and leaf relative water content ofMalushupehensis
2.3 干旱胁迫对平邑甜茶叶绿素荧光参数的影响
由图3可以看出,在干旱胁迫下Mh-GD处理平邑甜茶植株的叶绿素荧光动力学曲线高于Mh-CK处理。Mh-CK处理植株的单位反应中心吸收光能(ABS/RC)、性能指标(PI)、PSⅡ潜在活性(Fv/F0)和PSⅡ最大光合效率(Fv/Fm)分别高出Mh-GD处理80%,129%,10%,2%。Mh-GD处理的Fv/F0下降,表明PSⅡ活性中心受干旱胁迫的影响,光合原初反应过程受阻。PI反应可决定潜在光合作用能力,如反应中心密度、用于电荷分离过程的光子吸收率和电子传递速率,干旱胁迫后PI显著下降,说明Mh-GD处理叶片的光能转换效率、电子传递速率、光能吸收率均下降。
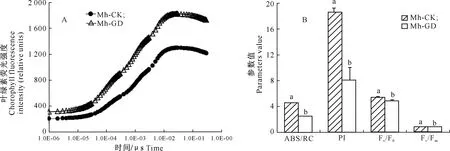
图3 干旱胁迫对平邑甜茶叶片荧光动力学曲线(A)及叶绿素荧光参数(B)的影响
Fig.3 Effect of gradual drought treatments on chlorophyll fluorescence intensity curve (A) and chlorophyll fluorescence parameters (B) ofMalushupehensis
2.4 干旱胁迫下平邑甜茶的蛋白水平变化
利用iTRAQ技术,对Mh-CK、Mh-GD处理平邑甜茶叶片组织蛋白进行相对定量与定量技术分析,共鉴定到1 897个蛋白。经过进一步鉴定发现,有181个共同表达的显著差异蛋白,其中上调蛋白81个(P<0.05,差异倍数>1.5),下调蛋白100个(P<0.05,差异倍数<0.67)。
2.5 平邑甜茶差异表达蛋白的GO富集分析
对平邑甜茶差异表达蛋白进行GO 显著性分析,确定其行使的主要生物学功能,结果见表1。由表1可见,在生物学过程中,差异表达蛋白主要参与代谢过程、生物合成过程。作为细胞组分的蛋白质主要集中在细胞质中,而与分子功能相关的蛋白主要是“结合”蛋白和“催化”蛋白(酶)。

表1 不同处理平邑甜茶差异表达蛋白的GO显著富集分析Table 1 Significant enrichment GO analysis of differentially expressed proteins (DEPs) of Malus hupehensis
2.6 平邑甜茶差异表达蛋白的Pathway富集分析
为了解差异表达蛋白的生物学功能,对平邑甜茶表达差异显著的蛋白进行了Pathway分析。结果(表2)显示,已知的差异表达蛋白显著富集的Pathway通路(P<0.05)集中在碳代谢(16个蛋白,占9%)、光合作用(6个蛋白,占3%)、代谢途径(17个蛋白,占9%)等方面,有56%(101个蛋白)的差异表达蛋白是未知的。
2.7 干旱胁迫下平邑甜茶差异表达蛋白的功能
在干旱胁迫响应中,平邑甜茶叶片差异表达蛋白参与了不同的生物学过程,显著差异表达蛋白共181个,其中95个(占52%)蛋白功能未知,已知的86个差异表达蛋白功能可归为10类(表3)。包括蛋白质代谢(25个蛋白,占13.8%)、信号转导(11个蛋白,占6.1%)、碳代谢(10个蛋白,占5.5%)、细胞加工(10个蛋白,占5.5%)、能量代谢(5个蛋白,占2.8%)、光合途径(6个蛋白,占3.3%)、金属离子结合(4个蛋白,占2.2%)、抗逆反应(8个蛋白,占4.4%)和其他(7个蛋白,占3.9%)(表3和表4)。

表3 干旱胁迫平邑甜茶显著差异表达蛋白(P<0.05和变化倍数≥2.0)Table 3 Significant differentially expressed proteins under of Malus hupehensis drought treatments (P<0.05 and fold change≥2.0)
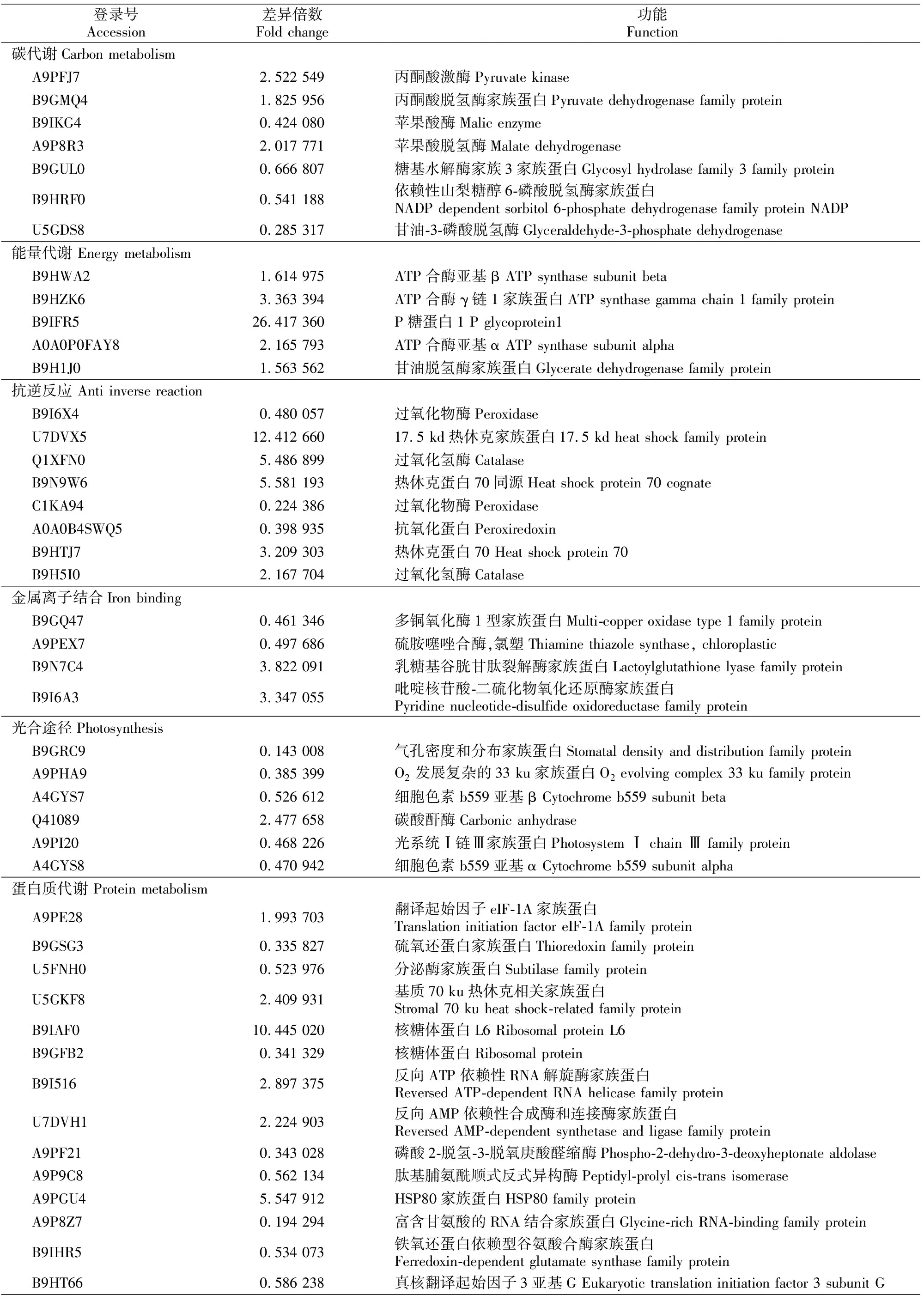
表3(续) Continued table 3
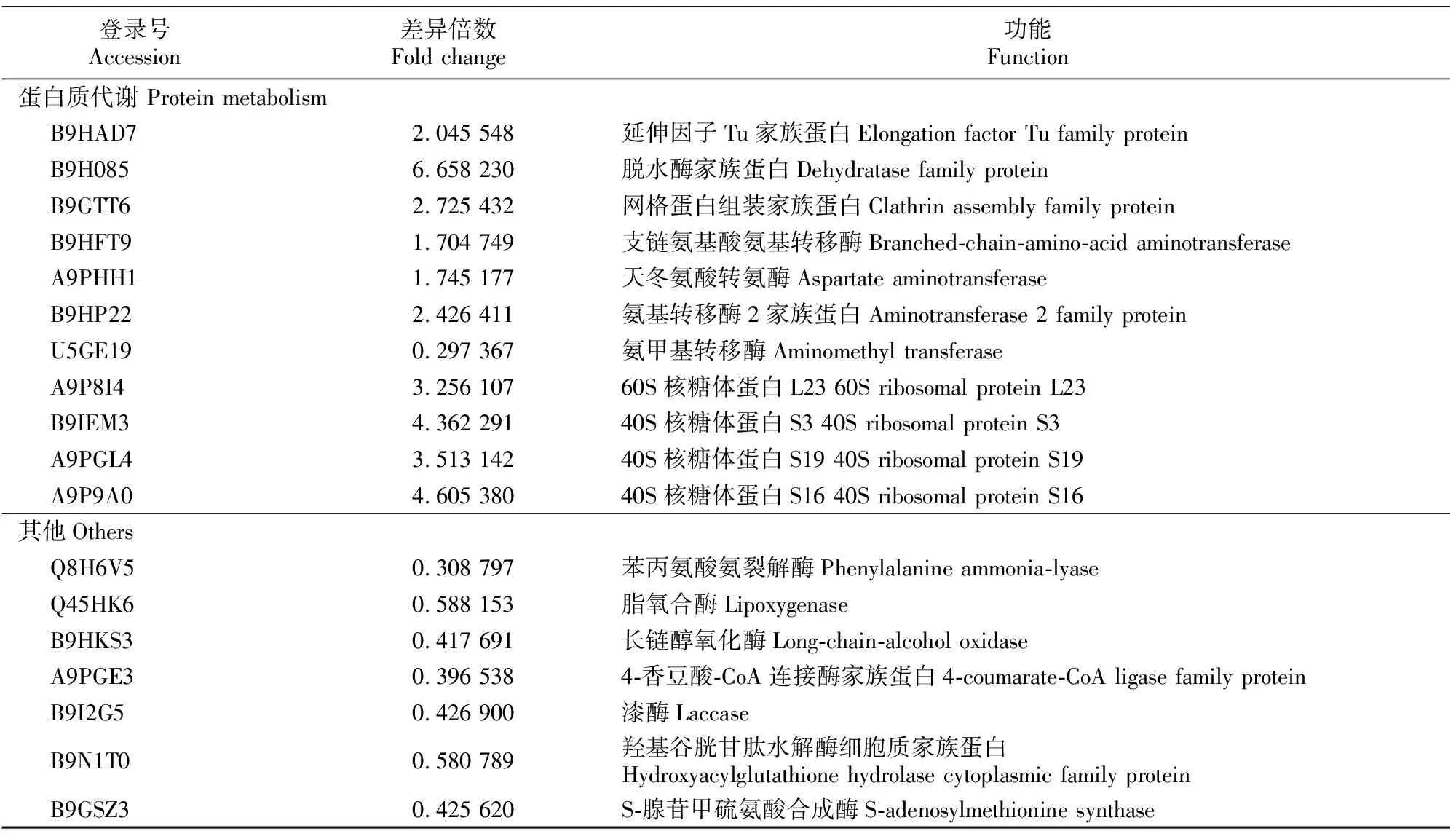
表3(续) Continued table 3
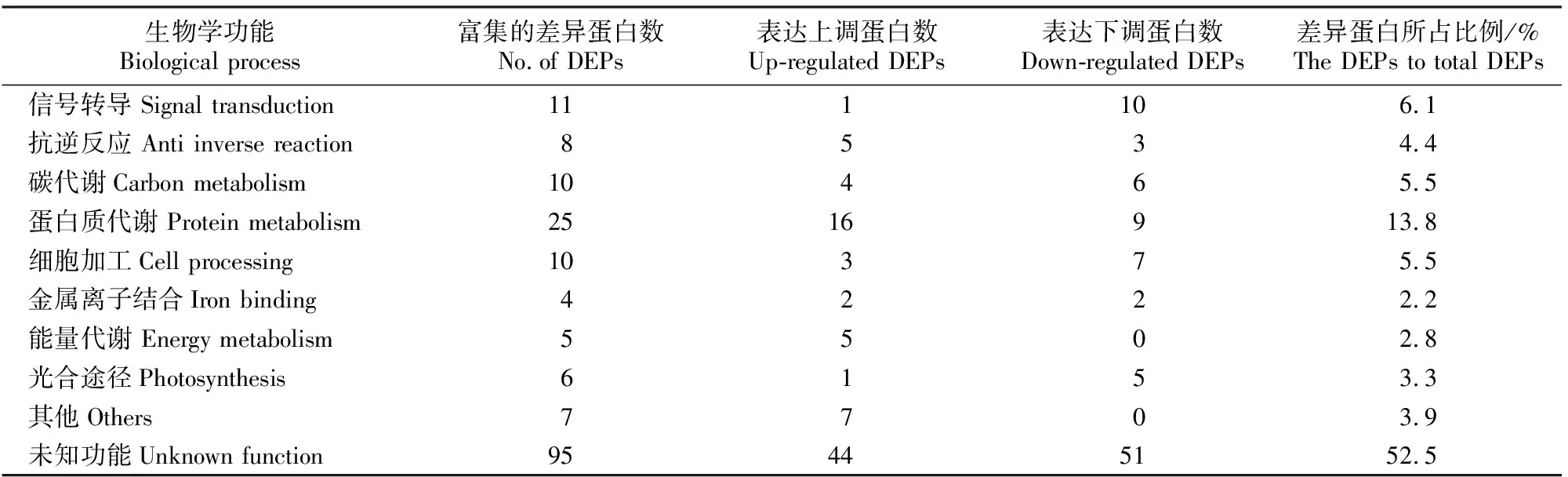
表4 干旱胁迫平邑甜茶差异表达蛋白的功能分类Table 4 Functional classification of differentially expressed proteins under drought treatments
3 讨论与结论
3.1 干旱胁迫下平邑甜茶植株的生理指标响应
随着土壤干旱胁迫的进行,Mh-CK处理平邑甜茶的ψleaf、光合作用参数及RWC均显著高于Mh-GD处理。多年来,人们都将黎明前叶水势(ψleaf)作为衡量土壤水分状态的直接指标。前人在苹果[13]和橡树[14]上的研究结果显示,干旱胁迫下ψleaf明显下降。Kautz等[15]研究结果表明,干旱胁迫会引起RWC、叶绿素含量、Pn下降,叶片厚度变薄,脯氨酸含量升高。这些变化均是对干旱胁迫的响应。
植株正常生理状态下,多数高等植物的Fv/Fm处于0.8~0.85,低于这个范围时,表示植物受到了胁迫。张永强等[16]研究显示,水分亏缺使冬小麦Fv/Fm、Fv/F0、稳态荧光(Ft)均显著下降,PSⅡ原初光能转化效率、PSⅡ潜在活性受到抑制,说明干旱胁迫直接影响了光合作用的电子传递和CO2同化。衣艳君等[17]研究表明,在脱水过程中毛尖紫萼藓的Fv/Fm对叶片含水量的响应存在相对含水量阈值,若低于此阈值则各荧光参数值会迅速下降。在本研究中,Mh-GD处理的Fv/Fm高于0.8,可能是因为叶片相对含水量大于Fv/Fm的响应阈值。孙山等[18]研究发现,当‘金太阳’杏叶片的RWC低于59%时,OJIP曲线和光吸收曲线形状发生显著变化,但对PSⅡ的Fv/Fm影响较小;光合性能指数PI比Fv/Fm能够更加全面地反映PSⅠ和PSⅡ之间电子传递的变化,PI随着干旱的加重而逐渐降低。这与本研究结果一致,表现为Mh-GD处理植株的PI显著低于Mh-CK处理。
3.2 平邑甜茶叶片差异表达蛋白的功能
比较Mh-GD和Mh-CK处理平邑甜茶叶片的差异蛋白发现,与抗逆、蛋白质合成代谢等过程相关的蛋白表达总体上调,而与光合途径、细胞加工、碳代谢、信号转导等过程相关的差异蛋白表达总体下调。Mh-GD处理差异蛋白表达与Mh-CK处理相比有升有降,说明干旱胁迫通过抑制或提高平邑甜茶体内某些蛋白的合成来增强植株对干旱环境的适应性。
3.2.1 信号转导蛋白 平邑甜茶通过信号感受器官感受外界的干旱刺激,然后把信号传递到细胞核内,从而关闭或启动一些相关基因表达以达到抵御胁迫的目的。本研究发现了11种与信号转导相关的蛋白。在植物中,G蛋白是活细胞内一类具有重要生理调节功能的蛋白质,它参与多种跨膜信号的转导[19],包括响应植物体内的激素信号与糖信号[20],参与调控气孔运动[21]、对病原体的防卫[22],植物光信号转导[23]等。本研究中,2个G蛋白A9PEC2和B9GQQ0表达出现下调。钙网蛋白参与调节各种细胞功能,可以作为内质网伴侣蛋白,也可起存储钙离子和信号转导作用。本研究中的钙网蛋白家族(B9N4Q4)表达下降。核苷二磷酸激酶2(NDPK2)是拟南芥光敏色素信号转导途径中的一个上游成分,参与光敏素A的响应,它作用于光敏色素的C-末端,是介导光敏色素光信号转导途径的一种正调节信号组分[24]。本研究发现,2个NDPK(U5GVG1和B9I3M0)表达量降低,说明它们参与平邑甜茶叶片在干旱胁迫下光信号的转导。磷酸酶2C家族蛋白(PP2C)参与ABA负调控作用与保卫细胞信号转导途径[25]。本研究中PP2C(B9HB91)表达下调,意味着在干旱胁迫下ABA含量增多。富亮氨酸重复类受体蛋白激酶(the leucine-rich repeats receptor-like protein kinase,LRR-RLK)是目前植物中最大的一类植物类受体蛋白激酶。Xing等[26]将杨树中1个LRR-RLK基因PdERECTA在拟南芥中表达,发现过表达植株较野生型植株对水分的利用率提高。前人研究发现,LRR-RLK能够介导逆境胁迫信号的感知及传递,对植物响应逆境胁迫具有重要的调控作用[27-28]。本研究发现,干旱胁迫下2个LRR-RLK(B9HD76和B9ILH3)表达下调。β-连环蛋白信号途径在动物方面的研究较多,而在植物上鲜有报道,Wnt/β-连环蛋白信号途径在动物生长发育过程中起重要作用。本研究发现,犰狳/β-连环蛋白重复家族蛋白(B9HJD4)表达下调,但其功能尚不清楚。
信号转导中唯一上调的蛋白是肌动蛋白家族(B9GJJ1)。多种肌动蛋白结合蛋白参与动态微丝骨架的调节,在植物生长发育和逆境生理中发挥重要作用。本研究中肌动蛋白表达上调可能是参与响应平邑甜茶叶片干旱胁迫下的应答。
3.2.2 碳代谢蛋白 本研究发现,参与葡萄糖代谢、三羧酸循环(TCA)、GDP-甘露糖生物合成和淀粉合成等碳水化合物合成过程的酶分别为甘油-3-磷酸脱氢酶(U5GDS8)、苹果酸酶(B9IKG4)、磷酸分解酶(A9PI53)、淀粉合成酶(B9I0S2)、糖基水解酶家族3蛋白(B9GUL0)及催化底物NADP依赖性山梨糖醇6-磷酸脱氢酶家族蛋白(B9HRF0)。它们具有氧化还原活性,表达均下降,可能是光合作用下降导致的。丙酮酸脱氢酶家族蛋白(B9GMQ4)和苹果酸脱氢酶(A9P8R3)参与TCA,丙酮酸激酶(A9PFJ7)参与糖酵解(EMP)过程,这3种蛋白表达上调说明呼吸作用增强。在干旱胁迫下,光合碳同化的速率下降,细胞呼吸作用加强,碳水化合物消耗增加。纤维素是一种多糖物质,也是植物细胞壁的重要组分,在干旱胁迫下植物为了维持细胞的形态和植物体的挺拔形态,合成纤维素的蛋白表达量上调。本研究中可逆糖基化多肽3家族蛋白(B9HIG2)表达上调可能是为了维持细胞的形态。
3.2.3 抗逆反应蛋白 在逆境胁迫下,植物体会产生一些有害的化学物质,导致自身受损,自由基、活性氧(ROS)是最常见的逆境有害物质。ROS的性质极其活泼,能够与一切植物体内的生物大分子反应,从而破坏其活性构象,打乱细胞正常代谢[29]。但细胞中也存在着超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等保护酶,可在干旱胁迫下清除ROS,维持代谢平衡,保护膜结构[30]。本研究中,抗氧化蛋白(A0A0B4SWQ5)、过氧化物酶(B9I6X4、C1KA94)表达下调,热休克蛋白HSP70(U7DVX5、B9HTJ7和B9N9W6)和过氧化氢酶(B9H5I0和Q1XFN0)表达上调。随着干旱程度的加剧,叶片SOD活性逐渐下降,POD活性随着干旱加重则有不同程度增加;CAT活性在中度干旱胁迫下会有所增加而在重度干旱下会降低[31]。HSP70家族在热休克蛋白家族中属于最保守、最主要的一类。在大多数生物中,HSP70是含量最多的一类热休克蛋白,当细胞受到胁迫后其含量会显著提高,参与各种机体细胞的保护。HSP的诱导合成,可以稳定细胞结构,维持细胞正常生理功能,使机体对逆境胁迫如热害、冷害、病毒感染等相应抵抗能力增加[32-34]。本研究中平邑甜茶可能通过上调CAT和HSP70表达来增强植物对干旱胁迫的抗性。
3.2.5 蛋白质代谢 本研究中参与蛋白质合成的酶类,如反向AMP依赖性合成酶和连接酶家族蛋白(U7DVH1)、脱水酶家族蛋白(B9H085)、反向ATP依赖性RNA解旋酶家族蛋白(B9I516),以及翻译起始因子eIF-1A家族蛋白(A9PE28)、网格蛋白组装家族蛋白(B9GTT6)、延伸因子Tu家族蛋白(B9HAD7)和多种核糖体蛋白,如60S核糖体蛋白L23(A9P8I4)、40S核糖体蛋白S19(A9PGL4)、40S核糖体蛋白S3(B9IEM3)、40S核糖体蛋白S16(A9P9A0)和核糖体蛋白L6(B9IAF0)表达均上调,表明植物体通过增加一些相关蛋白的合成来抵御干旱胁迫。

