核盘菌一分支酸变位酶同源效应蛋白的亚细胞定位
盛寅生 任爱芝 常雪 赵培宝

摘要
前期研究表明核盘菌Sclerotinia sclerotiorum产生的一种分支酸变位酶同源效应蛋白能够提高其致病能力。为了进一步研究该效应蛋白在核盘菌致病过程中的作用机制,我们通过构建GFP融合蛋白对其分泌行为和亚细胞定位开展了研究。首先通过PCR技术扩增了该基因的启动区+信号肽(SP)+叶绿体定位肽(CTP)的DNA序列,构建GFP融合载体,然后借助REMI技术转化核盘菌原生质体,筛选GFP能够表达的转化子,最后接种转化子菌丝于烟草叶片,激光共聚焦检测GFP荧光信号,发现GFP荧光与叶绿体自体荧光共定位,表明该效应蛋白可分泌进入寄主叶绿体内发挥作用。
关键词
菌核病; 效应子; 启动子; 信号肽; 叶绿体定位肽
中图分类号:
S 432.44
文献标识码: A
DOI: 10.16688/j.zwbh.2018025
Subcellular localization of an effector homologous with chorismate
mutase in Sclerotinia sclerotiorum
SHENG Yinsheng REN Aizhi CHANG Xue1,2, ZHAO Peibao1
(1. Department of Plant Protection, Liaocheng University, Liaocheng 252000, China;
2. Liaocheng Forestry Bureau, Shandong 252000, China)
Abstract
It has been proved that the effector homologous with chorismate mutase was related with pathogenicity of Sclerotinia sclerotiorum. In order to explore the pathogenicity mechanism of the effector, we analyzed the secretory and subcellular localization through constructing the GFP fusion protein. The DNA sequence of promoter +SP+CTP was cloned by PCR. Then the vector of GFP fusion promoter +SP+CTP was constructed, transformed in the protoplast of S.sclerotiorum using the REMI. The transformants in which GFP could express normally were obtained and the transformants mycelia were inoculated on the leaves of tobacco and the fluorescence signals were detected through confocal microscope. As a result, it was found that the GFP fusion protein could be secreted into host cell and colocalized with the chloroplast. The result indicated that the effector may play its role in the host chloroplasts.
Key words
sclerotinia rot; effector; promoter; signal peptide; chloroplast targeted peptide
核盘菌Sclerotinia sclerotiorum (Lib.) de Bary属子囊菌亚门Ascomycotina,核盘菌科Sclerotiniaceae,核盘菌属Sclerotinia,是一种寄主范围广泛的植物致病真菌,能侵染油菜、向日葵、豆科、葫芦科、茄科蔬菜等400多种植物,引起菌核病[1]。核盘菌与灰葡萄孢Botrytis cinerea Pers.致病机制类似,属于死体营养的病原真菌[2]。核盘菌对寄主的破坏性较大,在其致病过程中草酸和细胞壁降解酶发挥着重要作用[3-5],而且核盘菌能够产生活性氧并利用寄主过敏性坏死反应来克服寄主防御、促进自身侵染[6-8]。核盘菌全基因组序列的公布为核盘菌致病机制的研究开启了新篇章,除了傳统的细胞壁降解酶、草酸等致病因子,人们也开始关注一些分泌性效应蛋白在核盘菌与植物互作过程中的作用。例如Guyon 等通过分泌组分析找到了78个潜在的效应蛋白候选对象,并对其中的16个分泌蛋白在不同植物中的表达模式进行了分析[9];Lyu等证明了小分子效应蛋白SsSSVP1能够通过影响植物能量代谢来帮助自身侵染[10];Wang等研究发现核盘菌的效应蛋白Sspg1d能够与植物体内的一个小分子蛋白IPG-1互作,在致病早期发挥作用[11];Zhu等发现分泌效应蛋白SSITL能于侵染早期阶段在抑制茉莉酸介导的抗病过程中发挥作用[12]。我们前期研究明确了一分支酸变位酶同源效应蛋白能够提高核盘菌致病性,但对其作用机制还不清楚。为了进一步探究其作用机制,我们对其亚细胞定位进行了分析。
1 材料与方法
1.1 材料
核盘菌S.sclerotiorum由德克萨斯农工大学教授Dickman提供,保存于含PDA培养基的试管内;绿色荧光蛋白GFP基因来自质粒pBluntNAT-GFP1-1;潮霉素抗性基因hph来自质粒 PUC-ATPH;引物XS1-1:5′-GCAAGGAGGATCCTAATAGAATC-3′;XS1-2:5′-TCCCCCCGGGGCAT-GTTGTTCCATTAGGAAGG-3′为自行设计,用于扩增基因启动区+信号肽(SP)+叶绿体定位肽(CTP)部分,并于两引物5′端分别增加了BamHⅠ和XmaⅠ酶切位点;根据潮霉素基因序列设计了筛选引物Hph1和Hph2,Hph1: 5′-ATGAAAAAGCCTGAACTC-3′;Hph2:5′-CTATTCCTTTGCCCTCGG-3′。
1.2 试验方法
1.2.1 生物信息学分析
分别通过SignalP 4.1 Server、PredictNLS和ChloroP 1.1 Server等生物信息学工具对核盘菌的一分支酸变位酶同源效应子的信号肽、细胞定位特征进行分析。
1.2.2 基因片段的扩增及载体的构建
收集PDA培養的核盘菌菌丝,提取DNA,然后依据所设计的引物XS1-1和XS1-2扩增核盘菌分支酸变位酶同源基因的启动区+信号肽(SP)+叶绿体定位肽(CTP)的930 bp的DNA序列,将所得DNA片段与GFP基因融合构建转化载体。方法为:以pBluntNAT-GFP1-1为基础,插入真菌筛选标记潮霉素抗性基因,再将经PCR克隆获得的含启动子(N-Pro)+信号肽(SP)+叶绿体定位肽(CTP)的DNA片段连入载体中,构建得到启动子+SP+CTP+GFP融合载体pBluntNAT-PSC-GFP。
1.2.3 遗传转化及转化子筛选
酶解法制备核盘菌原生质体,将融合载体通过REMI技术转化核盘菌原生质体,300 μg/mL潮霉素筛选转化子,并提取转化子DNA,采用引物Hph1和Hph2进行 PCR,验证潮霉素抗性基因在核盘菌基因组上的整合,最后通过荧光显微镜检测GFP表达与否[13]。
1.2.4 效应蛋白的分泌特性及植物细胞定位分析
接种GFP能够正常表达转化子的菌丝于烟草叶片,通过荧光共聚焦显微镜检测荧光信号,分析其分泌特性和细胞定位。
2 结果与分析
2.1 信号肽及定位信号预测结果
通过SignalP 4.1 Server、PredictNLS 和ChloroP 1.1 Server等在线软件对该效应蛋白进行分析,发现该蛋白具有20个氨基酸组成的信号肽(SP)序列,并且具有包含45个氨基酸的叶绿体定位肽(CTP)序列特征,二者的氨基酸残基序列如图1所示:
图1 预测的效应蛋白信号肽和叶绿体
定位肽氨基酸序列
Fig.1 The SP and CTP of the effector
2.2 GFP融合载体的构建
2.2.1 启动子+SP+CTP序列的扩增
采用引物对XS1-1/XS1-2进行PCR扩增,获得长度约900 bp的DNA序列,如图2所示。
图2 效应子的启动子、信号肽、叶绿体定位肽序列的
PCR产物电泳分析结果
Fig.2 Agarose gel electrophoresis of PCR product
of the promoter+SP+CTP
经测序表明,该片段全长为938 bp,与预测的一致,包含分支酸变位酶基因740 bp的上游启动区序列+信号肽序列+叶绿体定位肽序列,该DNA片段包含预测的启动子元件CAAT Box和相应的信号肽、叶绿体定位肽序列,序列结果如图3所示:
图3 启动子、信号肽和定位肽DNA序列
Fig.3 DNA sequence of the promoter+SP+CTP
2.2.2 GFP融合载体的构建
将潮霉素抗性基因hph插入pBluntNAT-GFP1-1中,再分别将经PCR克隆获得的上述启动子(N-Pro)+信号肽(SP)+叶绿体定位肽(CTP)的一DNA片段连入载体中,构建得到启动子+SP+CTP+GFP融合载体,具体操作步骤如图4所示。
2.3 转化子的筛选与验证
将上述载体经REMI介导的技术转化核盘菌原生质体,筛选到了在含有300 μg/mL潮霉素的PDA培养基上生长的转化子,提取转化子DNA,以Hph1/Hph2为引物经PCR验证,扩增到了预期条带(图5),表明转化子中载体已整合到基因组中。
图4 融合载体构建流程图
Fig.4 Construction of the vector
图5 PCR检测转化子中潮霉素抗性基因
Fig.5 Detection of hph gene in transformants by
PCR amplification
2.4 荧光蛋白细胞定位分析结果
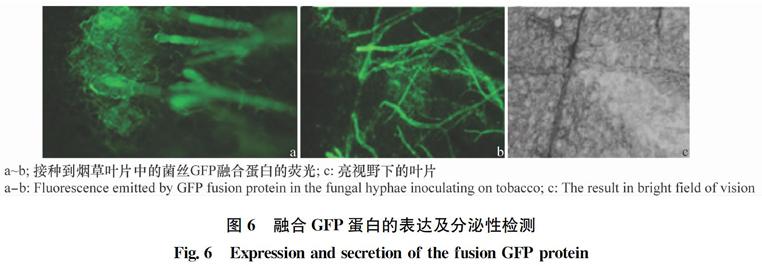
将Natural Pro+SP+CTP+GFP融合载体转化获得的转化子菌丝接种到烟草叶片上,经荧光显微镜检测发现GFP荧光蛋白均能正常表达,并且发现荧光蛋白具有分泌到菌丝外的现象(图6)。
图6 融合GFP蛋白的表达及分泌性检测
Fig.6 Expression and secretion of the fusion GFP protein
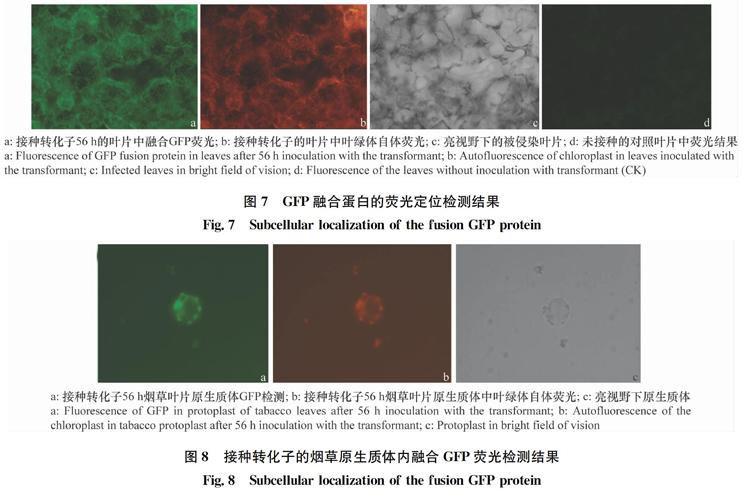
经转化子接种的烟草叶片在56 h后进一步检测叶片中荧光分布,同时制备烟草叶片原生质体,并通过荧光共聚焦显微镜检测,发现GFP荧光和叶绿体自体荧光能够共定位,GFP荧光蛋白有在细胞叶绿体内聚集现象(图7~8)。
3 结论与讨论
通过试验我们得到了能够正常表达GFP融合蛋白的转化子,该融合蛋白包含核盘菌分支酸变位酶同源蛋白的信号肽和叶绿体定位肽。经过接种转化子菌丝于烟草叶片后对荧光信号的检测发现该融合蛋白能夠正常表达、具有分泌性并聚集于烟草叶片细胞中的叶绿体处。由此推测该分支酸变位酶同源蛋白发挥作用的部位可能是在叶绿体,可能通过影响光合产物中分支酸衍生物的合成,从而影响寄主防御反应。
图7 GFP融合蛋白的荧光定位检测结果
Fig.7 Subcellular localization of the fusion GFP protein
图8 接种转化子的烟草原生质体内融合GFP荧光检测结果
Fig.8 Subcellular localization of the fusion GFP protein
分支酸衍生物 (chorismate derived compounds, CDCs) 在植物的生长、发育、防御及与其他生物的互作中起重要作用[14],特别是水杨酸(SA)信号通路是植物体内重要的抗性相关信号通路[15],在对活体寄生病原物的防御中发挥重要作用[16]。
莽草酸途径(shikimate pathway)是微生物和植物的基本代谢途径,其终产物是分支酸 (chorismate)[17]。分支酸是生物中许多化合物的前体, 包括芳香族氨基酸 (如苯丙氨酸、酪氨酸和色氨酸)、水杨酸 (SA)、IAA及其他次生代谢物[18]。
分支酸变位酶 (chorismate mutase, CM)催化分支酸转化成预苯酸, 为苯丙氨酸与酪氨酸的合成提供前体,从而改变分支酸进一步转化路径,影响体内水杨酸的水平及其植物抗性水平[19]。对于寄生性的病原微生物来讲,其所需要的苯丙氨酸和络氨酸可以从寄主获得,分支酸变位酶对于自身氨基酸代谢可能并不是必需的。但通过NCBI数据库中BLAST发现该类基因在部分真菌如黑粉菌Ustilago maydis、核盘菌Sclerotinia sclerotiorum等的部分病原微生物体内存在,推测可能在植物病原菌与植物的联系中发挥作用。研究也证明了在专性寄生的黑粉菌中分支酸变位酶基因Cmu1与其致病性密切相关,植物感病后其水杨酸水平显著下降[19]。生物信息学分析发现在死体营养的病原物中仅核盘菌具有分支酸变位酶同源基因,前期研究表明该基因与致病性相关,但对其如何发挥作用还不清楚。通常认为植物对死体营养病原物的抗性过程中水杨酸通路并不发挥主要作用[16],因此对于该基因如何在核盘菌与寄主植物互作过程中发挥作用值得进一步深入探索。
参考文献
[1] BOLAND G J, HALL R. Index of plant hosts of Sclerotinia sclerotiorum[J]. Canadian Journal of Plant Pathology, 1994, 16(2): 93-108.
[2] AMSELEM J, CUOMO C A, VAN KAN J A L, et al. Genomic analysis of the necrotrophic fungal pathogens Sclerotinia sclerotiorum and Botrytis cinerea [J]. PLoS Genetics, 2011, 7(8):1-27.
[3] BATEMAN D F, BEER S V. Simultaneous production and synergistic action of oxalic acid and polygalacturonase during pathogenesis by Sclerotinia rolfsii[J]. Phytopathology, 1965, 55: 204-211.
[4] HANCOCK J C. Degradation of pectic substances associated with pathogenesis by Sclerotinia sclerotiorum in sunflower and tomato stems [J]. Phytopathology, 1966, 56: 975-979.
[5] RIOU C, FREYSSINET G, FEVRE M. Production of cell wall-degrading enzymes by the phytopathogenic fungus Sclerotinia sclerotiorum[J].Applied and Environmental Microbiology, 1991, 57(5): 1478-1484.
[6] 李秀丽,高智谋. 核盘菌(Sclerotinia sclerotiorum)致病分子机理研究进展[J].安徽农业科学,2013,40(2):266-272.
[7] GOVRIN E M, LEVINE A. The hypersensitive response facilitates plant infection by the necrotrophic pathogen Botrytis cinerea [J]. Current Biology, 2000, 10(13): 751-757.
[8] KIM H J, CHEN C, KABBAGE M. Identification and characterization of Sclerotinia sclerotiorum NADPH oxidases [J]. Applied and Environmental Microbiology, 2011, 77(21): 7721-7729.
[9] GUYON K, BALAGUE C, ROBY D, et al. Secretome analysis reveals effector candidates associated with broad host range necrotrophy in the fungal plant pathogen Sclerotinia sclerotiorum [J]. BMC Genomics, 2015, 15: 336-354.
[10] LYU Xueliang, SHEN Cuicui, FU Yanping, et al. A small secreted virulence-related protein is essential for the necrotrophic interactions of Sclerotinia sclerotiorum with its host plants [J]. PLoS Pathogens, 2016, 12(2):1-28.
[11] WANG Xinyu, LI Qian, NIU Xiaowei, et al. Characterization of a canola C2 domain gene that interacts with PG, an effector of the necrotrophic fungus Sclerotinia sclerotiorum [J]. Journal of Experimental Botany, 2009, 60(9): 2613-2620.
[12] ZHU Wenjun, WEI Wei, FU Yanping, et al. A secretory protein of necrotrophic fungus Sclerotinia sclerotiorum that suppresses host resistance [J]. PLoS ONE, 2013, 8(1):1-19.
[13] ZHAO Peibao, REN Aizhi, XU Houjuan, et al. The gene fpk1, encoding a cAMP-dependent protein kinase catalytic subunit homolog, is required for hyphal growth, spore germination, and plant infection in Fusarium verticillioides [J]. Journal of Microbiology and Biotechnology, 2010, 20(1): 208-216.
[14] ROMERO R M, ROBERTS M F, PHILLIPSON J D. Chorismate mutase in microorganisms and plants [J]. Phytochemistry, 1995, 40(4):1015-1025.
[15] 丁麗娜, 杨国兴.植物抗病机制及信号转导的研究进展[J].生物技术通报,2016, 32(10):1-9.
[16] YANG Youxin, AHAMMED G J, WU Caijun, et al. Crosstalk among jasmonate, salicylate and ethylene signaling pathways in plant disease and immune responses [J]. Current Protein and Peptide Science, 2015, 16(5):450-461.
[17] STRACK D. Phenolic metabolism [M]∥DEY P M, HARBORNE J B. Plant Biochemistry. San Diego:Academic Press, 1997:387-416.
[18] DEWICK P M. The biosynthesis of shikimate metabolites [J]. Natural Product Reports, 1998, 15:17-18.
[19] ARMIN D, KERSTIN S, MATTHIAS M, et al. Metabolic priming by a secreted fungal effector [J]. Nature, 2011, 478:394-398.
(责任编辑: 杨明丽)

