纳米粒载体传输Bcl-xl siRNA的抗肿瘤活性的研究
李文婷,段醒妹,夏厚林*
肿瘤是当今世界上的共同医学问题,肿瘤严重影响着人类的健康[1],随着现代医学的发展与进步,肿瘤的治疗已经由传统的化疗及手术外科治疗转变为多种新型治疗方法,其中基因治疗在肿瘤治疗中显示出其独特的治疗优势。RNA干扰是基因治疗中常用的技术手段,是指内源性或者外源性与靶细胞的转录产物mRNA存在同源互补序列的双链RNA在细胞内特异地降解该mRNA,从而致使特异性的基因有效封闭的过程[2]。而裸siRNA在生物体内容易被核酶降解,转染效率低,因此需要寻求安全的基因载体来实现基因药物的有效递送。本实验制备得到纳米粒载体,并对其粒径和电位进行了测定,通过阳离子胶束递送Bcl-xl siRNA递送至C26细胞中,抑制Bcl-xl 基因的表达,从而引发C26细胞的凋亡,进一步达到抑制C26细胞生长的效果。
1 材料
1.1 材料
C26细胞(美国 ACTT;Bcl-xl siRNA(上海吉玛基因);(2,3-二油酰基-丙基)-三甲胺(DOTAP)(美国Avanti);聚乙二醇-聚己内酯(MPEG-PCL);细胞培养基(美国Hyclone);胎牛血清(美国 Hyclone);FAM siRNA(上海吉玛);MTT、二甲基亚砜(天津市科密欧化学试剂有限公司);Trizol RNA分离试剂(美国invitrogen公司);二氯甲烷,三氯甲烷,乙酸乙酯、氯仿、异丙醇、95%乙醇(成都科龙试剂);4%多聚甲醛(上海经科化学科技有限公司);结晶紫染液(美国Amresco);细胞凋亡试剂盒(南京凯基生物公司);PCR试剂盒(Prime ScriptTM Kit reagent Kit with gDNA Eraser)
1.2 仪器
JA1003电子天平(上海顺宇恒平科学仪器有限公司);EYELAN-1200A旋转蒸发仪(日本东京理化器械株式会社);EYELA-CCA-1111低温冷却液循环泵(东京理化器械株式会社);ZEN-3600激光粒度仪(英国Malvern);DZF-6090真空干燥箱(上海一恒科学仪器有限公司);紫外检测仪(美国Bio-RAD);低速离心机(上海赛默飞世尔仪器有限公司);流式细胞仪(美国BD Biosciences);酶联免疫检测仪(上海赛默飞世尔仪器有限公司);CO2 细胞培养箱(上海赛默飞世尔仪器有限公司);Q-PCR仪(加拿大Applied Biosystem)
2 方法与结果
2.1 方法
2.1.1 纳米粒DMP的制备 称取20 mg DOTAP和40mgMPEG-PCL,溶于4 mL的二氯甲烷,转移至梨形瓶中,在55℃水浴条件下1小时,旋转蒸发形成一层薄膜,加入5 mL的超纯水,在55℃条件下水浴15分钟,用超纯水定容至5 mL制备得到12 mg﹒mL-1的纳米粒DMP,置于4℃条件下保存。
2.1.2 纳米粒DMP的表征 对制备的阳离子胶束采用马尔文激光粒度仪中进行粒径和zeta电位的测定。吸取20 μl DMP溶液,用1 mL超纯水稀释100倍后放入设置温度为25℃,平衡时间为2分钟,所有结果测定3次。
2.1.3 纳米粒DMP的细胞毒性实验 将C26细胞接种于96孔板中,每孔1.2×104个细胞,且每孔添加100μL含10%胎牛血清及1%双抗的DMEM培养基。24中小时后,将100 μL浓度为0.1,0.15,0.2,0.3,0.4,0.6,0.8,1.2 μg﹒mL-1的DMP胶束及PEI25K加入相应的孔中,每组设6个复孔。继续培养72小时后,每孔加入20μLMTT溶液(5 mg﹒mL-1),继续培养4小时后小心倒掉上清液,每孔加入150 μL DMSO,摇床低速震荡10分钟使结晶完全溶解。同时设置对照组。利用酶联免疫检测仪在570 nm波长下测定各孔吸光度A。采用SPSS软件对数据处理计算出半数抑制率(IC50)。
2.1.4 体外基因沉默表达检测试验(Quantitative Realtime PCR,Q-PCR) Bcl-xl siRNA靶序列:5′- AAG GAU ACA GCU GGA GUC AGU-3′;以Scramble siRNA靶序列:5′-AAU UCU CCG AAC GUG UCA CGU-3′为阴性对照siRNA。将C26细胞接种于6孔板中,每孔13×104个细胞,且每孔添加2mL含10%胎牛血清及1%双抗的DMEM培养基。24小时后,用等量无血清DMEM培养基清洗并替换。依次加入制备的DMP、DMP/Scramble siRNA、DMP/siBclxl继续培养72小时,以加等量培养基作为空白对照。用TRIzol™ Reagent提取C26细胞中总RNA,并用SuperScript II逆转录酶测定法(Invitrogen)合成cDNA。实时定量PCR用SYBR GreenER定量PCR SuperMix Universal试剂盒(Invitrogen)进行。在AB7500实时PCR系统上用标准循环程序进行反应:50℃2分钟,95℃10分钟,40个循环的95℃15秒和60℃1分钟Applied Biosystems,Foster City,CA)。用于检测小鼠Bcl-x1(正向; 5"-TCG GGA TGG AGT AAA CTG GG-3",反向; 5"-CCA CGC ACA GTG CCC C-3"),和GAPDH(正向; 5"-ATG GGG AAG GTG AAG GTC G-3" -TAA AAG CAG CCC TGG TGA CC-3")。
2.1.5 纳米粒DMP传输Bcl-xl siRNA的体外抗肿瘤实验 将C26细胞接种于96孔板中,每孔1.2×104个细胞,且每孔添加100 μL含10%胎牛血清及1%双抗的DMEM培养基。24小时后,将100 μL的不同浓度的DMP/siBcl-xl加入相应的孔中,每组设置6个复孔。继续培养72小时后,每孔加入20 μL MTT溶液,继续培养4小时后小心倒掉上清液,每孔加入150μLDMSO,摇床低速震荡10分钟使结晶完全溶解。同时设置对照组。利用酶联免疫检测仪在570 nm波长下测定各孔吸光度A,并按照以下公式计算细胞存活率。
2.1.6 平板克隆形成实验 将生长状态良好的C26细胞接种到6孔板中,使每个孔中的细胞数为1000个,并添加2 mL完全培养基,放入培养箱培养。待细胞贴壁后按照试验设计向孔中分别加入DMP、DMP/Scramble siRNA、DMP/siBcl-xl(50nM)、DMP/siBcl-xl(100nM)、DMP/siBcl-xl(200nM)后继续培养1-2周,每日观察细胞生长状况,3-4天小心换液,以加等量培养基作为空白对照。待细胞生长至肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心漂洗。每孔加入适量4%多聚甲醛固定液固定细胞10分钟左右。弃固定液,加入结晶紫染液染色10-15分钟,用流动的水缓慢小心冲洗去染液,在空气中晾干,用肉眼直接计数克隆数,计算克隆形成率。
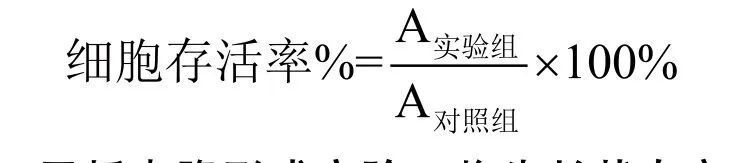
2.1.7 纳米粒传输Bcl-xl siRNA的抗肿瘤细胞凋亡实验 将生长状态良好的C26细胞接种于24孔板中,每孔加入500 μL含5×104个细胞的包含10%FBS和1%双抗的DMEM培养基。24小时后,用等量无血清DMEM培养基清洗并替换。依次加入制备的DMP、DMP/Scramble siRNA、DMP/siBcl-xl转染72小时,以加等量培养基作为空白对照,每组设3个复孔。将细胞用不含EDTA的胰蛋白酶消化吸收并用PBS洗涤细胞(2000 rpm离心5分钟后弃上清液)后用加入预冷的70%乙醇4℃固定过夜。次日1500 r﹒min-1离心5分钟弃固定液,用预冷PBS洗2遍。每个流式管加入200 μLPI染液震荡均匀,避光染色30分钟。用流式细胞仪检测细胞凋亡率。
2.2 实验结果
2.2.1 纳米粒DMP的表征 制备所得的纳米粒DMP呈均匀的半透明的状态,平均粒径为144.8 nm,可完全分散在水溶液中,多分散系数PDI为0.183, zeta电位为46.4mV。粒径和zeta电位结果如图所示。
2.2.2 纳米粒DMP的细胞毒性实验 阳离子胶束的细胞毒性实验用MTT法在293T细胞中进行测定。如图所示,PEI25K在293T细胞中表现出较高的细胞毒性,其IC50为0.83 μg﹒mL-1而阳离子胶束DMP的IC50为3.7 μg﹒mL-1,相比PEI25K,具有较低的细胞毒性。因此,阳离子胶束DMP比PEI25K的细胞毒性更低,能够作为一种安全的纳米传输siRNA。
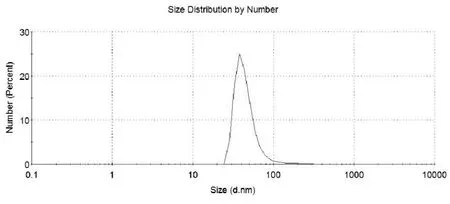
图1 DMP胶束的粒径分布
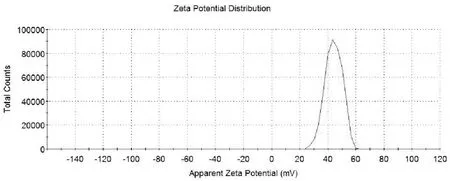
图2 DMP的zeta电位
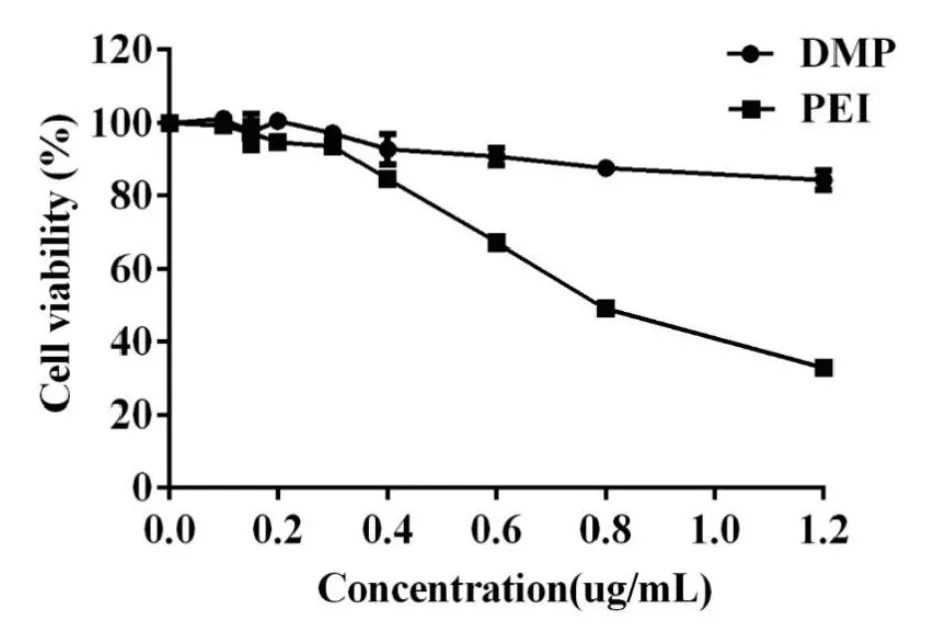
图3 DMP在293T细胞中的细胞毒性
2.2.3体外基因沉默表达检测(Q-PCR)结果
C26细胞中Bcl-xl的mRNA 在siRNA干扰后的含量如图所示。通过Q-PCR的结果显示,与空白组与DMP/Scramble siRNA 组相比,DMP/siBcl-xl组有效地降低了Bcl-xl信使RNA的水平。说明DMP能够将siRNA有效地导入并沉默Bcl-xl基因的表达。
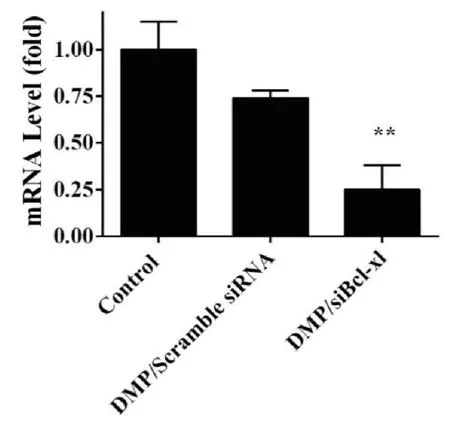
图4 DMP/siBcl-xl 明显地减少了Bcl-xl基因的mRNA 水平
2.2.4 DMP/siBcl-xl的体外抗肿瘤实验 我们通过用DMP传输siRNA至C26细胞中研究DMP/siBcl-xl能够抑制C26细胞的增殖。C26细胞的生存能力用MTT来测定,结果如图所示。结果显示DMP/siBcl-xl(50nM 和100nM)的生存率分别为69.6%±3.3%,56.3%±1.9%,与DMP组相比,其生存率远低于DMP组。实验结果表明DMP/siBcl-xl能够有效地抑制转染的C26细胞的生存能力,DMP组没有明显的减少细胞生存能力。结果表明Bcl-xl siRNA能够抑制Bcl-xl 基因的表达并且引发相关转录基因的沉默,所以DMP/siBcl-xl 能够实现C26细胞的抗增殖作用。
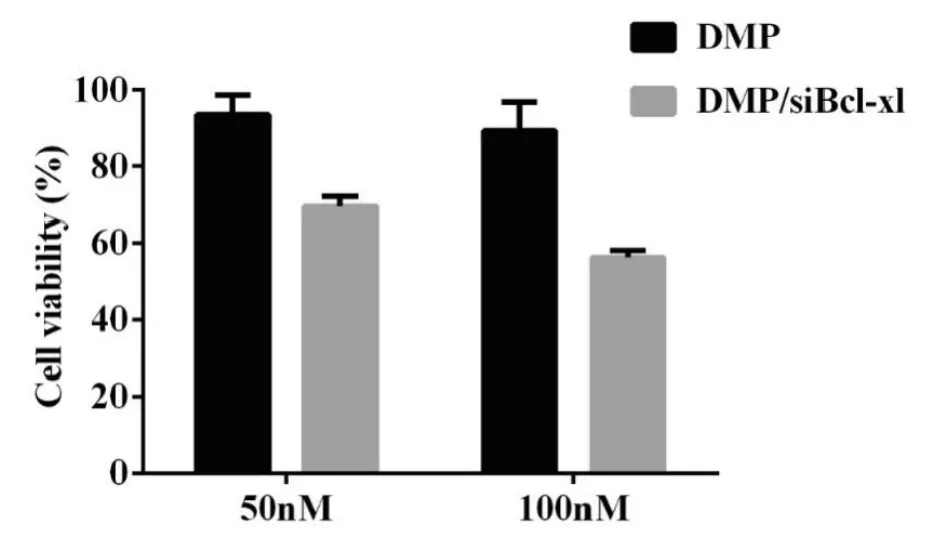
图5 DMP/siBcl-xl 对C26细胞的体外抗肿瘤效果
2.2.5 克隆形成实验 为了进一步研究DMP/siBclxl 的抗肿瘤活性,我们进行了克隆形成实验。如图所示,从照片中可明显看出与空白对照组相比较,DMP组与DMP/Scramble siRNA 组形成的克隆数明显较少,而DMP/siBcl-xl组形成的克隆数则比二者更少。通过对形成的克隆数进行计数,从而计算得到DMP/siBcl-xl 在50 nM,100 nM,200 nM的浓度下的抑制率分别为59.08%±6.82%, 90.90%±2.28%,98.98%±0.26%。结果显示,五个实验组均抑制了C26细胞的增殖,但DMP/siBcl-xl 显示出更强的抑制作用,再次证明DMP/siBcl-xl能够抑制C26细胞的增殖,具有显著的抗肿瘤活性。
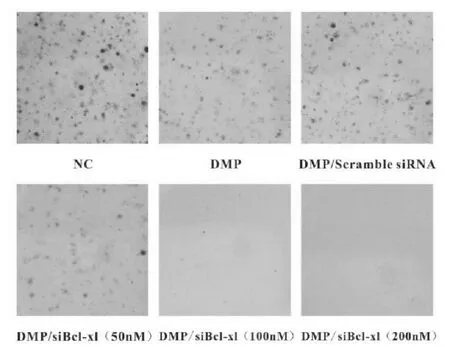
图6 经不同浓度DMP/siBcl-xl转染后的克隆形成图片
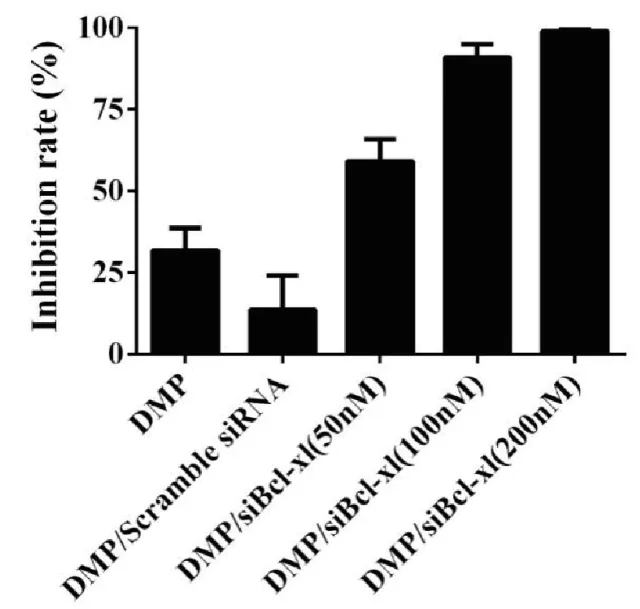
图7 经不同浓度的DMP/siBcl-xl转染后的克隆形成的抑制率
2.2.5 DMP/siBcl-xl的抗肿瘤细胞的凋亡实验 为了验证DMP/Bcl-xl siRNA引起的C26细胞增殖以及生存能力的下降是否与细胞的凋亡有关,用DMP、DMP/Scramble siRNA和DMP/siBcl-xl对C26细胞进行转染后,收集细胞测定凋亡细胞的数量。结果如图所示,DMP组的细胞凋亡率为5.6%±0.8%,DMP/Scramble siRNA组的细胞凋亡率为11.2%±1.1%,而DMP/siBcl-xl组的细胞凋亡率为33.0%±3.8%,该结果与MTT以及克隆形成实验结果一致,均证明DMP/siBcl-xl其治疗的机制可能就是通过引起细胞的凋亡来抑制癌细胞的增殖与生长。
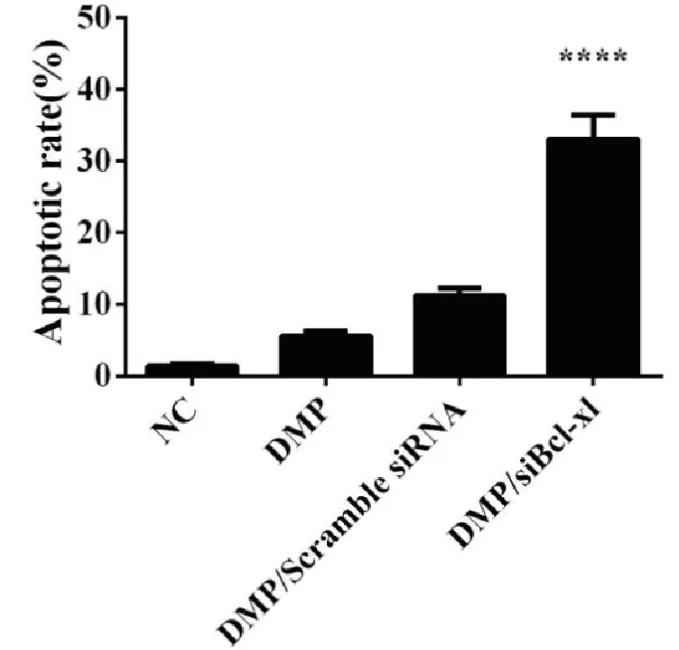
图8 DMP/siBcl-xl siRNA引起C26细胞凋亡情况
3 讨论
结肠癌是一种常见的恶性肿瘤,尽管可以通过手术治疗和化疗来缓解病情的恶化,但接近一半的患者后期恢复情况极差,在五年内出现复发或者死亡的情况。因此,越来越多的研究致力于新型的肿瘤治疗手段的发展。RNA干扰作为一种基因治疗技术,已经被广泛应用于肿瘤的治疗中。本实验采用了本实验通过基因治疗技术研究小干扰RNA分子Bcl-xl siRNA在纳米粒DMP的递送下能够沉默Bcl-xl基因,进而抑制Bcl-xl基因的表达,抑制C26细胞的生长,进一步引发C26细胞的凋亡,表明本实验所制备的DMP 纳米粒能够有效地将Bcl-xl siRNA递送至C26细胞中,实现体外抑制C26细胞生长的抗肿瘤效果。Bcl-2家族是抗凋亡基因家族,目前发现的Bcl-2家族成员超过25种[3],已在哺乳动物中发现 Bcl-2 是重要的抑凋亡蛋白[4~5]。
有学者认为 Bcl-2 通过抗氧化剂或抑制氧自由基的产生而发挥其抑制细胞凋亡的功能[6]。Bcl-xl基因是Bcl-2家族中的一员,在抑制细胞凋亡中发挥着重要作用,Bcl-xl不仅可以抑制细胞凋亡,而且可以抑制细胞坏死[7~10]。在课题中,我们所选用的siRNA为针对Bcl-xl设计的siRNA。所以针对Bcl-xl基因设计的siRNA是为了使Bcl-xl基因沉默不表达从而达到促进肿瘤细胞凋亡的目的。本实验中,我们制备出表面带正电荷的阳离子纳米粒,可以与带负电荷的Bcl-xl siRNA通过静电作用形成DMP/siBcl-xl复合物,进入细胞内发挥出调节Bcl-xl基因表达,并促进细胞凋亡的效果。本研究采用RNA干扰技术特异性沉默Bcl-xl基因,从而下调结肠癌细胞C26内Bcl-xl的表达,抑制C26细胞的增殖和生长,进一步引发C26细胞的凋亡。综上所述,DMP/siBcl-xl在体外对C26细胞有显著的抗肿瘤活性,为之后的体内抗肿瘤活性的研究奠定基础。

