参麦注射液联合化疗治疗非小细胞肺癌的Meta分析
彭婉,王建,马骁,陈念,马荣,谢倩,董泰玮,高思佳,敬勇,李敏
肺癌(lung cancer)是全球最常见、导致死亡人数最多的呼吸系统恶性肿瘤。据中国癌症统计报告,中国2015年有429万例肺癌新发病例,281万例肺癌死亡病例[1]。肺癌可以分成小细胞肺癌和非小细胞肺癌(Non-small cell lung cancer,NSCLC),其中NSCLC占所有肺癌病例的85%以上,死亡率高达80% ~90% ,临床主要表现为咳嗽、血痰、气促、胸痛、发热、疲乏无力等[2],由于NSCLC的病理机制非常复杂且目前尚未阐释清楚,因此目前缺乏该病的根本疗法。化学药物治疗(化疗)是非小细胞肺癌患者的一种重要治疗措施,针对不能手术治疗的患者,能够明显延缓肿瘤的进程。尽管化学药物在不断改善,其所带来的不良反应仍然较大,甚至有的患者因不能耐受严重的副反应而放弃治疗,因此,寻找一种增强化疗疗效同时减少毒副作用的药物,是目前肺癌治疗的研究方向之一。值得注意的是临床研究证实,联合用药是增强疗效,降低化疗不良反应的主要方法,如使用黄芪汤联合化疗治疗结肠癌已得到医疗人员的普遍认同。
参麦注射液是一种纯中药制剂,由红参、麦冬提取物组成。目前研究已经证实人参含有人参二醇类、人参三醇类、齐墩果酸类等多种人参单体皂苷,尚含有人参多糖、多肽类化合物等活性物质,这些物质具有抗肿瘤、提高免疫功能、增强造血功能等作用[3]。麦冬的主要化学成分有皂苷、多糖、黄芪和氨基酸等,现代药理研究表明,麦冬具有抗肿瘤,增强免疫功能等作用[4]。
目前很多已发表的文献报道参麦注射液联合化疗治疗NSCLC能够提高近期疗效,减轻毒副作用,改善生活质量[5~30]。然而目前所进行的大多是临床随机对照实验,系统地对参麦注射液治疗NSCLC有效率评估的文献并不多见。本研究采用循证医学的方法,检索数据库中自建库至2017年10月关于参麦注射液联合化疗治疗非小细胞肺癌的临床随机对照试验(randomized controlled trial, RCT)文献,通过Meta分析,科学、规范地评估参麦注射液用于辅助化疗治疗非小细胞肺癌治疗的效果,以指导临床NSCLC的治疗。
1 资料与方法
1.1 研究对象与类型
检索中国知网(CNKI)、万方、维普、Pubmed、Medline及Cochrane Library六大数据库中自建库起到2017年10月关于单纯使用化疗治疗非小细胞肺癌与化疗治疗非小细胞肺癌加用参麦注射液进行对比的RCT试验,无论是否使用随机化隐藏、盲法和提出失联与退访。
1.2 干预措施
实验组干预措施为参麦注射液静滴联合化疗;对照组干预措施为单纯化疗。
1.3 纳入标准
文献研究应符合以下纳入标准。(1)为RCT,分组组间均衡性较好,具有可比性;(2) 所有病例均经病理、细胞学检查证实为NSCLC患者,年龄、性别不限,治疗前无化疗禁忌症,肝肾功能、血液学、心电图无明显异常者;(3) 观察时间≥10d,样本量≥20例;(4) 2组患者性别、年龄、种族、病程及疾病的严重程度等一般资料的均衡性较高,组间具有可比性。
1.4 排除标准
文献研究方法凡涉及一下任何一条即排除。(1)数据有误、不详或无法获得数据的文献;(2) 联合手术或放疗;(3) 参麦注射液非静脉输入,经其他途径输入;(4) 无本研究关注的结局指标;(5) 文献调研、综述等题材,动物实验、机制研究等非临床试验;(6) 不符合“1.3纳入标准”中任何一条者。
1.5 结局评价指标
(1) 近期疗效:有效率=(CR+PR)/总例数×100%,按WHO抗肿瘤药物客观疗效标准评价疗效[31],分为完全( CR,病变完全消失,时间超过1个月) ,部分缓解(PR,肿块缩小50%以上,时间不少于4周),无变化(SD,肿块缩小不及50%或增大未超过25%)和进展(PD,1个或多个病变增大25%以上或出现新病灶)。(2) 生活质量按KPS 评分( Karnofsky performance scale)的增加率评定[32]。(3) 中医症状评分:采用中医病症诊断疗效标准编审委员会制定的中医疗效评定标准,第1周期化疗前2天、第2周期化疗后两周观察咳嗽、咯血、胸痛、气促、胃纳、乏力、消瘦、自汗或盗汗的变化,根据积分法评定中医症状疗效[33]。症状无、轻、中、重分别记1分、2分、3分、4分。(4) T细胞亚群:使用流式细胞仪测定T细胞亚群CD3、CD4、CD8、CD4/CD8的水平。
1.6 文献检索策略
由2名评价员独立检索以下数据库:中国期刊全文数据库(CNKI)、维普中文科技期刊数据库(VIP)、万方数字化期刊全文数据库、Pubmed、Medline和Cochrane Library有关内容。所有数据库均检索至2017年10月。中心检索词为:“参麦/shenmai”、“参麦注射液/shenmai injection”、“肺癌/lung cancer”、“非小细胞肺癌/non-small cell lung cancer”。
1.7 数据提取
通过阅读文献题目和摘要,筛选明显不相关的文献。如果摘要中说明为RCT,且分组分别为联合用药组和单纯化疗组,治疗时间≥10d,则下载并阅读原文。按照“1.3纳入标准”和“1.4排除标准”的要求进行筛选,同时符合“1.5结局评价指标”的要求方可纳入。2名评价员合理筛选符合纳入标准的文献,列表进行对照研究,提取基本信息,整理数据,建立相应数据库并且相互核对数据。若2名评价员意见不统一,则由第3位评价者介入进行商讨。提取内容包括偏倚风险评估内容中随机分组的方法和过程、研究对象的基本信息(病例数、性别分布、给药方式、给药剂量、疗程、NSCLC分级情况等)、临床治疗有效率、结局评价指标以及相关指标的数据等。
1.8 纳入文献的质量评价
2名评价员对符合要求的文献进行评估。采用Cochrane法严格评价所有纳入的文献,主要有随机方法、盲法、提出退出与失访、数据不完整与选择性报道偏倚等5个方面。本研究所选取的文献均提及对患者进行“随机分组”相关字眼,符合RCT要求。对于“随机”的描述,描述了具体正确的随机方法为“low risk”,未具体描述方法为“unclear risk”;如选用双盲并且提及了双盲方法的为“low risk”,选用“双盲”为“unclear risk”;数据报道不完整为“high risk”。
1.9 统计学方法
ReviewManager5.3软件对相关数据进行Meta分析,该软件由Cochrane协作商提供,二分类变量用比值比(OR)作为效应量,连续变量指标采用加权均数差值(WMD)。用卡方检验等分析方法检验各同类研究之间的异质性,并用P和I2来评价异质性的大小。当检验结果为P>0.1、I2<50%时[35],则认为观察组和对照组的结果间具有同质性,采用固定效应模型进行Meta分析;当检验结果为P≤0.1,I2≥50%时,则认为观察组和对照组的结果间具有异质性,采用随机效应模型,并进一步进行亚组分析Meta回归分析或定性分析。对于发表偏倚的评价采用到漏斗图进行标示。
2 结果
2.1 基本信息统计
2.1.1 检索及筛选结果 按照“1.6 文献检索策略”,初检出文献214篇。通过阅读论文题目及摘要后,筛掉重复的文献98篇,剩余116篇文献纳入进一步的筛选;排除明显不相关的以及符合排除标准的文献66篇,共收集参麦注射液联合化疗用于非小细胞肺癌治疗的临床研究50篇;进一步下载全文进行阅读,排除诊断标准、疗效评估和治疗时间等不符合纳入标准的文献24篇,最终纳入RCT文献研究26篇[5~30]。均为己发表的文献,发表时间自建库起到2017年10月。文献筛选流程及结果如图1所示。
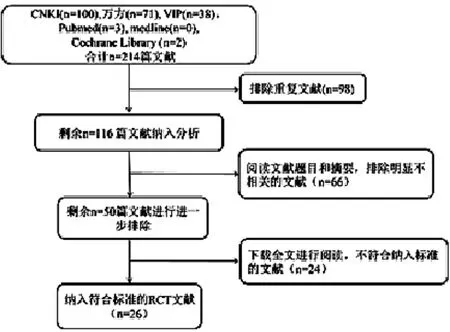
图1 文献筛选流程及结果
2.1.2 纳入文献的质量评价研究 采用Cochrane偏倚风险评价工具评估符合纳入标准的文献质量,26篇[5~30]RCT文献均提到使用随机分配法,其中仅有9篇[10-12,14,17,24,25,28,29]采用随机数字表法,3篇[19.23,27]采用信封法。但26篇[5~30]均未提到分配方案的随机化隐藏,均未提及是否使用盲法,均未提及是否有退出与失访病例,1篇[24]数据报道不完整,7篇[7,15,19,21-23,29]存在选择性报道偏倚,见图2;因此,纳入评价的文献研究质量不高。
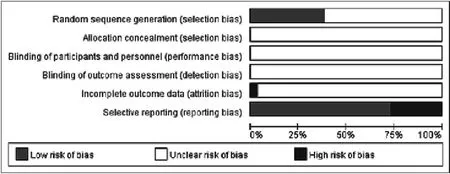
图2 纳入文献的质量评价情况
2.1.3 结局指标选择 26篇RCT文献的病例统计中,17篇[16,18-36]采用近期疗效有效率为主要结局评价指标;3篇[9,18,23]报道了中医症状评分;15篇[7,10,13,15-17,20-23,25-28,30]报道了KPS评分增加率;3篇[5,6,21]报道了T淋巴细胞含量百分比。
2.2 Meta分析结果
2.2.1 临床疗效综合分析 共23篇[5-8,10-13,16,17,19-30]文献进行报道了临床疗效,合计1628例患者,其中实验组834例,对照组794例。结果表明,实验组和对照组之间无异质性(P= 0.99,I2= 0%),故本次Meta分析采用固定效应模型。结果显示:联合用药组显著优于单纯化疗组,提示参麦注射液联合化疗治疗非小细胞肺癌可显著提高有效率[OR: 1.44,95%CI, (1.18,1.76) ;P=0.003],如图3所示。对该指标的漏斗图分析结果显示略不对称,存在一定的发表偏倚,如图4所示。
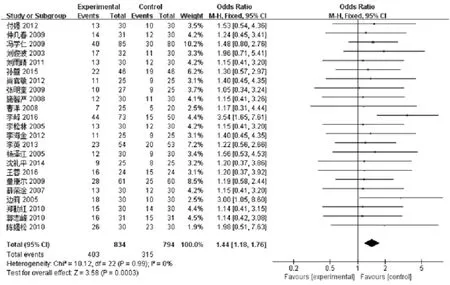
图3 参麦注射液治疗非小细胞肺癌的临床综合疗效有效率森林图
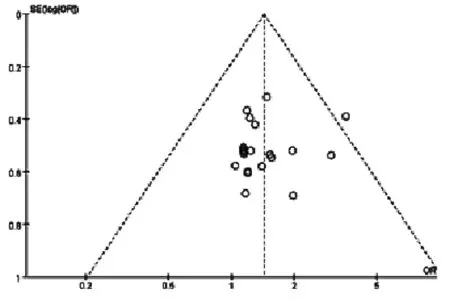
图4 参麦注射液治疗非小细胞肺癌的临床综合疗效有效率漏斗图
2.2.2 中医症状评分 中医症状评分是采用中医病症诊断疗效标准编审委员会制定的中医疗效评定标准,参麦注射液是在中医药理论指导下,具有益气固脱,养阴生津,生脉等功效的纯中药制剂,使用中医症状评分更能客观地评定参麦注射液对NSCLC的疗效。共3项[9,18,23]研究报道了中医症状评分,共计241例患者,其中实验组121例,对照组120例。结果表明,治疗后,实验组和对照组之间存在异质性(P<0.00001,I2=97 %),故本次Meta分析采用随机效应模型,结果显示:说明经过治疗,实验组患者较对照组患者的病情与症状缓解程度高,提示参麦注射液联合化疗治疗可从症状方面提高非小细胞肺癌临床治疗效果[MD: -5.01,95%CI, (-8.93, -1.09);P=0.01],如图5所示。
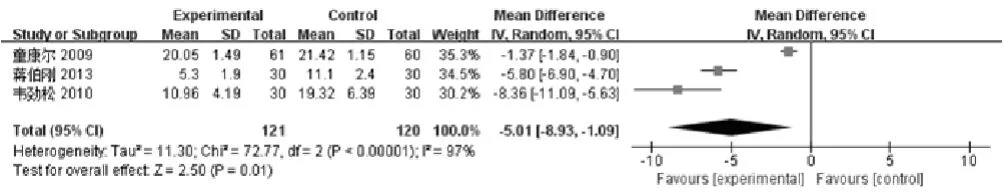
图5 参麦注射液治疗非小细胞肺癌的中医症状评分森林图
2.2.3 卡式评分 卡式评分是Karnofsky(卡氏,KPS,百分法)功能状态评分标准。得分越高,健康状况越好,越能忍受治疗给身体带来的副作用,因而也就有可能接受彻底的治疗。以卡式评分标准为指标,治疗后增加>10分者为提高,减少10分者为降低,增加或减少<10分者为稳定;本研究纳入的文献中共有15篇[7,10,13,15-17,20-23,25-28,30]报道了KPS评分,共计1127例患者,其中实验组572例,对照组555例。分析结果显示,治疗后,实验组和对照组无异质性(P=1.00,I2=0 %),故本次Meta分析使用固定效应模型,结果显示说明实验组较对照组改善程度更大,提示参麦注射液可显著提高患者的卡式评分增加率,更有利于患者机体功能状态的改善[OR: 3.18,95%CI, (2.42, 4.19);P<0.00001],如图6所示。对该指标的漏斗图分析结果显示基本不对称,不存在发表偏倚,如图7所示。
2.2.4 T细胞亚群 T细胞亚群水平反映了机体免疫力的高低,其中CD3淋巴细胞为T淋巴细胞,CD4 T淋巴细胞包括辅助性T淋巴细胞,CD8 T淋巴细胞为抑制性T 细胞,T淋巴细胞的相互调节维持机体免疫平衡,CD4、CD8 T淋巴细胞是目前认为最重要的病毒、细菌清除细胞,但体内CD4、CD8 T淋巴细胞百分比在病毒感染和长期反复慢性炎症时减少,导致机体免疫力降低。通过对NSCLC患者T淋巴细胞亚群的异常变化进行检测,能够了解其免疫动态[36]。3篇[5,6,21]文章报道了治疗后T细胞亚群(CD3、CD4、CD8、CD4/CD8)的水平,共计232例患者,其中实验组128例,对照组104例,结果如图8所示。
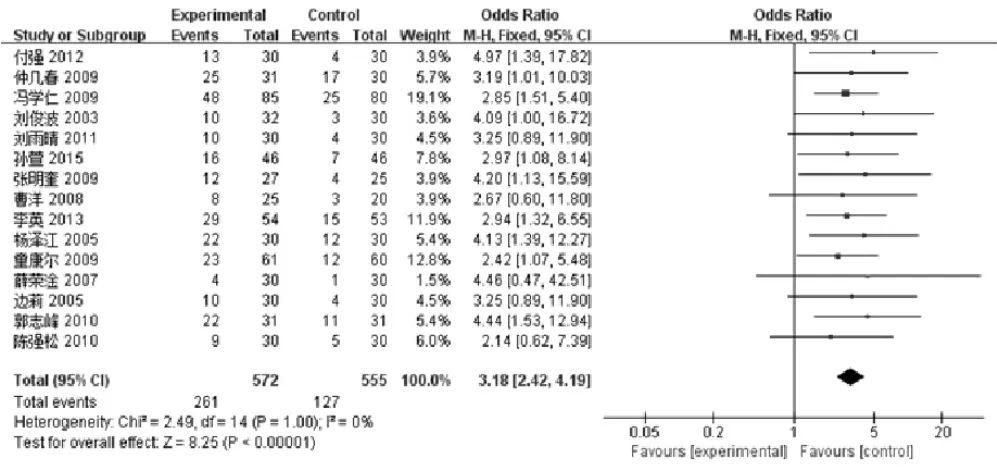
图6 参麦注射液治疗非小细胞肺癌的卡氏评分增加率的森林图
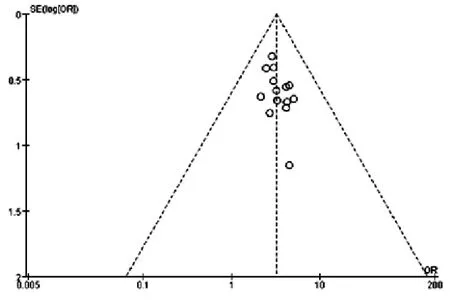
图7 参麦注射液治疗非小细胞肺癌的卡式评分增加率的漏斗图
(1) CD3:3篇文献报道了治疗后CD3的水平,结果显示,治疗后实验组和对照组存在异质性且有显著性差异(P=0.01,I2=83 %),故本次meta分析采用随机效应模型,结果显示:[MD:8.96,95%CI, (5.27,12.66);P<0.00001],说明经过治疗,实验组患者较对照组患者体内CD3水平升高更多,提示参麦注射液可显著提高化疗治疗非小细胞肺癌患者的CD3水平,提升其免疫力。
(2) CD4: 3篇文献报道了治疗后CD4的水平,分析结果显示,治疗后,实验组和对照组存在异质性且有显著性差异(P<0.00001,I2=95 %),故本次meta分析采用随机效应模型,结果显示:[MD: 9.29,95%CI, (2.47,16.11);P=0.008,说明经过治疗,联合用药组患者较单纯化疗组患者体内CD4水平增加更多,提示参麦注射液可显著提高化疗治疗非小细胞肺癌患者的CD4水平,提升其免疫功能。
(3) CD8: CD8 T细胞作为适应性免疫的重要组成部分,在清除各种病原微生物和肿瘤细胞中发挥关键作用,其受到抗原刺激后能够迅速地活化、增殖,在清除抗原后,效应CD8 T细胞大量消亡,仅小部分形成具有抗原特异性地记忆CD8 T细胞[37]。3篇文献报道了治疗后CD8的水平,结果显示,治疗后,实验组和对照组存在异质性且有显著性差异(P= 0.08,I2=60 %),故本次meta分析采用随机效应模型,结果显示:[MD:-8.43,95%CI, (-10.74,-6.12);P<0.00001],说明经过治疗,联合用药组患者较单纯化疗组患者体内CD8水平降低更多,提示参麦注射液可显著降低化疗治疗非小细胞肺癌患者的CD8水平,提升其免疫能力。
(4) CD4/CD8: 3篇文献报道了治疗后CD4/CD8的水平,结果显示,治疗后,实验组和对照组存在异质性且有显著性差异(P<0.00001,I2=94 %),故本次meta分析采用随机效应模型,结果显示:[MD: 0.72,95%CI, (0.15,1.29);P= 0.01],说明经过治疗,实验组患者较对照组患者体内CD4/CD8水平增加更多,提示参麦注射液可显著增加化疗治疗非小细胞肺癌患者的CD4/CD8水平,提升其免疫功能。
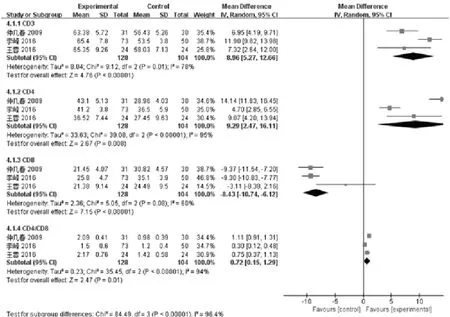
图8 参麦注射液治疗非小细胞肺癌的T细胞亚群森林图
3 讨论
目前,多数学者认为中医药辅助治疗中晚期NSCLC具有稳定病灶、防止肿瘤细胞转移、改善临床症状、提高患者生存质量、延长生存期等潜在的优势[37]。中医认为恶性肿瘤患者邪气内侵,正气虚弱,单纯化疗进一步损伤患者正气,因而降低免疫能力,因此中医认为肿瘤治疗中应坚持补益气血、扶助正气[38]。
亦有国外学者研究发现癌细胞可以通过阻断T细胞的抑制信号诱导肿瘤微环境的免疫耐受,亦能通过抑制细胞因子表达诱导免疫抑制状态来改变[39~40]。故提升免疫力对NSCLC的治疗具有重要意义。
由于肿瘤的发生机制复杂,其机制还未探索清楚,目前缺乏肿瘤的根治办法。随着医学模式的改变,患者的生存质量已经成为了治疗肿瘤的重要评价内容,尤其是晚期NSCLC患者普遍体质虚弱,免疫能力低下,自身代谢能力低,化疗耐受性差,恶性肿瘤的治疗目的已经不仅仅是杀灭肿瘤细胞、缩小肿瘤提及,更重要的是提升患者的生存质量和生存期。
参麦注射液由人参和麦冬2味药提取而成,其中人参的传统功效为“大补元气,补脾益肺,生津止渴,安神益智”,麦冬则具有“润肺养阴,益胃生津,清心除烦,润肠通便”的之功,二者均归肺经,合用则具养阴生津、生脉及气津双补之效[42]。现代药理研究也发现,参麦注射液对肺有一定的保护作用,临床上广泛用于NSCLC的治疗,同时具有调节免疫功能等作用。
CD3细胞能组成TCR-CD3复合体,传导T细胞信号,CD4细胞与MHC-Ⅱ类分子结合,增强T细胞与抗原提呈细胞或靶细胞之间的相互作用,并辅助TCR识别抗原,CD8细胞与MHC-Ⅰ类分子结合,增强T细胞与抗原提呈细胞或靶细胞之间的相互作用,并辅助TCR识别抗原[43]。因现代研究发现,参麦注射液联合化疗治疗能显著改善非小细胞肺癌患者的治疗效果和生活质量及免疫能力。本研究基于Meta分析,系统评价了参麦注射液联合化疗治疗NSCLC的近期疗效有效率(图3,[OR: 1.44,95%CI,(1.18, 1.76) ;P=0.003])和中医症状评分(图5,[MD: -5.01,95%CI, (-8.93, -1.09);P=0.01]),均具有显著性差异;KPS评分(图6, [OR: 3.18,95%CI, (2.42, 4.19);P< 0.00001])和T细胞亚群(图8,CD3 [MD=8.96,95%CI, (5.27,12.66);P< 0.00001 ];CD4 [MD=9.29,95%CI, (2.47,16.11);P=0.008];CD8[MD=-8.43,95%CI, (-10.74,-6.12);P<0.00001 ]);CD4/CD8 [MD=0.72,95%CI, (0.15,1.29);P= 0.01 ])亦具有显著性差异。其中,近期疗效有效率和中医症状评分是评价参麦注射液疗效的直接指标,其相对单用化疗显著提升提示参麦注射液治疗NSCLC能增强疗效;KPS评分是患者生存质量的评价指标,其升高说明使用参麦注射液后可改善患者生活质量,给患者更舒适的生活体验;T细胞亚群水平是说明免疫功能高低的指标,其结果中变化趋势亦说明了参麦注射液可增强患者免疫功能。综上,临床上采用化疗治疗NSCLC加用参麦注射液能够显著提高单用化疗时有效率及患者的生存质量,为参麦注射液在临床上的合理应用提供了参考。
但本研究纳入的26篇文献参考Cochrane协作网偏倚风险评估标准进行评估,显示整体研究结论的可靠性不足。临床综合疗效有效率和中医症状评分的漏斗图呈不对称分布,提示纳入的26篇文献存在选择性偏倚。系统评价研究结果表明,单纯使用化疗治疗非小细胞肺癌与化疗治疗非小细胞肺癌加用参麦注射液具有显著性差异,但是如何设计高质量的随机对照试验并进行进一步地评估其临床的有效性,有待于进一步探讨。

