GnRH-a反加雌激素对大鼠子宫内膜异位症模型的疗效及复发的研究
张玲玉,刘颖蕾,乔海风,开海丽,刘曼华*,吴刘成
(1.南通大学第二附属医院,江苏 南通 226001; 2.南通市妇幼保健院,江苏 南通 226001; 3.南通大学实验动物中心,江苏 南通 226001)
子宫内膜异位症(endometriosis)是一种妇科常见疾病,在育龄期妇女中的发病率在2%~10%,在不孕妇女中发病率高达50%[1]。临床主要表现为痛经、慢性盆腔痛及不孕,严重影响了妇女的健康和生活质量。子宫内膜异位症在治疗后5年复发率为45%~50%[2]。这个数据在被手术确诊的年龄小于21岁的妇女中甚至可达到56%[3]。子宫内膜异位症需要长期、个体化治疗。作为一种雌激素相关性疾病,抑制内源性雌激素是延缓内异症复发的关键。促性腺激素释放激素受体激动剂(gonadotropin-releasing hormone agonist,GnRH-a)有药物去势的作用,可以迅速将血清雌二醇降低至绝经期水平,但随之而来的潮热、盗汗、情绪波动等低雌激素症状限制了GnRH-a的长期用药。为缓解低雌激素症状,近年来提出来反添加疗法,但目前反添加疗法开始时间和如何用药临床上尚无统一标准[4]。本研究通过自体移植建立大鼠子宫内膜异位症模型,建模成功后,给予亮丙瑞林反加不同剂量的雌激素治疗,比较治疗前后大鼠子宫内膜异位灶体积大小、子宫内膜异位灶组织肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)以及血清糖类抗原125(carbohydrate antigen 125,CA125)的表达水平,评估子宫内膜异位症的治疗效果以及治疗后复发情况。
1 材料和方法
1.1 实验动物
SPF级SD大鼠60只,每只体重180~200 g,2月龄,雌性,购自南通大学实验动物中心[SCXK (苏) 2014-0001],动物从业人员上岗证号:220180114,饲养环境:南通大学实验动物中心[SYXK (苏) 2017-0046],温度:22℃~24℃,湿度:45%~70%,12 h明暗交替,自然饲养。一切进入屏障系统的人、物、饲料、水、空气、铺垫物及各种用品均须经过严格的微生物控制。在常规条件下适应性饲养1周。实验方案经过南通大学实验动物中心动物伦理委员会批准,编号为:20161202-001。无菌手术在南通大学实验动物中心实验室进行[SYXK (苏) 2017-0046]。并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
多克隆抗体TNF-α及StAR一抗(Abcam),DAB染色试剂盒(V9000,中杉金桥),CA125 ELISA试剂盒(ml6024076);注射用醋酸亮丙瑞林微球(天津武田药品有限公司)。光学显微镜,石蜡切片机,游标卡尺,微波炉,移液器,冷冻离心机。
1.3 实验方法
1.3.1 建模
60只SD大鼠术前1 d皮下注射苯甲酸雌二醇(0.1 mg/kg),使所有实验动物处于同一动情周期。手术当天禁食禁饮。SD大鼠予水合氯醛(7%)麻醉后,取大鼠下腹正中、尿道口上端1 cm做一长约2~3 cm纵行切口,结扎子宫系膜血管,再结扎需切除的子宫段的两端,其左侧子宫角切下约1.5 cm长片段,置于37℃无菌PBS缓冲液中,分离子宫内膜,取其0.5 cm × 0.5 cm一段,于腹壁切口两侧从腹肌与皮下筋膜层之间打隧道,将分离的子宫内膜展平置于隧道内,内膜紧贴肌层,缝合切口,整个手术控制在15 min左右[5],将手术完毕的大鼠置于干净的饲养笼中,保温至苏醒。术后予庆大霉素0.1 mL/d肌注3 d预防感染。
1.3.2 分组与给药
建模4周后开腹探查,51只大鼠建模成功。休息3 d,将建模成功的51只大鼠按随机数字表法分为五组:对照组:予生理盐水1 mg/kg皮下注射,共1次;研究组:反加组Ⅰ(10只)、反加组Ⅱ(10只)、反加组Ⅲ(10只)、GnRH-a组(11只)。研究组先予亮丙瑞林1 mg/kg皮下注射[6],共1次,其中反加组Ⅰ、Ⅱ、Ⅲ分别在给药第2周开始予不同剂量的戊酸雌二醇灌胃反加[7],反加组Ⅰ(低剂量雌激素组):25 μg/(kg·d),反加组Ⅱ(中剂量雌激素组):50 μg/(kg·d),反加组Ⅲ(高剂量雌激素组):100 μg/(kg·d),每天1次,共14 d,GnRH-a组在给药第2周予生理盐水灌胃反加,3 mL/(只·d),每天1次,共14 d。在治疗过程中对照组有1只大鼠因切口感染死亡;反加组Ⅰ有1只大鼠因切口感染死亡,2只大鼠因灌胃食道损伤死亡;反加组Ⅱ组有2只大鼠因切口感染死亡;反加组Ⅲ有2只大鼠因灌胃食道损伤死亡;GnRH-a组有2只大鼠因切口感染死亡,1只大鼠因灌胃食道损伤死亡。
1.3.3 取材
分别在亮丙瑞林给药后第4周及第7周,开腹探查,测量内异灶大小,取内异灶组织,置于4%多聚甲醛溶液中保存,石蜡包埋,用于免疫组化检测;用眼眶内眦静脉丛的采血法采血,4℃1000 r/min离心20 min,收集上清,-80℃保存,用于ELISA检测。
1.3.4 免疫组化
组织经中性福尔马林固定后,取材,常规脱水,石蜡包埋,切片,采用LSAB法,染色步骤按照说明书进行,用DAB(二氨基联苯胺)显色后,复染、脱水、透明、封片。以PBS(磷酸盐缓冲液)代替一抗作阴性对照。每批实验均同时设立阴性对照。
1.3.5 ELISA法
用于测定血清中CA125的含量,严格按试剂盒说明的实验步骤检测。
1.3.6 结果判定
显微镜下观察,每张免疫组化切片随机选择3个不同的视野(×400)观察,并判读阳性表达强度和阳性率。染色结果采用半定量分析方法:以染色强度结合阳性细胞数百分比进行评分。染色强度计分:无明显着色为0分,淡黄色或轻微黄色为1分,深黄或棕黄色为2分,棕褐色或黑褐色为3分。阳性细胞百分比即每张免疫组化切片选择3个不同的视野(×400)观察,每个视野计数100个细胞中阳性细胞数,计算阳性细胞平均数:≤5%为评为0分,6%~25%评1分,26%~50%评2分,51%~75%评3分,>75%均评为4分。对每个视野均进行染色强度计分与阳性细胞百分比乘积评分,评分以阳性细胞百分比与染色强度的乘积:0分为阴性,1~6分为弱阳性,7~12分为强阳性。
1.4 统计学方法
2 结果
2.1 大鼠内异症模型建立
建模28 d后开腹探查,60只大鼠中51只建模成功。建模成功的大鼠腹壁,肉眼可见异位病灶呈囊泡样,内充满透亮液体,表面被覆丰富脂肪组织,移植物表明可见新生血管爬行生长,周围结缔组织丰富。HE染色镜下观察异位囊壁由内向外分别为上皮细胞层、间质细胞层及少量纤维结缔组织。上皮细胞呈柱状排列,大部分上皮细胞有分泌现象可见核下空泡,间质层薄,少数可见腺体分布。见图1。
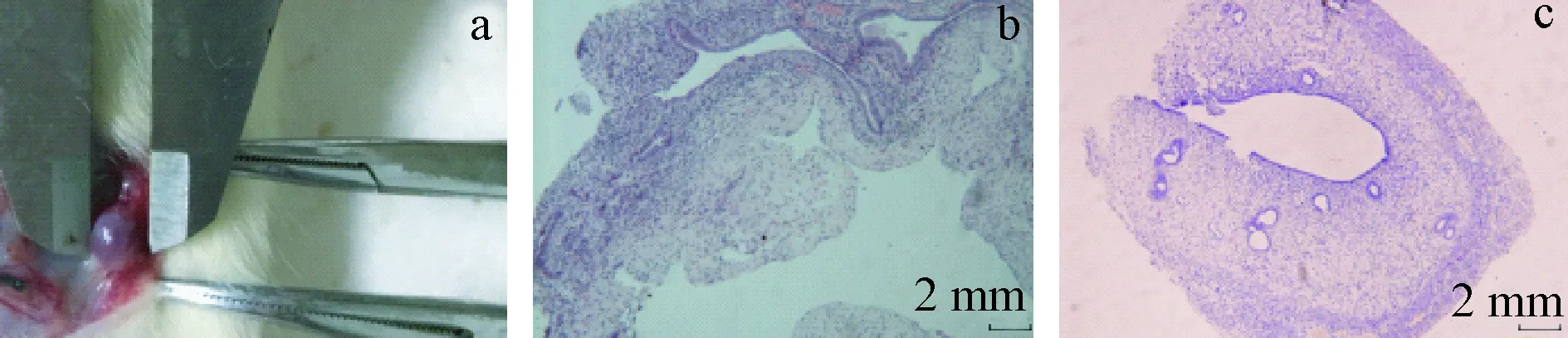
注:a:治疗前大鼠内异灶肉眼观察;b:异位内膜(HE染色,× 10);c:在位内膜(HE染色,× 10)。图1 大鼠子宫内膜异位灶及组织学观察Note. a: Endometriosis in a rat model (gross appearance). b: Histology of the ectopic endometrium in a rat (HE staining, × 10). c: Eutopic endometrium in a rat (HE staining, × 10).Figure 1 Endometriosis in a rat model and histological observation
2.2 大鼠内异症模型用药前后各组内异灶体积
用药前,各组内异症的体积间差异无显著性(P> 0.05)。第4周,反加组Ⅰ、反加组Ⅱ、反加组Ⅲ、GnRH-a组大鼠腹壁异位病灶体积较用药前明显缩小,对照组的体积较用药前增大,差异均有显著性(P< 0.05)。第7周,反加组Ⅰ、反加组Ⅱ、反加组Ⅲ、GnRH-a组大鼠腹壁异位病灶体积较第4周均有增大,反加组Ⅰ、反加组Ⅱ、GnRH-a组较用药前明显减小,差异均有显著性(P< 0.05),反加组Ⅲ较用药前相比差异无显著性,对照组与第4周相比,差异无显著性(P> 0.05);第7周时,反加应用中、高剂量雌激素组(反加组Ⅱ、反加组Ⅲ)较低剂量雌激素组和单纯应用GnRH-a组(反加组Ⅰ、GnRH-a组)体积增大明显,差异有显著性(P< 0.05)。见表1。
2.3 免疫组化表达
2.3.1 TNF-α在大鼠内异症病灶组织中的表达
TNF-α蛋白主要表达在子宫内膜异位症异位内膜组织腺上皮细胞的细胞浆中,间质细胞浆中少量表达。阳性呈棕黄色至褐色(图2)。用药前,各组内异症病灶组织中TNF-α表达差异无显著性(P> 0.05)。第4周,反加组Ⅰ、反加组Ⅱ、反加组Ⅲ、GnRH-a组大鼠腹壁异位病灶TNF-α表达均较用药前缩小,且均较对照组明显缩小,差异均有显著性(P< 0.05),而对照组的TNF-α表达与用药前相比差异无显著性(P> 0.05)。第7周,反加组Ⅱ、反加组Ⅲ大鼠腹壁异位病灶TNF-α表达较第4周增加,差异有显著性(P< 0.05);对照组、反加组Ⅰ、GnRH-a组表达与第4周相比差异无显著性(P> 0.05);反加组Ⅰ、反加组Ⅱ、GnRH-a组TNF-α表达较用药前明显减小,差异均有显著性(P< 0.05),反加组Ⅲ较用药前相比差异无显著性;第7周时反加应用中、高剂量雌激素组(反加组Ⅱ、反加组Ⅲ)较低剂量雌激素组和单纯应用GnRH-a组(反加组Ⅰ、GnRH-a组)TNF-α表达高,差异有显著性(P< 0.05)。见表2。
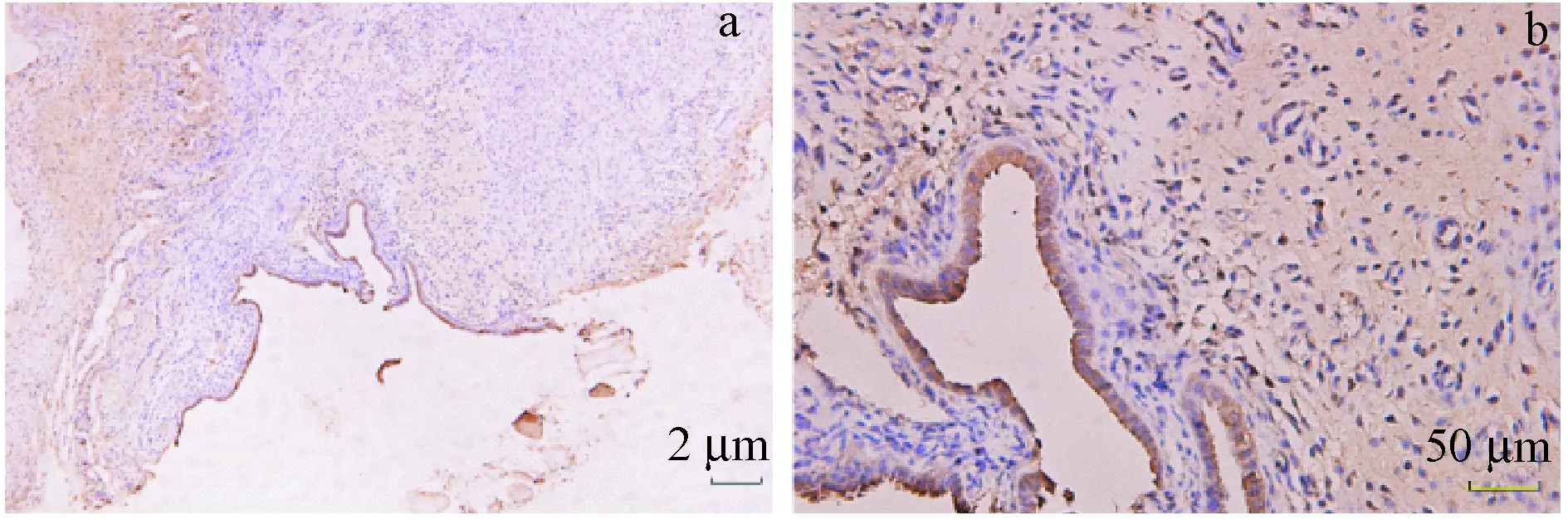
注:a:免疫组化(× 10);b:免疫组化(× 40)。图2 TNF-α在大鼠内异症组织的表达Note. a: Immunohistochemical staining (× 10). b: Immuno-histochemical staining (× 40).Figure 2 TNF-α expression in the ectopic endometrium
表1 GnRH-a用药后反加不同剂量雌激素大鼠异症病灶体积变化±s,mm3)
注:反加组Ⅰ:低剂量雌激素组:25 μg/(kg·d);反加组Ⅱ:中剂量雌激素组:50 μg/(kg·d);反加组Ⅲ:高剂量雌激素组:100 μg/(kg·d)。与同组用药前比较,aP< 0.05;与同组第4周比较,bP< 0.05;与对照组比较,cP< 0.05。
Note. Add-back group Ⅰ: low-dose estrogen group: 25 μg/(kg·d); Add-back group Ⅱ: medium-dose estrogen group: 50 μg/(kg·d); Add-back group Ⅲ: high-dose estrogen group: 100 μg/(kg·d). Compared with the same group before treatment,aP< 0.05; compared with the same group at the 4th week,bP< 0.05; compared with the control group,cP< 0.05.
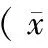
表2 GnRH-a用药后反加不同剂量雌激素大鼠子宫内膜异位病灶组织中TNF-α和StAR的表达±s)
注:反加组Ⅰ:低剂量雌激素组:25 μg/(kg·d);反加组Ⅱ:中剂量雌激素组:50 μg/(kg·d);反加组Ⅲ:高剂量雌激素组:100 μg/(kg·d)。与同组治疗前比较,aP< 0.05;与同组治疗4周比较,bP< 0.05;与对照组同一时间点比较,cP< 0.05;与GnRH-a组同一时间点比较,dP< 0.05。
Note. Add-back group Ⅰ: low-dose estrogen group: 25 μg/(kg·d); Add-back group Ⅱ: medium-dose estrogen group: 50 μg/(kg·d); Add-back group Ⅲ: high-dose estrogen group: 100 μg/(kg·d). Compared with the same group before treatment,aP< 0.05; compared with the same group at the 4th week,bP< 0.05; compared with the control group at the same time,cP< 0.05; compared with the GnRH-a group at the same time,dP< 0.05.
2.3.2 StAR在大鼠内异症病灶组织中的表达
StAR主要表达于异位内膜组织腺上皮细胞的细胞浆中,在位内膜中很少表达。阳性呈棕黄色至褐色(图3)。用药前,各组内异症病灶组织中StAR表达差异无显著性(P> 0.05)。第4周,反加组Ⅰ、反加组Ⅱ、反加组Ⅲ、GnRH-a组大鼠腹壁异位病灶StAR均较用药前减小,差异有显著性(P< 0.05),且均较对照组明显降低,差异有显著性(P< 0.05),而对照组的大鼠腹壁异位病灶StAR表达与用药前相比差异无显著性(P> 0.05)。第7周,对照组大鼠腹壁异位病灶StAR表达较用药前减小,差异有显著性(P< 0.05);反加组Ⅱ、反加组ⅢStAR表达较第4周增加,差异有显著性(P< 0.05);反加组Ⅰ、反加组Ⅱ、GnRH-a组StAR表达较用药前明显减小,差异均有显著性(P< 0.05);反加组Ⅲ较用药前相比差异无显著性;第7周时反加应用中、高剂量雌激素组(反加组Ⅱ、反加组Ⅲ)较低剂量雌激素组和单纯应用GnRH-α组(反加组Ⅰ、GnRH-a组)StAR表达高,差异有显著性(P< 0.05)。见表2。
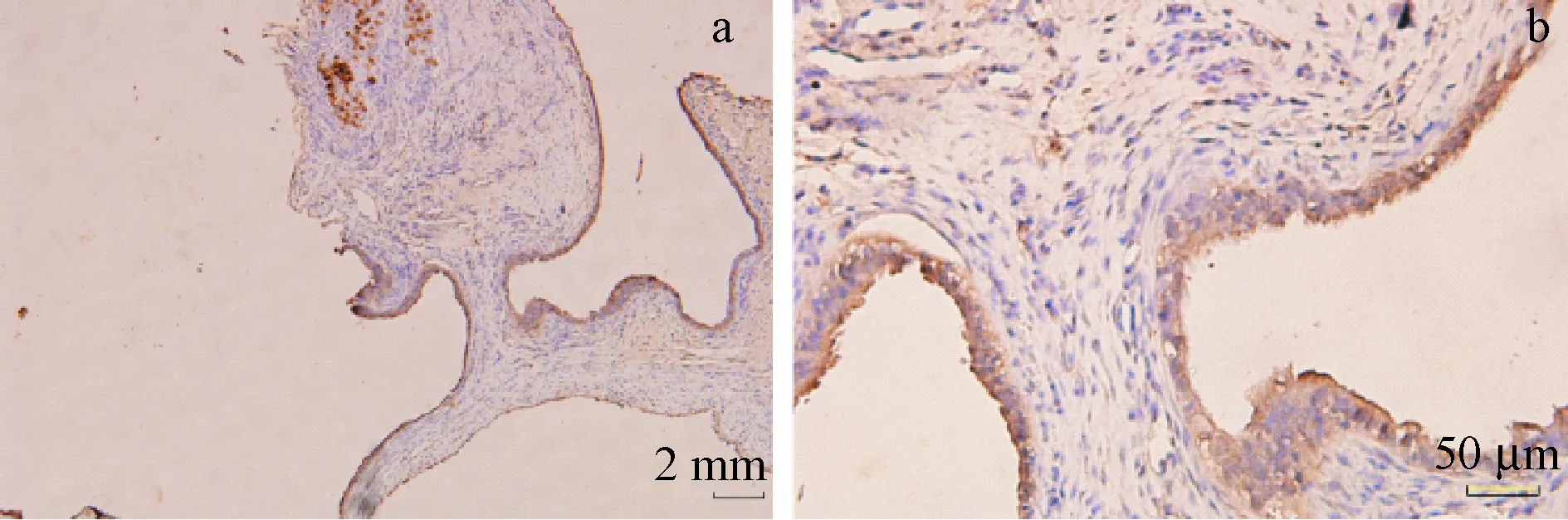
注:a:免疫组化(× 10);b:免疫组化(× 40)。图3 StAR在大鼠内异症组织的表达Note. a: Immunohistochemical staining (× 10). b: Immuno-histochemical staining (× 40).Figure 3 StAR expression in the ectopic endometrium
2.4 血清CA125在大鼠内异症模型中的表达
用药前,各组血清CA125浓度差异无显著性(P> 0.05),第4周,反加组Ⅰ、反加组Ⅱ、反加组Ⅲ、GnRH-a组大鼠血清CA125浓度平均数均减小,与用药前相比差异有显著性(P< 0.05),与对照组相比,差异有显著性(P< 0.05),而对照组的评分与用药前相比差异无显著性(P> 0.05)。第7周,反加组Ⅱ、反加组Ⅲ大鼠血清CA125浓度较第4周增加,差异有显著性(P< 0.05);GnRH-a组大鼠血清CA125浓度较4周同组减小,差异有显著性(P< 0.05);对照组、反加组Ⅰ与第4周相比差异无显著性(P> 0.05);反加组Ⅰ、反加组Ⅱ、反加组Ⅲ、GnRH-a组大鼠血清CA125浓度较用药前明显减小,差异均有显著性(P< 0.05);第7周时反加应用中、高剂量雌激素组(反加组Ⅱ、反加组Ⅲ)较低剂量雌激素组和单纯应用GnRH-a组(反加组Ⅰ、GnRH-a组)血清CA125浓度高,差异有显著性(P< 0.05)。见表3。
表3 GnRH-a用药后反加不同剂量雌激素大鼠血清CA125浓度的变化±s,U/mL)
注:反加组Ⅰ:低剂量雌激素组:25 μg/(kg·d);反加组Ⅱ:中剂量雌激素组:50 μg/(kg·d);反加组Ⅲ:高剂量雌激素组:100 μg/(kg·d)。与同组治疗前比较,aP< 0.05;与同组治疗4周比较,bP< 0.05;与对照组同一时间点比较,cP< 0.05;与GnRH-a组同一时间点比较,dP< 0.05。
Note. Add-back group Ⅰ: low-dose estrogen group: 25 μg/(kg·d); Add-back group Ⅱ: medium-dose estrogen group: 50 μg/(kg·d); Add-back group Ⅲ: high-dose estrogen group: 100 μg/(kg·d). Compared with the same group before treatment,aP< 0.05; compared with the same group at the 4th week,bP< 0.05; compared with the control group at the same time,cP< 0.05; compared with the GnRH-a group at the same time,dP< 0.05.
3 讨论
子宫内膜异位症是一种雌激素依赖性疾病,治疗后易复发,其机制尚不清楚。临床上评估子宫内膜异位症复发的依据为:(1)症状:以盆腔疼痛为主诉,达到甚至超过术前水平;(2)盆腔检查:再次出现包块,直肠陷窝触痛结节等;(3)B超示卵巢囊肿,囊肿为中低回声,甚至出现点状强回声;(4)血清CA125降低后再次升高。但确诊,仍需使用腹腔镜检查通过组织学证实。考虑到反复使用腹腔镜的伦理及实际应用问题,本实验采用大鼠子宫内膜异位症模型进行研究。
GnRH-a现已广泛应用于治疗子宫内膜异位症,本研究应用亮丙瑞林治疗大鼠子宫内膜异位症模型发现,第4周,研究组较对照组体积明显缩小,血清CA125水平下降,而对照组内异症模型体积增大,提示亮丙瑞林对大鼠子宫内膜异位症模型疗效肯定。GnRH-a治疗过程中机体血清雌二醇迅速降低至绝经期水平,若机体长期处于低雌激素血症状态,可出现潮热、盗汗、阴道干燥、头痛等血管舒缩症状及不可逆的骨丢失等不良反应[8,14]。长期低雌激素血症,会引起原始卵泡减少,卵泡闭锁,导致卵巢功能受损[9]。为缓解低雌激素血症症状,保护卵巢功能,近年来提出来“反添加”疗法,即GnRH-a与类固醇激素联合应用。如何调节GnRH-a和类固醇激素的用量和应用时间的长短仍是值得我们研究的问题,脉冲式加用性激素是否会激惹隐伏的雌激素敏感组织,从而导致疾病提前复发的问题值得我们进一步探讨。
本研究采用不同剂量雌激素进行反添加,在第7周时,研究组大鼠腹壁异位病灶体积较第4周均有不同程度增大,提示停药后可能出现了子宫内膜异位症的复发倾向,反加应用中、高剂量雌激素组较低剂量雌激素组和单纯应用GnRH-a组体积增大明显,且反加应用中、高剂量雌激素组血清CA125较治疗第4周升高,提示反加应用中、高剂量雌激素可能加速了内异症的复发。进一步说明内异症是一种雌激素依赖性疾病,对内异症的反加治疗应注意雌激素的应用剂量,与Barbieri[10]的研究结论一致。
TNF-α是一类具有多种生物活性的细胞因子,由激活的单核细胞、淋巴细胞和巨噬细胞等产生,在生理状态下,TNF-α参与调节胚胎着床、卵泡发育、免疫监视、抗肿瘤等环节[11];在病理状态下,TNF-α可介导炎症反应和免疫反应。TNF-α在子宫内膜异位症发生发展过程中炎症浸润、新生血管形成、粘连的形成等环节发挥了巨大作用。TNF-α不仅可以诱导IL-6、IL-8等炎症因子释放,诱导新生血管生成,还可以促进间质细胞和间皮之间的粘附,刺激子宫内膜间质细胞的生成[12],可能在子宫内膜异位症的形成和发展中发挥了重要作用。本研究发现,用药前,TNF-α在子宫内膜异位组织中高表达,提示高水平的TNF-α可能促进了内异症的发生、发展的过程;第4周,研究组子宫内膜异位灶组织中TNF-α表达降低,提示GnRH-a对子宫内膜异位症大鼠模型有较好的治疗作用;在停药观察3周后,反加中、高剂量雌激素组较反加低剂量雌激素组和单纯应用GnRH-a组大鼠子宫内膜异位症组织TNF-α表达高,提示中、高剂量雌激素可能通过提高TNF-α表达促进子宫内膜异位症的复发,其可能机制为中、高剂量雌激素刺激单核细胞、淋巴细胞和巨噬细胞再次分泌TNF-α,增高的TNF-α促进异位内膜炎症细胞因子IL-6、IL-8等的释放,进而诱发异位内膜及基质细胞增殖、血管再生、刺激成纤维细胞增殖及胶原合成,从而再次形成异位病灶。
Attar[13]等发现子宫内膜异位细胞含有类固醇生成的完整基因,能将胆固醇从头合成雌二醇。StAR是类固醇激素合成的重要限速酶,可将胆固醇从线粒体的外膜转运至内膜,在其它类固醇激素合成酶如P450scc、芳香化酶等的作用下,合成雌二醇[15]。子宫内膜异位组织可以通过StAR从头合成雌激素,造成局部高雌激素状态,加速子宫内膜异位症进展。激活的巨噬细胞能够产生各种类型的细胞因子和PGs,PGE2能诱导StAR表达[16],促进局部雌激素的合成,为子宫内膜异位症的形成与发展打下基础。本研究发现,用药前,StAR在大鼠子宫内膜异位病灶组织中表达增高,提示StAR可能参与了大鼠内异症的发生发展,用药第4周,研究组StAR表达降低,再次说明GnRH-a对子宫内膜异位症大鼠模型有较好的治疗作用,在停药观察3周后,反加中、高剂量雌激素组较低剂量雌激素组和单纯应用GnRH-a组大鼠子宫内膜异位症组织StAR表达高,提示中、高剂量雌激素可能通过诱导StAR的高表达促进子宫内膜异位症的复发,其机制可能为中、高剂量的雌激素作用下,异位内膜组织中巨噬细胞的数量增加,激活的巨噬细胞分泌PGE2,上调了StAR的表达,外周组织中胆固醇芳香构化,局部合成雌激素,雌激素与雌激素受体结合,启动雌激素介导的信号通路,诱导相关细胞因子参与并促进子宫内膜异位病灶的再次形成。
综上所述,GnRH-a反加低剂量雌激素治疗大鼠内异症模型可有效缩小病灶,降低TNF-α、StAR及CA125的表达,疗效确切。但反向添加中、高剂量雌激素可能加速了大鼠子宫内膜异位症的复发,TNF-α、StAR表达的再次升高可能是子宫内膜异位症复发的机制。但本实验样本量较小,随访时间较短,尚需大样本、长时期随访进一步研究证实。另本实验为动物实验,在对人的临床应用中尚存在一定差距,还需循证医学证据。

