花椒原生质体分离与培养研究
李 南,杨秀平,周正君,邓 鹏
(西北农林科技大学 林学院,陕西 杨陵 712100)
花椒(Zanthoxylumbungeanum)属于芸香科花椒属植物,是一种具有浓郁辛香的落叶灌木或小乔木[1-2]。作为我国重要经济树种,具有很高的利用价值,花椒良种选育工作对花椒产业发展尤为重要,但花椒属于无融合生殖植物,无融合生殖率达25%[3],人工杂交十分困难,目前花椒遗传改良主要依靠自然变异[4-5],但变异率低及变异的不确定性,使得花椒种质创新和良种繁育工作一直没有取得突破性进展。而体细胞杂交技术能够人为融合异源植物原生质体,培养杂种植株,获得理想的优良新种质。因此,花椒体细胞杂交技术体系,是实现花椒种质创新及性状改良的一个有效途径。而体细胞杂交的前提是原生质体的有效分离与培养,但目前尚未见花椒原生质体分离与培养方面的报道。采用酶解法,以韩城大红袍试管苗花椒叶片和凤县大红袍花椒愈伤组织及悬浮细胞为试验材料,对花椒原生质体分离条件及影响因素进行研究,并从花椒试管苗叶片剥离的原生质体为试验材料,对影响花椒原生质体培养的因素进行了探究,建立了稳定高效的花椒原生质体分离培养技术体系,为体细胞杂交奠定基础。
1 材料与方法
1.1 材料
以西北农林科技大学林木育种实验室保存的韩城大红袍花椒试管苗、凤县大红袍花椒愈伤组织和凤县大红袍花椒细胞悬浮系为试验材料。
1.2 方法
1.2.1 原生质体分离及纯化 酶液用CPW[6]溶液配制,以甘露醇为渗透压调节剂,加入5 mmol·L-1MES(2,N-玛琳-乙基磺酸)作为pH稳定剂,pH 5.8,以2 000 r·min-1离心1 min,取上层清液,经0.22 μm微孔滤膜过滤灭菌。
分别称取0.4 g叶片、愈伤组织或悬浮细胞,放入装有4 mL含有不同浓度纤维素酶和果胶酶组合的混合酶液中酶解10 h,酶解温度为(27±1)℃,置于50 r·min-1的摇床中暗处理。分别对酶液浓度(w/v)(纤维素酶R-10:0.5%、1.0%、1.5%、2.0%,果胶酶:0.5%、1.0%、1.5%)和甘露醇浓度(0.4、0.5、0.6、0.7、0.8、0.9 mol·L-1)2个因素设置不同水平进行单因素试验。每试验重复3次。
酶解结束后,将酶解液中加入4 mL CPW的13%甘露醇溶液,依次通过100目和400目不锈钢筛网过滤,除去未酶解的材料及大细胞团,然后将滤液转至10 mL的离心管中离心 10 min,转速500 r·min-1。原生质体沉于管底,吸去上清液,加2 mL CPW的13%甘露醇溶液重新悬浮原生质体,在底部加入6 mL CPW的26%蔗糖溶液,以300 r·min-1离心3 min,原生质体在蔗糖与甘露醇两液面间形成一条清晰的带,吸出原生质体带,转移至另一个离心管中,加入1 mL WPM培养基,以500 r·min-1离心10 min沉淀原生质体,吸去上清液,获得纯净原生质体,随后用1 mL WPM培养基悬浮。用血球板计数法[7]计算产量,用FDA染色法[8]测定原生质体活力。
1.2.2 原生质体培养 用1.2中韩城大红袍叶片中分离的原生质体调至5×105个·mL-1,分别接种到WPM、MS、B5和T进行液体浅层法培养(培养液中以甘露醇为渗透压调节剂,甘露醇初始浓度为0.6 mol·L-1,pH 5.8)。在直径为6 cm的培养皿中加入2 mL原生质体悬浮液,用Parafilm封住培养皿的口,置于转速为100 r·min-1摇床中25℃暗培养。比较不同培养基、培养密度、激素组合等对原生质体再生细胞分裂的影响。
每周添加1次新鲜培养基,甘露醇浓度从0.6 mol·L-1降至0.4 mol·L-1,再降至0.2 mol·L-1,再形成2 mm左右的愈伤组织后转至MS+2,4-D 0.1 mol·L-1+NAA 1.5 mol·L-1+6-BA 0.5 mol·L-1的固体培养基中。
2 结果与分析
2.1 花椒原生质体分离及纯化
2.1.1 酶液浓度对花椒原生质体分离的影响 通过原生质体活力与产量的统计表明,酶液浓度对花椒原生质体的产量和活力有显著影响(表1)。以叶片为分离材料时,同一果胶酶浓度下,随着纤维素酶R-10浓度的提高,原生质体产量和活力均表现为先升高后下降,纤维素酶浓度为1.5%(w/v)时原生质体产量高,以1.5%(w/v)纤维素酶R-10+1.5%(w/v)果胶酶处理产量最高,达99.99×105个·g-1,但酶解碎片多,原生质体活力较低,为59.98%;当纤维素酶R-10浓度不变时,随着果胶酶浓度提高,原生质体产量增加,但活力下降。当酶液浓度为1.0%(w/v)纤维素酶R-10+1.5%(w/v)果胶酶时,原生质体产量和活力均较高,分别达81.51×105个·g-1和72.28%。
以愈伤组织为分离材料时,随酶液浓度的增加,原生质体产量均呈现上升趋势。当纤维素酶R-10浓度为2%(w/v) +0.5%(w/v)果胶酶时原生质体产量最大,产量达31.16×105个·g-1(活力58.09%)。随着酶浓度增加,原生质体的活力呈现出先升高后下降的趋势。当酶液浓度为1.5%(w/v)纤维素酶R-10+0.5%(w/v)果胶酶时,原生质体活力最大,为62.84%,但产量较低,仅为15.69×105个·g-1。
以悬浮细胞为分离材料时,不同果胶酶浓度下随着纤维素酶R-10浓度的提高,原生质体产量均有所增加,活力则表现为先升高后下降。当酶液浓度为1.5%(w/v)纤维素酶R-10+0.5%(w/v)果胶酶时活力最大,为65.69%(产量30.80×105个·g-1);酶液浓度为2.0%(w/v)纤维素酶R-10+0.5%(w/v)果胶酶时产量最大,为55.61×105个·g-1(活力63.55%)。
综合考虑原生质体产量和活力的影响,花椒叶肉细胞原生质体分离的最佳酶液浓度为1.0%(w/v)纤维素酶R-10+1.5%(w/v)果胶酶,愈伤组织和悬浮细胞原生质体分离的最佳酶液浓度为2.0%(w/v)纤维素酶R-10+0.5%(w/v)果胶酶。

表1 酶液浓度对花椒原生质体分离的影响
注:采用Duncan's 新复极差法测验(LSR),同列不同小写字母表示不同处理间差异达到α=0.05显著水平。
2.1.2 甘露醇浓度对花椒原生质体分离的影响 试验结果表明,甘露醇浓度过低或过高,原生质体产量和活力均较低(图1),花椒叶肉细胞原生质体分离的最佳甘露醇浓度为0.7 mol·L-1,花椒愈伤组织和悬浮细胞原生质体分离的最佳甘露醇浓度为0.6 mol·L-1。
甘露醇浓度0.4~0.5 mol·L-1时,花椒叶肉细胞原生质体产量和活力都较低;0.6~0.7 mol·L-1时,原生质体产量和活力大幅提高,甘露醇浓度为0.7 mol·L-1时,产量和活力均达到最大值,分别为80.45×105个·g-1和73.59%;0.8~0.9 mol·L-1时,原生质体产量和活力迅速下降,至0.9 mol·L-1时,原生质体产量和活力仅为27.71×105个·g-1和47.94%。
甘露醇浓度0.4~0.5 mol·L-1时,悬浮细胞和愈伤组织细胞原生质体产量和活力逐渐增大,当甘露醇浓度为0.6 mol·L-1时,产量和活力达到最大值,随后逐渐下降。甘露醇浓度为0.9 mol·L-1时,悬浮细胞分离的原生质体活力较甘露醇浓度为0.6 mol·L-1时下降了53.59%,而愈伤组织细胞原生质体活力下降了35.84%,表明高渗压溶液对悬浮细胞原生质体影响大。
2.2 花椒原生质体培养
2.2.1 培养基种类对花椒原生质体培养的影响 将原生质体用培养液调至1×105个·mL-1,不添加任何激素,进行液体浅层培养。结果表明(表2),在MS作为基本培养基时,不能观察到细胞分裂,大部分细胞破碎死。当B5、WPM、T作为基础培养基时,原生质体第1次细胞分裂时间相同,均在3 d后原生质体进行第1次分裂,但细胞分裂率及形成细胞团所需时间有所不同。2个月后,仅有WPM培养基中的细胞团可形成2 mm左右的愈伤组织。因此,WPM是进行花椒原生质体培养较好的培养基。
2.2.2 不同激素组合对原生质体培养的影响 将原生质体用培养液调至1×105个·mL-1,以WPM为基础培养基,采用了L9(33)正交试验设计(表3),比较了6-BA、NAA、2,4-D对原生质体培养的影响。
试验结果表明(表4),花椒原生质体在0.5 mg·L-12,4-D+1.0 mg·L-16-BA+1.0 mg·L-1NAA与1.0 mg·L-12,4-D+1.5 mg·L-16-BA+1.0 mg·L-1NAA培养基上能够分裂。分裂频率以1.0 mg·L-12,4-D+0.5 mg·L-16-BA+1.0 mg·L-1NAA较高,在第2天即可见原生质体分裂,4~6 d后形成2~4个细胞的细胞团,但细胞就此停止分裂,并在培养基中出现了褐化的沉淀物。而在0.5 mg·L-12,4-D+1.0 mg·L-16-BA+1.0 mg·L-1NAA培养基中可持续分裂。因此,0.5 mg·L-12,4-D+1.0 mg·L-16-BA+1.0 mg·L-1NAA是进行花椒原生质体较好的激素配比。

图1 甘露醇浓度对花椒原生质体分离的影响

基础培养基第1次分裂时间/d15 d后原生质体分裂频率/%28 d后细胞团出现频率/%MS---WPM36.352.01B533.410.09T30.09-
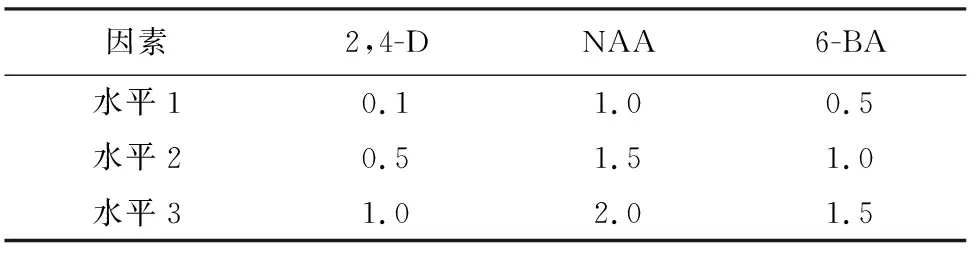
表3 花椒原生质体L9(33)正交试验的因素与水平
2.2.3 培养密度对原生质体培养的影响 以WPM为基础培养基,不添加任何激素,将原生质体密度分别调至0.5×105个·mL-1、1×105个·mL-1、5×105个·mL-1、10×105个·mL-1进行液体浅层培养。结果表明(表5),不同培养密度对原生质体培养具有较大的影响,过高或过低,都会抑制原生质体的发育。当培养密度<1×105个·mL-1时,尽管前期发生少量细胞分裂,但形成细胞团数量极小,后期细胞生长缓慢或停止生长;当培养密度为1×105个·mL-1时,分裂频率较低,但原生质体能够持续分裂;当培养密度达5×105个·mL-1时,分裂频率较高,但分裂1~3次后则停止分裂,并且原生质体有破碎现象;而在1×106个·mL-1培养密度下,原生质体破碎、褐化现象严重,未见分裂。因此试验中培养密度为1×105个·mL-1是适宜花椒原生质体较好的培养密度。
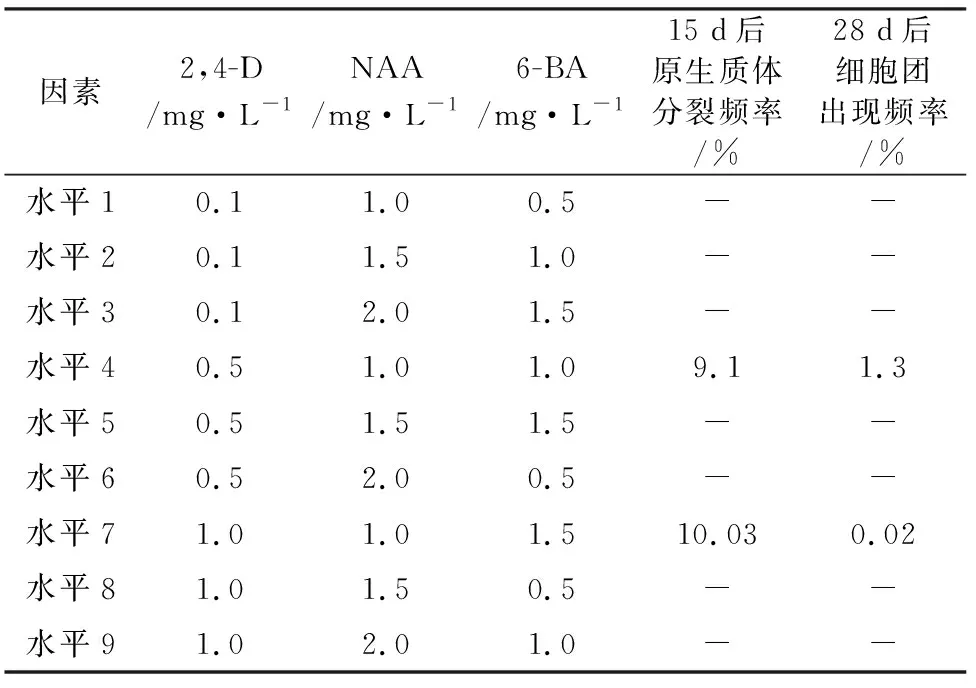
表4 不同植物生长激素组合对花椒原生质体的影响

表5 培养密度对原生质体培养的影响
3 结论与讨论
建立稳定高效的原生质体分离与培养体系,是原生质体培养及体细胞杂交的基础[9]。本文以韩城大红袍花椒叶片和凤县大红袍花椒愈伤组织及悬浮细胞为原生质体试验的起始材料,对影响花椒原生质体分离和培养的因素进行系统研究。初步探究了花椒原生质体的分离与培养的最佳条件。
纤维素酶和果胶酶常作为植物原生质体分离的酶制剂,不同植物种类和分离材料所用的酶制剂浓度各不相同。例如:D.Chabane[10]等用于分离椰枣叶片酶液浓度是1.5%(w/v)纤维素酶+0.15%(w/v)果胶酶Y-23+0.2%半纤维素酶,王欢[11]等用于分离刺槐愈伤组织的酶液浓度为2.5%(w/v)纤维素酶R-10+0.6%(w/v)果胶酶Y-23+1%(w/v)离析酶R-10。
在植物原生质体分离过程中,甘露醇常作为渗透压调节剂,浓度过高会使原生质体失水皱缩,浓度过低会使原生质体过度吸水胀裂死亡,因此适宜浓度的甘露醇对原生质体产量和活力具有重要意义[12-14]。本试验中甘露醇浓度为0.7 mol·L-1时,花椒叶肉细胞原生质体产量和活力最高,这与R.Rezazadeh[15]等对芒果原生质体分离研究结果相一致;甘露醇浓度为0.6 mol·L-1时,花椒愈伤组织和悬浮细胞分离的原生质体产量和活力最高,这与王鹏凯[16]等对北美鹅掌楸原生质体的分离研究结果相同。
本试验在无激素的WPM培养的原生质体在液体浅层培养基中形成了新的愈伤组织,其他方式培养的原生质体均无分裂或仅形成数十个细胞的细胞团后便解体。原生质体培养受培养基种类、原生质体密度、外源生长调节剂等多种因素的影响,而培养基的种类直接影响到原生质体的培养。不同种类的植物所用的培养基不相同,很多木本植物都采用MS培养基,如杨树和野生梨等。也有一些使用富有机营养的KM8P培养基,如榆树和牛蹄豆树[17]。
外源生长调节剂对木本植物原生质体的培养也是非常重要的,一般包括生长素类和细胞分裂素类。各类树种对激素的种类和浓度要求有所不同。例如,何业毕[18]等分离出枣树原生质体用NAA进行培养,马锋旺[19]等分离出的中国李原生质体则用2,4-D和6-BA培养效果较好。马锋旺[20-21]等在培养杏的原生质体时,发现使用2,4-D培养效果优于NAA,但2,4-D必须和BA配合使用才能启动原生质体进行分裂。但柑桔原生质体在不加任何外源激素的情况下就能分裂形成多细胞团,添加了植物激素NAA和BA反而对原生质体培养有抑制作用[22]。
原生质体培养密度对其生长影响很大。在适宜的密度范围内植物原生质体才能正常分裂与发育。密度过高时,会因为营养不足或细胞代谢物过多而妨碍细胞的正常生长;当密度过低时,会使与分裂有关的物质达不到一定的浓度而使再生细胞不能持续分裂。试验发现当花椒原生质体的培养密度在0.5×105个·mL-1与1 ×105个·mL-1时,由于密度偏低,原生质体很难分裂,而密度在10×105个·mL-1时,褐化现象严重,原生质体多数死亡,原因可能是密度过高,在培养是产生了一些不利于原生质体的有害物质使得原生质体无法分裂。
本研究建立的花椒原生质体分离与培养体系,为花椒体细胞杂交奠定了基础,为花椒种质进一步创新和品质改良提供了新的途径,对植物细胞工程在花椒种质资源创新工作中的应用具有重要的意义。但是,研究还需要进一步探索,主要包括对不同基因型的材料进行研究,对原生质体的分裂频率较低和形成细胞团的频率低的原因进行探究等。

