盐碱胁迫对星星草-丛枝菌根真菌共生体酶活性及游离氨基酸的影响1)
张良 杨春雪
(东北林业大学,哈尔滨,150040)
星星草(Puccinelliatenuiflora),又名小花碱茅,属禾本科碱茅属多年生草本植物,在哈萨克斯坦、阿尔泰到雅库梯以及我国西北、内蒙古、东北、华北、青海等地区分布居多,其在我国东北松嫩平原盐碱地治理中承担着非常重要的过度作用[1]。星星草能够生长于盐碱化土地,是优良的牧草,具有很强的耐盐性[2]、耐旱性[3]和抗寒性[4]。近年来,土地盐碱化成为一个世界性的难题,根据UNESCO和FAO的不完全统计,截止至2000年,全世界土地盐渍化面积约为9.55亿hm2,大约占全球表面积的7%[5],并且有日益加重的趋势,每年由于盐碱地的影响而被废弃的土地约有1亿hm2[6],所以盐碱地的治理显得尤为重要。我国利用20年时间对140多种抗盐碱性牧草进行了科学筛选,星星草由于具有优良的生态习性而成为首选牧草之一[7]。
利用微生物与植物联合手段对盐碱地治理是目前引起人们高度关注的一种生物方法。该方法一般利用能够与植物形成互惠共生体的微生物来改良土壤理化性质,其中丛枝菌根(AM)真菌应用最为广泛。AM真菌可以与绝大部分植物形成互惠共生改善土壤结构,促进宿主植物的生长发育,特别是还可以提高植物的抗盐性[8-12]。植物在受到外界生物或者非生物胁迫时,其体内原本的平衡状态会被打破,细胞内一系列针对胁迫作出的防御反应会随着体内活性氧含量的上升而展开,其中酶类抗氧化系统能有效地降低胁迫环境对植物的伤害从而起到保护植物的作用[13]。相关研究也表明,接种AM真菌不仅能够提高植物的抗盐性,增强宿主叶片的光合作用,同时还能够增加游离氨基酸类等氮源的积累,这既能够进一步加强体内渗透调节又可以通过这种方式来加强盐碱胁迫解除时叶绿体或其他有机物的合成[14-16]。
以往有关星星草的研究,只关注了在不同盐碱浓度处理下AM真菌对星星草自身体内超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)这三大抗氧化酶活性的影响[17]。本研究拟通过对抗坏血酸过氧化物酶(ASA-POD)、谷胱甘肽还原酶(GR)、蔗糖合成酶(SS)活性以及游离氨基酸质量分数的研究,进一步从生理水平上揭示星星草-AM真菌共生体应答盐碱逆境的机制,为利用菌根技术进一步提高星星草的耐盐能力,改良与恢复退化松嫩盐碱草地提供科学依据。
1 材料与方法
1.1 试验材料
于2016年从松嫩盐碱草地将星星草种子采回并进行保存。从北京市农林科学院植物营养与资源研究所及石河子大学绿洲农作物病害防控重点实验室购回摩西球囊霉(Funneliformismosseae)和根内根生囊霉(Rhizophagusintraradices)2种AM真菌接种物,包含菌根片段、真菌菌丝和孢子等,孢子量约为18个·g-1。有机草炭、蛭石、腐殖酸等购自黑龙江省哈尔滨市花卉市场。
1.2 试验方法
1.2.1 试验设计及盆栽
将购回的基质土按V(泥炭)∶V(珍珠岩)∶V(园艺蛭石)=1∶1∶1的比例配置,置于高压灭菌锅中,121 ℃、240 kPa灭菌2 h,在各花盆(18 cm×18 cm)中均匀放置经高温高压灭菌的基质土,精确称取R.intraradices、F.mosseae各25 g并均匀混于2 cm表层基质中,未接种的则将灭菌后的2种真菌均匀混于表层2 cm基质中。将拌有R.intraradices、F.mosseae以及对照CK分为3组并分别用托盘盛装及浸盆,待盆内表层土湿润后均匀播种。播种前星星草种子先经0.01% KMnO4溶液消毒,再用无菌水冲洗干净并浸泡24 h。待均匀播种后覆盖适当基质保墒,以促进种子萌发。种子发芽前适时适量浇水,以浸盆为主,既可以有效保持基质湿润又可以防止冲散种子。待种子萌发后根据基质湿润程度适量适时补充水分,在东北林业大学园林学院植物光照培养室内进行植物培养。播种35 d后,每周定期浇灌30 mL Hoagland营养液1次。80 d后开始进行100 mL的胁迫处理,处理周期为10 d,非胁迫组则用蒸馏水代替,设置100、200、300、400 mmol·L-1NaCl和NaHCO3处理溶液,分别浇灌到R.intraradices、F.mosseae以及对照CK,共27组处理,每组处理3次重复。
1.2.2 菌根侵染率的测定
从基质中挖出星星草并清除粘连在根部的泥土,可用清水将其冲洗干净,注意水流速度的控制以免损坏根部。根部清理干净后,准确剪取1 cm保存于FAA固定液(90 mL 70%酒精;5 mL冰醋酸;5 mL 38%甲醛)中,如若长期使用可存放于冰箱中(4 ℃)。按照《菌根学》[18]测定菌根侵染率、侵染密度、丛枝丰度、泡囊丰度。
1.2.3 生理指标的测定
抗坏血酸过氧化物酶、谷胱甘肽还原酶以及蔗糖合成酶活性测定均以星星草叶片为材料并运用比色法测定,游离氨基酸质量分数采用水合茚三酮比色法测定[19]。
1.3 数据分析
菌根侵染率采用MYCOCALC软件计算。利用SPSS软件对侵染率、侵染密度、泡囊丰度、丛枝丰度以及生理指标进行Duncan’s单因素方差多重比较分析,差异显著水平为0.05。
2 结果与分析
2.1 盐碱胁迫下AM真菌对星星草菌根侵染指标的影响
由表1可见,无论盐胁迫浓度高低,接种F.mosseae或R.intraradices处理都可以达到100%的根系侵染率。接种F.mosseae处理的星星草根系在100 mmol·L-1盐浓度胁迫时丛枝丰度比无胁迫时增加了3.52%;在其他浓度胁迫下,泡囊丰度以及根系侵染密度都随着盐浓度的上升呈现出明显的下降趋势;其中在200 mmol·L-1处理时泡囊丰度与根系侵染密度下降值最大,减少量分别达11.70%和14.80%;300 mmol·L-1胁迫时丛枝丰度减少量最大,为3.62%。而接种R.intraradices处理的星星草根系丛枝丰度、泡囊丰度与根系侵染密度呈现出先升高后降低的趋势,均在100 mmol·L-1处理时达到最大增量;之后在200 mmol·L-1处理时,泡囊丰度出现最大减小值,为9.59%;而根系侵染密度则在300 mmol·L-1处理时减少量最大,为8.30%。
由表2可见,在盐碱胁迫下,随着浓度的升高,接种F.mosseae处理的星星草根系丛枝丰度、泡囊丰度、根系侵染密度度呈现下降趋势,而接种R.intraradices处理的星星草的这3项侵染指标则先上升后下降,在400 mmol·L-1处理时这2种接种处理的根系侵染率均达到了最低值,分别为76.67%和90.00%,F.mosseae接种处理比R.intraradices处理低13.33%。接种F.mosseae处理的星星草泡囊丰度在100 mmol·L-1处理下减小值最大,为12.71%;而丛枝丰度以及根系侵染密度都在200 mmol·L-1胁迫时减少量最多,分别为2.98%与12.06%。接种R.intraradices处理的星星草的3项侵染指标都在100 mmol·L-1处理时达到最大值;之后,随着处理浓度升高分别下降,其中丛枝丰度与泡囊丰度在200 mmol·L-1处理时下降的最多,根系侵染密度在300 mmol·L-1胁迫时出现了最大下降值,达13.57%。
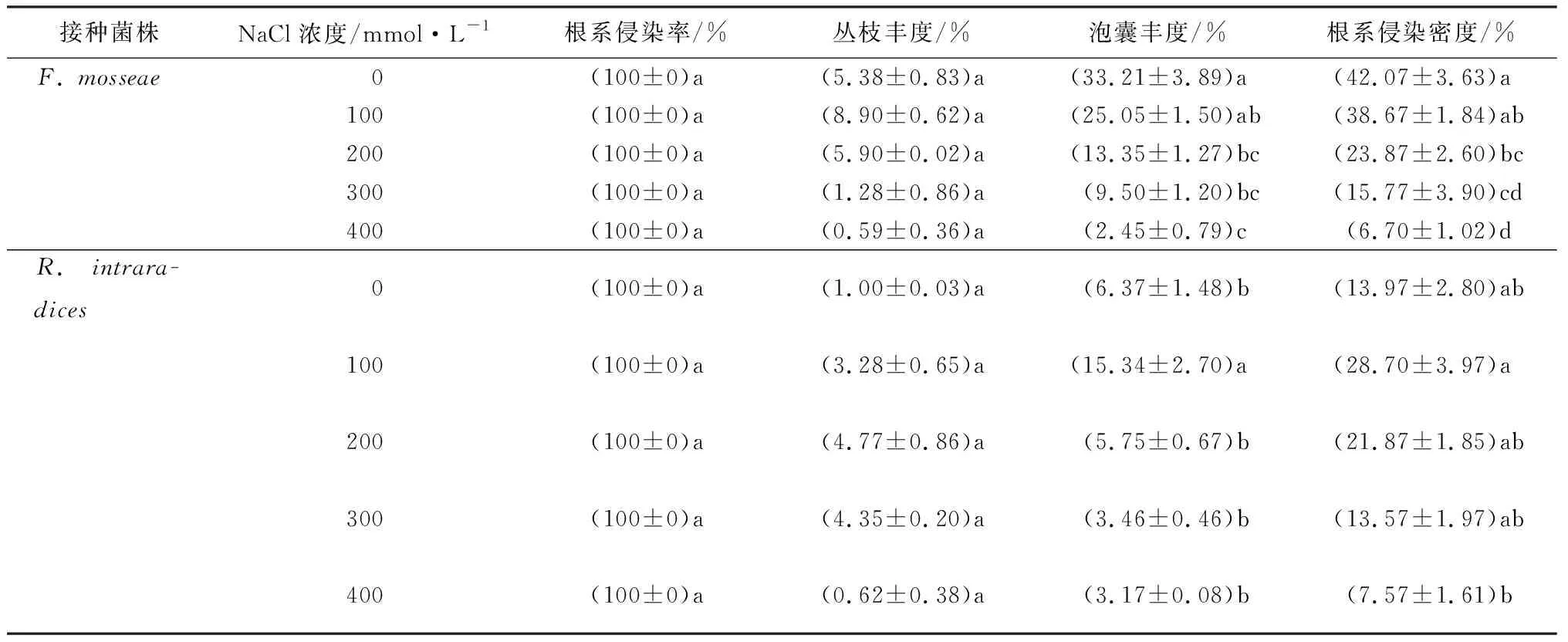
表1 盐胁迫下AM真菌对星星草菌根侵染率的影响(NaCl)
注:表中数据除NaCl浓度外,其余均为平均值±标准误。同一接种处理下,数据后不同小写字母表示处理间差异显著(α=0.05)。

表2 盐碱胁迫下AM真菌对星星草菌根侵染率的影响(NaHCO3)
注:表中数据除NaHCO3浓度外,其余均为平均值±标准误。同一接种处理下,数据后不同小写字母表示处理间差异显著(α=0.05)。
2.2 盐碱胁迫下AM真菌对星星草酶活性的影响
由表3可见,无论是胁迫还是非胁迫条件下,几乎在所有处理中接种R.intraradices处理的星星草优势要强于对照与接种F.mosseae处理,并且随着盐碱浓度的升高,ASA-POD活性是先升高后降低的。在无胁迫处理时,接种R.intraradices,星星草ASA-POD活性与未接种以及接种F.mosseae处理的差异显著(P<0.05)。当胁迫浓度升高100 mmol·L-1时,盐胁迫下星星草ASA-POD活性提高程度明显高于盐碱胁迫处理;在200 mmol·L-1浓度胁迫时活性达到最大,但只有在盐胁迫下表现出差异显著性(P<0.05);当盐碱浓度在200~300 mmol·L-1时,ASA-POD活性开始下降,当处理浓度达到400 mmol·L-1时,盐碱胁迫下CK与接种真菌类型的星星草ASA-POD活性降低程度要大于盐胁迫,并且CK与分别接种过真菌的星星草ASA-POD活性呈差异显著关系(P<0.05)。
由表3可见,随着盐碱胁迫浓度的升高,星星草谷胱甘肽还原酶(GR)的活性先升高后降低,而且接种F.mosseae与R.intraradices对星星草GR的活性影响较大,几乎是CK组的2倍,接种F.mosseae处理的星星草GR活性几乎全部高于接种R.intraradices处理。在未进行盐碱胁迫与100 mmol·L-1盐碱胁迫时,接种F.mosseae与R.intraradices处理以及未接种类型星星草GR活性互为差异显著(P<0.05),且在100 mmol·L-1盐处理时接种R.intraradices处理星星草GR活性增强程度最为明显,为12.72%。当胁迫浓度为200 mmol·L-1时,星星草GR活性达到峰值,盐处理组接种F.mosseae、R.intraradices处理以及未接种类型星星草GR活性互为差异显著(P<0.05),而盐碱处理组中未接种类型只分别与接种F.mosseae、R.intraradices处理的星星草GR活性呈差异显著关系(P<0.05)。当胁迫浓度在300~400 mmol·L-1时,星星草GR活性开始下降,且在这2个处理浓度下盐处理组与盐碱处理组中未接种类型星星草GR活性分别与接种F.mosseae、R.intraradices真菌类型星星草GR活性呈差异显著关系(P<0.05)。
从表3可知,星星草蔗糖合成酶(SS)活性随着盐碱胁迫浓度的升高,星星草SS活性除接种R.intraradices处理外都呈先增强后减弱的趋势,在200 mmol·L-1胁迫时SS活性最强,并且只有在400 mmol·L-1盐胁迫下接种R.intraradices处理的星星草SS活性与未接种真菌星星草SS活性差异显著(P<0.05)。盐处理中除未进行胁迫组外,0~400 mmol·L-1胁迫下接种F.mosseae处理的星星草SS活性要强于接种R.intraradices处理,其中在200 mmol·L-1处理时两者的活性差值最大,前者约为后者的1.46倍,而就在此浓度胁迫下,接种F.mosseae处理SS活性增强程度也较为明显,增强量为34.30%。在盐碱处理组中,当处理浓度达到200 mmol·L-1时,接种F.mosseae处理的星星草SS活性增强明显,提高了85.46%,接种R.intraradices处理的SS活性增强了49.03%。当处理浓度上升到300 mmol·L-1,接种F.mosseae处理与接种R.intraradices处理的星星草SS活性下降明显。
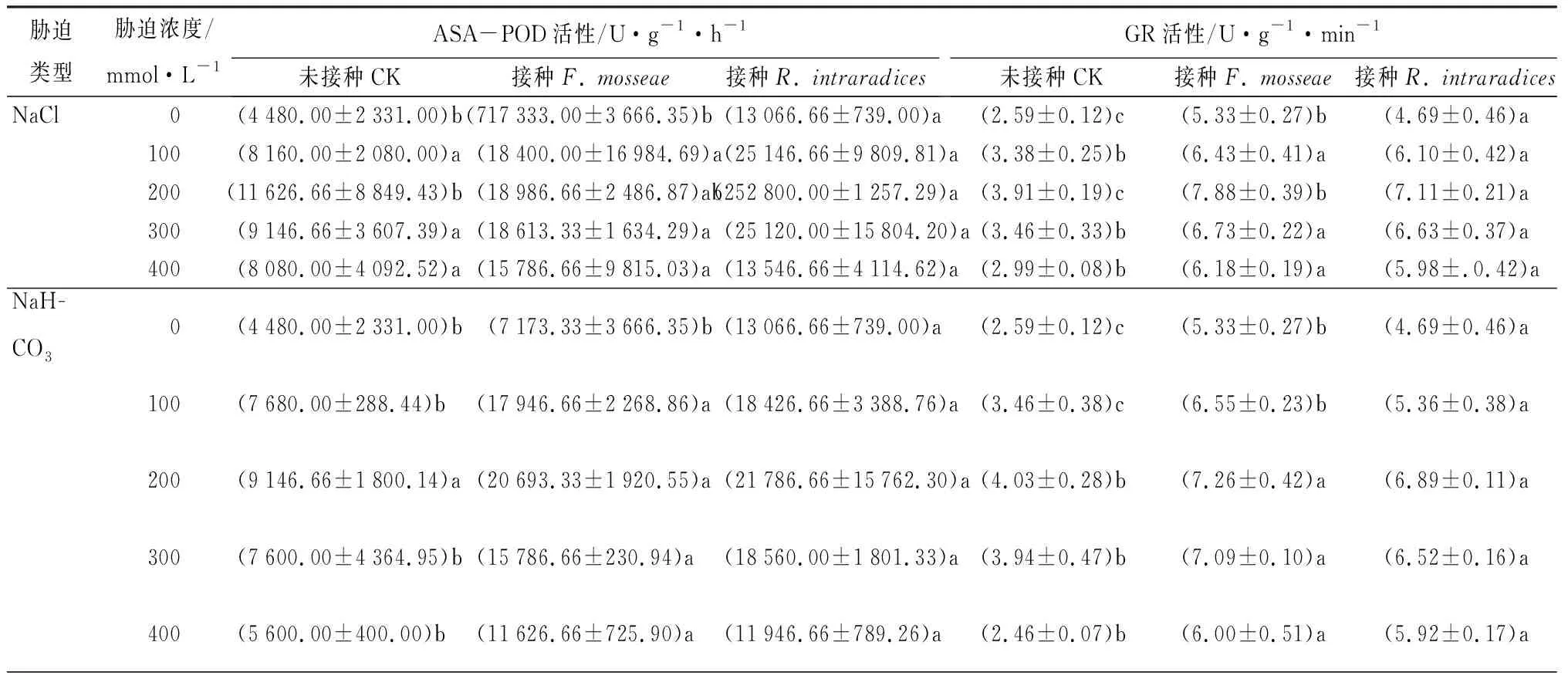
表3 盐碱胁迫下AM真菌对星星草体内酶活性与氨基酸质量分数的影响

胁迫类型胁迫浓度/mmol·L-1SS活性/mg·g-1·h-1未接种CK接种F. mosseae接种R. intraradices游离氨基酸质量分数/mg·g-1未接种CK接种F. mosseae接种R. intraradicesNaCl 0(209404.76±60947.38)a (314761.90±127097.87)a(328214.28±81198.76)a (0.06±1.06)a(0.07±0.22)a(0.07±0.42)a100(251666.66±105601.61)a(340119.04±153696.93)a(324404.76±155822.91)a(0.11±2.27)b(0.11±0.47)b(0.15±0.38)a200(260238.09±47110.82)a(456785.71±256290.50)a(312142.85±58626.93)a(0.21±2.33)b(0.26±0.23)a(0.28±1.59)a300(265833.33±120400.23)a(397976.19±184327.69)a(338571.42±91205.78)a(0.11±1.01)a(0.14±3.70)a(0.12±0.83)a400(265357.14±22082.29)b(369761.90±15412.41)ab(319285.71±43578.74)a(0.09±1.13)a(0.12±1.07)a(0.12±6.00)aNaH-CO30(209404.76±60947.38)a(314761.90±127097.87)a(328214.28±81198.76)a(0.06±1.06)a(0.07±0.22)a(0.07±0.42)a100(224761.90±50209.17)a(337738.09±132335.92)a(307857.14±23015.63)a(0.09±1.22)a(0.10±2.04)a(0.12±1.97)a200(295238.09±125021.59)a(626428.57±371890.68)a(458809.52±134786.45)a(0.20±9.43)a(0.27±1.09)a(0.29±2.35)a300(226904.76±31319.48)a(245833.33±108583.95)a(275000.00±142539.37)a(0.18±0.33)a(0.19±3.34)a(0.22±11.34)a400(187500.00±20237.74)a(203452.38±35928.52)a(233095.23±99780.58)a(0.09±3.06)b(0.15±0.16)ab(0.11±2.10)a
注:表中数据为平均值±标准误。同一胁迫处理下,数据后不同小写字母表示处理间差异显著(α=0.05)。
2.3 盐碱胁迫下AM真菌对星星草游离氨基酸的影响
从表3可知,星星草体内游离氨基酸质量分数随着盐碱胁迫浓度的升高呈先上升后下降的趋势,并在200 mmol·L-1胁迫时游离氨基酸质量分数达到峰值。在100 mmol·L-1盐胁迫时,接种R.intraradices处理星星草游离氨基酸质量分数分别与接种F.mosseae处理及未接种处理差异显著(P<0.05),且接种R.intraradices处理的游离氨基酸质量分数比未接种的增加了1.27倍。当胁迫浓度上升到200 mmol·L-1时,只有盐胁迫组中未接种处理游离氨基酸质量分数分别与接种2种真菌处理的差异显著(P<0.05)。胁迫浓度提高到400 mmol·L-1时,盐碱处理组各接种处理星星草游离氨基酸质量分数下降值要明显于盐处理组,且未接种处理与接种R.intraradices处理游离氨基酸质量分数差异显著(P<0.05)。从趋势上看,盐胁迫下星星草游离氨基酸质量分数快速上升快速下降,而盐碱胁迫下则是快速增加缓慢下降的。
3 结论与讨论
3.1 盐碱胁迫对AM真菌侵染率的影响
随着盐碱胁迫浓度的升高,不同种类的AM真菌对宿主植物的侵染率不同。接种F.mosseae处理的侵染率呈下降趋势,而接种R.intraradices处理的侵染率先升高后降低,这说明盐碱胁迫对不同AM真菌的生长影响是不同的。但在相关学者的研究中却发现,随着盐碱处理强度的升高,AM真菌的侵染率呈下降趋势[25],这与本研究结果有一定差异,所以笔者认为可能是在对植株施加盐碱胁迫时,某特定浓度的盐碱溶液处理可能会影响AM真菌菌丝的形成速度,从而影响其侵染率。如唐明[20]在对AM真菌提高植物抗重金属以及盐碱能力的研究中发现,在盐碱胁迫前用适宜浓度溶液处理接种苗8周,菌根结构在10周后开始形成,由于土壤中的盐碱胁迫使得菌丝无法正常生长,从而迫使更多AM真菌将侵染方向转移至植物根系,能够有效地加快共生体菌根的形成,这也同时说明了AM真菌菌丝的形成与盐分关系密切。另外,水分也会影响到AM真菌的生长[21]。在相关的一些研究中也发现,AM真菌种类、宿主植物种类以及根系形态等因素也与侵染率有一定关系,所以具体影响AM真菌侵染率的原因还有待进一步探索。
3.2 盐碱胁迫下AM真菌对星星草抗氧化酶的影响
植物在生长发育过程中由于电子传递不可避免的会产生大量的活性氧自由基,其积累过多会导致膜系统的破坏以及大分子的流失,正常情况下会将体内活性氧自由基数量保持在细胞可以忍受的状态,而当植物受到胁迫时,体内活性氧数量的增加则会导致细胞受到损伤。相关研究发现,接种AM真菌之后的星星草,无论是否在盐碱胁迫下,其体内的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)这3种抗氧化酶活性都会有所提高,但是当超过某特定浓度胁迫时,星星草体内抗氧化系统已无法应对这种高浓度胁迫,致使这3种酶的活性开始下降[17,22-23]。本研究对盐碱胁迫下AM真菌对星星草体内另外两大抗氧化酶——抗坏血酸过氧化物酶(ASA-POD)与谷胱甘肽还原酶(GR)活性影响进行了探讨,无论在盐胁迫还是盐碱胁迫下,AM真菌都能够明显提高星星草体内ASA-POD的活性,但就2种胁迫类型相比,在单纯盐胁迫下共生体ASA-POD活性提高程度要明显高于盐碱胁迫,而在对GR活性的研究中,这种现象并不明显。这说明AM真菌对星星草抗氧化酶活性的提高能力可能因氧化酶的种类以及胁迫类型的不同而有所差异,也可能与植物种类有关。王英男等[24]对盐碱胁迫下AM真菌对羊草生长影响的试验表明,AM真菌对羊草体内SOD、POD、CAT活性影响在盐胁迫与盐碱胁迫下差异较大,这一结果与本研究结果基本一致。其中ASA-POD与活性氧的结合能力要比CAT弱,它会协助SOD与CAT来清除活性氧,通常在ASA-GSH氧化还原这条途径中清除活性自由基[25]。而GR主要功能则是将氧化型谷胱甘肽(GSSG)还原为还原性谷胱甘肽(GSH),通常也与ASA-POD协同作用促进脱氢抗坏血酸(DHA)的形成,而GSH与DHA也会促进活性氧自由基的分解,降低对植物危害[26]。本研究也认为,单纯盐胁迫与盐碱胁迫对以上2种氧化酶发挥作用途径的影响也有一定差异,针对这一问题还有待进一步探讨。
3.3 盐碱胁迫下AM真菌对星星草蔗糖合成酶以及蔗糖转化的影响
蔗糖合成酶(SS)既能够催化蔗糖的合成又可以催化蔗糖的分解,但普遍认为SS的作用是分解蔗糖[27]。SS的活性强弱直接或者间接影响到蔗糖转化与代谢,细胞壁合成以及细胞分化,最后还会影响到淀粉合成,这些都与植物的抗逆性有密切关联,植物组织中通常含有较高的SS,它能够衡量植物的生长强度以及代谢水平。植物在生长发育过程中任何阶段都需要消耗蔗糖,蔗糖积累水平的高低能够直接反馈出逆境胁迫对植物的影响。本研究中发现,接种AM真菌之后星星草体内SS活性增强,并且在低浓度盐碱胁迫下SS活性呈现出上升趋势,这说明低浓度的盐碱刺激能够促进SS的催化作用,但在高浓度处理下SS活性呈现出下降趋势。这一结果与问雪丛[28]在盐碱胁迫对虎尾草幼苗的糖代谢以光合作用研究中的结果一致。更值得关注的是,在盐碱胁迫下,SS的活性提高程度要明显强于在单纯盐胁迫下,这可能是因为在高pH的环境下,更有利于蔗糖合成酶合成蔗糖,即蔗糖合成酶在碱性环境下活性更强,而在单纯的盐胁迫下发挥作用的是蔗糖合成的逆反应,即蔗糖的分解[29]。并且在盐碱胁迫下SS活性下降趋势较盐胁迫下更为明显,可见高浓度盐碱胁迫下,AM真菌对星星草SS活性的促进作用受到的抑制更加明显,至于上述2种作用强度差异的原因还有待进一步的探索。
3.4 盐碱胁迫下AM真菌对星星草游离氨基酸质量分数的影响
氨基酸是组成蛋白质的基本单位,也是植物根系吸收与同化氮素的主要形式之一,当植物受到盐碱胁迫时,氮素代谢也会受到抑制,致使植物无法正常生长发育,这对禾本科植物的影响非常显著[30]。植物通过积累游离氨基酸类等有机质增加渗透调节能力,在盐碱胁迫下大量积累此类物质,待盐碱胁迫解除时还可用作叶绿素或者其他有机物的合成。相关研究表明,在盐碱环境下,AM真菌能够聚集大量的游离态氨基酸作为渗透调节物质,并且将盐离子积累在宿主根部,以保证植物的渗透势,维持植物在盐碱环境中的生存。本研究发现,在低浓度盐与盐碱胁迫下,游离氨基酸的质量分数呈现出增加趋势,但超过一定浓度后,在盐胁迫下游离氨基酸质量分数的下降趋势要在盐碱浓度胁迫下的趋势明显,这种下降趋势与王英男等[24]对羊草(Leymuschinensis)的研究结果相一致。有研究者认为,游离氨基酸质量分数的变化可以作为判断植物抗盐碱性的一种特征,游离氨基酸的积累是植物在盐碱胁迫下的一种表现[31-32]。
在一定范围的盐碱胁迫强度内,接种F.mosseae与R.intraradices不仅能够有效地通过提高植物抗氧化酶活性、蔗糖转化以及游离氨基酸的积累量来增强植物的抗盐碱性,还能够通过一定程度的改变土壤质地来减少对植物体的侵害;通过侵染率以及SS活性也可看出,碱胁迫比盐胁迫带来的损伤程度更强。星星草是一种有利于改良盐碱地的植物,AM真菌又是一种能够有效提高植物耐盐碱能力的共生真菌,对其共生体耐盐碱能力的研究可为今后盐碱地的改良提供科学依据。

