实时荧光定量PCR检测核桃胶胞炭疽菌
余鹏举 朱天辉 万雪琴 李姝江 王若梅 韩珊
(四川农业大学,成都,611130)
核桃(Juglansregia)又名胡桃、羌桃,属胡桃科(Juglandaceae)核桃属,是我国重要的“木本粮油”战略树种,有重要的经济价值和药用价值,但随着核桃集约栽培程度的不断提高和种植面积的扩大,传统的粗放管理模式及品种的不当选择导致核桃病害危害日趋严重,已成为核桃产业发展面临的严峻问题[1-2]。其中核桃炭疽病是近年来危害核桃产业的主要病害。该病害主要为害核桃果实,引起早期落果或核桃不成实,发病重的年份可致丰产不丰收,而且感染叶片、嫩梢,病害连接成片,造成叶片、嫩梢大面积坏死。核桃炭疽病的病原菌为胶胞炭疽菌(Colletotrichumgloeosporioides),该病原菌在病枝、病果或土壤中越冬,翌年春季病原菌开始活动并借风、雨和昆虫等媒介传播。发病轻重与降雨密切相关,雨季早且降雨量大则病害发病早且严重。此外,水位高、株行间距小和通风透光不良也易造成病害发病严重和传播蔓延[3]。由于该病具有潜伏侵染的特性,且具有发病时间集中、暴发性强等特点[2,4-5],故选择化学药剂进行防治仍是当前主要对策,但发病后再进行防治,往往对核桃产量已造成较重影响。因此,亟需一种能够在发病初期进行早期快速检测的技术,为及时有效的防控措施提供指导。
传统的炭疽病病害的诊断主要依据植株的明显病症和病原菌形态,操作难度大,耗时耗力,且此时病害往往已对植株造成危害,因此,快速准确的检测技术逐步应用于炭疽病的诊断过程中。邢红梅等采用常规PCR成功检测出红掌炭疽病的病原菌(C.gloeosporioides)[6],姚锦爱等通过常规和巢式PCR对建兰胶胞炭疽菌(C.gloeosporioides)成功进行检测[7]。近年来,实时荧光定量PCR技术作为一项新兴技术,因其较常规PCR具有更高的灵敏性、特异性以及高精确定量等优点[8],在植物病害研究上不断深入,并多用于病原菌群体以及基因表达等方面的检测[9-10],但该技术在核桃胶胞炭疽菌检测方面尚无研究报道。本研究针对核桃胶胞炭疽菌建立SYBR Green I实时荧光定量PCR检测方法,对核桃炭疽病的早期预报、定量监测和提高经济效益具有重要意义。
1 材料与方法
1.1 供试菌株
四川农业大学林学院森林保护病理实验室从核桃植株上分离保存鉴定的13株核桃胶胞炭疽菌菌株;6种核桃树其他常见病害病原菌,分别为腐烂病病原菌核桃壳囊孢(Cytosporajuglandina)、褐斑病病原菌核桃日规壳(Marssoninajuglandisn)、枝枯病病原菌胡桃楸拟茎点霉菌(Phomopsisjuglandina)、叶斑病病原菌链格孢菌(Alternariaalternata)、根腐病病原菌腐皮镰刀菌(Fusariumsolani)、果实黑斑病病原菌小孢拟盘多毛孢(Pestalotiopsismicrospora)(表1)。

表1 供试核桃胶胞炭疽菌菌株及其他常见病害病原菌
1.2 供试菌株DNA提取
所用供试菌株于PDA平板上25 ℃培养1周(12 h光暗交替)备用,用刀片将菌丝轻轻刮下,置灭菌研钵中用液氮研磨成粉末状,采用CTAB法提取菌株总DNA。健康核桃植株组织及所有微生物总基因组DNA的提取使用植物基因组DNA提取试剂盒(天根生物科技有限公司),所用植株组织样品均随机采自四川农业大学崇州基地5~8年生健康核桃植株枝干树皮。所有DNA样品置于-20 ℃保存备用。
1.3 特异引物设计
用DNAMAN软件对1.2中提取胶胞炭疽菌菌株DNA的PCR扩增产物的测序结果与GenBank数据库中已登录的炭疽属不同种的ITS序列进行多重同源性比较,根据比对结果选取序列差异位点,用Primer Premier 6进行引物设计,筛选得特异引物:YH1:5′-GGCCTCCCGCCTCCGGGCGGGT-3′;YH2:5′-TTTGAGGGCCTACATCAGC-3′(成都擎科梓熙生物技术有限公司合成),预期扩增目标片段306 bp。在NCBI GenBank database(http://www.ncbi.nlm.nih.gov/BLAST)内使用Blast初步验证引物的特异性。
1.4 引物特异性检测
以不同地理来源的13株核桃胶胞炭疽菌菌株所提取的总DNA、6种其他核桃植株常见病害病原菌所提取的总DNA、健康核桃植株组织及所有微生物总基因组DNA作为模板,以双蒸水作为对照,进行常规PCR和实时荧光定量PCR检测,验证引物特异性。
常规PCR反应体系,25 μL总体积中包含TaqDNA聚合酶12.5 μL,上、下游引物各1.0 μL,DNA模板1.0 μL,双蒸水9.5 μL。反应程序为,94 ℃变性5 min;94 ℃变性1 min,68 ℃退火1 min,72 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min。扩增后的PCR产物在1%的琼脂糖凝胶上进行分析。
实时荧光定量PCR反应体系:采用三步反应法,25 μL总体积中包含SYBR®Premix Ex TaqTMII(TAKARA SYBR®Premix Ex TaqTMII)12.5 μL,上、下游引物各2.0 μL,DNA模板2.0 μL,双蒸水6.5 μL。反应程序为,95 ℃变性30 s;95 ℃变性5 s,68 ℃退火40 s,72 ℃延伸1 min,共45个循环;最后熔融曲线,95 ℃ 10 s,然后65 ℃到95 ℃,每10 s升0.5 ℃。实时荧光定量PCR的每个样品重复3次,通过熔解曲线判断是否有唯一的产物峰。
1.5 引物灵敏度检测
将1.2中提取的核桃胶胞炭疽菌DNA经1%琼脂糖电泳,割胶,纯化后得到标准品,紫外分光光度计检测其含量及纯度,并按10倍梯度稀释为100、10、1、10-1、10-2、10-3、10-4、10-5、10-6mg·L-1,置于-20 ℃备用。使用特异引物YH1/YH2进行常规PCR扩增和实时荧光定量PCR扩增,以双蒸水作为对照,测定特异引物灵敏度。
1.6 实时荧光定量PCR标准曲线的绘制
使用EASY Dilution(TAKARA)梯度稀释核桃胶胞炭疽菌DNA作为模板(如1.5所述),在CFX96 Real-Time PCR Detection System上进行实时荧光定量PCR扩增,重复3次,以扩增得到的Ct值为纵坐标(Y),以标准品模板质量对数值为横坐标(X),做出标准曲线,得到线性和可靠的标准曲线(R2>0.99)。
1.7 感病核桃林间样品的定量检测验证
为进一步验证建立的SYBR Green I实时荧光定量PCR检测体系的准确性和实用性,以2016—2017年从四川、陕西、湖北等地核桃林间采集的10份患有炭疽病的核桃植株组织为验证材料,对这些来自于不同地区、不同发病部位的林间感病核桃植株样品进行定量检测验证,每份样品组织取200 mg,采用CTAB法结合植物基因组DNA提取试剂盒(天根生物科技有限公司)提取总DNA,作为PCR反应模板,按照1.4中所述SYBR Green I实时荧光定量PCR检测体系进行定量检测验证,每份样品重复3次。
2 结果与分析
2.1 引物特异性验证
使用特异引物YH1/YH2对13株核桃胶胞炭疽菌菌株所提取的总DNA、6种核桃植株其他常见病害病原菌所提取的总DNA、健康核桃植株组织及所有微生物总基因组DNA进行PCR扩增,结果显示:13株核桃胶胞炭疽菌总DNA样品均扩增出306 bp目标片段,而6种核桃植株其他常见病害病原菌所提取的总DNA、健康核桃植株组织及所有微生物总基因组DNA和对照均未扩增出目标片段(图1)。实时荧光定量PCR结果同样显示:该特异引物对6份核桃胶胞炭疽菌模板样品均只有唯一的吸收峰(图2)。因此,该引物对核桃炭疽病致病菌胶胞炭疽菌具有特异性。
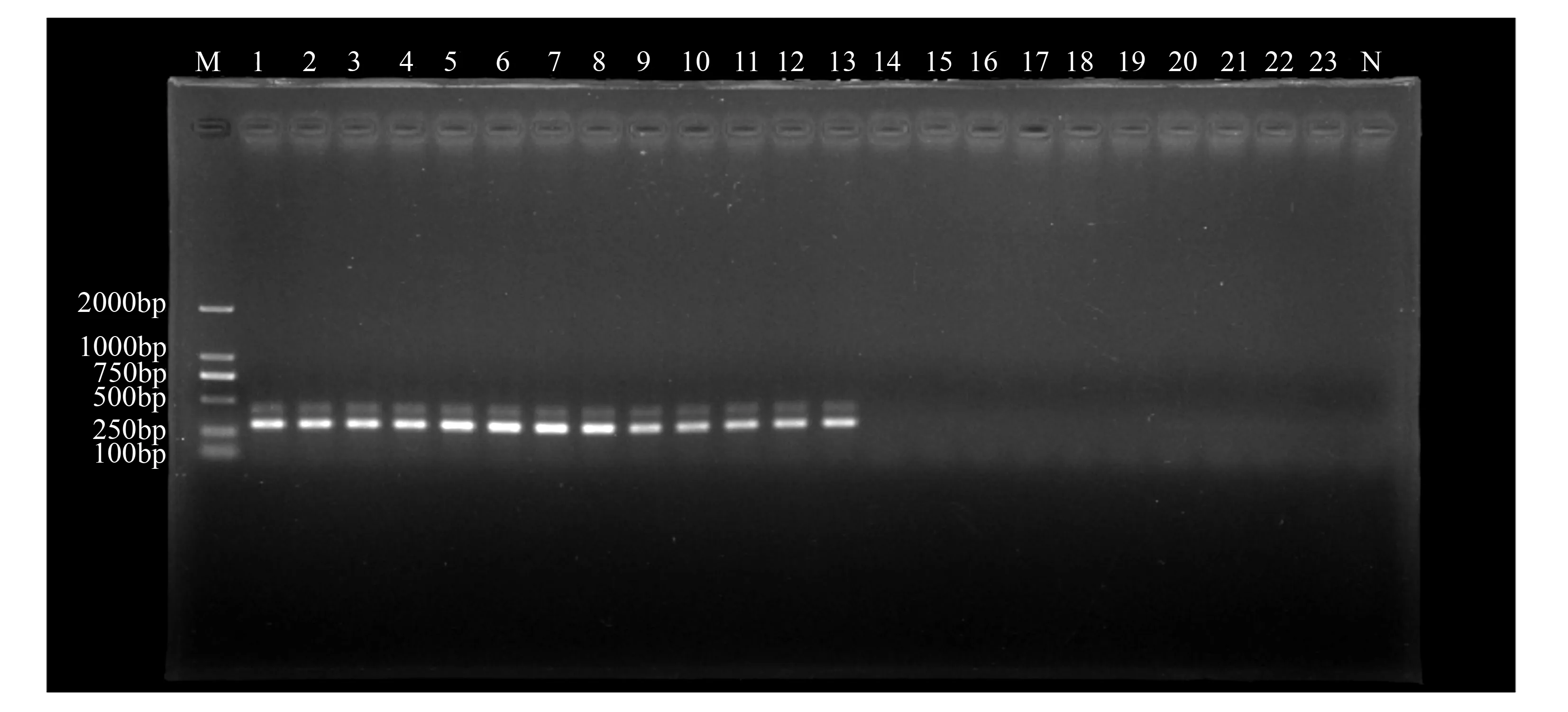
M.DL2000 DNA Marker;1~13.胶胞炭疽菌;14~19.6种其他核桃常见病害病原菌,分别为Cytosporajuglandina、Marssoninajuglandis、Phomopsisjuglandina、Alternariaalternata、Fusariumsolani、Pestalotiopsismicrospora;20~23.健康核桃植株组织及所有微生物总基因组DNA;N.阴性对照。
图1核桃胶胞炭疽菌与其他菌DNA经常规PCR扩增后的电泳结果
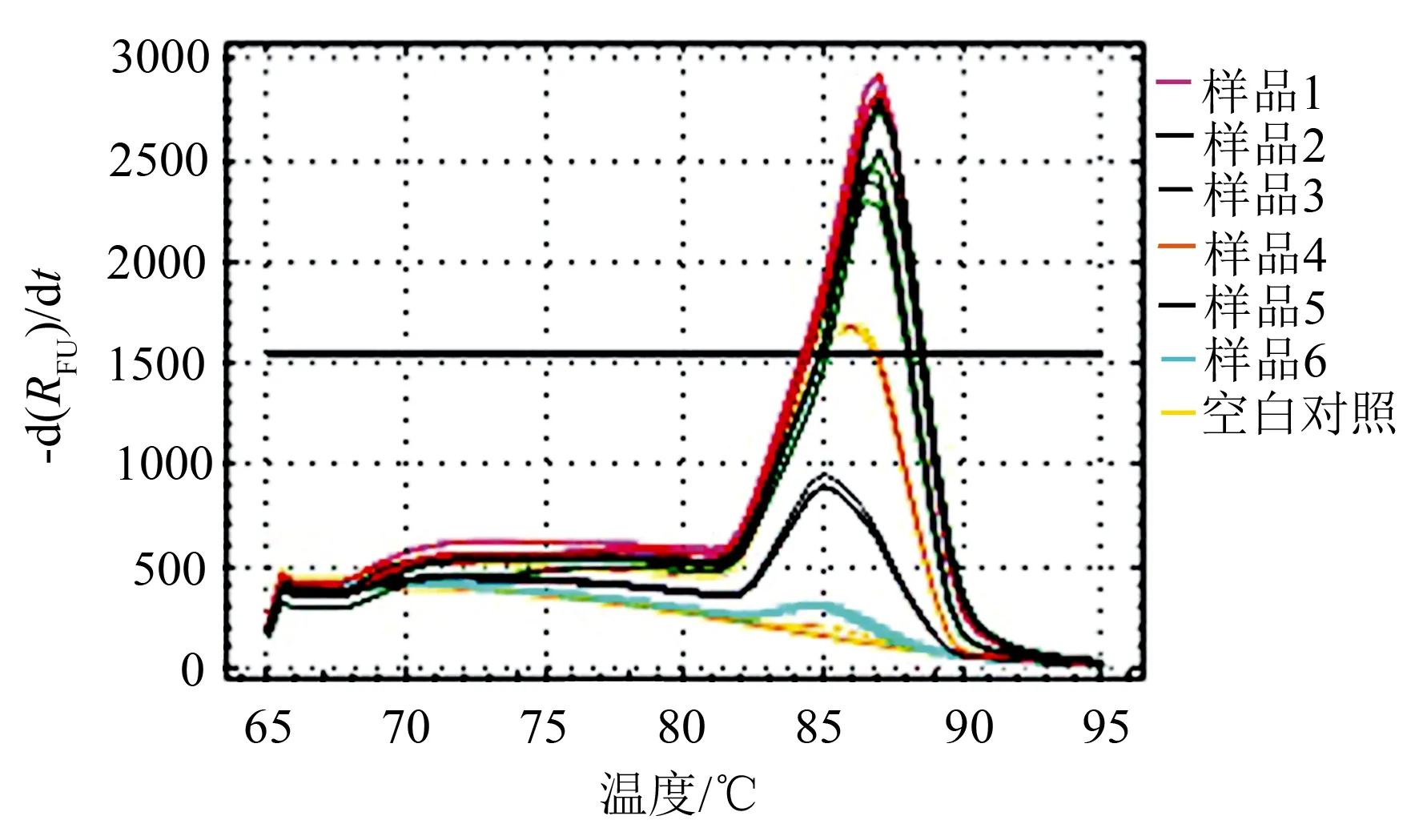
图2引物YH1/YH2对核桃炭疽病病原菌实时荧光定量PCR扩增的熔解曲线
2.2 特异引物的灵敏度
利用梯度稀释的核桃胶胞炭疽菌的标准品对特异引物进行常规PCR和实时荧光定量PCR的灵敏度测定。常规PCR结果表明(图3),标准品质量浓度大于10-1mg·L-1的均能扩增出明显条带,标准品质量浓度为10-1mg·L-1的可以扩增出模糊的条带,标准品质量浓度小于10-1mg·L-1的扩增条带已无法准确辨别。实时荧光定量PCR条件下(图4),当标准品质量浓度小于等于10-3mg·L-1时,其扩增曲线的荧光值低于阀值。故常规PCR检出标准品的最低质量浓度为10-1mg·L-1,实时荧光定量PCR可检出标准品的最低质量浓度为10-3mg·L-1,即实时荧光定量PCR检测方法的灵敏度是常规PCR检测方法的100倍。

M.DL2000 DNA Marker;1~9.常规PCR反应梯度分别为100、10、1、10-1、10-2、10-3、10-4、10-5、10-6mg·L-1;N.阴性对照。
图3常规PCR灵敏度验证电泳结果
2.3 实时荧光定量PCR标准曲线绘制
对梯度稀释的标准品进行实时荧光定量PCR扩增,在扩增图谱中(图5),荧光值增加时对应的循环数与用于定量的标准品的浓度梯度呈负相关性,得出循环数Ct值(Y)与标准品模板质量对数值(X)的线性关系为:Y=-5.925X+32.881 4,相关系数R2=0.995,因此标准曲线可以作为后续检测样品的可靠定量参考。

图4 引物YH1/YH2的实时荧光定量PCR的灵敏度检测
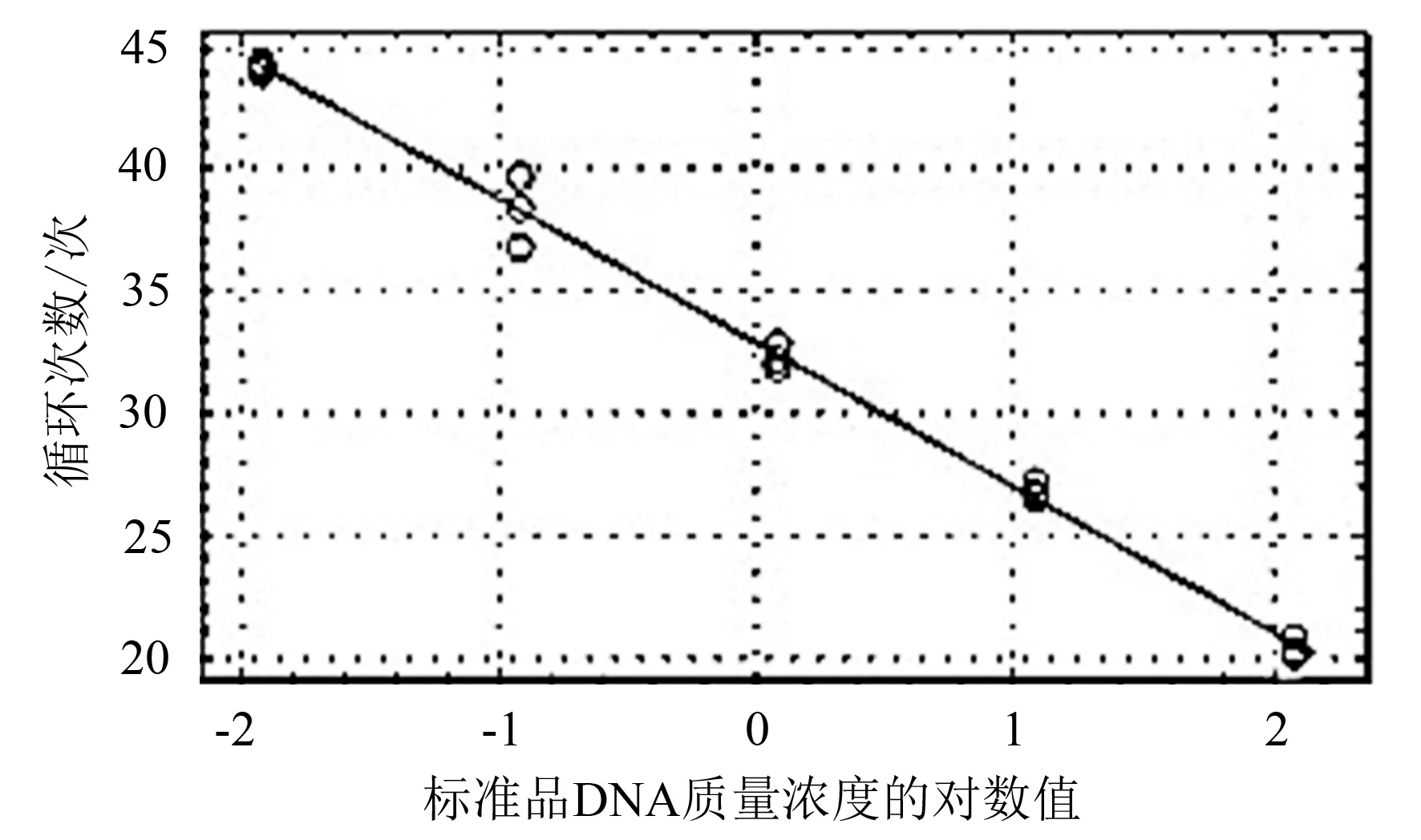
图5 实时荧光定量PCR标准曲线
2.4 林间感病核桃样品定量检测验证
使用特异性引物YH1/YH2对10份林间感病核桃植株组织样品进行实时荧光定量PCR定量检测验证,结果表明(表2),10份林间感病核桃植株组织中表现出轻度、中度、重度症状的7份样品均检测出含有胶胞炭疽菌且含菌量可测定,含菌量最高为148.354 mg·L-1;3份无症感病核桃植株组织样品中只有一份测出含有胶胞炭疽菌,含菌量为0.012 mg·L-1;且病症表现越明显检测到的含菌量质量浓度越高。所有阳性产物通过克隆、测序(成都擎科梓熙生物技术有限公司)获得ITS序列,在NCBI GenBank database内Blast比对分析表明,与胶胞炭疽菌(GenBank登录号为KT342872.1)序列一致性达96.0%~99.0%,进一步证明这些林间感病核桃样品确实被核桃胶胞炭疽菌侵染。
3 讨论
核桃炭疽病的林间病症以及往年发病规律是传统方法诊断核桃炭疽病的主要依据,但由于该病所具有潜伏侵染、发病急、暴发强的特点,采用传统方法诊断就易造成误诊和漏诊的现象,且依靠传统方法准确诊断核桃炭疽病很大程度依赖于炭疽病的典型病症,此时确诊为核桃炭疽病再进行防治,往往已经对核桃的产量造成影响,且防治效果不佳。近年来,随着分子生物学技术的不断发展,越来越多的快速检测技术逐步应用于植物真菌病害的检测。核糖体DNA内转录间隔区(ITS)既具有保守性又在种间水平上具有特异性,针对ITS区进行PCR扩增、测序及序列分析后再设计特异性引物来诊断和检测植物病原菌已越来越被广泛的应用[11-12]。本研究根据核桃炭疽病病原菌胶胞炭疽菌的核糖体DNA内转录间隔区(ITS)设计特异性引物,建立了核桃炭疽病SYBR Green I实时荧光定量PCR检测技术,并与常规PCR的灵敏度进行了比较,结果表明,实时荧光定量PCR的灵敏度是常规PCR的100倍,达到10-3mg·L-1,比实时荧光定量PCR法检测油菜菌核病菌的灵敏度1.4×10-3mg·L-1略高[13],但比实时荧光定量PCR法检测杨梅凋萎病菌的灵敏度10-6μg·L-1低[14]。通过对林间感病核桃样品组织的定量检测,也进一步验证所建立SYBR Green I实时荧光定量PCR检测技术在监测核桃炭疽病的实践应用中的可靠性和实用性。

表2 林间感染炭疽病核桃样品病原菌检测结果
注:表中数据均为平均值±标准误;“-”代表未检出,“+”代表检出。
实时荧光定量PCR具有PCR扩增的高灵敏性、DNA杂交的高特异性和光谱技术的高精确定量以及较常规PCR、巢式PCR更加快速简便等优点,既可以做定量分析又可以做定性分析,且因无须在扩增后进行操作,如电泳检测,大大降低了污染的可能性,提高检测的准确性[8]。基于以上原因且考虑到实际应用中实时荧光定量PCR的经济成本、仪器要求等问题,如何优化本试验针对核桃胶胞炭疽菌所建立的SYBRGreenI实时荧光定量PCR检测体系,使其较常规PCR甚至巢式PCR等其他检测技术更具有推广适用价值,是本试验接下来研究的主要内容。黄怀冬等通过引入常规PCR预扩增,以预扩增PCR产物为模板进行qPCR对尖孢镰刀菌(Fusariumoxysporum)进行检测,较未引入预扩增时灵敏度提高了10倍[15]。Guoetal.在保守性好的tubB基因序列基础上设计了病原菌(Rhizoctoniacerealis)的特异性引物,并成功构建其实时荧光定量PCR检测体系[16]。本研究接下来将在所建立的SYBRGreenI实时荧光定量PCR检测核桃炭疽病体系中加入常规PCR预扩增环节,并尝试寻找保守性好的基因序列设计适合实时荧光定量PCR的更优特异性引物,旨在建立针对核桃组织内炭疽病菌更为高效、灵敏的实时荧光定量PCR检测体系。

