牦牛鲜精与冻精HSP70表达差异比较研究
唐 朋,凌笑笑,贾聪俊,梁春年,吴晓云,王宏博,褚 敏,阎 萍*
(1.中国农业科学院兰州畜牧与兽药研究所,甘肃省牦牛繁育重点实验室,兰州 730050;2.甘肃农业大学动物科技学院,兰州 730050)
牦牛是青藏高原地区重要的经济动物,其提供的肉、奶和毛皮是当地牧民赖以生存和发展的生活资料,同时也是牧区经济的支柱产业和牧民经济收入的主要来源[1]。但与其它哺乳动物相比,牦牛两年一胎或三年两胎的低繁殖率,成为制约高原畜牧业发展及生态保护的主要瓶颈。人工授精(artificial insemination,AI)是提高牦牛繁殖效率不可或缺的环节,这就需要解决精液冷冻保存问题。精液冷冻保存技术是现代常用的辅助生殖技术,可长期有效保存优质种公畜遗传资源,加快育种进程。然而,冻融后精子活力和繁殖力的明显降低是导致人工授精失败的根本原因[2]。有研究发现,在精液冷冻和解冻过程中,精子发生不可逆的质膜破裂、酶(蛋白质)的变性、脂质过氧化作用导致的氧化应激、DNA损伤等致命性损伤,导致至少50%的精子活力降低,甚至死亡,推测这可能与冻融过程中精子蛋白功能的损伤有关[3-6]。Huang等[7]研究发现,冻融后精子活力的维持需要一些蛋白质发挥作用。因此,分析精子中蛋白质的变化可能是预测精子质量的有效方法。
热休克蛋白(heat shock protein,HSPs),又称为热应激蛋白或应激蛋白,是细胞及生物体在理化和生物等应激原刺激后,所产生的一类伴随细胞内功能性伴侣蛋白。作为分子伴侣,HSPs可通过调控高度特化的信号转导和转录因子在内的蛋白质折叠,维持细胞内环境稳态。HSPs还具有抗凋亡特性,可以调节各种免疫反应。因此,HSPs作为潜在的临床诊断标志物是医学领域中的研究热点[8]。HSP70是HSPs家族最广泛、最重要的成员,在细胞内源性保护机制中发挥重要作用[9]。HSP70在蛋白质折叠和重折叠,识别非天然蛋白质构象,蛋白质的跨膜转运防止新合成的蛋白质聚集,处理受损和错误折叠蛋白质等方面发挥重要作用[10-11]。李俊杰等[12]研究发现,精子由于应激产生HSP70,增强细胞对外界损伤的耐受程度,维持细胞的正常代谢功能,且与哺乳动物精子的生成相关。敲除HSP70小鼠表现为精母细胞结构异常,初级精母细胞形成受阻,细胞凋亡数增加等[13]。还有报道认为,HSP70可能在人精-卵识别中发挥重要作用,其蛋白表达水平与牛、猪的受精率密切相关[14-16]。虽然有研究表明,冻融精液与鲜精相比,精子受精能力明显降低[17],但冻融后牦牛精子质量、精子HSP70表达量变化鲜少报道。因此,本试验以大通牦牛为研究对象,探究冷冻前后对精子活力、质膜完整性的影响;采用qRT-PCR、Western blot和免疫荧光技术探究冷冻前后精子HSP70表达量及蛋白分布的变化,为探索HSP70在牦牛精子中的功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 本试验所用的牦牛精液均来自青海省大通种牛场繁育研究中心。假阴道法(40 ℃) 采集6头健康且繁殖能力正常的大通牦牛种公牛的精液。鲜精活力≥ 0.70,冻精活力≥ 0.30,精子密度≥ 1×108·mL-1。
1.1.2 主要试剂 Percoll细胞分离液、12孔板专用细胞爬片均购自索莱宝科技有限公司(北京),反转录试剂盒、实时荧光定量试剂盒均购自宝生物公司(大连),Anti-HSP70(ab2787)抗体、二抗均购自Abcam公司(美国),RNeasy mini kit购自QIAGEN生物公司(德国),BIOXcell稀释液购自IMV(德国卡苏)生物公司,Western blot和免疫荧光检测所用的其他试剂均购自碧云天生物公司(南京)。
1.2 鲜精稀释、冻精解冻及精子纯化
1.2.1 稀释液配置 低温稀释液与冷冻稀释液配置相同,均由1体积BIOXcell稀释液和4倍体积灭菌双蒸水组成。
1.2.2 牦牛鲜精采集及稀释 新鲜精液用光学显微镜进行精液常规品质检查,将精子活力在70%以上、无异味、色泽正常的精液中缓慢加入2倍体积低温稀释液(37 ℃预热),轻轻摇晃,使精液与稀释液充分接触,室温下静置平衡2 h,放入4 ℃恒温箱中运回实验室备用。
1.2.3 牦牛精液冷冻与解冻 取对应牦牛的精液置于试管中,室温下800 r·min-1低速离心10 min, 弃上清,沉淀用冷冻稀释液1∶2稀释,并分装于0.25 mL的冷冻细管中,封口机封口。放入冷冻程序仪中,以3 ℃·min-1速率降至4 ℃,平衡2~3 h, 用液氮熏蒸法处理10 min后,投入液氮中保存。
解冻时,将冷冻细管从液氮中迅速取出后,立即放到37 ℃水浴锅中,解冻15 s,待精液完全溶解后,取出细管,剪开两端,倒出精液进行后续试验。
1.2.4 精子纯化 取适量新鲜精液和冻融精液分别缓慢加入3倍体积45% Percoll单层梯度液上层,800 r·min-1离心20 min,去上清,向沉淀中加3 mL PBS缓冲液洗涤2次,5 000 r·min-1离心5 min, 留沉淀。
1.3 冷冻前后精子质量评定
精子活力:分别取10 μL新鲜精液和冻融精液均匀滴于37 ℃预热的载玻片上,盖上盖玻片,放在恒温电子加热板上1 min左右。在光学显微镜下,取5个不同视野观察精子运动状态,对直线运动的精子进行计数,计算精子活力。每种处理6个生物学重复。
精子质膜完整性:采用低渗肿胀-伊红拒染法(hypoosmotic swelling- excludingeosin Y test,HOS-EY)。将低渗液先置于37 ℃密闭离心管中,加热5 min, 适量精液与低渗液混合,37 ℃孵育30 min,加入0.05 mL伊红低渗染料,混匀。在100×相差显微镜下观察300个精子形态和染色情况,质膜完整表现为尾部弯曲和头部未着色,同时计算质膜完整率。每种处理6个生物学重复。
1.4 冷冻前后牦牛精子HSP70基因表达检测
1.4.1 总RNA提取及cDNA合成 取适量纯化后精子,参照RNeasy mini kit操作说明进行总RNA提取。用NanoDrop 2000超微量分光光度计检测总RNA浓度和纯度,选择OD260nm/OD280nm为1.8~2.1的总RNA样品,参照反转录试剂盒说明,将500 ng总RNA反转录为等浓度cDNA,-20 ℃保存备用。
1.4.2 qRT-PCR 利用Primer Premier 5.0软件,根据GenBank公布的牛HSP70(登录号:NM_203322)和β-actin(登录号:NM_173979)基因序列设计特异性引物(表1),引物由北京擎科生物技术股份有限公司合成。按照荧光定量试剂盒建议的体系进行qRT-PCR扩增。反应体系为25 μL:SYBR GreenⅠPremix Mix 12.5 μL,上、下游引物各1 μL,cDNA 3 μL,加RNase-free ddH2O至总体积25 μL。反应程序采用两步法:94 ℃预变性30 s;94 ℃变性5 s, 60 ℃退火30 s,40个循环。每个样品重复3次。
表1引物序列
Table1Theprimersequences

基因Gene引物序列(5′→3′)The sequences of primer产物长度/bp Product lengthHSP70F: TGTCGCTGGGACTGGAGA,R: GCTGGTTGTCCGAGTAGGTG111β-actinF: ATTGCCGATGGTGATGAC,R: ACGGAGCGTGGCTACAG177
1.5 Western blot检测冷冻前后牦牛精子HSP70蛋白
适量鲜精和冻精纯化后,加入裂解液和PMSF,置于冰上裂解30 min,超声波破碎,12 000 r·min-1,4 ℃离心10 min,保留上清蛋白溶液。BCA蛋白浓度测定试剂盒定量总蛋白质浓度,分装,置于-20 ℃ 冰箱保存。采用常规Western blot方法测定提取蛋白样品中HSP70含量水平。取适量蛋白按比例加入5× SDS上样缓冲液,100 ℃煮沸10 min,每孔上样量为20 μg,经SDS-PAGE凝胶电泳、转至PVDF膜及封闭后(5% BSA,37 ℃2.5 h),分别加入HSP70和α-tubulin一抗,4 ℃孵育过夜。PBS摇床洗膜3次,加入HRP标记二抗,37 ℃孵育1.5 h, PBS洗膜3次,电化学发光(electrochemiluminescence,ECL)试剂盒进行曝光拍照,记录试验结果。使用Image J图像分析软件扫描测定,重复3次, 计算每个条带的总灰度值。HSP70蛋白相对含量=HSP70蛋白灰度值/α-tubulin蛋白灰度值。
1.6 免疫荧光检测冷冻前后牦牛精子HSP70蛋白
适量牦牛精液纯化后,加4%多聚甲醛混匀,固定25 min, 取3 μL均匀铺至TC处理的盖玻片上,风干后PBS清洗3次,每次10 min;用1% Triton X-100 通透15 min,PBS清洗3次;5% BSA封闭30 min,PBS清洗3次;HSP70一抗(1∶100)37 ℃湿盒中孵育2 h,PBS清洗3次;加入FITC标记二抗(1∶100),暗盒中37 ℃静置1 h,PBS清洗3次;DAPI染核5 min,PBS洗3次;将盖玻片转移至载玻片上,甘油封片;荧光显微镜下观察并拍照,每张片子随机选取5个视野,使用Image J图像分析软件分析每个视野内阳性区域HSP70的光密度值。
1.7 数据分析
数据均以“平均值±标准误(mean±SE)”表示,qRT-PCR以β-actin作为内参基因,冷冻前后HSP70基因相对表达量采用2-△△Ct方法进行均一化处理。采用SPSS 19.0软件对数据进行t检验分析,每个处理6个重复,差异显著性水平为P<0.05。GraphPad Prism 5.0软件作图。
2 结 果
2.1 冷冻前后精子活力和质膜完整性的变化
分别采集6头牦牛新鲜和冻融精液,分析冷冻前后牦牛精子活力、质膜完整率的变化,结果见图1和表2。由表2可见,鲜精组精子活力、质膜完整率分别为(71.7±1.054)%、(78.4±0.698)%,冻精组精子活力和质膜完整率分别为(33.3±0.494)%、(38.2±1.124)%,与鲜精组相比,冻精组精子活力和质膜完整率均极显著降低(P<0.01)。

A.鲜精组;B.冻精组。1.质膜完整的精子;2.质膜不完整的精子
A. Fresh group;B. Frozen-thawed group. 1.Sperm with integral plasma membrane;2.Sperm with incomplete plasma membrane
图1 冷冻前后精子质膜完整性检测(100×)
Fig.1 Detection of sperm plasma membrane integrity before and after freezing(100×)
表2冷冻前后精子活力和质膜完整性测定(n=6)
Table2Detectionofspermmotilityandplasmamembraneintegritybeforeandafterfreezing(n=6)

组别Group精子活力/%Sperm motility质膜完整率/%Plasma membrane integrity rate鲜精组Fresh group71.7±1.054A78.4±0.698A冻精组Frozen-thawed group33.3±0.494B38.2±1.124B
同列上标不同大写字母表示组间差异极显著(P<0.01)
Means in the same column with different capital letter superscripts differ extremely significantly between groups(P<0.01)
2.2 冷冻前后精子中HSP70 mRNA的表达
qRT-PCR结果显示(图2),HSP70在精子冷冻前后均有表达,但表达量存在差异。与鲜精相比,冻精HSP70相对表达量显著降低(P<0.05)。
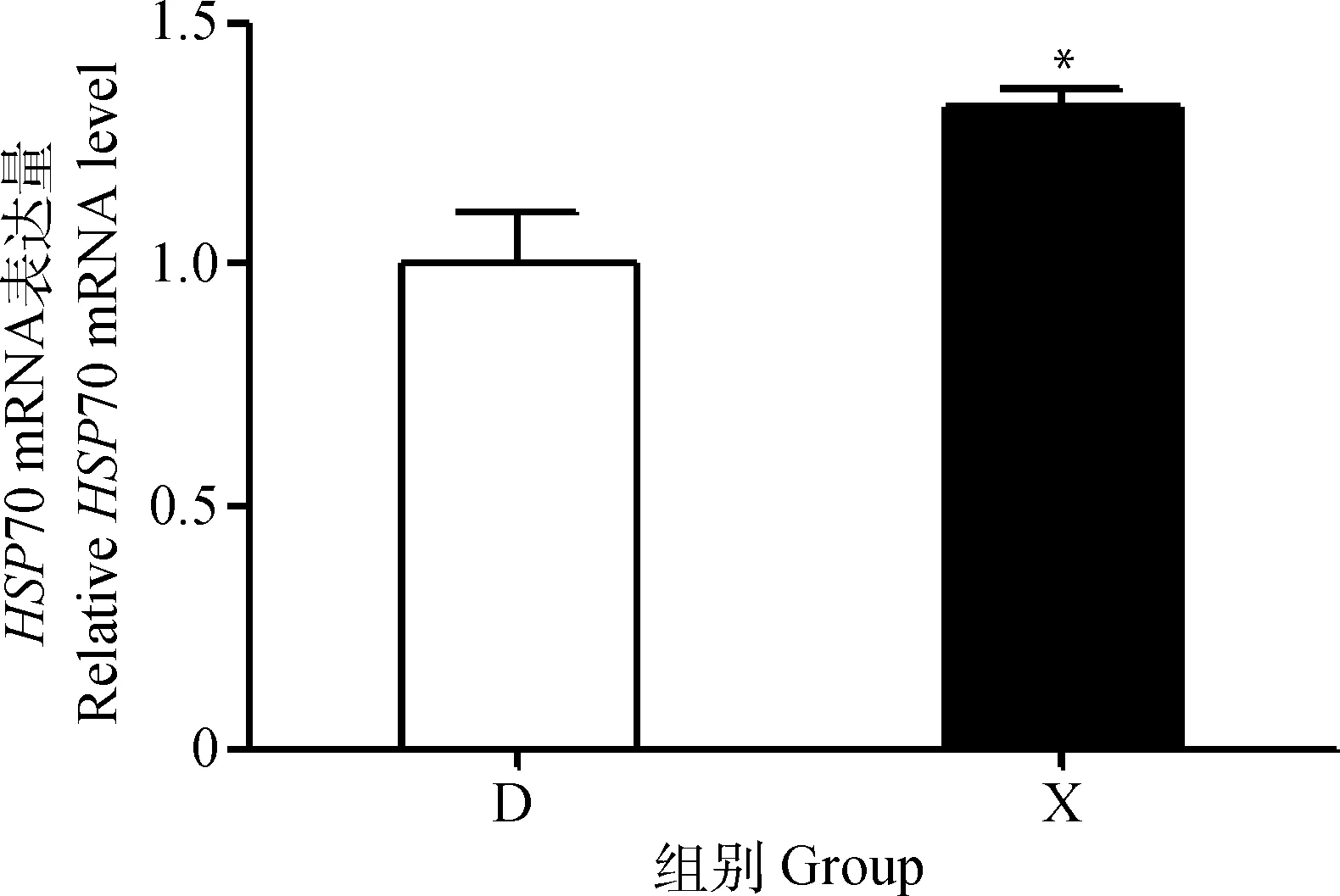
D. 冻精组;X. 鲜精组。组间比较,*. P<0.05。下同
D. Freezing group; X. Fresh group. Comparison between groups, *.P<0.05. The same as follows
图2 冷冻前后牦牛精子HSP70 mRNA的表达量
Fig.2 Expression of HSP70 mRNA in yak sperm before and after freezing
2.3 冷冻前后精子中HSP70蛋白的表达
通过Western blot分析冷冻前后牦牛精子中HSP70蛋白相对表达量(图3)结果可知,冷冻前后精子中HSP70蛋白水平表达趋势与转录水平较为类似。HSP70蛋白在精子冷冻前后均有表达,但表达量存在差异。鲜精中HSP70蛋白表达量极显著高于冻精(P<0.01)。

A. Western blot检测;B. HSP70蛋白相对表达量。**. P<0.01。下同
A. Western blot detection; B. The relative expression of HSP70 protein.**. P<0.01. The same as follow
图3 冷冻前后牦牛精子HSP70蛋白相对表达
Fig.3 Relative expression of HSP70 protein in yak sperm before and after freezing
2.4 冷冻前后精子中HSP70蛋白的表达与定位
免疫荧光检测结果如图4所示,冷冻前后精子细胞内HSP70蛋白均有不同程度的表达。在鲜精中,免疫阳性反应主要定位于精子顶体区、顶体赤道段、后顶体区和精子中段,而冻精HSP70蛋白主要在精子后顶体区和精子中段表达。鲜精组HSP70蛋白的平均光密度值极显著高于冻精(P<0.01)。
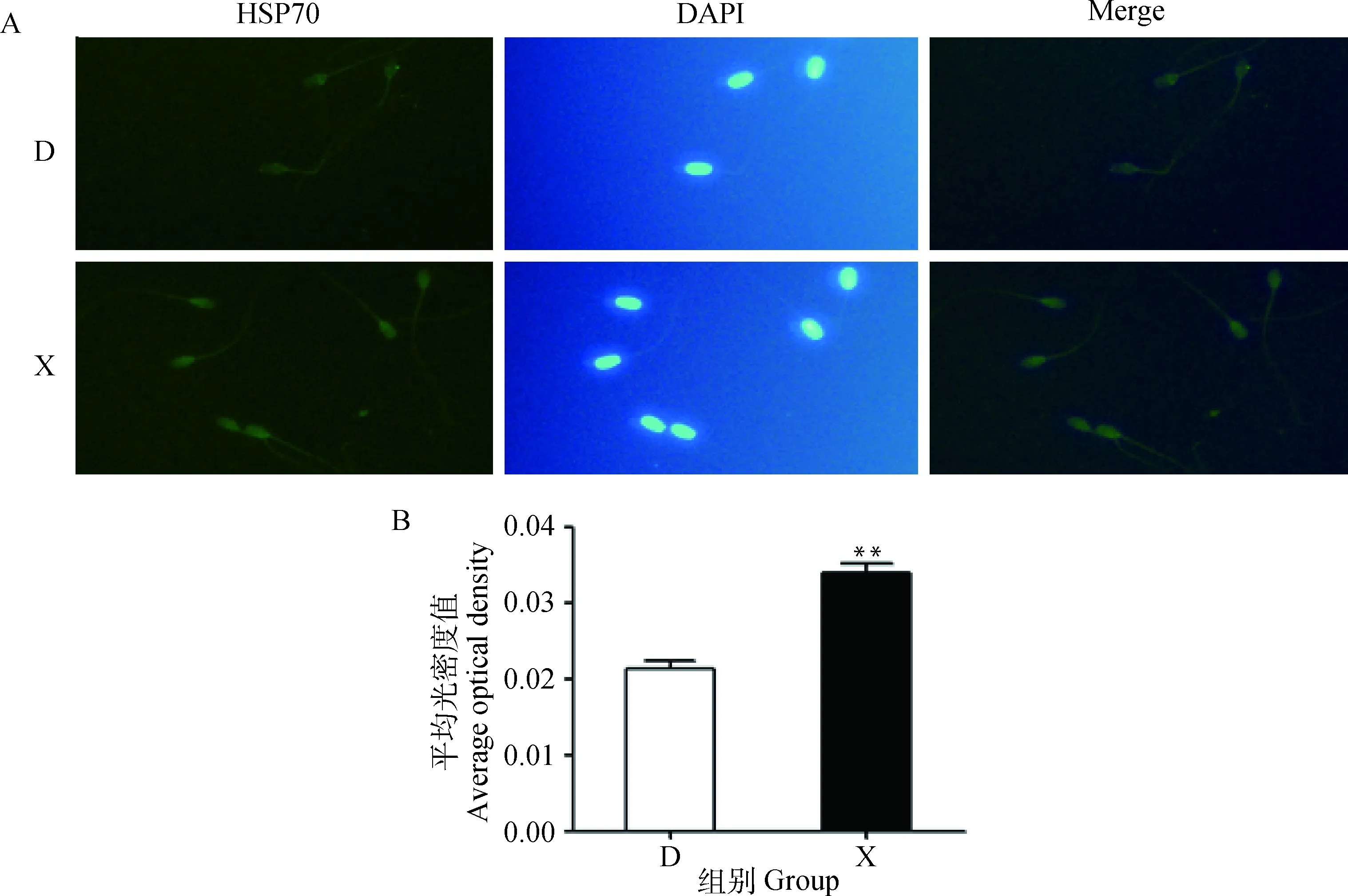
A.HSP70蛋白免疫荧光检测(100×);B.平均光密度值分析
A. Immunofluorescence detection of HSP70 protein(100×);B. Average optical density analysis
图4 冷冻前后牦牛精子HSP70蛋白的表达
Fig.4 Expression of HSP70 protein in yak sperm before and after freezing
3 讨 论
3.1 冷冻前后HSP70表达变化
HSP70蛋白主要存在于细胞质和细胞核内,作为分子伴侣,主要参与蛋白质折叠,维持细胞内稳态。研究表明,温度的变化可能会影响精子质量,冻融过程导致40%~50%活精子损失[3,18]。研究发现,正常精子HSP70表达水平高于异常或死精子[19]。本研究采用qRT-PCR和Western blot方法确定冷冻前后HSP70表达量差异,研究结果显示,冻融后精子HSP70 mRNA表达量显著降低(P<0.05);HSP70蛋白水平极显著下降(P<0.01),这种由温度变化导致的牦牛精子HSP70表达量下降与先前研究结果一致[17],可能由于冻融后死精子数的增加导致HSP70合成减少;也可能是精子中HSP70被用于合成其它酶类以降低精子在超低温条件下的损伤。
成熟精子HSP70蛋白亚细胞定位与其他体细胞不同,精子处于获能或顶体反应的不同阶段,HSP70呈现出一个动态再分配过程。在诱导获能期间,HSP70蛋白缓慢沿着精子质膜侧向迁移和重排。正常生理状态下,处于不同阶段的精子细胞中HSP70蛋白分配至不同部位,但其表达量不会存在显著差异[15]。Kamaruddin等[20]研究发现,刚射出的精子仅在顶体检测到HSP70,而经获能和顶体反应的精子HSP70被重新分配至赤道段、后顶体区和精子中段。本研究进一步采用免疫荧光对HSP70蛋白表达定位显示:鲜精HSP70定位于顶体区、顶体赤道段、后顶体区和精子中段;冻精HSP70蛋白主要定位于后顶体区和精子中段。与鲜精相比,冻精HSP70平均光密度值极显著减弱(P<0.01)。本试验结果与Varghese等[21]的研究结论相似。推测冷冻前后HSP70蛋白的定位差异可能是导致冷冻精子繁殖力降低的原因。
3.2 冷冻前后精液品质评估
目前,用来评估冻融后精子质量的参数有精子活力和质膜完整性。研究发现,HSP70与脂质膜相互作用,推测其参与膜蛋白和跨膜易位蛋白的折叠[22]。本研究通过分析比较鲜精组和冻融组精子质膜完整性发现,冻融后精子质膜完整性极显著下降(P<0.01),这可能与精子HSP70蛋白降低有关。线粒体是精子能量的主要来源,冻融后精子活力的下降与线粒体结构损伤及ATP水平降低有关[23]。而HSPs具有一种内在的ATP酶活性,对于体内靶蛋白活化是必不可少的[24]。Aboagla等[25]发现精子膜蛋白在膜的流动性中发挥重要作用,精子膜蛋白异常折叠导致膜的流动性降低,进而影响精子活力。本研究结果表明,冻融后精子活力极显著降低(P<0.01),这与王昕等[26]的研究结果一致,推测可能与精子HSP70表达量有关,仍需进一步研究。
4 结 论
HSP70 mRNA与蛋白在冷冻前后牦牛精子内均有表达,但表达量和分布存在差异。其中冻融后HSP70在转录和翻译水平分别呈现显著(P<0.05)和极显著降低(P<0.01)。免疫荧光结果显示,鲜精HSP70主要在顶体区、顶体赤道段、后顶体区和精子中段表达,而冻精HSP70主要定位于后顶体区和精子中段且平均光密度值极显著降低(P<0.01)。本研究为探索HSP70在牦牛精子中的生物学功能提供了基础数据,但其作用机制有待深入研究。

