苹果赤霉素氧化酶基因MdGA2ox8的克隆及功能分析
李飞鸿,侯应军,李雪涵,余心怡,渠慎春
苹果赤霉素氧化酶基因的克隆及功能分析
李飞鸿,侯应军,李雪涵,余心怡,渠慎春
(南京农业大学园艺学院,南京 210095)
【目的】从‘苏帅’苹果()中分离克隆赤霉素氧化酶基因的开放阅读框(ORF),分析其序列特征及在苹果中的组织表达特异性,通过在烟草中过表达研究其对烟草生长发育的影响,为该基因功能分析及应用提供理论参考。【方法】采用RT-PCR方法从苹果中克隆出的ORF区。利用NCBI、DNAMAN和Pfam在线软件进行氨基酸序列比对和保守结构域分析;利用Expasy在线软件对氨基酸组成、分子量、等电点进行分析;利用SignalP和TMHMM Server V.2.0分别在线分析蛋白质的信号肽和预测蛋白质的跨膜结构域;利用MEGA 7.0软件构建系统进化树。采用实时荧光定量PCR(RT-qPCR)方法检测在苹果不同组织中的表达量。构建过表达载体,采用农杆菌介导的遗传转化技术将导入烟草中,获得具有潮霉素抗性的转基因烟草植株,通过GUS染色、基因组PCR和RT-PCR鉴定转基因阳性植株;将野生型和转基因烟草移栽后,在第一朵花开放时测定转基因烟草的株高、节间长度和叶片长宽比以及烟草叶片叶绿素含量,激素GA1和GA4含量,并通过RT-qPCR方法分析烟草中相关基因的表达水平。【结果】成功克隆并获得了长为1 122 bp的ORF区,编码373个氨基酸残基,蛋白相对分子质量为42.8 kD,理论等电点为5.44,不稳定系数为49.73,具有GA2ox的保守结构域DIOX_N和20G-Fell_Oxy,但无明显疏水区,无跨膜区,无信号肽,为非分泌蛋白。序列系统进化分析结果显示MdGA2ox8与白梨GA2ox8亲缘关系最近。RT-qPCR结果表明,在苹果各组织中差异表达,在花中的表达量最高,其次为老叶>幼叶>韧皮部,在木质部和幼果中几乎不表达。将转入模式植物烟草中,获得了5个转基因阳性株系。与野生型相比,过表达烟草植株GA4含量降低,GA1含量有所升高,其中野生型和转基因烟草GA1平均含量分别为1.26和1.75 ng·g-1,GA4平均含量分别为5.43和1.07 ng·g-1。与野生型相比,转基因烟草植株GA1和GA4总含量降低,使植株节间缩短、矮化以及花期推迟,其中野生型和转基因烟草植株平均高度分别为38.50和7.36 cm,节间长度分别为9.5和3.3 cm;转基因烟草叶片颜色深绿,叶片长宽比降低。烟草内源赤霉素合成途径相关基因和的表达水平受的正反馈调节。【结论】获得苹果赤霉素氧化酶基因的开放阅读框,具有组织表达差异性。过表达烟草植株中GA1和GA4总含量降低,导致植株节间长度缩短、植株矮化。
苹果;赤霉素氧化酶;矮化;;过表达;烟草
0 引言
【研究意义】苹果()是世界范围内广泛栽培的果树之一。矮化栽培现已成为世界苹果栽培最主要的高效栽培模式,此栽培模式近几年在我国发展迅速,主要通过矮化砧木实现。‘苏帅’是由南京农业大学通过杂交培育的短枝型苹果品种[1],以此品种为材料,克隆赤霉素代谢关键酶基因,通过研究其表达模式及功能,探讨其节间缩短的主要机理,对果树矮化和短枝形成机制的研究具有重要意义。【前人研究进展】在植物体内,具有生物活性的GA有GA1、GA3、GA4和GA7[2]。GA20-氧化酶(GA20ox)、GA3-氧化酶(GA3ox)和GA2-氧化酶(GA2ox)是参与植物赤霉素合成与代谢的关键酶,其中GA20ox和GA3ox参与GA合成,而GA2ox则参与GA的分解代谢[2]。GA2ox是由多基因家族编码的双加氧酶,是赤霉素代谢过程中关键酶之一,作用于有生物活性的GA1和GA4,分别将它们转变成无活性的分解代谢物GA8和GA34,使植物体内GA的活性降低,维持植物体内生物活性GA和无活性GA的平衡[3]。研究表明,沉默可以促进植物生长和纤维的产生[4],而过表达则可以导致植株赤霉素含量的减少和矮化[5]。目前,已经从拟南芥[6]、水稻[7]、梨[8-9]、葡萄[10]、马铃薯[11]、西洋参[12]、太子参[13]、柳枝稷[14]、山茶[15]、油菜[16]中克隆得到。【本研究切入点】迄今,有关苹果赤霉素合成相关基因克隆的研究仅见少量报道[17-20],而对苹果的分离及功能研究尚未见报道。【拟解决的关键问题】应用RT-PCR技术克隆的开放阅读框(ORF),分析其组织特异性,利用生物信息学方法对其序列进行分析,构建过表达载体,通过农杆菌介导的方法转化烟草,分析过表达对烟草生长的影响,为果树矮化机理研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料‘苏帅’由南京农业大学以‘印度’苹果为母本、‘金帅’为父本杂交育成,2011年通过江苏省作物品种审定委员会鉴定(苏鉴果201108)。该品种植株生长健壮,树冠紧凑,枝条粗壮,具有典型的短枝型苹果品种特征[1]。本研究所用‘苏帅’苗为八棱海棠作为砧木的3年生盆栽苗,所用基质为泥炭土,株高160 cm,由南京农业大学果树生物技术实验室保存。于2016年6月取‘苏帅’中枝顶端展叶2周的幼叶,液氮速冻后于-70℃保存备用;烟草K326种子由玉溪中烟种子有限责任公司提供。
1.1.2 菌株与试剂 大肠杆菌菌株DH5、农杆菌菌株EHA105均购自上海唯地生物技术有限公司。T4 DNA连接酶购自New England Biolabs公司。各种限制性内切酶、PrimeSTAR GXL DNA聚合酶、反转录试剂盒、DNA凝胶回收试剂盒和质粒提取试剂盒均购自TaKaRa公司。pEASY-Blunt克隆载体购自TransGen Biotech、植物RNA提取试剂盒购自成都福际生物技术有限公司。GA1标准样品和GA4标准样品均购自Sigma公司,色谱级甲醇购自Tedia公司,其他试剂均为国产分析纯。
1.2 方法
1.2.1根据先前研究结果[21],‘苏帅’苹果中基因MDP0000309451可能与其节间较短的表型相关,参照NCBI GenBank中苹果基因序列,采用Primer-BLAST设计引物序列(表1),由上海捷瑞生物工程有限公司合成。

表1 苹果MdGA2ox8克隆、表达及功能分析所用引物
以‘苏帅’中枝顶端展叶2周的幼嫩叶片为材料提取总RNA及反转录得到的cDNA为模板,引物-F1和-R1用于ORF克隆。PCR反应体系:模板(cDNA)1.0 μL,10×PCR Buffer 2.5 μL,dNTP 2.0 μL,上下游引物各0.75 μL,1.0 μL PrimeSTAR GXL酶,用超纯水补足至25 μL。反应程序:98℃ 3 min;98℃ 10 s,55℃ 15 s,68℃ 10 s,35个循环;68℃延伸5 min,4℃保存。产物回收:PCR产物用1.0%的琼脂糖凝胶电泳检测并拍照,按照胶回收试剂盒说明书的步骤进行PCR产物的回收。产物的连接转化:将回收产物与pEASY-Blunt克隆载体相连接,步骤如下:(1)连接:PCR产物3 μL,pEASY-Blunt克隆载体1 μL,总体积4 μL,25℃反应15 min;(2)转化:取-70℃保存的大肠杆菌DH5,冰上融化,至半融化状态时加入4 μL的连接产物,轻弹混匀,冰浴20—30 min,42℃热激30 s,立即放于冰上2 min,在超净工作台中加入250 μL的无抗性的LB液体培养基,200 r/min,37℃摇菌培养1 h;(3)涂板:离心后去上清液,留取100 μL菌液均匀涂于50 mg·L-1Km抗性的平板上,37℃培养8—12 h;(4)阳性克隆检测:挑取白色单菌落,接种在含有50 mg·L-1Km的LB液体培养基中,250 r/min,37℃摇菌培养4 h,PCR检测阳性克隆,测序验证。
1.2.2序列分析 将测序验证正确的核苷酸序列和推导氨基酸序列分别在NCBI数据库上用BLASTn和BLASTp进行序列相似性分析;通过ExPASy Proteomics Server的在线软件Protparam(https://web.expasy.org/protparam/)对蛋白进行理化性质的分析和预测,应用ProtScale(https://web.expasy. org/cgi-bin/protscale/protscale.pl)软件预测蛋白质的疏水性;利用SignalP(http://www.cbs.dtu.dk/services/ SignalP/)在线分析蛋白质的信号肽;应用TMHMM Server V.2.0(http://www.cbs.dtu.dk/services/TMHMM/)在线程序预测蛋白质的跨膜结构域;下载可可()、拟南芥()、大豆()、玉米()、葡萄()、白梨()、草莓(subsp.)、烟草()、甜菜(subsp.)9个物种的氨基酸序列,使用Pfam(http://pfam.xfam.org/search# searchSequenceBlock)和DNAMAN对氨基酸序列进行分析和比对,系统发育树使用MEGA 7.0软件构建[22]。
1.2.3 表达载体的构建及农杆菌的转化 含酶切位点产物的扩增:设计引物-F2和-R2,以测序正确的pEASY-质粒为模板,-F2和-R2引物扩增含Ⅰ和HⅠ酶切位点的PCR产物,PCR反应体系:模板(pEASY-质粒)0.5 μL,10×PCR Buffer 2.5 μL,dNTP 2 μL,上下游引物各0.75 μL(100 ng·μL-1),PrimeSTAR GXL酶1 μL,用超纯水补足至25 μL。PCR程序:98℃ 3 min;98℃ 10 s,60℃ 15 s,68℃ 10 s,35个循环;68℃延伸5 min,4℃保存。
PCR产物回收:PCR扩增产物用1.0%的琼脂糖凝胶电泳检测并拍照,按照胶回收试剂盒说明书的步骤进行PCR扩增产物的回收。PCR产物连接转化:将回收产物连接pEASY-Blunt克隆载体,步骤同1.2.1,转化大肠杆菌DH5,PCR检测阳性克隆,测序验证。
双酶切:将测序正确的阳性菌液提取质粒,构建pCAMBIA1301-35SN-载体,步骤如下:(1)双酶切体系:HⅠ 2 μL,Ⅰ 2 μL,10×K Buffer 2 μL,质粒(分别为pCAMBIA1301-35SN-或pCAMBIA1301-35SN空载)7 μL,ddH2O补足至40 μL,37℃反应3 h;(2)连接:将酶切产物进行琼脂糖凝胶电泳检测,切胶回收酶切后的目的基因和空载片段,连接体系:T4DNA连接酶0.5 μL,Ligase 10×Buffer 1 μL,pCAMBIA1301-35SN载体回收片段3.5 μL,目的基因5 μL,总体系10 μL,于16℃反应1 h;(3)转化和涂板:同1.2.1节;(4)阳性克隆检测:挑取白色单菌落,接种在含有50 mg·L-1Km的LB液体培养基中,250 r/min,37℃摇菌培养4 h,用-F2和-R2引物进行PCR检测阳性克隆,送去测序验证;(5)将成功构建的载体pCAMBIA1301-35SN-转化农杆菌EHA105菌株,具体步骤参照说明书。将PCR检测阳性的菌液提取质粒,并送公司测序。
1.2.4遗传转化烟草及其鉴定 采用叶盘转化法转化烟草K326[23-24],其中筛选抗性标记潮霉素(Hyg)的浓度为10 mg·L-1,每两周更换一次培养基,以保持转基因烟草的抗性筛选压。转基因烟草的鉴定如下:首先剪取抗性烟草的叶片进行GUS染色,对于GUS检测呈蓝色的植株,进一步提取其DNA,利用基因特异引物-F1和-R1进行PCR检测。然后,提取PCR检测阳性株系的叶片RNA(按照试剂盒说明书),反转录为cDNA,内参检测模板质量,再以-F1和- R1为引物,进行PCR检测,反应体系:模板(cDNA)1 μL,10×PCR Buffer 2.5 μL,dNTP 2 μL,上下游引物各0.5 μL,rTaq酶0.15 μL,用超纯水补足至25 μL。PCR程序:94℃ 5 min;94℃ 40 s,55℃ 40 s,72℃ 90 s,35个循环;72℃延伸10 min,PCR产物4℃保存,用1%的琼脂糖凝胶电泳检测。
1.2.5组织特异性表达 2018年4—5月取‘苏帅’的花、幼叶、老叶、韧皮部、木质部和幼果分别进行检测,上游引物-RT-F,下游引物-RT-R,作为内参基因(表1)。每处理重复3次,根据2−ΔCt公式计算结果,通过SPSS软件计算标准误差和差异显著性。
1.2.6 转基因烟草形态指标的测定 转基因烟草和野生型各5株,经炼苗后移栽,在第一朵花开放时进行各项指标的测定和取样。测量烟草株高和节间长度(从顶而下第3—13片叶的总节间长度),测量从顶而下第4、5、6、7片叶的叶长和叶宽,计算叶片的长宽比。
1.2.7 转基因烟草叶绿素含量的测定 选取转基因株系与野生型烟草的由顶而下第4、5片叶,参照李合生的丙酮乙醇(1﹕1)提取方法提取烟草叶片叶绿素[25]。
1.2.8 转基因烟草GA1、GA4含量的测定 选取转基因株系、野生型烟草的由顶而下第4、5片叶,准确称量0.5 g。送南京钟鼎生物技术有限公司,采用ESI-HPLC-MS/MS方法检测植物激素GA1、GA4的含量。
1.2.9 转基因烟草中基因的表达分析 以作为内参基因进行RT-qPCR分析。通过NCBI设计特异引物:上游引物-RT-F和下游引物-RT-R,同时设计相关基因和的引物,分别为-RT-F,-RT-R和-RT-F,-RT-R。每处理重复3次,根据2−ΔΔCt公式计算结果。
1.3 数据统计与分析
利用SPSS 17.0软件进行显著性分析。利用Excel 2010和GraphPad Prism 7.0软件进行数据分析并作图。
2 结果
2.1 MdGA2ox8获得与序列分析
以‘苏帅’叶片cDNA为模板,通过PCR扩增,琼脂糖凝胶电泳检测出一条1 000—2 000 bp的特异条带(图1-B)。经产物回收、克隆、测序,该序列全长为1 122 bp,编码373个氨基酸。该基因已经在GenBank登录,登录号为XM_008372903。运用ExPASy Proteomics Server的在线软件Protparam对MdGA2ox8蛋白质进行理化性质的分析和预测。结果显示,其分子式为C1906H2959N507O573S19,相对分子质量为42.8 kD,理论等电点5.44。其中负电荷氨基酸残基(Asp+Glu)总数为48,正电荷氨基酸残基(Arg+Lys)总数为39,脂肪系数为79.68,蛋白质不稳定系数为49.73,平均亲水系数为-0.39,预测该蛋白为亲水蛋白。预测MdGA2ox8蛋白无跨膜区,无信号肽序列,为非分泌蛋白。NCBI上分析氨基酸序列的保守结构域,发现属于PcbC superfamily超家族,有两个比较保守的结构域,分别是DIOX_N和2OG-FeII_Oxy保守结构域。
将编码的氨基酸序列在NCBI进行搜索,下载白梨、葡萄、草莓、可可等9个物种的氨基酸序列与其进行同源性比对,发现编码的氨基酸序列与白梨、草莓和大豆具有较高的相似性,序列一致性分别为89.72%、70.34%和63.03%。多重序列比对结果表明这些所编码的氨基酸序列均含有两个保守结构域,分别为DIOX_N和2OG-FeII_Oxy(图2)。为探讨苹果与其他植物之间的关系,选取相似性较高的10种植物的GA2ox蛋白氨基酸序列与MdGA2ox8蛋白氨基酸序列进行比较分析,采用邻位相连法绘制进化树。如图3所示,苹果编码的氨基酸序列与白梨的氨基酸序列属于同一个进化支,亲缘关系最近,然后与草莓聚为一支,再与他双子叶、单子叶植物聚类。


红色方框代表DIOX_N结构域;黑色方框代表2OG-FeII_Oxy结构域
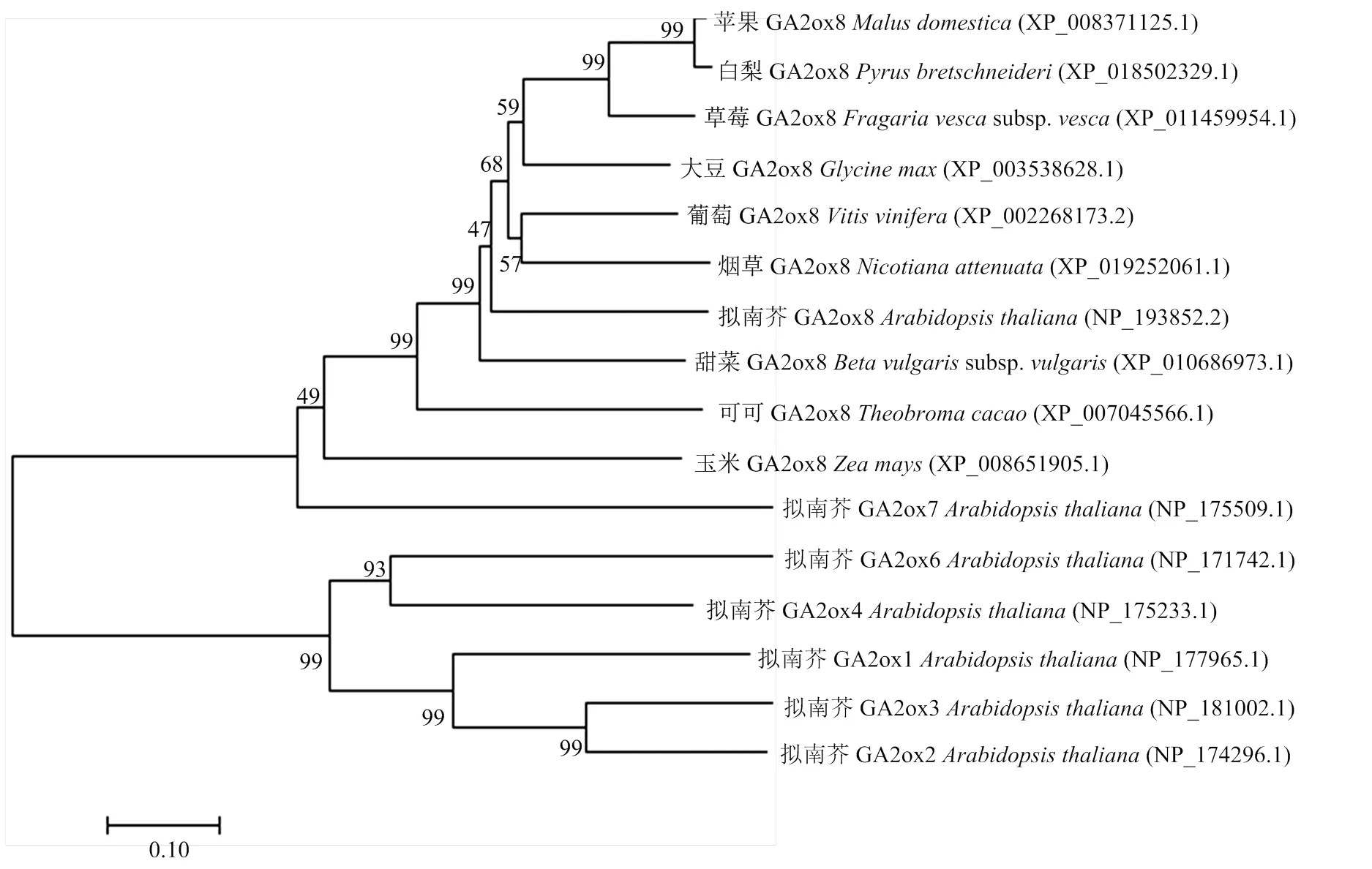
图3 不同物种GA2ox8的系统进化树
2.2 MdGA2ox8的组织表达
通过RT-qPCR方法检测在苹果不同组织中的表达(图4),发现在花中的表达量最高,与其他组织的表达量差异显著;其次为老叶、幼叶和韧皮部,但相互之间差异不显著,而在幼果和木质部的表达量最低,几乎不表达,表明的表达具有组织特异性。
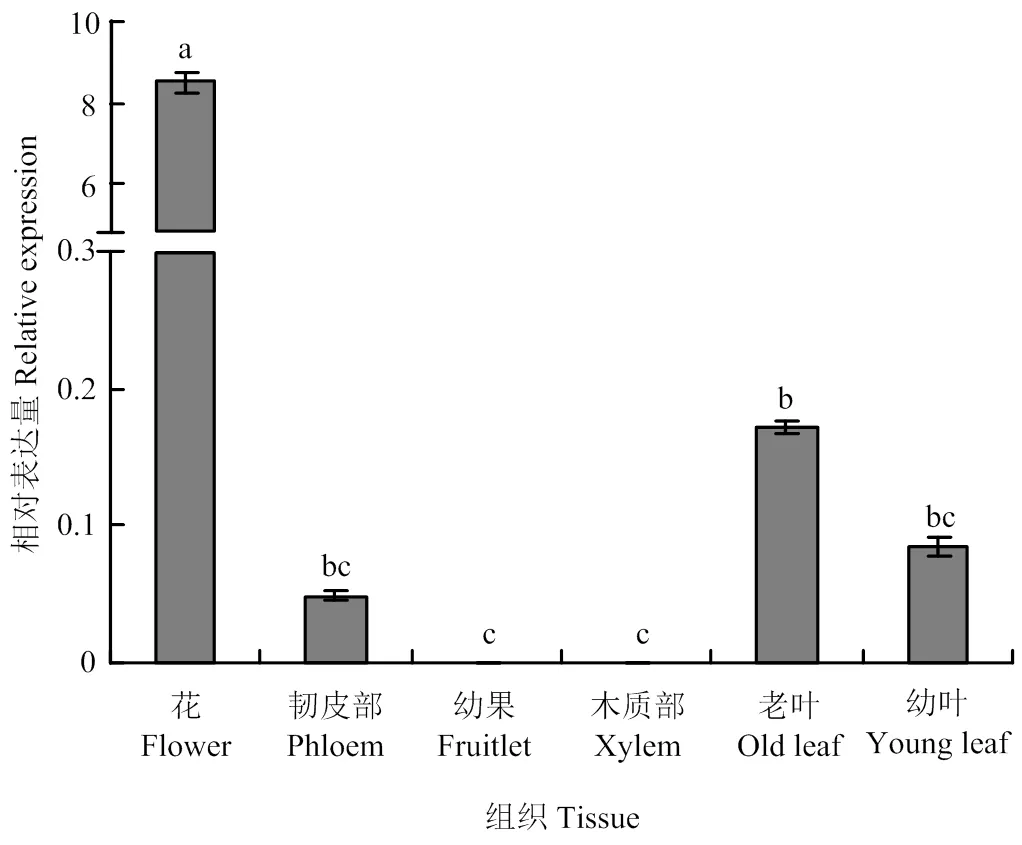
不同小写字母表示差异显著(P<0.05)。下同
2.3 MdGA2ox8表达载体的构建及转基因烟草植株的鉴定
用Ⅰ和HⅠ酶将从克隆载体上切下,与相同酶切的pCAMBIA1301-35SN载体连接,转化大肠杆菌DH5,经PCR鉴定及测序验证,成功构建了植物表达载体pCAMBIA1301-35SN-(图1-A)。提取质粒并成功转化农杆菌。用阳性单菌落农杆菌菌液(OD=0.5)侵染烟草叶片,共培养3 d,用无菌水洗涤3次,无菌滤纸吸干水分,接种在10 mg·L-1的Hyg抗性培养基中,筛选培养30 d,获得22个抗潮霉素的烟草抗性芽,GUS检测结果表明,其中7株为GUS阳性植株(图5-A),近一步提取这7株烟草DNA,用-F1和-R1引物进行PCR扩增,以野生型烟草叶片为对照,结果显示,在获得的7株GUS阳性植株中,6株成功检测到(图5-B),推断已成功导入烟草基因组中。为了进一步验证在转基因阳性植株中是否在转录水平表达,提取经PCR检测的阳性转基因烟草植株叶片总RNA并反转录成cDNA,检测的表达。结果表明,有5个抗性植株中扩增得到片段大小一致的特异条带(图5-C);胶回收、克隆测序表明,所扩增条带为目的基因序列,进一步证明成功导入烟草基因组中并在转录水平上进行表达,得到5个阳性转基因植株。

M:Marker;1—7(B)、2—7(C):转基因烟草植株transgenic tobacco plants;8:pCAMBIA1301-35SN-MdGA2ox8质粒pCAMBIA1301-35SN-MdGA2ox8 vector;WT(A)、9(B)、1(C):野生型烟草Wild-type tobacco
2.4 MdGA2ox8过表达对烟草形态指标的影响
经过生根、炼苗、移栽,3个月后,过表达影响了转基因烟草的株高、节间长度和开花时间。如图6-A、6-B所示,转基因株系L-1、L-6、L-7、L-11和L-31出现明显的花期延迟和矮化表型,分别比野生型低66%、81%、94%、75%和88%,其中野生型株高达到38.5 cm,而转基因株系L-7和L-31株高分别只有2.3和4.5 cm。同时与野生型相比,转基因烟草的节间长度均有所缩短,以L-7和L-31株系节间缩短最为严重(图6-C)。此外,转基因烟草叶片长宽比均比野生型显著降低(图6-D)。野生型烟草开花时间为85—90 d,而转基因株系均未开花。
2.5 MdGA2ox8过表达对烟草叶绿素含量的影响
转基因株系的叶绿素含量均高于野生型,其中L-1、L-7、L-11、L-31株系的叶绿素含量与野生型相比达显著水平,分别比野生型提高61%、44%、31%和27%,而L-6株系的叶绿素含量仅比野生型高13%(图7)。
2.6 MdGA2ox8过表达对烟草GA1、GA4含量的影响
为研究过表达对赤霉素合成的影响及主要作用通路,选取野生型烟草和转表达量高的烟草植株叶片,测定GA1和GA4的含量。从图8-A可以看出,转的烟草植株叶片中GA1含量均高于野生型,其中,野生型的GA1含量为1.26 ng·g-1,L-6、L-7和L-31株系GA1的含量分别为野生型的1.32、1.29和1.56倍。然而,转基因植株的GA4含量均低于野生型(图8-B)。如图8-C所示,过表达的烟草中GA1+GA4总含量均低于野生型,其中野生型的GA1+GA4总含量为6.69 ng·g-1,株系L-6、L-7和L-31的GA1+GA4总含量分别为3.08、1.90和3.47 ng·g-1。

WT:野生型烟草wild-type tobacco;L:转基因株系transgenic line;L-1、L-6、L-7、L-11、L-31:MdGA2ox8过表达烟草的5个株系MdGA2ox8overexpression tobacco
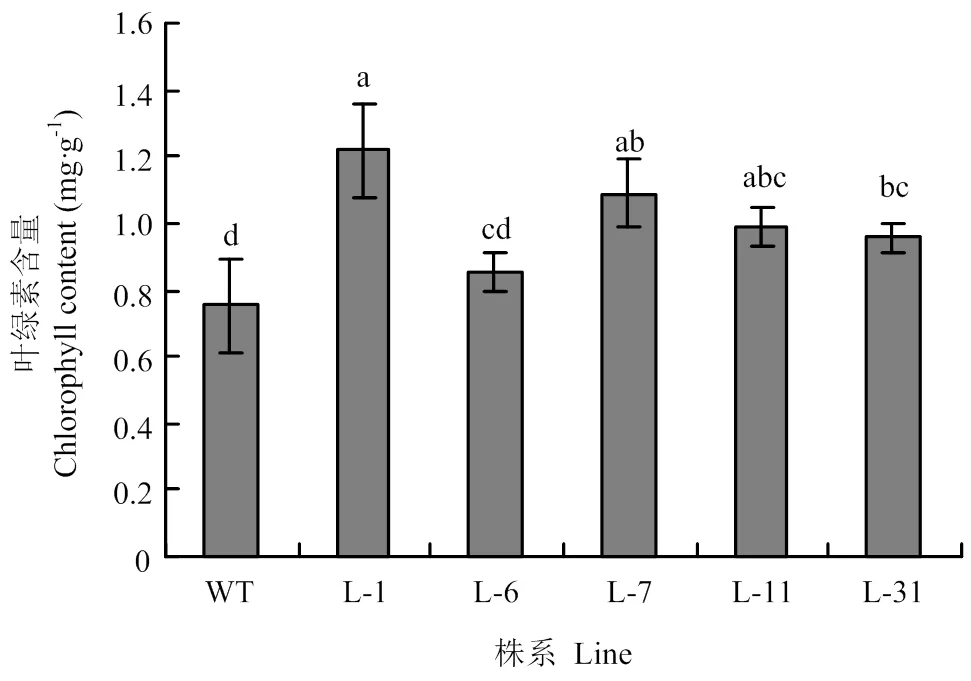
图7 MdGA2ox8过表达对烟草叶绿素含量的影响
2.7 赤霉素相关基因在烟草中的表达
为确认转基因烟草株高的降低(图6-A、6-B)是由的过表达所致,以烟草叶片的cDNA为模板,利用RT-qPCR技术分析了转基因烟草中的表达量。结果表明,野生型烟草中无的表达,而转基因烟草株系中的表达量极高,且各转基因株系间其表达量不同(图9-A)。此外,转基因烟草L-6、L-7、L-11、L-31株系中和的表达量均高于野生型,而L-1株系中其表达量低于野生型(图9-B、9-C)。
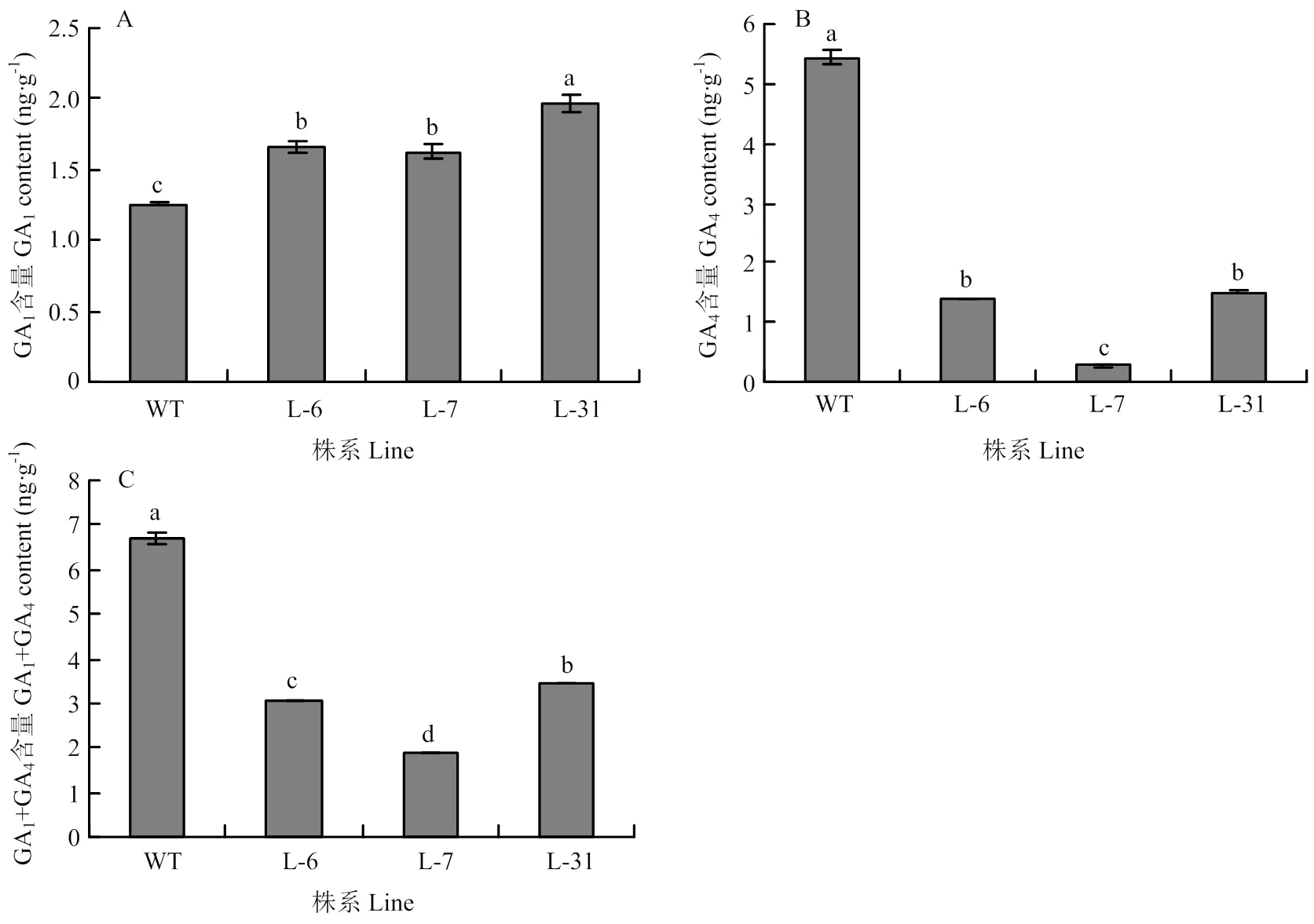
图8 MdGA2ox8过表达对烟草叶片赤霉素含量的影响

图9 RT-qPCR检测MdGA2ox8过表达株系
3 讨论
赤霉素是一个较大的萜类化合物家族,在植物整个生命循环过程中起着重要的调控作用。植物中是一个小基因家族,由多个基因编码,目前已从拟南芥中分离得到8个[26-27],但在苹果上相关基因的克隆与分析却没有很好地开展[17-18]。本研究成功获得了苹果ORF,其具有基因家族共同的结构特点,含有DIOX-N和20G-Fell_Oxy保守结构域,通过同源分析结果显示与其他物种的基因同源性最高达90%,因此推测该基因属于基因家族的成员,命名为。本研究将MdGA2ox8与其他10种植物的15条GA2ox序列进行系统进化分析,结果与前人研究结果一致[13],与AtGA2ox8和AtGA2ox7聚为一类,可能主要催化C20-Gas(GA12和GA53)2-羟基化[15]。
本研究通过农杆菌介导的叶盘转化法获得了5株转基因株系,结果表明过表达烟草引起植株的矮化、节间缩短,叶片长宽比降低和花期延迟。Schomburg等[28]研究发现,过表达导致烟草矮化和花期推迟。此外,Kotoda等[5]也发现过表达拟南芥出现矮化和晚花表型;过表达和烟草节间严重缩短,植株矮化[28],这与本研究结果相一致。另外,转基因烟草株系的总叶绿素含量均高于对照,说明过表达不仅诱导植株矮化,还提高了总叶绿素含量,这与王庆杰等[29-31]研究结果一致。
赤霉素合成代谢早期途径在高等植物中基本相同,而在GA12以后的代谢途径中,在不同物种和不同组织中的表达量有较大差异。在荔波连蕊茶中在嫩枝和两年生茎段中的表达量最高[15];在蜜柑成年树的新叶和花芽以及幼苗茎中表达,但在其他组织中表达量较低[5]。本研究的结果与上述结果不同,主要在花中优势表达,在幼果和木质部中几乎不表达,这可能是物种或时间不同所致。因此推测主要在花中起作用,以控制活性GA的水平,可能参与果实的形成,但不参与果实和木质部的发育。
RT-qPCR技术是现代生物学研究中常用的检测基因表达水平的技术手段[10],通过对转基因烟草株系基因表达水平进行分析研究,结果表明5个转基因株系中表达量显著高于野生型,说明这5株转基因烟草均为过表达株系,但各株系间表达量具有差异,这与李军等[32]的研究结果相一致,推测其表达量的差异可能是插入位点和拷贝数的不同造成的[33]。此外,赤霉素合成相关基因和在株系L-6、L-7、L-11和L-31中的表达量均高于野生型,笔者推测可能是由于过表达,导致具有生物活性的GA含量降低,从而提高了和的表达量。而转基因株系L-1的和表达量较低,推测可能是表达量未达到反馈调节水平。
在植物体内,具有生物活性的GA有GA1、GA3、GA4和GA7[2]。GA2ox作用于有生物活性的GA1和GA4,分别将它们转变成无活性的分解代谢物GA8和GA34,使植物体内GA的活性降低[3]。为检测过表达对赤霉素合成与代谢的影响,进而研究的作用通路,选取转表达量高的烟草植株(L6、L7、L31)和野生型烟草植株的叶片,测定赤霉素GA1和GA4的含量。结果表明,转基因烟草植株叶片中GA1与GA4含量的总和比野生型低,这可能是引起烟草植株节间缩短、矮化的主要原因,这与拟南芥中过表达导致赤霉素含量的减少进而植株矮化的研究结果一致[5],也有研究表明,在烟草中过表达降低了烟草活性GA的水平并引起矮化[28]。刘露露等[31]研究发现,过表达烟草GA4含量增加而GA1含量并无显著变化;Xiao等[34]分析内源GA显示转()植物中GA4和GA1水平降低,与野生植物相比GA34含量增加。本研究与其结果一致,在转基因烟草叶片中GA4含量显著低于野生型,但与其研究结果不同的是GA1含量较高于野生型。结合烟草赤霉素合成相关基因分析,推测GA1含量相比野生型增加,可能是由于赤霉素合成相关基因(如)表达量上升的原因。然而,本研究结果表明GA4含量的降低是活性GA含量降低的主要因素,因此推测主要作用于分解代谢活性GA4转变为无活性的GA34,从而影响植株高度。
4 结论
从‘苏帅’苹果中克隆得到长为1 122 bp的开放阅读框(ORF),编码373个氨基酸,属于PcbC superfamily超家族,有DIOX_N和2OG-FeII_Oxy保守结构域,同源序列比对和进化树分析均表明其与白梨同源性最高,进化关系最近。过表达降低了烟草叶片中GA4含量,导致烟草节间缩短、植株矮化、叶色深绿、叶片长宽比降低以及延迟开花时期;正反馈调节赤霉素合成相关基因和的表达量。
[1] 盛炳成, 渠慎春. 苹果新品种‘苏帅’. 园艺学报, 2012, 39(10): 2075-2076.
Sheng B C, Qu S C. A new apple cultivar ‘Sushuai’., 2012, 39(10): 2075-2076. (in Chinese)
[2] Hedden P, Phillips A L. Gibberellin metabolism: new insights revealed by the genes., 2000, 5(12): 523-530.
[3] Olszewski N, Sun T, Gubler F. Gibberellin signaling: biosynthesis, catabolism, and response pathways., 2002, 14(suppl. 1): S61-S80.
[4] Dayan J, Schwarzkopf M, Avni A, Aloni R. Enhancing plant growth and fiber production by silencing GA 2-oxidase., 2010, 8(4): 425-435.
[5] Kotoda N, Matsuo S, Honda I, Yano K, Shimizu T. Gibberellin 2-oxidase genes from Satsuma mandarin (Marc.) caused late flowering and dwarfism in transgenic., 2017, 86(2): 183-193.
[6] Lee D H, Lee I C, Kim K J, Kim D S, Na H J, Lee I J, Kang S M, Jeon H W, Le P Y, Ko J H. Expression of4 fromunder the control of a senescence-associated promoter results in a dominant semi-dwarf plant with normal flowering., 2014, 57(2): 106-116.
[7] Huang J, Tang D, Shen Y, Qin B, Hong L, You A, Li M, Wang X, Yu H, Gu M, Cheng Z. Activation of gibberellin 2-oxidase 6 decreases active gibberellin levels and creates a dominant semi-dwarf phenotype in rice (L.)., 2010, 37(1): 23-36.
[8] 丁伟, 周葱, 刘超, 何家轩, 贾兵, 朱立武. 缺铁胁迫对梨叶片中GA信号转导相关基因的影响. 西北植物学报, 2015, 35(2): 233-238.
DING W, ZHOU C, LIU C, HE J X, JIA B, ZHU L W. Effect of Iron-deficiency on the expression of GA signal transduction related genes in leaf‘Dangshansuli’ pear (Rehd.)., 2015, 35(2): 233-238. (in Chinese)
[9] 程飞飞. 矮生梨‘中矮1号’基因的克隆与功能分析[D]. 北京: 中国农业科学院, 2012.
CHENG F F. Cloning and function analysis ofe gene in dwarf pear of ‘Zhongai 1’[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012. (in Chinese)
[10] 王西成, 任国慧, 房经贵, 李阿英, 刘洪, 吴伟民, 赵密珍.葡萄赤霉素合成相关基因克隆、亚细胞定位和表达分析. 中国农业科学, 2012, 45(11): 2224-2231.
WANG X C, REN G H, FANG J G, LI A Y, LIU H, WU W M, ZHAO M Z.Cloning, subcellular localization and expression analysis of genes related to the synthesis of gibberellin from grapevine., 2012, 45(11): 2224-2231. (in Chinese)
[11] 石建斌. 马铃薯赤霉素合成代谢途径关键酶基因、的克隆与功能分析[D]. 西宁: 青海大学, 2016.
SHI J B.The cloning and function analysis of key enzyme gene,)[D]. Xining: Qinghai University, 2016. (in Chinese)
[12] 孙同玉, 祝娟, 孙鹏, 廖登群, 李先恩, 祁建军. 西洋参基因的克隆与序列分析. 中草药, 2014, 45(24): 3599-3606.
SUN T Y, ZHU J, SUN P, LIAO D Q, LI X E, QI J J.Cloning and sequence analysis ofgene in., 2014, 45(24): 3599-3606. (in Chinese)
[13] 丁铃, 江维克, 周涛, 李军, 郑伟, 龙登凯, 肖承鸿. 太子参2个赤霉素2-氧化酶基因的克隆与序列分析. 中草药, 2017, 48(15): 3145-3152.
DING L, JIANG W k, ZHOU T, LI J, ZHENG W, LONG D K, XIAO C H. Molecular cloning and sequence analysis of twogenes in., 2017, 48(15): 3145-3152. (in Chinese)
[14] Wuddineh W A, Mazarei M, Zhang J, Poovaiah C R, Mann D G, Ziebell A, Sykes R W, Davis M F, Stewart Jr C N. Identification and overexpression of() in switchgrass (L.) for improved plant architecture and reduced biomass recalcitrance., 2015, 13(5): 636-647.
[15] 肖政, 李纪元, 范正琪, 李辛雷, 殷恒福. 荔波连蕊茶基因的克隆及表达分析. 林业科学研究, 2016, 29(1): 41-47.
XIAO Z, LI J Y, FAN Z Q, LI X L, YIN H F.Cloning and expression analysis ofgene from., 2016, 29(1): 41-47. (in Chinese)
[16] Yan J, Liao X, He R, Zhong M, Feng P, Li X, Tang D, Liu X, Zhao X. Ectopic expression of GA 2-oxidase 6 from rapeseed (L.) causes dwarfism, late flowering and enhanced chlorophyll accumulation in., 2017, 111: 10-19.
[17] Zhao H, Dong J, Wang T. Function and expression analysis of gibberellin oxidases in apple., 2010, 28(2): 231-238.
[18] Kusaba S, Honda C, Kano-Murakami Y. Isolation and expression analysis of gibberellin 20-oxidase homologous gene in apple., 2001, 52(355): 375-376.
[19] 白牡丹, 王彩虹, 田义轲, 陈宝印, 刘云龙. 苹果茎尖组织中基因的结构特征及蛋白序列的生物信息学分析. 华北农学报, 2012, 27(5): 55-59.
BAI M D, WANG C H, TIAN Y K, CHEN B Y, LIU Y L.Gene structure identification and protein sequence bioinformation analysis forfrom apical tissue of apple shoots., 2012, 27(5): 55-59. (in Chinese)
[20] 白牡丹, 王彩虹, 田义轲, 刘云龙, 陈宝印. 柱型与普通型苹果茎尖组织中基因的序列比较及表达量分析. 西北农业学报, 2012, 21(11): 124-127.
BAI M D, WANG C H, TIAN Y K, LIU Y L, CHEN B Y.Sequence and expression analysis ofgene from shoots apical tissue between columnar and standard apple., 2012, 21(11): 124-127. (in Chinese)
[21] 辛璐. 短枝型苹果‘苏帅’赤霉素相关差异基因的筛选与表达分析[D]. 南京: 南京农业大学, 2015.
XIN L. Screening and expression of the difference for gibberellin related genes of spur-type apple ‘Sushuai’[D]. Nanjing: Nanjing Agricultural University, 2015. (in Chinese)
[22] Kumar S, Stecher G, Tamura K. MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets., 2016, 33(7): 1870-1874.
[23] Horsch R B, Fry J E, Hoffmann N L, Eichholtz D, Rogers S G, Fraley R T. A simple and general method for transferring genes into plants., 1985, 227(4691): 1229-1231.
[24] 赵勤. 根癌农杆菌介导烟草K326遗传转化体系优化. 农业科学与技术, 2011, 12(1): 62-64.
ZHAO Q. Optimization of genetic transformation system of tobacco K326 mediated by., 2011, 12(1): 62-64. (in Chinese)
[25] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000.
LI H S.. Beijing: Higher Education Press, 2000. (in Chinese)
[26] Hedden P, Phillips A L. Manipulation of hormone biosynthetic genes in transgenic plants., 2000, 11(2): 130-137.
[27] Thomas S G, Phillips A L, Hedden P. Molecular cloning and functional expression of gibberellin 2-oxidases, multifunctional enzymes involved in gibberellin deactivation., 1999, 96(8): 4698-4703.
[28] Schomburg F M, Bizzell C M, Lee D J, Zeevaart J A D, Amasino R M. Overexpression of a novel class of gibberellin 2-oxidases decreases gibberellin levels and creates dwarf plants., 2003, 15(1): 151-163.
[29] 王庆杰, 金仲鑫, 周李杰, 郝玉金, 姚玉新. 苹果过量表达对光合、激素和生长的影响. 中国农业科学, 2015, 48(14): 2868-2875.
WANG Q J, JIN Z X, ZHOU L J, HAO Y J, YAO Y X. Impacts ofoverexpression on photosynthesis, hormone and growth in apple., 2015, 48(14): 2868-2875. (in Chinese)
[30] 朱登峰. 甘蓝型油菜中表达的表型分析及其对木质素生物合成的影响[D]. 海口: 海南大学, 2010.
ZHU D F. Effects of expressedon lignin biosynthesis and phenotypic analysis in transgenicplants[D]. Haikou: Hainan University, 2010. (in Chinese)
[31] 刘露露, 鲁婷婷, 王爽, 李美靓, 赵双菁, 刘莹莹, 魏志刚. 杨树过表达对烟草叶片发育的影响. 北京林业大学学报, 2018, 40(2): 22-30.
Liu L L, Lu T T, Wang S, Li M L, Zhao S J, Liu Y Y, Wei Z G. Effects of poplaroverexpression on leaf development of tobacco., 2018, 40(2): 22-30. (in Chinese)
[32] 李军, 赵爱春, Diane U, 王茜龄, 刘长英, 鲁成, 余茂德. 桑树的克隆及功能分析. 中国农业科学, 2014, 47(22): 4524-4532.
LI J, ZHAO A C, Diane U, WANG X L, LIU C Y, LU C, YU M D. Cloning and function analysis of agene from mulberry., 2014, 47(22): 4524-4532. (in Chinese)
[33] 李亚丽, 刘中来, 周洁, 徐国娟, 瞿绍洪. 转基因水稻的遗传分析及T-DNA整合位点的研究. 分子植物育种, 2012, 10(2): 121-130.
LI Y L, LIU Z L, ZHOU J, XU G J, QU S H. Genetic analysis oftransgenic rice and molecular characterization of T-DNA integration sites in the rice genome., 2012, 10(2): 121-130. (in Chinese)
[34] Xiao Z, Fu R, Li J, Fan Z, Yin H. Overexpression of the gibberellin 2-oxidase gene frominduces dwarfism and smaller flowers in., 2016, 34(1): 182-191.
(责任编辑 岳梅)
Cloning and Function Analysis of Apple Gibberellin Oxidase Gene
LI FeiHong, Hou YingJun, LI XueHan, YU XinYi, QU ShenChun
(College of Horticulture, Nanjing Agricultural University, Nanjing 210095)
【Objective】The objective of this study is to clone the open reading frame (ORF) of a gibberellin 2-oxidase gene (gibberellin2-oxidase 8,) from apple cultivar ‘Sushuai’, to analyze its sequence characteristics and tissue expression specificity. The effects of overexpression ofon tobacco growth and development were studied in order to provide a theoretical reference for the functional analysis and application of the gene.【Method】The ORF region ofwas cloned from apple by RT-PCR method. The amino acid sequence alignment and conserved domain analysis were performed by NCBI, DNAMAN and Pfamonline software. The composition, theoretical molecular weight and isoelectric point (pI) of the amino acid were deduced by Expasy software online. The protein signal peptide and transmembrane domain were analyzed by SignalP and TMHMM Server V.2.0. The phylogenetictree was constructed by a neighbor-joining (NJ) method using MEGA 7.0 program. The expression level in different tissues of apple was detected by RT-qPCR. To characterize the function of,ORF driven by thepromoter was delivered into tobacco by-mediated transformation approach. Transgenic plants with hygromycin resistance were obtained and identified by using GUS staining, genomic PCR, and RT-PCR. After transplanting, the plant height, internode length, blade aspect ratio, content of chlorophyll, and content of GA1, GA4in tobacco were measured at the first flowering stage. The expression level of related genes in tobacco was analyzed by RT-qPCR.【Result】The ORF sequence ofobtained from ‘Sushuai’ is 1 122 bp in length, encoding a putative protein about 373 amino acids. The predicted molecular weight of MdGA2ox8 is 42.8 kD, the theoretical pI is 5.44 and the instability coefficient is 49.73. MdGA2ox8 contains conserved domains DIOX_N and 20G-Fell_Oxy, without obvious hydrophobic region, transmembrane domain and signal peptide. The MdGA2ox8 protein is a non-secreted protein. Phylogenetic analysis showed that theMdGA2ox8 protein was closely related toGA2ox8 protein. The RT-qPCR results showed thatwas differentially expressed in apple tissues, with the highest expression in flowers, followed by old leaf>young leaf>phloem, but almost no expression in xylem and fruitlet. Five transgenic positive lines were obtained by transferringinto model plant tobacco. Compared with the wild-type, the GA4content decreased and GA1content increased in overexpressedtobacco plants. the average content of GA1in wild-type and transgenic tobacco was 1.26 and 1.75 ng·g-1, respectively. The average content of GA4in wild-type and transgenic tobacco was 5.43 and 1.07 ng·g-1, respectively. Compared with the wild-type, the total content of GA4and GA1in transgenic tobacco plants decreased, resulting in shorter internode length, dwarfing and delayed flowering. The average height of wild-type and transgenic tobacco plants was 38.50 and 7.36 cm, respectively. The average internode length of tobacco plants was 9.5 and 3.3 cm, respectively. The leaf of transgenic tobacco was dark green and the leaf aspect was reduced. Moreover, the expression level of endogenous gibberellin synthesis pathway-related genesandwas positively regulated by【Conclusion】The ORF of gibberellin 2-oxidase genewas obtained. The difference of tissue expression inwas found. The total content of GA1and GA4inoverexpressed tobacco decreased, which resulted in the shortening of internode length and dwarfing of plants.
apple (); gibberellin oxidase; dwarf;; overexpression; tobacco
2018-06-04;
2018-07-16
国家自然科学基金(3187110456)、江苏省科学技术厅现代农业-重点及面上项目(BE2017367)
李飞鸿,E-mail:798247396@qq.com。
渠慎春,Tel:025-84395724;E-mail:qscnj@njau.edu.cn
10.3864/j.issn.0578-1752.2018.22.012
