四川省草莓灰霉病菌对咯菌腈的抗性测定及其机制
贡常委,秦旖曼,屈劲松,王学贵
四川省草莓灰霉病菌对咯菌腈的抗性测定及其机制
贡常委,秦旖曼,屈劲松,王学贵
(四川农业大学农学院/无公害农药研究实验室,成都 611130)
【目的】灰霉病是草莓生产过程中的一种重要病害,严重影响了其产量和品质。论文旨在明确四川省草莓灰霉病菌对咯菌腈的抗性频率以及抗性机制,为草莓灰霉病的药剂防治提供理论依据。【方法】2016—2017年从四川成都、德阳、眉山、乐山及雅安等地采集草莓灰霉病样本,并分离纯化得到188株草莓灰霉病菌菌株。采用区分计量法测定188株灰霉病菌对咯菌腈的敏感性水平,采用菌丝生长速率抑制法测定咯菌腈对代表性菌株的毒力和渗透压敏感性,采用甘油铜比色法测定经咯菌腈处理的抗性菌株和敏感菌株甘油含量,采用分段测序对抗性菌株和敏感菌株Ⅲ型组氨酸激酶基因(BC1G_00374)扩增测序,采用Swissmodle和I-TASSER预测和评价突变对BOS1的结构影响。【结果】188株灰霉病菌菌株中有8株表现为高抗,9株为中抗,43株为低抗,其余表现为敏感;咯菌腈对代表性菌株的EC50介于0.03—0.62 μg·mL-1,代表性菌株的抗性倍数范围为2.2—45.9。NaCl浓度在1.25—10 g·L-1可刺激敏感菌株生长,浓度在1.25—20 g·L-1范围可刺激抗性菌株生长,但>40 g·L-1时则抑制菌丝生长,尤其对抗性菌株,抗性越高抑制作用越强;在正常条件下各代表性菌株甘油含量介于0.0025—0.0148 μg·mL-1,且菌株的甘油含量与咯菌腈抗性没有明显的关联性,但在使用咯菌腈处理(0.1 μg·mL-1)抗性菌株和敏感菌株后,甘油含量均上升,且抗性菌株甘油含量上升幅度明显低于敏感菌株。低抗菌株YAHY-13、CDCZ-2以及中抗菌株CDCZ-42在TAR和HAMP区域均发生突变,中抗菌株CDCZ-20和高抗菌株MYFC-10、CDCZ-43在TAR和REC区域均有突变,但CDCZ-20菌株在TAR区域位点是I365N,而两株高抗菌株在TAR区域位点是I365S。不同突变位置对BOS1区域结构有不同程度的影响,其中F127S、I365N、I365S、V1136I、A1259T均处于BOS1区域结构的无规则卷曲,但TAR区域I365N和I365S使区域结构无规则卷曲发生整体偏移。【结论】四川省已有部分地区草莓灰霉病菌对咯菌腈产生了抗性;相比敏感菌株,田间抗性菌株对渗透压的耐受能力增加,但当浓度超过耐受范围后对渗透胁迫高度敏感,药剂胁迫下田间抗性菌株甘油含量增加量显著小于敏感菌株;组氨酸激酶突变的位置和方式与灰霉病菌菌株对咯菌腈的抗性水平存在必然联系。
灰霉病菌;咯菌腈;抗药性;渗透压;甘油含量;
0 引言
【研究意义】灰霉病(主要致病菌为灰葡萄孢,)危害多种作物,现已被列入世界十大重要作物真菌病害[1-2]。灰霉病菌寄主广泛,可侵染200多种植物[3],不仅在生长期通过植物表面或植物伤口侵染,还会在蔬菜和水果的运输、储藏期进行危害,影响其产量和质量。由于该病原菌具有繁殖速度快、变异频率高等特点,在杀菌剂长期选择压力下,极易造成抗药性的暴发,且由于菌株多抗性特点,导致灰霉病的防治十分困难[4-5]。咯菌腈(fludioxonil)是瑞士先正达公司开发的一种新型苯基吡咯类杀菌剂,对灰霉病菌有特效,抑制孢子萌发的同时也能够抑制菌丝体的生长[6]。检测灰霉病菌对咯菌腈的抗性频率以及抗性机制,可为灰霉病的药剂防治提供理论依据。【前人研究进展】防治灰霉病的化学药剂主要有7大类:苯并咪唑类、N-苯基氨基甲酸酯类、二甲酰亚胺类、苯胺基嘧啶类、甲氧基丙烯酸酯类、琥珀酸脱氢酶抑制剂类(SDHIs)、苯基吡咯类。苯并咪唑类杀菌剂是防治灰霉病历史最长的一类药剂,但引入我国后不久就出现了抗性报道[7];二甲酰亚胺类杀菌剂在使用几年后便在田间发现了高抗菌株[8];张玮等[9]研究发现,我国葡萄灰霉病菌对嘧霉胺的抗性频率为22.22%—62.50%,且以高抗和中抗菌株为主,高抗菌株频率达44.23%。咯菌腈杀菌谱广,毒性低,可用于防治由担子菌、子囊菌、半知菌等引起的多种植物病害[6]。徐建强等[10]研究表明,咯菌腈对牡丹的4种叶片真菌,即牡丹黑斑病菌()、黄斑病菌()、腔孢叶斑病菌()和叶霉病菌()的菌丝生长、孢子萌发、芽管伸长及产孢均具有很强的抑制活性。咯菌腈作用靶标为Ⅲ型组氨酸激酶,可抑制Ⅲ型组氨酸激酶磷酸化,激活HOG-MAPK途径,然后由它磷酸化下游目标Ypd1,最终可合成大量的甘油致使细胞死亡[11-12];灰霉病菌Ⅲ型组氨酸激酶BOS1通过基因敲除的方法被克隆鉴定,敲除突变体对苯基吡咯类杀菌剂的抗性显著提升[13];为了揭示对HOG-MAPK途径的具体功能,SEGMÜLLER等构建了和(Hog1-like基因)双突变体,BOS1负调控SAK1磷酸化,参与对甘油合成和渗透压的调节功能;同时BOS1独立于HOG-MAPK途径,调节杀菌剂敏感性、在高渗条件下的适应性[14-15]。在典型的Ⅲ型组氨酸激酶结构域的N-末端有5—6个重复HAMP结构域[16],HAMP亚基含有两个螺旋,由约14个柔性残基连接,每一个螺旋都由典型的七肽重复序列(A-G)组成,在A和D的位置具有疏水残基[17],根据NCBI对灰霉病菌B05.10菌株BOS1的注释,它除了具有5个重复的HAMP结构域外,还具有RAP、TAR、HisKA、HATPase_c、G-X-G motif、REC等结构。目前有关咯菌腈药剂的抗性报道较少,在国外部分地区有低、中水平抗性的报道,Vignutelli等[18]在法国监测到一株低抗菌株,Fernándezortuño等[19]在美国弗吉尼亚州分离得到一株低抗菌株,这也是美国在咯菌腈生产并使用10年后首次监测到咯菌腈的抗性菌株。【本研究切入点】国内外虽陆续有咯菌腈抗性菌株的报道,但对灰霉病菌咯菌腈抗性机制研究相对较少,且不同区域使用药剂类型及使用频率亦有差异,导致灰霉病菌对其产生抗性机制的原因可能有所不同;本文通过测定四川省草莓灰霉病菌对咯菌腈的抗性水平和频率,分析渗透压、甘油含量以及组氨酸激酶BOS1突变的位置和方式与咯菌腈抗性水平之间的关系,从而探索灰霉病菌对咯菌腈的抗性机制。【拟解决的关键问题】明确四川省草莓灰霉病菌对咯菌腈抗性频率、抗性水平和部分生理指标,通过抗性菌株靶标基因扩增测序,明确四川省草莓灰霉病菌对咯菌腈抗性机制,为科学使用咯菌腈提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 采用课题组2016—2017年在四川省草莓主产区采集、分离的草莓灰霉病菌菌株(表1)。

表1 四川省草莓灰霉病菌供试菌株
1.1.2 供试药剂与仪器 95%咯菌腈原药(山东亿嘉生物科技有限公司);甘油、氢氧化钠、氯化钠、琼脂粉等化学试剂均购置于成都浩搏优科技有限公司,DNA提取试剂盒购置于上海生工生物工程股份有限公司(上海生工);引物合成和测序均在上海生工完成。
SHP-250恒温培养箱(上海三发科学仪器有限公司);SW-OJ-2FD超净工作台(苏州安泰空气技术有限公司);UV3000紫外分光光度计(上海美普达仪器有限公司);D37520离心机(美国科峻仪器公司);Powerpac 200型电泳仪(Bio-rad公司);C1000 PCR扩增仪(Bio-rad公司)。
1.2 试验方法
1.2.1 灰霉病菌对咯菌腈的抗性水平检测 按照区分剂量法[20],对2016—2017年采集于四川省的188株草莓灰霉病菌对咯菌腈的抗性进行评价,即将采集并分离的菌株分别接种在含0.1、0.5、1 μg·mL-13种咯菌腈浓度的PDA培养基上培养。将能在含0.1、0.5、1 μg·mL-1咯菌腈浓度的PDA培养基生长菌丝的菌株视为高抗菌株,将能在含0.1、0.5 μg·mL-1咯菌腈浓度的PDA培养基生长菌丝,而不能在1 μg·mL-1咯菌腈浓度的培养基上生长菌丝的菌株视为中抗菌株,将能在含0.1 μg·mL-1咯菌腈浓度的PDA培养基生长菌丝,而不能在0.5和1 μg·mL-1咯菌腈浓度的培养基上生长菌丝菌株视为低抗菌株,将不能在含有咯菌腈的培养基上生长菌丝的菌株视为敏感菌株,统计抗性和敏感菌株的发生频率,并对抗性类型进行统计分析[21]。
1.2.2 咯菌腈抗性菌株毒力测定 采用菌丝生长速率法[22]。将原药分别配制成0.025、0.05、0.1、0.5、1 μg·mL-15个浓度,每个浓度设3个重复,均匀混入PDA培养基中,然后将供试菌原接种于含毒培养基上,同时设置空白对照,在22℃恒温培养箱中培养。培养4 d后,采用“十字交叉法”测定菌落直径,根据菌落直径的平均值计算咯菌腈对菌丝生长的抑制率。
抑制率=(对照菌落直径-药剂处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
根据抑制率查表得到相对应的机率值,将药剂浓度转换为对数值。以机率值为纵坐标,浓度对数值为横坐标,得到毒力回归方程,根据毒力回归方程,计算杀菌剂的有效中浓度(EC50),参考敏感基线EC50=0.0135 μg·mL-1[23],计算抗性倍数,抗性倍数=抗性菌株EC50/敏感菌株EC50。
1.2.3 咯菌腈抗性及敏感菌株渗透压敏感性测定 采用菌丝生长速率法[22]。将NaCl溶液配制为0、1.25、2.5、5、10、20、40、80 g·L-1,每个浓度设3个重复,均匀混入PDA培养基中,然后将供试菌原接种于含NaCl的培养基上,同时设置空白对照,在22℃恒温培养箱中培养。培养5 d后,采用“十字交叉法”测定菌落直径,并计算不同浓度下的菌丝生长抑制率,计算公式参考1.2.2。
1.2.4 咯菌腈抗性及敏感菌株甘油含量测定 采用甘油铜比色法[24]。标准曲线制定:在50 mL的锥形瓶中依次加入0.05 g·mL-1的CuSO4溶液1 mL,0.05 g·mL-1的NaOH溶液3.5 mL,再分别加入10 mL浓度为0.0025、0.003、0.004、0.005、0.006、0.008、0.01 g·mL-1的甘油,振荡反应12 min后,用三层滤纸过滤,在630 nm下测定吸光度,记录数据并利用Excel 2016软件求得标准曲线。
将敏感菌株和抗性菌株分别接种于液体培养基中,每个菌种接种6瓶,每瓶接种5个菌饼,25℃,175 r/min培养60 h后,每个菌株取3瓶,加入0.1 μg·mL-1的咯菌腈1 mL,培养4 h后,过滤收集菌丝,用超纯水洗净,滤纸吸干水分并风干。每个样品取0.5 g菌丝,在研钵中加入20 mL无菌水和少量石英砂,低温研磨,将上清液转移至50 mL离心管中,80℃加热15 min,然后在8 500 r/min下离心10 min,取上清液在630 nm下测定吸光度。以蒸馏水作为空白对照。将测得的吸光度代入标准曲线,求得菌株的甘油含量[25]。
1.2.5 咯菌腈抗性菌株的分子检测 灰霉病菌DNA提取:采用真菌基因组DNA快速抽提试剂盒的方法提取灰霉病菌DNA。将新鲜菌株接种到含有100 mL PDA培养液的250 mL三角瓶中(每瓶5—7个菌饼),然后置于摇床(25℃、120 r/min)振荡培养。将培养4 d后的菌丝取出后,放置4层纱布于布氏漏斗上,在无菌条件下抽干菌丝上的培养液;取50—100 mg菌丝用液氮研磨成粉末,加入到1.5 mL离心管中。加入400 μL Buffer Digestion和4 μL巯基乙醇,振荡混匀。将离心管置于65℃水浴锅中水浴1 h至细胞完全裂解,每10 min颠倒混匀一次;加入200 μL Buffer PF,充分颠倒混匀,-20℃冰箱放置5 min;室温10 000 r/min离心5 min,将上清液转移到新的1.5 mL离心管中;加入等体积的异丙醇,颠倒5—8次使之充分混匀,室温放置2—3 min。室温10 000 r/min离心5 min,弃上清液;加入1 mL 75%乙醇,颠倒漂洗1—3 min,室温10 000 r/min离心2 min,弃上清液,重复步骤1次;开盖,室温倒置5—10 min至残留的乙醇完全挥发;得到的DNA用50 μL TE Buffer溶解,置于-20℃下保存备用。
靶标基因扩增[20]:根据杀菌剂的靶标基因(BC1G_00374)序列设计引物,采用50 μL的反应体系进行分段扩增,PCR反应程序如下:95℃ 3 min;95℃ 30 s,55℃ 30 s,72℃ 2 min,35个循环;72℃ 5 min;16℃2 min。取5 μL PCR产物于1%琼脂糖凝胶中进行电泳(120 V,15 min),EB染色,在凝胶成像仪下观察条带大小。引物序列见表2,扩增反应体系:Template DNA(100 ng·μL-1)1.0 μL,2×Phanta Max Buffer 25 μL,Dntp Mix(10 mmol·L-1each)2.0 μL,Phanta Max Super-Fidelity DNA Polymerase(1 U·μL-1)1.0 μL,BF(10 pmol·L-1)2.0 μL,BR(10 pmol·L-1)2.0 μL,ddH2O 17 μL。
靶标基因测序分析:将PCR产物测序,测得菌株基因序列用DNAMAN序列分析软件进行拼接并翻译氨基酸序列,采用Swissmodle(https://swissmodel. expasy.org/)和I-TASSER(https://zhanglab.cmmb.med. umich.edu/ I-TASSER/)对BOS1的三级结构进行预测分析;采用ENDscript 3.0[26]对比对代表性菌株BOS1的氨基酸序列以及空间结构进行比较。

表2 靶标基因BOS1分段扩增所需引物
2 结果
2.1 草莓灰霉病菌对咯菌腈抗性频率测定
采用区分计量法对2016—2017年采集于四川省不同地区的188株草莓灰霉病菌进行抗性频率测定,结果见表3。在188株菌株中,高抗菌株有8株(4.25%),中抗菌株有9株(4.78%),低抗菌株有43株(22.87%),敏感菌株128株(68.08%);其中绵阳涪城区的高抗菌株比例最大(23.53%),而成都崇州、成都彭州、德阳广汉、眉山仁寿的中抗菌株比例也分别达到7.84%、10.00%、9.09%和7.69%;敏感菌株比例高于80%的仅有成都双流(88.89%)和眉山东坡区(88.88%)。
2.2 咯菌腈对草莓灰霉病菌毒力测定
基于草莓灰霉病菌区分计量法检测的结果,从其中筛选敏感菌株CDPZ-8和CDCZ-11,低抗菌株CDCZ-2和YAHY-13,中抗菌株CDCZ-42和CDCZ-20,高抗菌株MYFC-10和CDCZ-43进行了毒力测定(表4)。结果表明,低抗菌株及中抗菌株,抗性倍数均<10,高抗菌株抗性倍数>10。其中敏感菌株的EC50在0.03—0.05 μg·mL-1,抗性倍数为2.2—3.7;低抗菌株和中抗菌株EC50在0.08—0.11 μg·mL-1,抗性倍数为5.9—8.1,毒力结果相差不大;高抗菌株EC50在0.43—0.62 μg·mL-1,抗性倍数为31.9—45.9。

表3 四川省不同采集地点的草莓灰霉病菌对咯菌腈的抗性水平
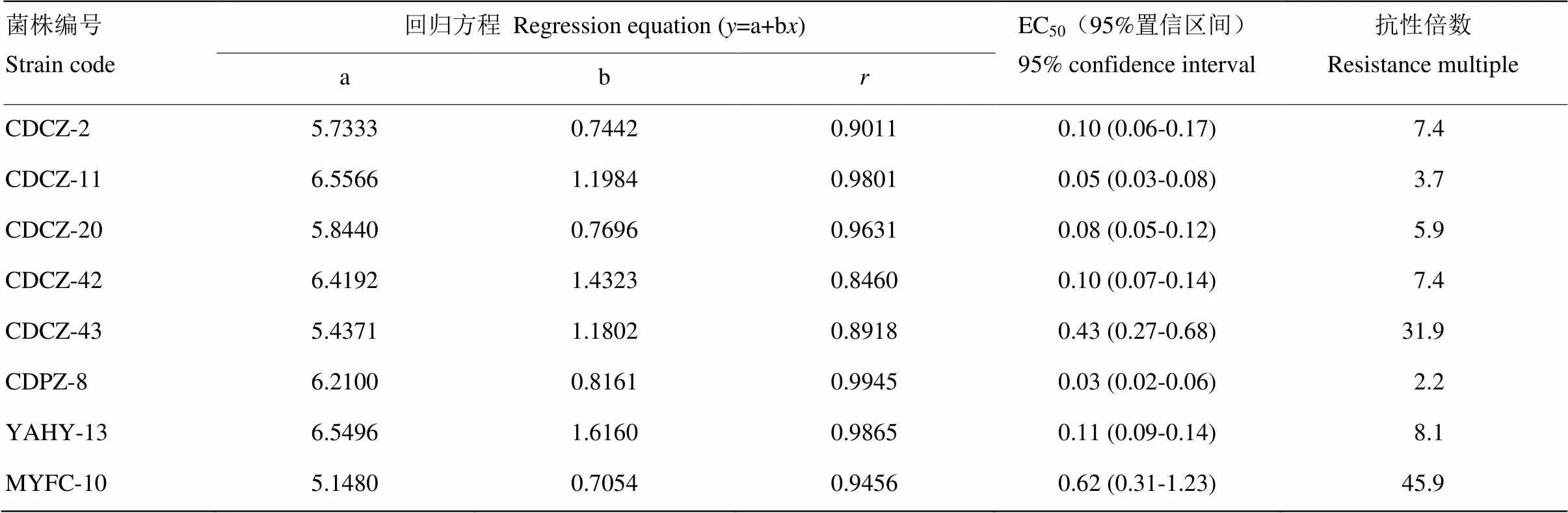
表4 咯菌腈对抗性及敏感草莓灰霉病菌菌株毒力
2.3 咯菌腈抗性及敏感菌株渗透压敏感性测定
将筛选菌株接种至分别含0、1.25、2.5、5、10、20、40、80 g·L-1NaCl溶液的PDA中培养,结果见图1。敏感菌株在1.25—10 g·L-1NaCl浓度范围内可刺激生长,抗性菌株在1.25—20 g·L-1NaCl浓度范围内刺激生长(MYFC-10菌株除外),在高浓度40 g·L-1以上生长被抑制,在80 g·L-1NaCl溶液的PDA中培养抗性越高的菌株其抑制率越高。

图1 代表性菌株在不同浓度NaCl下的抑制率
2.4 咯菌腈抗性及敏感菌株的甘油含量测定
甘油铜比色法标准曲线:=5.427+0.0012,²=0.9929,线性相关性良好。由表5可知,在正常条件下各菌株之间甘油含量范围是0.0025—0.0148 μg·mL-1,且与对咯菌腈抗性没有明显的相关性,在加入0.1 μg·mL-1的咯菌腈1 mL处理4 h后,敏感菌株甘油含量明显上升,抗性菌株甘油含量虽然增加,但变化不明显,增加幅度低于敏感菌株。结果表明,咯菌腈抗性菌株在有药剂胁迫的作用下,甘油的合成受到了影响,且菌株抗性越高,抑制作用越明显。
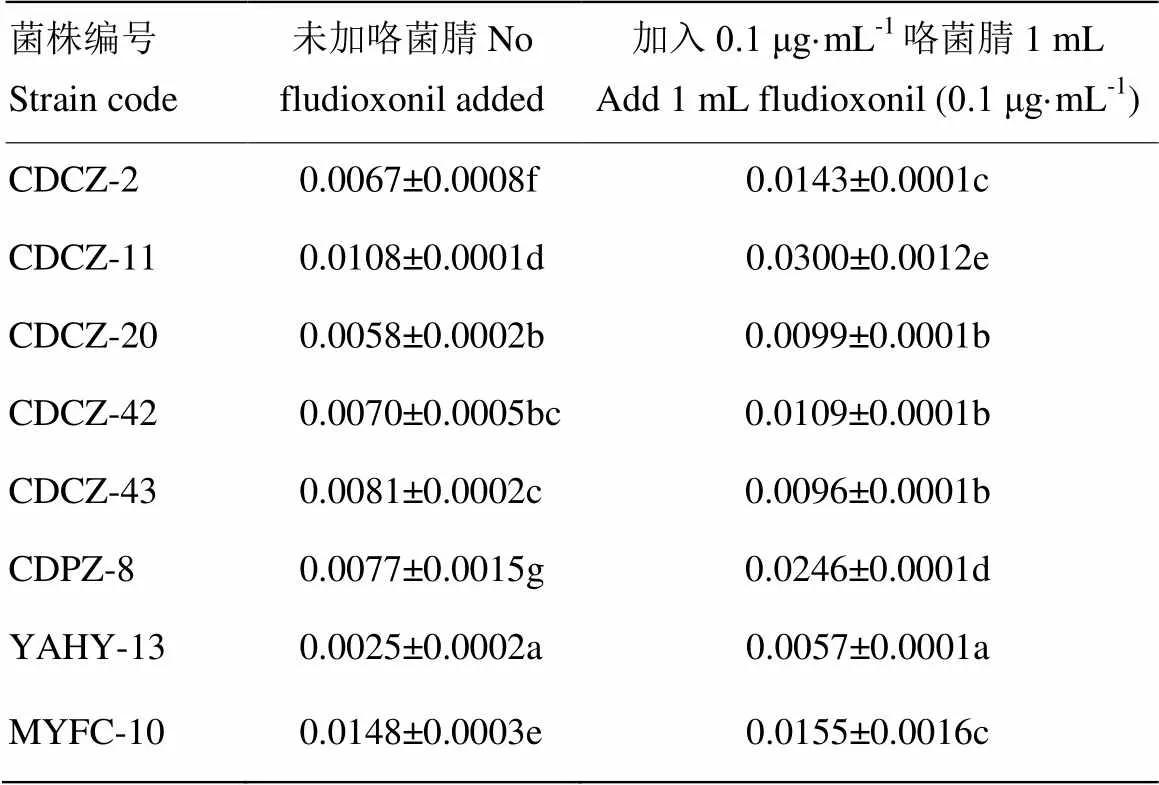
表5 咯菌腈对代表性菌株甘油含量影响
表中数据为平均数±标准误,同列数据后不同字母表示差异显著(<0.05)
Data are mean±SE. Different lowercases in the same column indicate significant difference at<0.05 level
2.5 代表性菌株Ⅲ型组氨酸激酶基因BOS1测序
将待测菌株进行培养,并提取DNA,对双组份组氨酸激酶基因(Broad Institute登录号:BC1G_00374)进行测序。由图2可知,不同突变位置对BOS1区域结构有不同程度的影响,F127S、I365N、I365S、V1136I、A1259T均处于BOS1区域结构的无规则卷曲,但只有TAR区域I365N和I365S与野生型区域结构有很大差异,其中I365N使365 aa附近下部无规则卷曲发生整体偏移,而I365S使365 aa附近下部和上部无规则卷曲都发生整体偏移;V287G处于螺旋,且两者螺旋结构差异不大;将拼接后的DNA序列翻译氨基酸序列,然后进行比对,发现在6个待测菌株中有5种突变类型,3种变异菌株。所有抗性菌株均在TAR区域有突变,且低抗菌株YAHY-13、CDCZ-2以及中抗菌株CDCZ-42在HAMP区域亦发生突变;而中抗菌株CDCZ-20和高抗菌株MYFC-10和CDCZ-43在TAR、REC区域均有突变,但CDCZ-20菌株在TAR区域突变位点是I365N,而两株高抗菌株突变位点是I365S(图3、表6)。
3 讨论
同种病害在不同区域对同一种药剂表现出不同的抗性频率和水平,与药剂使用历史和频率有关。本研究表明,四川省多个地区的草莓灰霉病菌对咯菌腈已产生不同程度的抗性,其抗性频率为31.92%,其中绵阳涪城区的高抗菌株比例最大,成都崇州、成都彭州、德阳广汉、眉山仁寿的中抗菌株比例亦达到7%以上,而成都双流和眉山东坡区的敏感菌株比例在80%以上。1984年,瑞士先正达作物保护有限公司通过修饰硝吡咯菌素合成咯菌腈,1996年被美国等国家允许登记使用,Li等[27]对在2009—2012年间从美国、德国采集的11株接触过咯菌腈的灰霉病菌菌株进行抗性监测,发现2株低抗菌株(EC50范围为0.16—0.26 μg·mL-1),2株中抗菌株(EC50范围为0.32—0.38 μg·mL-1);Liu等[28]从河南不同地点采集分离了274株番茄灰霉病菌,敏感性测定发现这些菌株对咯菌腈EC50在0.0033—0.0415 μg·mL-1(平均值为0.005 μg·mL-1),并通过对敏感野生型菌株用咯菌腈持续培养,获得3个咯菌腈抗性突变株;禾丽菲等[29]2016年从山东济南、泰安、聊城、潍坊、莱芜及淄博等地分离了126株番茄叶霉病菌,采用菌丝生长速率法测定这些菌株的敏感基线,发现敏感基线上升至0.64 μg·mL-1;Sang等[30]在2015—2017年间从施用咯菌腈防治灰霉病的浙江部分区域草莓灰霉病果和病杆上分离了242株菌株,采用区分剂量法发现3株高抗菌株和13株低抗菌株。由此可见,病原菌在咯菌腈的长期选择压力下会导致抗性的产生。

表6 代表性菌株Ⅲ型组氨酸激酶基因BOS1测序结果
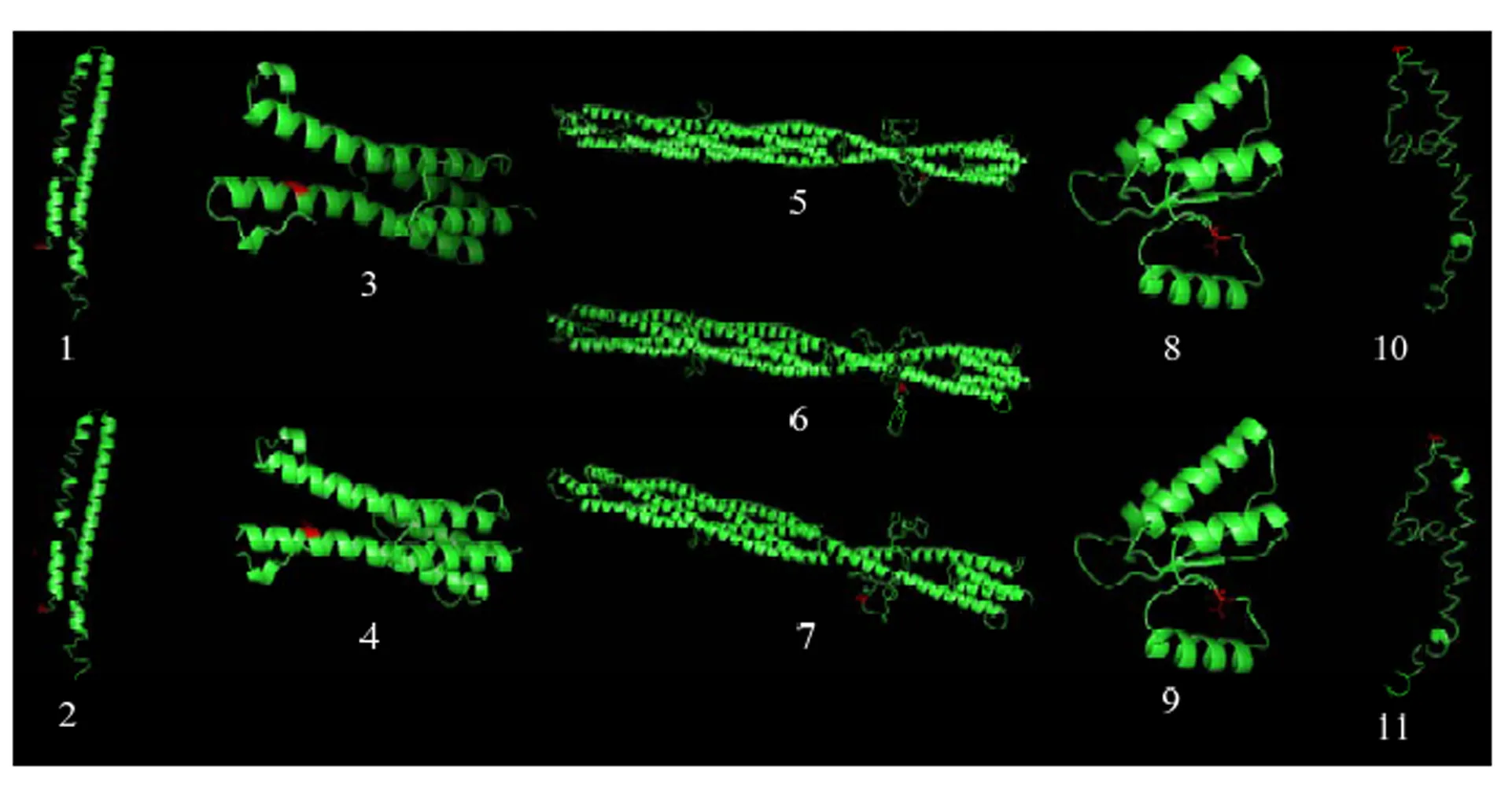
绿色Green:没有突变位点的结构Structure without mutation site;红色red:突变位点结构Structure of mutation site;1、3、5、8、10:野生型BOS1蛋白在125—233、267—347、289—628、1111—1228、1229—1310 aa区域的三级结构Tertiary structure of wild type BOS1 protein in 125-233, 267-347, 289-628, 1111-1228, 1229-1310 aa regions;2:BOS1蛋白F127S在125—233 aa的三级结构Tertiary structure of BOS1 proteinF127S in 125-233 aa;4:BOS1蛋白V287G在267—347 aa的三级结构Tertiary structure of BOS1 proteinV287G in 267-347 aa;6、7:BOS1蛋白I365N及BOS1蛋白I365S在289—628 aa的三级结构Tertiary structure of BOS1 proteinI365N and BOS1 proteinI365S in 289-628 aa;9:BOS1蛋白V1136I在1111—1228 aa的三级结构Tertiary structure of BOS1 proteinV1136I in 1111-1228 aa;11:BOS1蛋白A1259T在1229—1310 aa的三级结构Tertiary structure of BOS1 proteinA1259T in 1229-1310 aa

图3 BOS1氨基酸序列对比
本研究发现,在高渗作用下,与敏感菌株相比田间抗性菌株对渗透压的耐受能力增加,但是当浓度超过耐受范围后对渗透胁迫高度敏感,菌株抗性越高越敏感,抑制率越高;在药剂胁迫作用下,抗性菌株产生甘油增加量显著低于敏感菌株,且抗性越强,甘油增加量越少;这与Ren等研究结果一致[31]。LI等[32]也发现与敏感菌核病菌菌株相比,药剂筛选、化学诱变及紫外诱变的抗性菌株对氯化钠和葡萄糖形成的高渗透压均敏感;Zhang等[33]研究发现,粗糙脉孢菌(OsS)突变体对高渗透压敏感,不能在含4% NaCl的培养基上生长,但OS突变体对苯吡咯类杀菌剂表现抗性;随后研究发现OsS编码一个与酿酒酵母HOG1同源丝裂原活化蛋白(MAP)激酶,突变体阻碍甘油在细胞内的积累从而导致抗性的产生;Kojima等[34]通过基因缺失突变的方法,敲除HOG1后发现灰葡萄孢对咯菌腈的抗性增加;在酿酒酵母中,渗透感应蛋白组氨酸激酶Slnl通过磷酸传递到YPD1,响应调控蛋白Sskl,从而对HOG1途径起负调控作用,不会产生大量甘油;但在高渗作用下,Slnl的活性暂时受到抑制,引发HOG1的途径激活,并且表达渗透响应基因,产生大量的甘油,而细胞是通过甘油的合成来平衡细胞内外的压强以维持正常生长[35-36]。
咯菌腈的作用靶标为Ⅲ型双组分组氨酸激酶,是酿酒酵母Slnl同源基因,通过抑制Ⅲ型组氨酸激酶的活性,产生大量的甘油使真菌细胞胀裂死亡;咯菌腈抗性菌株因为Ⅲ型组氨酸激酶基因的突变,使咯菌腈与靶标Ⅲ型组氨酸激酶亲和性下降而正常表达,从而维持细胞形态[16]。本文通过对咯菌腈的靶标基因(BC1G_00374)测序,发现四川省的低抗及中抗菌株各一株在HAMP区域发生突变,BOS1的三维结构由螺旋和折叠组成跨膜结构,高抗菌株均在C端存在突变,敏感菌株和低抗菌株(CDCZ-2除外)在此位置不存在突变;CDCZ-2除了此位置的突变,还存在N段V287G的突变,另一株低抗菌株也存在N段V287G的突变;因此突变的位置以及方式与灰霉病菌菌株对咯菌腈的抗性水平存在必然的联系。Ren等[31]发现田间BOS1G311R、BOS1G265D、BOS1N609T菌株以及BOS1G545E对咯菌腈达到高抗水平;Sang等[30]发现田间BOS1F127S, I365N, S426P、BOS1G538R, A1259T、BOS1R319K, V336M, D337N, V346I, A350S, Q369P, N373S菌株以及BOS1G262S, Q369P, N373S对咯菌腈均达到高抗水平,采用分子模拟对接评价不同突变对BOS1空间结构的影响,发现这些BOS1突变体与咯菌腈的亲和力比野生型BOS1亲和力显著降低;Fillinger等[37]利用HAMP结构建模发现BOS1的HAMP结构域中疏水残基的置换能够改变HAMP的螺旋结构,从而可能终止信号转导;氨基酸残基E529、T581或E692的突变加强信号转导能力,而不影响HAMP的螺旋结构。因此,下一步可采用Surflex-Dock分子模拟[38]对接技术进行模拟或者评估本研究中所得抗性菌株BOS1与咯菌腈亲和性,明确其抗性机制。
2016年,尚岩[39]报道四川、重庆、云南、湖北的15个地区桃、樱桃的灰霉病菌对咯菌腈抗性频率为0,由于咯菌腈与多菌灵、乙霉威、腐霉利、嘧霉胺和啶酰菌胺之间均不存在交互抗性[40],可考虑与其他类型杀菌剂混用、交替轮换等方法来防治灰霉病,减缓抗性菌株产生的频率,做到合理、科学用药。
4 结论
四川省部分地区草莓灰霉病菌已对咯菌腈产生了抗性;与敏感菌株相比,田间抗性菌株对渗透压的耐受能力增加,但当浓度超过耐受范围后对渗透胁迫高度敏感;在高渗作用下,菌株抗性越高抑制率越高,说明抗性菌株对高渗敏感;在咯菌腈胁迫作用下,抗性菌株产生甘油增加量显著低于敏感菌株,且抗性越强,甘油增加量越少;突变的位置及方式与灰霉病菌菌株对咯菌腈的抗性水平存在必然联系。
[1] ROMANAZZI G, FELIZIANI E.(gray mold)// Bautista-Baños S.:. Elsevier, 2014: 131-146.
[2] 张国珍, 钟珊. 草莓灰霉病研究进展. 植物保护, 2018, 44(2):1-10.
ZHANG G Z, ZHONG S. Advances in strawberry gray mold., 2018, 44(2): 1-10. (in Chinese)
[3] WILLIAMSON B, TUDZYNSKI B, TUDZYNSKI P, VAN KAN J A.: the cause of grey mould disease., 2007, 8(5): 561-580.
[4] MYRESIOTIS C K, KARAOGLANIDIS G S, TZAVELLAKLONARI K. Resistance ofisolates from vegetable crops to anilinopyrimidine, phenylpyrrole, hydroxyanilide, benzimidazole, and dicarboximide fungicides., 2007, 91(4): 407-413.
[5] FERNÁNDEZ-ORTUÑO D, BRYSON P K, GRABKE A, SCHNABEL G. Monitoring for resistance infrom strawberry to seven chemical classes of fungicides in the eastern United States//. 2013, 103(6): S2.43.
[6] SCHIRRA M, D’AQUINO S, PALMA A, MARCEDDU S, ANGIONI A, CABRAS P, SCHERM B, MIGHELI Q. Residue level, persistence, and storage performance of citrus fruit treated with fludioxonil., 2005, 53(17): 6718-6724.
[7] 乔广行, 严红, 么奕清, 黄金宝, 李兴红. 北京地区番茄灰霉病菌的多重抗药性检测. 植物保护, 2011, 37(5): 176-180.
QIAO G H, YAN H, YAO Y Q, HUANG J B, LI X H. Detection of multiple fungicide resistance infrom tomato in Beijing., 2011, 37(5): 176-180. (in Chinese)
[8] BARDAS G A, VELOUKAS T, KOUTITA O, KARAOGLANIDISG S. Multiple resistance offrom kiwifruit to SDHIs, QoIs and fungicides of other chemical groups., 2010, 66(9): 967-973.
[9] 张玮, 乔广行, 黄金宝, 王忠跃, 李兴红. 中国葡萄灰霉病菌对嘧霉胺的抗药性检测. 中国农业科学, 2013, 46(6): 1208-1212.
ZHANG W, QIAO G H, HUANG J B, WANG Z Y, LI X H. Evaluation on resistance of grape gray mold pathogento pyrimethanil in China., 2013, 46(6): 1208-1212. (in Chinese)
[10] 徐建强, 平忠良, 刘莹, 马世闯, 许道超, 杨岚, 郑伟, 刘圣明, 夏彦飞, 林晓民. 咯菌腈对四种牡丹叶片病原真菌的抑制活性. 中国农业科学, 2017, 50(20): 4036-4045.
XU J Q, PING Z L, LIU Y, MA S C, XU D C, YANG L, ZHENG W, LIU S M, XIA Y F, LIN X M. Inhibitory activity of fludioxonil to four pathogenic fungi of peony leaves., 2017, 50(20): 4036-4045. (in Chinese)
[11] FURUKAWA K, RANDHAWA A, KAUR H, MONDAL A K, HOHMANN S. Fungal fludioxonil sensitivity is diminished by a constitutively active form of the group III histidine kinase., 2012, 586(16): 2417-2422.
[12] LAWRY S M, TEBBETS B, KEAN I, STEWART D, HETELLE J, KLEIN B S. Fludioxonil induces Drk1, a fungal group III hybrid histidine kinase, to dephosphorylate its downstream target, Ypd1., 2017, 61(2): e01414-16.
[13] VIAUD M, FILLINGER S, LIU W, POLEPALLI JS, LE PÊCHEUR P, KUNDURU AR, LEROUX P, LEGENDRE L. A class III histidine kinase acts as a novel virulence factor in., 2006, 19(9): 1042-1050.
[14] SEGMÜLLER N, ELLENDORF U, TUDZYNSKI B, TUDZYNSKI P. BcSAK1, a stress-activated mitogen-activated protein kinase, is involved in vegetative differentiation and pathogenicity in., 2007, 6(2): 211-221.
[15] LIU W, LEROUX P, FILLINGER S. The HOG1-like MAP kinase Sak1 ofis negatively regulated by the upstream histidine kinase Bos1 and is not involved in dicarboximide- and phenylpyrrole-resistance., 2008, 45(7): 1062-1074.
[16] PARKINSON J S. Signaling mechanisms of HAMP domains in chemoreceptors and sensor kinases., 2010, 64: 101-122.
[17] AIROLA M V, WATTS K J, BILWES A M, CRANE B R. Structure of concatenated HAMP domains provides a mechanism for signal transduction., 2010, 18(4): 436-448.
[18] VIGNUTELLI A, HIBER-BODMER M, HIBER U W. Genetic analysis of resistance to the phenylpyrrole fludioxonil and the dicarboximide vinclozolin in()., 2002, 106(3): 329-335.
[19] FERNÁNDEZORTUÑO D, BRYSON P K, GRABKE A,SCHNABEL GFirst report of fludioxonil resistance infrom a strawberry field in Virginia., 2013, 97(6): 848-849.
[20] 武东霞. 灰葡萄孢菌()对苯噻菌酯和咯菌睛的抗药性风险研究[D]. 南京: 南京农业大学, 2015.
WU D X. Resistance risk for benzothiostrobin and fludioxonil against[D]. Nanjing: Nanjing Agricultural University, 2015. (in Chinese)
[21] YOSHIDA H, ANO H, ISHIDA C, TANIGAWA N, KIKUI M, TAKASHIMA T, TSUYUGUCHI I. A study of INH 0.1 microgram/ml resistantstrains assessed by BrothMIC MTB-1 method., 2002, 77(7): 533-535.
[22] 慕立义. 植物化学保护研究方法. 北京: 中国农业出版社, 1994.
MU L Y.. Beijing: China Agriculture Press, 1994. (in Chinese)
[23] 赵建江, 张小风, 马志强, 王文桥, 韩秀英. 番茄灰霉病菌对咯菌腈的敏感基线及其与不同杀菌剂的交互抗性. 农药, 2013, 52(9): 684-685.
ZHAO J J, ZHANG X F, MA Z Q, WANG W Q, HAN X Y. Baseline-sensitivity ofon tomato to fludioxonil and cross-resistance against diverse fungicides., 2013, 52(9): 684-685. (in Chinese)
[24] 仇骏, 王大兵, 黄得庆. 甘油铜比色法测定水中甘油的含量方法研究. 中国化工贸易, 2014, 30(6): 140.
QIU J, WANG D B, HUANG D Q. Determination of glycerin in water by glycerol copper colorimetric method., 2014, 30(6): 140. (in Chinese)
[25] Duan Y B, Ge C G, Liu S G, Chen C J, Zhou M G. Effect of phenylpyrrole fungicide fludioxonil on morphological and physiological characteristics of., 2013, 106(1/2): 61-67.
[26] ROBERT X, GOUET P. Deciphering key features in protein structures with the new ENDscript server., 2014, 42(Web Server issue): W320-W324.
[27] LI X, FERNÁNDEZ-ORTUÑO D, GRABKE A, SCHNABEL G. Resistance to fludioxonil inisolates from blackberry and strawberry., 2014, 104(7): 724-732.
[28] LIU S, HAI F, JIANG J. Sensitivity to fludioxonil ofisolates from tomato in Henan Province of China and characterizations of fludioxonil-resistant mutants., 2017, 165(2): 98-104.
[29] 禾丽菲, 陈乐乐, 肖斌, 赵时峰, 李秀环, 慕卫, 刘峰. 番茄叶霉病菌对咯菌腈敏感基线的建立及田间防治效果评价. 中国农业科学, 2018, 51(8): 1475-1483.
HE L F, CHEN L L, XIAO B, ZHAO S F, LI X H, MU W, LIU F. Establishment of sensitivity baseline and evaluation of field control efficacy of fludioxonil against., 2018, 51(8): 1475-1483. (in Chinese)
[30] SANG C, REN W, WANG J, XU C, ZHANG Z H, ZHOU M G, CHEN C J, WANG K. Detection and fitness comparison of target-based highly fludioxonil-resistant isolates of, from strawberry and cucumber in China., 2018, 147: 110-118.
[31] REN W C, SHAO W Y, HAN X, Zhou M G, CHEN C J. Molecular and biochemical characterization of laboratory and field mutants ofresistant to fludioxonil., 2016, 100(7): 1414-1423.
[32] LI J L, WU F C, ZHU F X. Fitness is recovered with the decline of dimethachlon resistance in laboratory-induced mutants ofafter long-term cold storage., 2015, 31(3): 305-309.
[33] ZHANG Y, LAMM R, PILLONEL C, LAM S, XU J R. Osmoregulation and fungicide resistance: theos-2 gene encodes a HOG1 mitogen-activated protein kinase homologue., 2002, 68(2): 532-538.
[34] KOJIMA K, TAKANO Y, YOSHIMI A, TANAKA C, KIKUCHI T, OKUNO T. Fungicide activity through activation of a fungal signalling pathway., 2004, 53(6): 1785-1796.
[35] HOHMANN S. Osmotic stress signaling and osmoadaptation in yeasts., 2002, 66(2): 300-372.
[36] CHEN R E, THOMER J. Function and regulation in MAPK signaling pathways: lessons learned from the yeast., 2007, 1773(8): 1311-1340.
[37] FILLINGER S, AJOUZ S, NICOT P C, LEROUX P, BARDIN M. Functional and structural comparison of pyrrolnitrin- and iprodione- induced modifications in the class III histidine-kinase Bos1 of., 2012, 7(8): e42520.
[38] YANG Y, LI M X, DUAN Y B, LI T, SHI Y Y, ZHAO D L, ZHOU Z H, XIN W J, WU J, PAN X Y, LI Y J, ZHU Y Y, ZHOU M G. A new point mutation in2-tubulin confers resistance to carbendazim in., 2018, 145: 15-21.
[39] 尚岩. 桃、樱桃灰霉病菌对七种杀菌剂的抗药性研究[D]. 武汉: 华中农业大学, 2016.
SHANG Y. Study on resistance offrom peach and cherry to seven fungicides[D]. Wuhan: Huazhong Agricultural University, 2016. (in Chinese)
[40] 贾娇, 苏前富, 孟玲敏, 张伟, 李红, 刘婉丽, 晋齐鸣. 禾谷镰孢菌对咯菌腈的抗药性诱导及对不同药剂的交互抗性//中国植物病理学会会议论文集, 2015: 553.
JIA J, SU Q F, MENG L M , ZHANG W, LI H, LIU W L, JIN Q M. The resistance ofto fludioxonil and the interaction resistance to different medicaments//, 2015: 553. (in Chinese)
(责任编辑 岳梅)
Resistance Detection and Mechanism of Strawberryto Fludioxonil in Sichuan Province
GONG ChangWei, QIN YiMan, QU JinSong, WANG XueGui
(College of agronomy/Biorational Pesticide Research Laboratory, Sichuan Agricultural University, Chengdu 611130)
【Objective】Grey mold is an important disease in strawberry production, which seriously affects the yield and quality of strawberry.The objective of this study is to clarify the resistance frequency and resistance mechanism ofin different strawberry-growing areas in Sichuan Province, and to provide theoretical basis for the fungicide control of strawberry grey mold.【Method】The disease samples were collected from Chengdu, Deyang, Meishan, Leshan and Yaan in Sichuan Province from 2016 to 2017, and 188 strains ofwere isolated and purified. The sensitivity of 188 strains ofwas classified with the distinguish measurement method. The toxicity and osmotic pressure sensitivity of fludioxonil to some representative strains were assayed using the method of mycelial growth-inhibition capacity. The glycerol content of the resistant and sensitive strains treated with fludioxonil was determined by the method of glycerol-copper colorimetric assay. The sequences of type III histidine kinase gene(BC1G_00374) in the resistant- and sensitive-fludioxonil strains were piecewise amplified and sequenced. The effects of mutations on the structure of BOS1 were predicted and evaluated by Swissmodle and I-TASSER, respectively.【Result】Of 188 strains, 8 strains showed high resistance, 9 strains showed medium resistance, 43 strains showed low resistance and the rest were sensitive. The EC50of representative strains ranged from 0.03 to 0.62 μg·mL-1, and the resistance multiple of the representative strains ranged from 2.2 to 45.9. The concentrations of 1.25-10 g·L-1and 1.25-20 g·L-1NaCl could stimulate the hypha growth of the sensitive- and resistant-fludioxonil strains, respectively, whereas the concentration of >40 g·L-1inhibited the hypha growth, especially in the resistant strains, and the higher the resistant level, the stronger the inhibition rate. The glycerol content of representative strains ranged from 0.0025 to 0.0148 μg·mL-1under normal conditions, and there was no significant correlation between glycerol content and fludioxonil resistance of the strain, but the glycerol content of the resistant and sensitive strains increased after the treatment of fludioxonil (0.1 μg·mL-1). The increase of glycerol content in resistant strains was significantly lower than that in sensitive strains. The low resistance strains YAHY-13, CDCZ-2 and medium resistance strain CDCZ-42 mutated in the TAR and HAMP regions, meanwhile the medium resistance strain CDCZ-20 and high resistance strains MYFC-10 and CDCZ-43 mutated in TAR and REC regions, whereas the mutation site of TAR region in CDCZ-20 was I365N, and which of MYFC-10 and CDCZ-43 was I365S. Different mutation positions showed different effects on the region structure of BOS1, in which the F127S, I365N, I365S, V1136I, A1259T were all in the irregular curl of BOS1 structure, but the I365N and I365S in TAR region made the overall deviation of the region structure irregular curl. 【Conclusion】In some areas of Sichuan Province,has developed resistance to fludioxonil. Compared with the sensitive strains, the tolerance ability of field resistant strains to osmotic pressure increased, but when the concentrations exceeded the tolerance range, they were highly sensitive to osmotic stress and the increase of glycerol content in the field resistant strains under the fludioxonil stress was significantly lower than that of the sensitive strains. The mutation position and mode of histidine kinase BOS1 are closely related to the resistance level ofto fludioxonil.
; fludioxonil; resistance;osmotic pressure; glycerol content;
2018-06-04;
2018-07-27
国家公益性行业(农业)科研专项(201303025)
贡常委,Tel:028-86290977;E-mail:youguqiu@163.com。
王学贵,Tel:028-86290977;E-mail:wangxuegui@sicau.edu.cn
10.3864/j.issn.0578-1752.2018.22.006
