甘蓝BoSPx的克隆与表达分析
王玉奎,白晓璟,廉小平,张贺翠,罗绍兰,蒲敏,左同鸿,刘倩莹,朱利泉
甘蓝的克隆与表达分析
王玉奎1,白晓璟1,廉小平2,张贺翠1,罗绍兰1,蒲敏1,左同鸿1,刘倩莹1,朱利泉1
(1西南大学农学与生物科技学院,重庆 400715;2西南大学园艺园林学院,重庆 400715)
【目的】自交不亲和性(self-incompatibility,SI)是显花植物在长期进化过程中形成的限制自交衰退、促进杂交优势的一种复杂而完善的重要遗传机制。通过对SI与钙共响应新基因的克隆、时空特异性表达分析和筛选与其互作的蛋白,并对在自花授粉后刺激柱头的响应机制进行研究,以期为甘蓝SI的深入研究提供依据。【方法】采用转录组测序、自花和异花授粉后差异筛选以及PCR克隆获得。利用DNAMAN软件和Smart软件进行氨基酸序列比对和保守结构域分析,通过Expasy在线软件预测BoSPx蛋白分子量、等电点、二级结构和跨膜结构域;采用MEGA6.0软件中的邻接法构建BoSPx蛋白的系统发育树,并推测BoSPx蛋白在甘蓝自花授粉后的功能。利用RT-PCR技术进行组织特异性表达分析,通过qRT-PCR检测自花和异花授粉后的相对表达量。构建GFP表达载体,共聚焦显微镜观察BoSPx的亚细胞定位;酵母双杂交技术寻找其相互作用的蛋白。【结果】克隆获得一个新基因——,其含有1个外显子,无内含子,是单外显子结构。的开放阅读框为396 bp,编码具有131个氨基酸残基的蛋白质。理论等电点为4.54,是一种亲水性蛋白,没有信号肽和跨膜域,含有3个保守的EF-hand模体(第48—60、64—80和81—96位)。起始密码子上游启动子序列500 bp左右含有生长素响应应答元件。在开花前1—2 d的柱头、萼片、叶片、花药、花瓣中均有表达,在柱头中表达量最高,并且在自花和异花授粉的柱头中表达量都是先升高后降低,在自花授粉15 min时表达量达到最高,而后急剧下降,下降的低值与开花前1—2 d的柱头峰值相当。亚细胞定位分析表明BoSPx蛋白定位于细胞核和细胞质中。酵母双杂交结果表明BoSPx与SRKARC1之间无相互作用,但与生长素家族蛋白BoSAUR71和BoPID均能互作。【结论】受自花授粉显著诱导表达,可能是受生长素调节的钙结合蛋白,对SI和钙产生共响应;该蛋白具有多组织表达和核质同在的特性,表明BoSPx可能参与SRK-ARC1-ExO70A1途径以外的未知信号通路。
甘蓝;BoSPx;酵母双杂交;生长素;自花授粉;自交不亲和
0 引言
【研究意义】自交不亲和性(self-incompatibility,SI)是植物在长期的进化过程中为了防止自交衰退、保持遗传变异和促进杂种优势,形成的一种复杂而完善的重要遗传机制。芸薹属甘蓝属于典型的孢子体型自交不亲和植物(sporophytic self-incompatibility,SSI),其分子机制主要集中于SI信号传导元件协同作用抑制自花花粉萌发或花粉管生长上[1],是基于磷酸化激活SI信号元件与泛素化降解花粉亲和因子的过程。Gu等[2]以SRK(S-locus receptor kinase)胞内激酶域为诱饵,通过酵母双杂交技术从甘蓝型油菜柱头cDNA文库鉴定出与SRK结合的靶蛋白—ARC1(arm repeating containing),ARC1在自交不亲和反应过程中起正调控作用。Stone等[3]和VANOOSTHUYSE等[4]利用反义抑制和RNAi技术分别抑制甘蓝型油菜()和琴叶拟南芥()的表达,以及在甘蓝型油菜中过表达均只能部分打破材料的不亲和性。在拟南芥中,直系同源基因是假性遗传因子,向自交亲和的拟南芥中仅仅转入琴叶拟南芥的也能表现出强自交不亲和性[5-7]。由此表明ARC1可能并非SRK唯一下游信号元件。因此,寻找其他参与调控自交不亲和反应的蛋白质元件的编码基因,对进行人工调控来改变芸薹属植物的自交育性和创造新的育种理论和方法具有重要意义。【前人研究进展】甘蓝SI信号传导过程还涉及很多其他功能分子[8],如钙和生长素响应蛋白等。钙与生长素在自交亲和性异花花粉萌发并穿越柱头的伸长过程中起关键作用[9-10]。Iwano等[11]通过双授粉试验和用单倍型SP11(SCR)处理共表达YC3.60和Sb-SRK的琴叶拟南芥和芜菁的乳突细胞,发现Ca2+浓度的增加是由于单倍型SCR与SRK相互特异性识别引起的,同时,乳突细胞中Ca2+浓度的增加最终导致花粉水化被抑制。迄今为止,胞质中Ca2+浓度的增加如何抑制花粉水化的分子机制尚不清楚。当雄蕊和雌蕊发育时,生长素(IAA)主要累积于花药和花萼中,在花药中,IAA随着花粉的发育不断积累,但其对雄蕊发育的影响仅局限于花丝变短。在授粉后相应器官的反应方面,在拟南芥成花诱导和花的发育过程中出现水溶性的IAA,而且IAA可以促进花粉在雌蕊上萌发和花粉管的生长[12]。梨自花授粉后柱头内的IAA含量变化较显著[13],IAA在烟草自交不亲和的花粉与柱头的识别过程中出现了相似的显著变化[14],而且自交不亲和性与柱头生长素含量之间存在负相关关系,表明柱头表面细胞内未知的生长素信号响应柱头对自花花粉的抑制作用[15]。【本研究切入点】除了ARC1,SRK(SI的关键元件)下游还可能存在其他未知信号元件。前期研究中,发现了一种花丝较短的SI型材料,其钙调素和生长素响应相关基因表达量明显较高,但其分子机理尚不清楚。【拟解决的关键问题】本研究拟通过克隆甘蓝,并对其进行序列、启动子活性以及组织特异性表达分析,同时利用qRT-PCR检测自花授粉和异花授粉后的表达模式,探索该蛋白与信号传导元件SRK、ARC1等之间的相互作用,以期为甘蓝自交不亲和性的深入研究提供依据。
1 材料与方法
1.1 试验材料及其处理
材料取于西南大学园艺园林学院十字花科蔬菜研究基地选育的甘蓝高代自交不亲和系A4和F1植株,2017年3月底对开花前1—2 d花蕾人工去雄,然后分别以F1和A4植株的花粉为父本,以A4柱头为母本进行授粉处理。用F1植株花粉给去雄的A4柱头进行0、15、30和60 min的异花授粉处理,简称CP(cross- pollination)组。用A4植株花粉给去雄A4柱头进行0、15、30和60 min的自花授粉处理,简称SP(self-pollination)组。授粉处理后用毛笔快速扫去柱头上的花粉,液氮速冻,-80℃保存备用。
1.2 转录组测序及差异表达基因筛选
分别提取上述处理材料的RNA,送百迈克公司进行转录组测序,利用TopHat2软件将所得转录组数据与参考基因组序列比对[16],采用Trinity软件对样品数据进行Unigenes组装,通过Fold Change≥2且错误发现率FDR≤0.05来筛选候选差异基因。根据表达量的差异倍数、GO(Gene Ontology)富集分析以及KEGG(kyoto encyclopedia of gene and genomes)富集分析筛选表达差异显著的基因。
1.3 目的基因的克隆
利用Primer Premer 5.0软件对上述筛选出的目的基因设计引物1300-GFP-F/1300-GFP-R(电子附表1),以结球甘蓝A4柱头cDNA和gDNA为模板进行扩增,PCR反应体系为20 μL ddH2O、25 μL 2×PCR Mixster Mix混合酶、上/下游引物各1 μL和cDNA模板1 μL;反应程序为94℃ 3 min;94℃ 30 s,58℃ 30 s,72℃ 40 s,40个循环;72℃5 min。将目的片段与PCAMBIA1300载体连接,并转化。菌液PCR和双酶切鉴定阳性克隆,送至上海生物工程股份有限公司测序。
1.4 生物信息学分析
通过NCBI网站在线查找目的基因的开放阅读框(ORF)、5′端非翻译区(5′UTR)和3′端非翻译区(3′UTR)。通过Bio-soft和DNAMAN8.0软件推导编码区的氨基酸序列;利用ExPASy-ProtParam tool(http://www.expasy.org/)分析蛋白质的理化性质;利用NCBI结构域数据库(https://www.ncbi.nlm.nih. gov/Structure/cdd/wrpsb.cgi)预测蛋白质的保守结构域;利用TMPRE(http//www.ch.embnet.org/software/ TMPRED_form.html)及SignalP(http://www.cbs.dtu.dk/ services/SignalP/)预测蛋白质的跨膜结构及信号肽;利用Smart(http://smart.embl-heidelberg.de/)和PROSITE(htttp://prosite.expasy.org/)预测蛋白质的高级结构域和功能位点。利用TargetP(https://omictools. com/targetp-tool)预测蛋白质的亚细胞定位。通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/)分析该基因起始密码子上游序列启动子的顺式作用元件。
1.5 组织特异性表达分析
按照RNA提取试剂盒RNAprep pure Plant Kit说明书(天根)提取甘蓝柱头、叶片、花药等不同组织的RNA,并反转录合成第一链cDNA。以为内参基因,用Phanta Max Super-Fidelity DNA Polymerase 25 μL反应体系检测不同组织中目的基因的表达情况。反应程序为95℃ 3 min;95℃ 15 s,60℃ 15 s,72℃ 10 s,35个循环;72℃5 min。
1.6 实时荧光定量PCR分析
提取不同授粉处理的柱头RNA,并进行反转录反应,合成单链cDNA,参考LIAO等[17]方法利用荧光定量PCR仪检测目的基因的表达模式。以甘蓝为内参基因,3次重复。利用2-ΔΔCT法分析的相对表达量。
1.7 亚细胞定位
将目的基因序列与绿色荧光基因连接,构建PCAMBIA1300-BoSPx融合表达载体,以生长4周龄的拟南芥莲座叶为材料制备原生质体,利用瞬时转染法将PCAMBIA1300空载体和重组载体PCAMBIA1300-BoSPx分别转入原生质体,23℃黑暗培养16 h,利用激光共聚焦显微镜观察BoSPx蛋白的定位[18]。
1.8 共转化酵母感受态细胞及酵母双杂互作的鉴定
参照MatchmakerTMGold Yeast Two-Hybrid System操作说明,利用聚乙二醇/醋酸锂法(PEG/ LiAC)将构建好的重组质粒pGBKT7-BoSPx分别与pGADT7-SRK、pGADT7-ARC1、pGADT7- BoSAUR71和pGADT7-BoPID相应地转化到酵母感受态细胞Y2HGold。并设立阴性对照(pGADT7-T×pGBKT7- Lam)和阳性对照(pGADT7-T和pGBKT7- 53),将共转化后的酵母感受态细胞涂布于营养缺陷型SD/-Leu -Trp固体培养基中,30℃倒置培养4 d。挑取白斑用无菌水稀释涂布于营养缺陷型SD/-Trp/- Leu/-His/-Ade固体培养基中。30℃倒置培养3—5 d,观察其生长情况。
2 结果
2.1 根据转录组数据筛选差异表达基因
根据转录组文库中自花授粉与异花授粉不同时段表达量的差异,以<0.05和|log2(fold change)|≥2作为显著差异表达阈值,筛选自花授粉不同时段差异显著的基因。对筛选出的自花授粉表达差异显著的基因进行GO和KEGG富集分析,发现1个与Ca2+和生长素信号途径相关的调控基因。该基因在未授粉时相对表达量为13,自花授粉15 min后达到最高,为221.98,而后急剧下调,其异花授粉表达量变化不明显(图1),两者的表达量水平差异达4.5倍,此时正是SI相关基因表达时期。表明该基因可能是自交不亲和相关基因,命名为。

SP:自花授粉;CP:异花授粉。下同
2.2 结球甘蓝BoSPx是不含内含子的单外显子基因
根据转录组数据获得的部分编码区CDS序列,结合NCBI数据库和芸薹属数据库BLAST比对获得全长cCDA序列。以甘蓝柱头cDNA和gDNA为模板,进行PCR扩增。获得的cDNA和gDNA全长均为400 bp左右(图2),经克隆测序与数据库获得的序列完全一致,该基因CDS序列为396 bp,说明该基因是不含内含子的单外显子基因。编码一个具有131个氨基酸残基的蛋白质。

图2 甘蓝BoSPx的cDNA和gDNA序列的扩增
2.3 BoSPx蛋白的结构分析
利用DNAMAN软件和ExPASy ProParam在线软件分析BoSPx蛋白的结构特征(图3-A),在氨基酸残基组成上,Glu和Leu出现频率较高,分别占氨基酸总数的10.7%和9.9%,该蛋白相对分子质量为14.78 kD,理论等电点为4.54,带正电荷的氨基酸残基总数为25,带负电荷的氨基酸残基总数为16;不稳定指数为51.83,为短半衰期蛋白;总平均疏水指数(grand average of hyropathicity,GRAVY)为-0.378,推测BoSPx蛋白可能为亲水蛋白;BoSPx蛋白定位于细胞核和细胞质,该蛋白含有3个EF-Hand模体(第48—60、64—80和81—96位),其两侧是由12个残基构成的α-螺旋结构域。通常组成EF-hand模体环的12个氨基酸残基以X、Y、Z、-X、-Y、-Z模式构成(图3-B)。分别位于第1、3、5、7、9、12位的氨基酸残基上,X、Y、Z、-X、-Y、-Z配体空间排列形成五边双锥结构参与金属配体配位,EF-Hand模体环中的第6个氨基酸残基在大多数情况下是Gly,位置1(X)、3(Y)和12(-Z)是最保守的[19-21]。1位上的氨基酸残基似乎总是疏水的,12位上的Glu或Asp提供了2个氧原子配位钙,EF-hand模体环以明显的几何图形容纳钙形成一个稳定的四螺旋束结构域。钙离子结合钙结合蛋白时可以诱导EF-hand模体环构象发生变化,导致靶蛋白激活或失活。
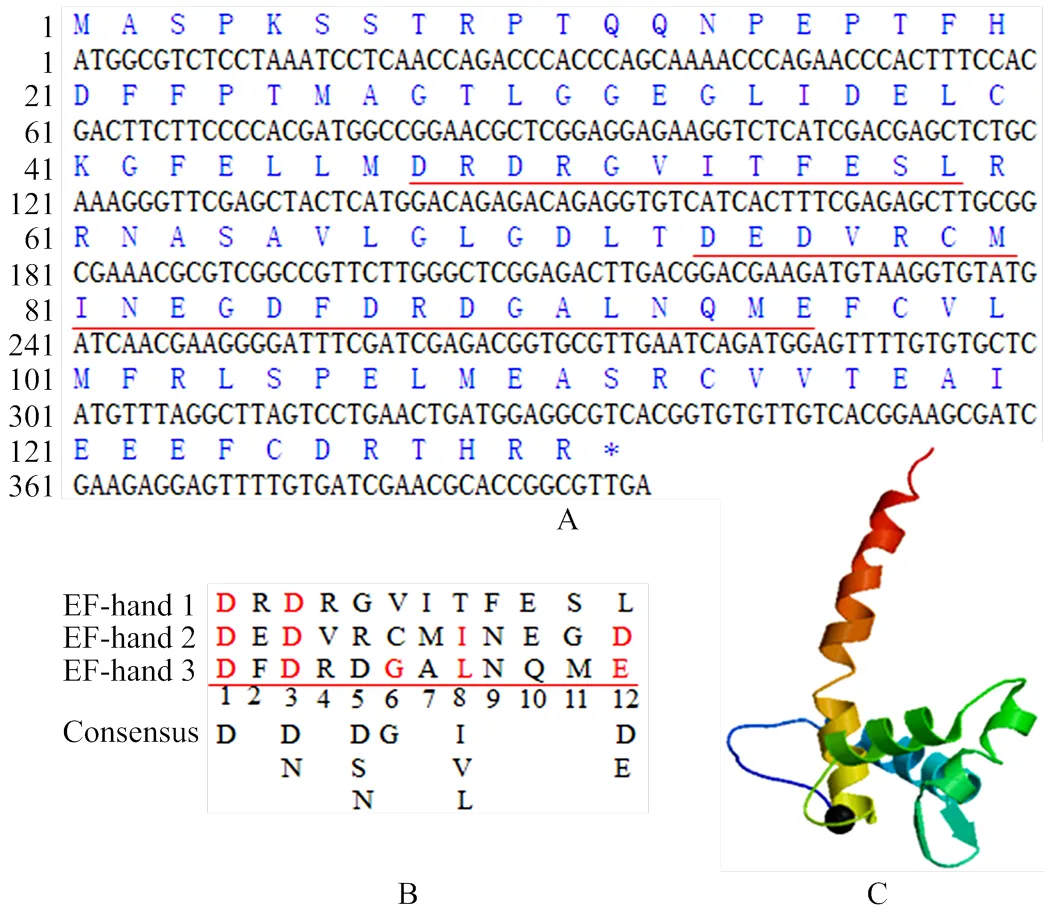
A:BoSPx序列及其推导的氨基酸序列;B:同Marsden等[22]共有序列比对分析BoSPx的EF-Hand结构域特征,下划线部分为3个EF-hand结构域;C:BoSPx蛋白三维结构预测,黑色标记的为Ca2+结合的核心区域
通过对BoSPx蛋白进行预测和分析,发现该蛋白二级结构主要由α螺旋(alpha helix,Hh)和loop(L)组成。其中Hh占58.02%,L占41.2%,为全α蛋白。BoSPx没有核定位信号(nuclear localization signals,NLS),不存在跨膜螺旋区。BoSPx没有N-糖基化位点,其含有16个磷酸化位点,其磷酸化位点主要集中在第0—30、50—80、100—125位氨基酸残基处。BoSPx第101位甲硫氨酸疏水性最强,系数为1.8;第13位谷氨酰胺亲水性最强,系数为-2.667。疏水性分析显示该蛋白平均负峰值个数显著多于正峰数,说明它们亲水性较好,属于可溶性蛋白。利用Swiss-modle在线软件对BoSPx的三级结构进行预测,得到该蛋白的三维结构(图3-C)。
2.4 BoSPx蛋白系统进化分析
通过对BoSPx与其他物种氨基酸序列进行比对构建系统进化树(图4)。BoSPx与甘蓝型油菜BnSPx蛋白的同源性最近,其相似度达96%;与亚麻芥亲缘关系最远,为79%。按照亲缘关系远近的原则,选取同源性最近的4种植物进行多序列比对,并利用Smart预测可获得每个蛋白的EF-Hand模体,通过E-value值分析可知BoSPx蛋白的EF-hand模体具有相对较高的同源性。为了进一步比较各个蛋白之间的同源性,通过DNAMAN软件中的Multiple Sequence Alignment程序比较,并通过Graphic File输出结果,发现EF-Hand模体存在几个相对保守的氨基酸片段(图5),不同功能的蛋白在此区域存在较高的同源性。

图4 BoSPx与其他物种BoSPx氨基酸序列的系统进化树

BnSPx:XP_013685948;RsSPx:XP_018468047;BrSPx:XP_009127085;下划线代表EF-Hand结构域,同时也代表该蛋白在此区域保守性高
2.5 BoSPx蛋白功能分析
为了进一步解析该基因是否受自花授粉显著诱导,通过芸薹属数据库(http://brassicadb.org/brad/ index.php)及NCBI数据库选取起始密码子上游2 000 bp的序列,利用PlantCARE在线软件分析该基因启动子的顺式作用元件,结果显示,的启动子区含有多个元件,包括启动子基本元件TATA-box和CAAT-box等;还含有光、ABA、IAA和胁迫响应相关等10多种应答顺式元件(表1),其中,IAA元件是一个TGACGTAA序列片段,位于起始密码子上游500 bp左右,推测BoSPx蛋白结合钙后,引起IAA浓度变化后,反馈调节BoSPx表达,形成一个正反馈过程,从而导致花器异常[23-25]。
2.6 BoSPx的表达分析
通过对萼片、花瓣、柱头、叶片和花药中的表达进行RT-PCR分析(图6)。结果表明,在开花前1—2 d的柱头、萼片、叶片、花药、花瓣中均有表达,且在柱头中表达量最高。通过对不同授粉处理后柱头中的qRT-PCR分析(图7),结果表明,在自花授粉后表达趋势为先上调后下调,在异花授粉后下调。自花授粉15 min后相对表达量约为7.804,而异花授粉15 min后相对表达量约为0.223,两者相对表达量相差约35倍。此时正是SI相关基因表达时期,在自花授粉15 min时能够强烈诱导柱头表达,说明的表达对自交不亲和性产生反应。
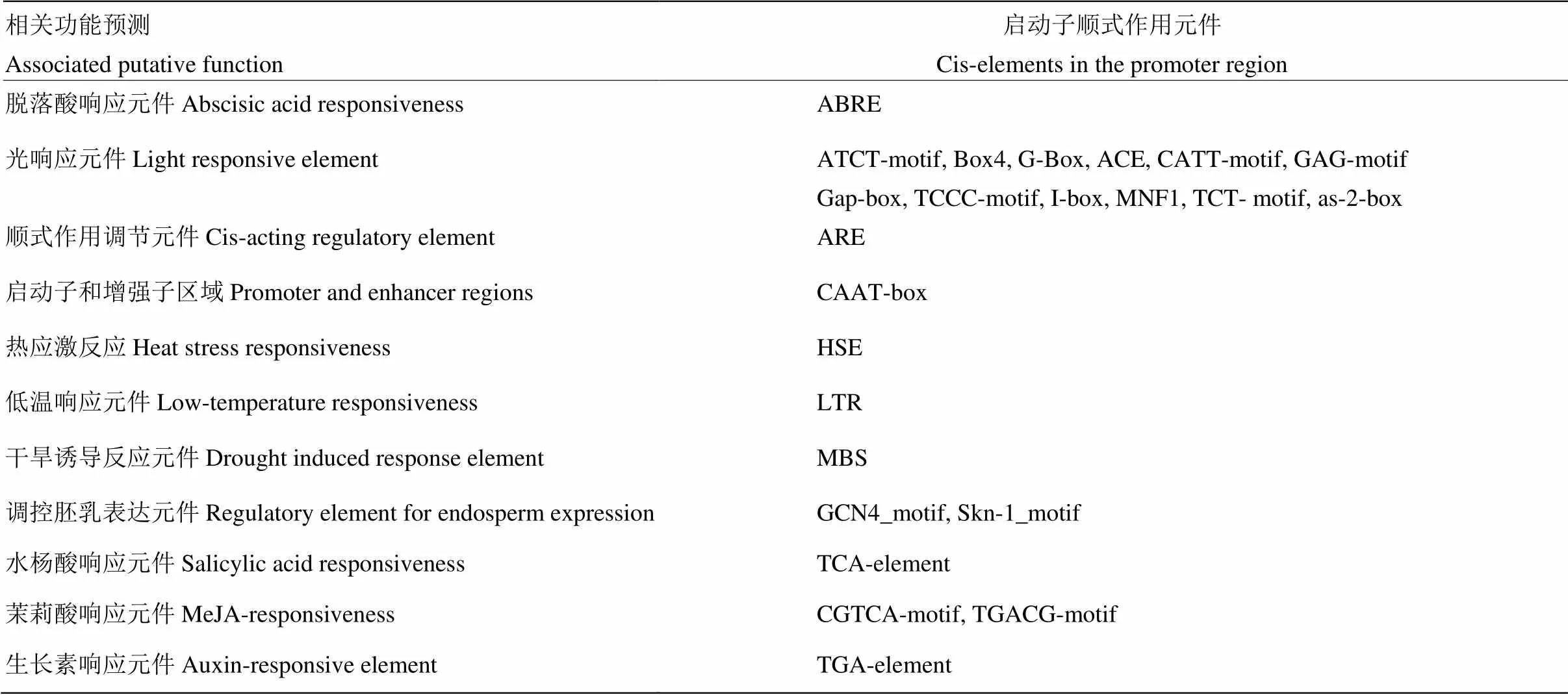
表1 BoSPx上游调控区顺式作用元件

图6 甘蓝BoSPx在不同组织中的RT-PCR分析
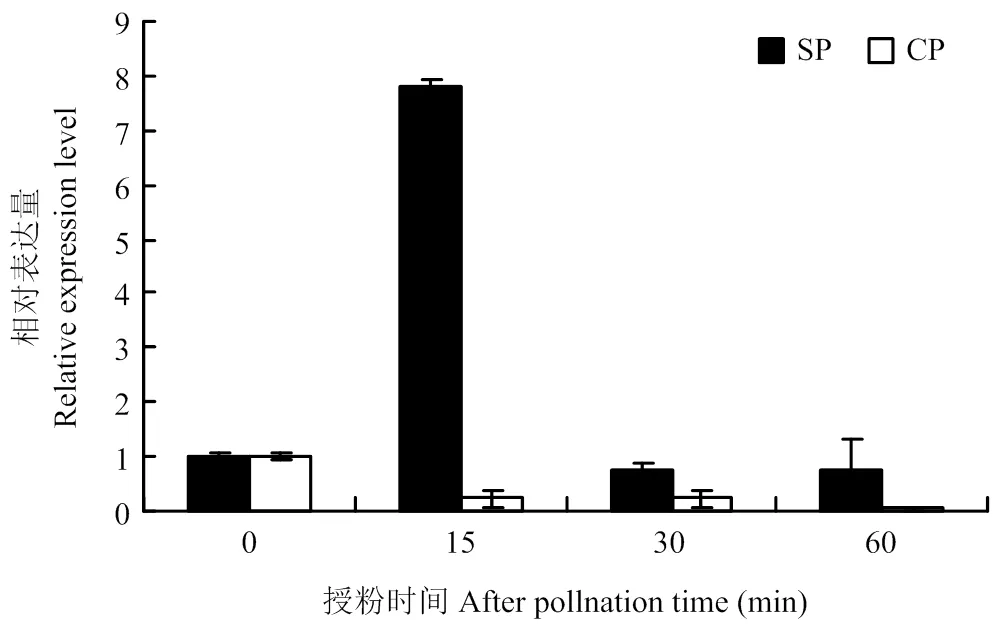
图7 BoSPx在不同授粉处理的表达分析
Fig 7 Expression analysis ofin response to self and cross pollination
2.7 BoSPx的亚细胞定位
通过构建融合表达载体,并转化拟南芥原生质体细胞。发现GFP蛋白分布在整个细胞中;而含GFP-BoSPx的蛋白主要分布在细胞质和细胞核中,表明BoSPx蛋白定位在细胞质和细胞核内(图8)。
2.8 BoSPx与SRK、ARC1、BoSAUR71和BoPID之间的相互作用
将阴阳对照载体和重组载体组合(pGBKT7- BoSPx×(pGADT7-SRK、pGADT7-ARC1、pGADT7- SAUR71、pGADT7-PID))共转化酵母感受态Y2HGold菌种中,分别涂布在SD/-Leu/-Trp(DDO)固体培养基上,30℃倒置培养3 d后,固体平板有菌落生成(图9)。通过PCR检测,均能扩增出目的条带,说明重组质粒同时转化进入酵母细胞中。
从DDO固体培养基上挑取阳性克隆悬浮于5 μL无菌水中,混匀后滴在营养缺陷型(SD/-Ade/-His/- Leu/-Trp)固体培养基上,30℃倒置培养3 d后,发现阴性对照不能生长,显红色(图10);共转化质粒BoSPx/SRK、BoSPx/ARC1不能生长,无色;BoSPx/BoSAUR71、BoSPx/BoPID和阳性对照能够生长,显白色(表2)。说明BoSPx在酵母中与SRK(XP_013591187)和ARC1(XP_013636377)无相互作用,与BoPID(XP_013631900.1)和BoSAUR71(XP_013632246)之间存在相互作用[26]。
3 讨论
3.1 BoSPx受自花授粉诱导显著表达
本研究基于以自交不亲和甘蓝柱头经不同授粉处理后的转录组数据,筛选出1个受自花授粉诱导显著上调表达的新基因,荧光定量分析表明在自花授粉15 min后的相对表达量约为7.804,约为未授粉表达量的7.8倍,而异花授粉15 min后的相对表达量约为0.223,在自花授粉15 min时,两者的表达量水平差异约达35倍,此时正是SI相关基因表达时期。如此表达量差异和表达时期,说明是响应甘蓝自交不亲和反应的基因。启动子中含有ABA、IAA和胁迫响应相关等10多种应答顺式元件,并且在甘蓝柱头的表达量明显高于其他部位,表明其可能通过某些未知信号传导途径参与调控自交不亲和反应。
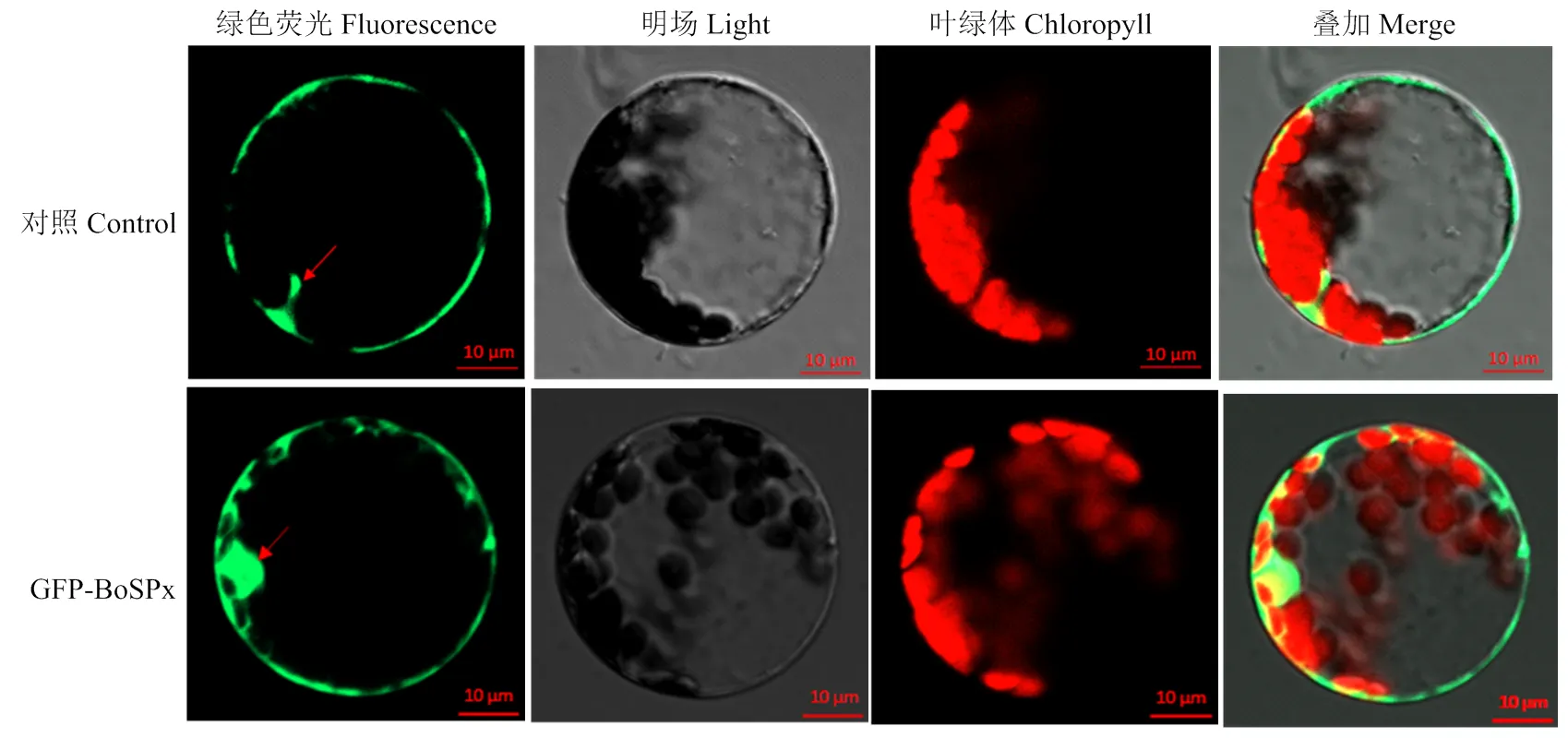
图8 BoSPx蛋白在拟南芥原生质体中的亚细胞定位分析
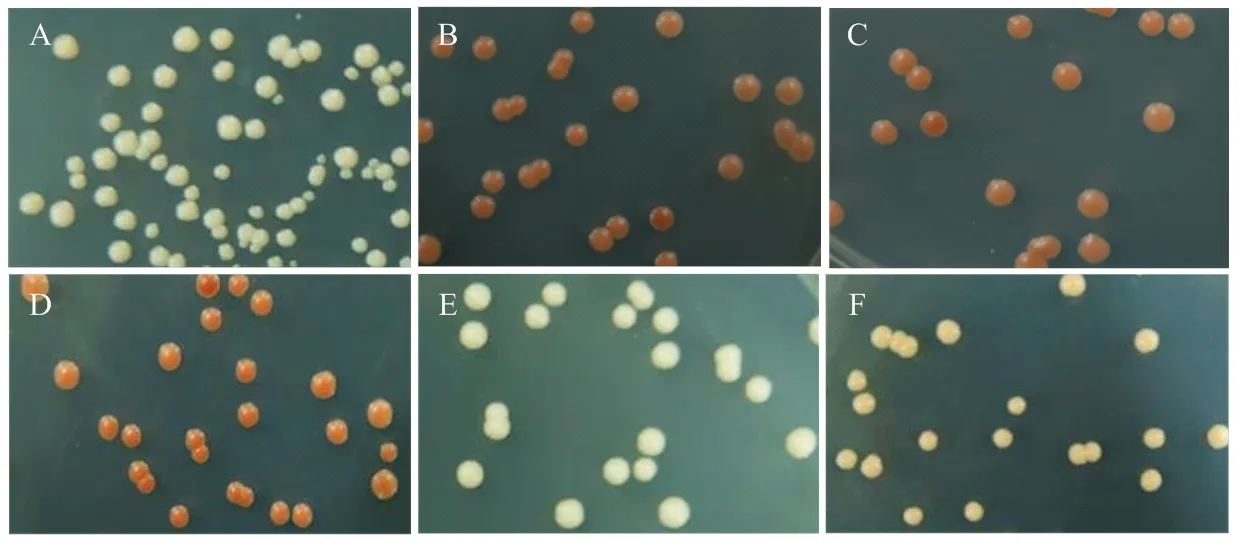
A:阳性对照 Positive control(pGADT7-T+pGBKT7-53);B:阴性对照Negative control(pGADT7-T+ pGBKT7-Lam);C:pGADT7-SRK + pGBKT7-BoSPx;D:pGADT7-ARC1+pGBKT7-BoSPx;E:pGADT7-SAUR71+ pGBKT7-BoSPx;F:pGADT7-BoPID + pGBKT7-BoSPx
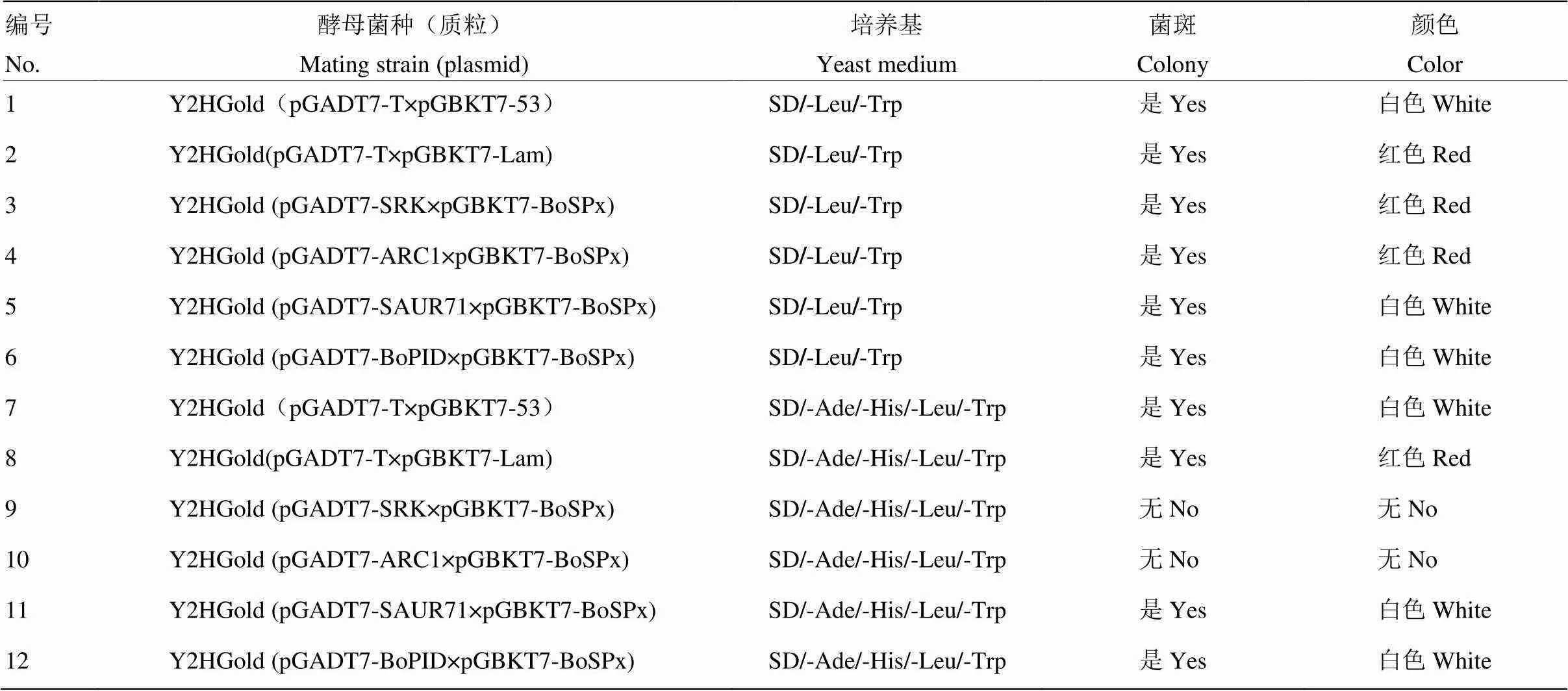
表2 质粒共转化酵母的相互作用分析

1:阳性对照Positive control(pGADT7-T+pGBKT7-53);2:阴性对照Negative control(pGADT7-T+pGBKT7-Lam);3:pGADT7-SRK+pGBKT7- BoSPx;4:pGADT7-ARC1+pGBKT7-BoSPx;5:pGADT7-SAUR71+ pGBKT7-BoSPx;6:pGADT7-BoPID+pGBKT7-BoSPx
3.2 BoSPx可能是响应生长素的钙结合蛋白
BoSPx含有3个EF-hand模体,其能结合Ca2+后发生蛋白构象的改变传递钙信号。Thomas等[27]通过研究罂粟SI过程中发现Ca2+浓度增加使肌动蛋白解聚最终导致下游细胞程序性死亡(programmed cell death,PCD)。Geitmann等[28]也证实了在虞美人()自交不亲和反应过程中,花粉管中细胞骨架发生改变和依赖第二信使Ca2+启动细胞程序性死亡,最终抑制花粉管生长。Iwano等[11]通过双授粉试验和制备原生质体转化试验证实了在芸薹属自交不亲和反应过程Ca2+浓度增加是必须的,并且足以导致花粉水化被抑制。同时也证明了乳突细胞中钙离子浓度的增加是由同种单倍型SCR和SRK特异性识别相互作用引起的。且在自花授粉6 min后Ca2+浓度达到最高。这与自花授粉后表达量水平基本一致。推测BoSPx可能作为Ca2+结合蛋白元件参与了甘蓝自花授粉后花粉与柱头的相互作用[29-30]。另外,Nasrallah等[25]通过过量表达ARF3(Auxin Response Factor 3)下调生长素反应促进十字花科植物SI反应中“自我”花粉的抑制。BoSPx蛋白定位于细胞核和细胞质,这种定位与ARC1相同,研究表明ARC1在SUMO前后分别定位于细胞质和细胞核内[31-32],在SI反应中作为S受体激酶底物时,其定位于细胞质内。BoSPx相同于ARC1在参与SI反应中的定位变化进一步说明BoSPx蛋白的表达很可能是对自交不亲和反应的响应。以上结果表明,我们克隆到的基因的表达产物是Ca2+响应的蛋白元件,BoSPx可能通过调节生长素的合成或分布来参与SI反应。
3.3 BoSPx可能参与未知的SI过程
本研究中通过酵母双杂试验证明BoSPx不能与SRK、ARC1互作,但能与BoPID(PINOID)和BoSAUR71相互作用,说明BoSPx没有直接参与SRK- ARC1-Exo70A1途径,而很可能参与了另外一条导致SI的未知途径[33-34]。在拟南芥中,PID(PINOID)蛋白丝氨酸/苏氨酸蛋白激酶是生长素信号传导的关键组分,可作为细胞生长素流出的正调控因子,也可作为生长素信号传导的负调控因子;Benjamins等[35]通过过量表达和喷洒钙离子抑制剂证实了钙内流和钙离子抑制剂能够在体内增强PID激酶活性。Christensen等[36]发现PID(PINOID)能够促进PINs(auxin efflux carrier component)蛋白家族磷酸化从而调节PINs蛋白的极性定位。这些结果进一步明确,BoSPx可能通过调节生长素的分布来参与SI反应,从而可能导致花器异常发育。转录组数据中在自花授粉后有差异表达,未授粉表达量为39,自花授粉15 min为13,在授粉60 min上调表达为59,与的表达模式正好相反,说明BoSPx与BoPID蛋白互作可能会改变BoPID蛋白的激酶活性,从而促进PIN蛋白磷酸化进一步改变PIN的极性定位。BoSPx可能通过结合Ca2+激活BoPID激酶活性,BoPID磷酸化BoPINs蛋白改变BoPINs蛋白的极性定位[37-39]。BoPINs蛋白定位的改变可能会使植物体内生长素浓度梯度分布紊乱,已有研究表明自交不亲和性与生长素含量之间存在负相关关系[15]。进一步表明BoSPx蛋白可能通过调控BoPID磷酸化BoPINs家族蛋白使柱头乳突细胞内生长素浓度分布紊乱,导致花器异常甚至胚胎发育异常,不能正常授粉受精,最终导致不亲和反应[12,25]。(small auxin-up RNA71)是一种生长素早期应答基因。SAUR蛋白能够体外与钙调蛋白结合,这表明它可能是钙调蛋白和生长素信号之间的桥梁和联系分子[40],生长素在对花器发育发挥生理作用的同时,又可能在分子水平上通过IAA响应元件,调节的表达,如此形成反馈作用。Kant等[41]研究证明了在水稻中在生长素的合成和运输中起着负调节作用。BoSPx通过与生长素家族蛋白SAUR71形成复合物可能负调控生长素的浓度和分布,既可能影响花柱或花粉管生长,造成花器异常,不能正常受精,又可能通过IAA响应元件,调节的表达,形成反馈作用。这可能是参与的甘蓝对钙和SI的共响应模式。
4 结论
受SI的自花授粉诱导显著表达,可能是响应生长素的钙结合蛋白,对SI和钙产生共响应;BoSPx不能与SRK、ARC1互作,但能与BoPID和BoSAUR71相互作用,BoSPx可能参与到SRK-ARC1-ExO70A1途径以外的未知信号通路中。
[1] Chapman L A, Goring D R. Pollen-pistil interactions regulating successful fertilization in the., 2010, 61(7): 1987-1999.
[2] GU T, MAZZURCO M, SULAMAN WAHEEDA SULAMAN, DINAH D.MATIAS and DAPHNE R.GORING. Binding of an arm repeat protein to the kinase domain of the S-locus receptor kinase., 1998, 95(1): 382-387.
[3] Stone S L, Anderson M, Mullen R T, Goring D R. ARC1 is an E3 ubiquitin ligase and promotes the ubiquitination of proteins during the rejection of self-incompatible Brassica pollen., 2003, 15(4): 885-898.
[4] VANOOSTHUYSE V, TICHTINSKY G, DUMAS C, GAUDE T, MARK C J. Interaction of calmodulin, a sorting nexin and kinase-associated protein phosphatase with theS locus receptor kinase., 2003, 133(2): 919-929.
[5] Mikhail E, Nasrall a h, Liu P, June B. Generation of self-incompatibleby transfer of two S locus genes from., 2002, 297: 247-249.
[6] Nasrallah M E, Liu P, Sherman-Broyles S, Boggs N A, Nasrallah J B. Natural variation in expression of self- incompatibility in: implications for the evolution of selfing., 2004, 101(45): 16070-16074.
[7] June B, Nasrall a h, Mikhail E. Robust self-incompatibility in the absence of a functional ARC1, gene in., 2014, 26: 3838-3841.
[8] Allen A M, Hiscock S J. Evolution and phylogeny of self- incompatibility systems in angiosperms[M]//. Springer, Berlin, Heidelberg, 2008: 73-101.
[9] Samuel M A, Goring D R. Self pollen rejection through the intersection of two cellular pathways in the: self- incompatibility and the compatible pollen response., 2008: 173-191.
[10] Samuel M A, Mudgil Y, Salt J N, Delmas F, Ramachandran S, Chilelli A, Goring D R. Interactions between the s-domain receptor kinases and AtPUB-ARM E3 ubiquitin ligases suggest a conserved signaling pathway in., 2008, 147: 2084-2095.
[11] IWANO M, ITO K, FUJII S, KAKITA M, ASANO-SHIMOSATO H, IGARASHI M, KAOTHIEN-NAKAYAMA P, ENTANI T, KANATANI A, TAKEHISA M, TANAKA M, KOMATSU K, SHIBA H, NAGAI T, MIYAWAKI A, ISOGAI A, TAKAYAMA S. Calcium signalling mediates self-incompatibility response in the., 2015, 1(9): 15128.
[12] Aloni R, Aloni E, Langhans M, Ullrich C I. Role of auxin in regulatingflower development., 2006(223): 315-328.
[13] 齐国辉, 徐继忠, 张玉星. 鸭梨自交不亲和性与花柱内源激素关系的研究. 河北农业大学学报, 2007, 30(1): 31-34.
Qi G H, Xu J Z, Zhang Y X. Study on the relationship between self-incompatibility of Ya pear and endogenous hormones in style., 2007, 30(1): 31-34. (in Chinese)
[14] BAVRINA T V, MILYAEVA E L, MACHACCKOVA I. Effect of phytohormone biosynthesis genes (ipt and iaaM+ iaaH) on the sexual reproduction of transgenic tobacco plants., 2002, 49(4): 484-491.
[15] Chen D, Zhao J. Free IAA in stigmas and styles during pollen germination., 2008, 134: 202-221.
[16] Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg S L. TopHat2: accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions., 2013, 14: R36.
[17] Liao X L, Zhu S F, Zhao W J. Cloning, Sequencing of 16S rDNA of HLB and establishment of real time PCR method., 2004, 12(1): 80-85.
[18] 赵娟莹, 刘佳明, 冯志娟. 大豆锌指转录因子GmDi19-5对高温的响应及互作蛋白的筛选. 中国农业科学, 2017, 50(12): 2389-2398.
Zhao J Y, Liu J M, Feng Z J. Response of soybean zinc fingerprinting factor GmDi19-5 to high temperature and screening of interaction proteins., 2017, 50(12): 2389-2398. (in Chinese)
[19] 蒲敏, 罗绍兰, 廉小平, 张贺翠, 白晓璟, 王玉奎, 左同鸿, 高启国, 任雪松, 朱利泉. 自花授粉诱导的甘蓝功能基因BoSPI的克隆与表达分析. 作物学报, 2018, 44(2): 177-184.
Pu M, Luo S L, Lian X P, Zhang H C, Bai X J, Wang Y K, Zuo T H, Gao Q G, Ren X S, Zhu L Q. Cloning and expression analysis of bovine functional gene BoSPI induced by self-pollination., 2018, 44(2): 177-184. (in Chinese)
[20] Marsden B J, Shaw G S, Sykes B D. Calcium binding proteins. elucidating the contributions to calcium affinity from an analysis of species variants and peptide fragments., 1990, 68(3): 587-601.
[21] 许俊强. 甘蓝花粉管钙感受蛋白编码基因CML49的克隆及功能鉴定研究[D]. 重庆: 西南大学, 2014.
Xu J Q. Cloning and functional identification of calcium sensing protein encoding gene CML49 inpollen tube[D]. Chongqing: Southwest University, 2014. (in Chinese)
[22] Marsden B J, Shaw G S, Sykes B D. Calcium binding proteins. Elucidating the contributions to calcium affinity from an analysis of species variants and peptide fragments., 1990, 68(3): 587-601.
[23] Goh C S, Lee Y, Kim S H. Calcium could be involved in auxin- regulated maintenance of the quiescent center in theroot., 2012, 55(2): 143-150.
[24] Vanneste S, Friml J. Calcium: The missing link in auxin action., 2013, 2: 650-675.
[25] Tantikanjana T, Nasrallah J B. Non-cell-autonomous regulation of crucifer self-incompatibility by auxin response factor ARF3., 2012, 109(47): 19468-19473.
[26] 毕云龙, 高启国, 施松梅, 刘晓欢, 蒲全明, 张莹, 张林成, 廉小平, 柳菁, 朱利泉. 甘蓝BoSU03蛋白基因的克隆及其与SRK相互作用分析. 园艺学报, 2015, 42(11): 2206-2214.
Bi Y L, Gao Q G, Shi S M, Liu X H, Pu Q M, Zhang Y, Zhang L C, Lian X P, Liu J, Zhu L Q. Cloning of BoSU03 protein gene and its interaction with SRK., 2015, 42(11): 2206- 2214. (in Chinese)
[27] Thomas S G, Huang S, Li S,STAIGER C J, VERNONICA E,FRANKLIN T. Actin depolymerization is sufficient to induce programmed cell death in self-incompatible pollen., 2006, 174(2): 221-229.
[28] Geitmann A, Snowman B N, Emons A M C,VERNONICA E,FRANKLIN T. Alterations in the actin cytoskeleton of pollen tubes are induced by the self-incompatibility reaction in., 2000, 12(7): 1239-1251.
[29] Cheung A Y. Pollen-pistil interactions during pollen-tube growth., 1996, 1(2): 45-51.
[30] Hiscock S J, Allen A M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus., 2008, 179(2): 286-317.
[31] Shi S, Gao Q, Zeng J, Liu X H, Pu Q M, Zhang H C, Yang X H, Zhu L Q. N-terminal domains of ARC1 are essential for interaction with the N-terminal region of Exo70A1 in transducing self-incompatibility of., 2016, 48(9): 777-787.
[32] 杨红, 朱利泉, 张贺翠. 利用酵母双杂交系统鉴定甘蓝SCR与SRK胞外域片段间的相互作用. 中国农业科学, 2011, 44(9): 1953-1962.
Yang H, Zhu L Q, Zhang H C. Study on the interactions between the truncated fragments of SCR and eSRK fromLby a yeast two-hybrid system., 2011, 44(9):1953-1962. (in Chinese)
[33] 施松梅, 高启国, 廉小平, 毕云龙, 刘晓欢, 蒲全明, 刘贵喜, 柳菁, 任雪松, 杨晓红, 朱利泉, 王小佳. 结球甘蓝SRK-ARC1-Exo70A1互作域的确定及作用强度. 中国农业科学, 2016, 49(1): 14-26.
Shi S M, Gao Q G, Lian X P, Bi Y L, Liu X H, Pu Q M, Liu G X, Liu J, Ren X S, Yang X H, Zhu L Q, Wang X J. Determination and interaction intensity of the SRK-ARC1-Exo70A1 Interaction field of.,2016, 49(1): 14-26. (in Chinese)
[34] 张贺翠, 柳菁, 廉小平, 曾静, 杨昆. 甘蓝 ROH1与EXO70A1的表达与相互作用. 中国农业科学, 2016, 49(4): 775-783.
Zhang H C, Liu J, Lian X P, Zeng J, Yang K. Expression and Interaction of ROH1 and EXO70A1 in., 2016, 49(4): 775-783. (in Chinese)
[35] BENJAMINS R, CARLOS S, AMPUDIA G, HOOYKAAS P J J, OFFRINGA R. PINOID-mediated signaling involves calcium-binding proteins., 2003, 132(3): 1623-1630.
[36] Christensen S K, Dagenais N, Chory J, Weigel D. Regulation of auxin response by the protein kinase PINOID., 2000, 100(4): 469-478.
[37] Friml J, Yang X, Michniewicz M,WEIJERS D,QUINT A,TIETZ O. A PINOID-dependent binary switch in apical-basal PIN polar targeting directs auxin efflux., 2004, 306(5697): 862-865.
[38] Zegzouti H, Anthony R G, Jahchan N, BOGRE L, CHRISTENSEN S K. Phosphorylation and activation of PINOID by the phospholipid signaling kinase 3-phosphoinositide-dependent protein kinase 1 (PDK1) in., 2006, 103(16): 6404-6409.
[39] Michniewicz M, Zago M K, Abas L, WEIJERS D, SCHWEIGHOFER A, MESKIENE I, HEISLER M, GOHNO C, ZHANG J, HUANG F, SCHWAB R, WEIGEL D, MEYEROWITZ E M, LUSCHNIG C, OFFRINGA R, FRIML J. Antagonistic regulation of PIN phosphorylation by PP2A and PINOID directs auxin flux., 2007, 130(6): 1044-1056.
[40] Park J E, Kim Y S, Yoon H K, Park C M. Functional characterization of a small auxin-up RNA gene in apical hook development in., 2007, 172(1): 150-157.
[41] Kant S, Bi Y M, Zhu T, ROTHSTEIN S J., a small auxin-up RNA gene, acts as a negative regulator of auxin synthesis and transport in rice., 2009, 151(2): 691-701.
(责任编辑 李莉)
Cloning and expression Analysis ofin
Wang YuKui1, Bai XiaoJing1, Lian XiaoPing2, Zhang HeCui1, Luo ShaoLan1, Pu Min1, Zuo TongHong1, Liu QianYing1, Zhu LiQuan1
(1College of Agronomy and Biotechnology, Southwest University, Chongqing 400715;2College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400715)
【Objective】Self-incompatibility (SI) is a genetic barrier to inhibit self-pollination and promote hybridization in flowering plants. Here, cloning of a novel gene co-responsive to SI and calcium production during pollination, and spatio-temporal specific expression analysis of the novel gene BoSPx under self-pollination conditions, screening its interaction proteins were conducted to explore. the responding mechanism of BoSPx to self-pollination stimulated stigma in order to provide some further insights into SI process invar.【Method】BoSPx was cloned by using transcriptome sequencing, self-pollination and cross-pollination differential screening, and PCR cloning. Amino acid sequence alignment and conserved domain analysis were performed by DNAMAN and Smart software. Expasy online software was used to predict BoSPx protein molecular weight, isoelectric point, secondary structure and transmembrane domain. Phylogenetic tree that constructed by the neighboring method in MEGA6.0 software was used to speculate on the function of BoSPx protein after self-pollination.RT-PCR and qRT-PCR were used to detecttissue-specific expression and the relative expression of BoSPx after self-pollination and cross-pollination. The BoSPx-GFP expression vector was constructed and the subcellular localization of BoSPx was observed under confocal microscopy; The interaction proteins were searched by using yeast two-hybrid system. 【Result】A novel gene, which contains a single exon without any introns, namedwas cloned. The open reading frame ofis 396 bp, encodes a protein with 131 amino acid residues. BoSPx is a hydrophilic protein, no signal peptide and transmembrane, and the theoretical isoelectric point is 4.54. Conserved domains analysis found BoSPx contains three conserved EF-hand motifs (48-60, 64-80, and 81-96). About 500 bp up-stream oftranslation start code contains an auxin response element. RT-PCR analysis found that BoSPx was expressed highest in stigma,was also expressed in sepals, leaves, anthers and petals in flowering stage. Theexpression levels in both self-pollinated and cross-pollinated stigma showed “up-down-up” expression pattern. Moreover, The expression ofin the stigma of self-pollination and cross-pollination increased at first and then decreased down to the highest expression level in stigma in flowering stage. The expression ofincreased rapidly after self-pollination at 15 min and then decreased sharply so that result in SI progress. The decreased value ofwas 1-2 days before flowering. Subcellular location analysis found that BoSPx expression in both the nucleus and cytoplasm. Yeast two-hybrid system did not detect interaction between BoSPx and SRK and ARC1, but BoSPx interacted with auxin family proteins BoSAUR71 and BoPID.【Conclusion】BoSPx is highly expressed by self-pollination, which may be an auxin-regulated calcium-binding protein, which has a common response to SI and calcium.The protein has multi-tissue expression and nuclear and cytoplasmic properties, indicating that BoSPx may be involved in unknown signaling pathways other than the SRK-ARC1-ExO70A1 pathway.
; BoSPx; yeast two-hybrid; auxin; self-pollination; self-incompatibility
2018-04-21;
2018-07-21
国家自然科学基金(31572127)
王玉奎,Tel:13251395081;E-mail:wangyuk0808@163.com。
朱利泉,Tel:023-68250794;E-mail:zhuliquan@swu.edu.cn
10.3864/j.issn.0578-1752.2018.22.011
