马铃薯脱毒苗对NaCl胁迫的响应及耐盐性评价
陈彦云,李紫辰,曹君迈,徐胜明,莫 磊
(1. 宁夏大学 生命科学院,宁夏 银川 750021;2.宁夏大学/西北退化生态系统恢复与重建教育部重点实验室,宁夏 银川 750021;3.北方民族大学 生物科学与工程学院,宁夏 银川 750021)
【研究意义】盐渍化土壤分布很广,约占陆地总面积的30 %[1],我国盐渍土面积约3.47×107hm2[2],居世界第4位。土壤盐碱化是世界农业生态退化的重大问题之一,它不仅造成资源破坏,而且还给生物圈和生态环境带来了巨大压力[3],同时,已严重影响到我们赖以生存的作物发育及产量。因此,研究作物耐盐性、选育耐盐新品种已势在必行[1]。对小麦[4]、水稻[5]、玉米[6]、马铃薯[7]、白榆[8]、甜菜[9]等耐(抗)盐性生理生化及发育方面的研究均证实植物保护酶活性和发育与植物的抗盐性有一定的关系。但用于评价植物耐盐性的指标不完全一致[10],因此,筛选适宜指标对植物耐盐性进行有效评价并能应用于生产尤为重要。【前人研究进展】马铃薯(SolanumtuberosumL.)是世界性的粮菜兼用作物,所面临的一个重要难题便是盐碱地的问题。盐渍化土壤显著影响马铃薯的生长发育,特别是对其苗有抑制作用[11]。马铃薯是耐盐作物中对盐中度敏感作物之一[12],盐胁迫影响马铃薯生长发育及生理特性[13]。盐碱土壤和盐水灌溉对马铃薯的产量具有一定影响[14]。一般认为,对作物危害最大的无机盐是钠盐,即使是50 mM NaCl对于耐盐性较强的水稻也是致死的[15]。龚家栋[16]认为马铃薯耐盐极限值还无法定论。【本研究切入点】近年来,随着马铃薯组织培养技术的发展,选用试管苗为试验材料可克服外界环境条件难控性,且材料性状能在相对一致的条件下得到表达。【拟解决的关键问题】试管苗是研究发育中马铃薯块茎生理的适宜模式系统[17]。利用该系统,前人报道的关于盐胁迫下马铃薯脱毒苗试管苗生长发育特性及保护酶活性研究相对较多[2,17-22],而将二者结合起来,利用两因素随机区组设计,研究马铃薯脱毒苗对NaCl 胁迫的响应,并进一步通过主成份分析筛选马铃薯耐(抗)盐指标,从而评价马铃薯品种的耐盐性尚未见文献报道。此实验为开展早期抗盐品种筛选提供技术支持,为后期筛选抗盐品种和盐碱地上推广种植提供理论参考。
1 材料与方法
1.1 材料
克新1号(Kexin 1),大西洋(Atlantic),青薯168(Qingshu168),脱毒基础苗由北方民族大学生物科学与工程学院细胞生物学实验室提供。
1.2 试验方法
1.2.1 试验设计 试验采用两因素随机设计,因素1为品种,分3个品种:大西洋、克新1号、青薯168;因素2为NaCl盐浓度,分5种浓度处理: 0 (CK)、17、34、102、136 mmol·L-1,试验重复3次,共15个处理,每个处理接种10瓶,均于培养30 d时供生理指标和主要农艺指标测定。
1.2.2 组织培养方法 将继代培养的脱毒苗按单节茎切段转移到MS培养基中进行培养。培养基组成为MS+各盐浓度。培养瓶直径为6.5 cm,内装40 mL胁迫培养基,接种量25株/瓶。
1.2.3 培养条件 参照曹君迈的实验方法进行[23]。
1.3 农艺性状测定
培养30 d时从各瓶中取出25株马铃薯幼苗洗净,分别使用直尺以及游标卡尺分别测定马铃薯幼苗的株高、茎粗及叶片数,使用数据记录表格记录相关数据。
1.4 生化指标的测定
CAT活性采用紫外吸收法[24]。POD活性的采用愈创木酚[24]法。电导率 (Electrical Conductivity)的测定采用外渗电导法[19]。脯氨酸含量的测定采用茚三酮法[24]。
1.5 数据分析
用Microsoft ExceL2003进行数据处理并计算标准误差(±SD)。SPSS17.0统计软件进行方差分析、Duncan’s新复极差差异显著性检验,对调查的各性状指标的均值输入此软件,进行主成分分析。绘图采用SigmaPlot12.0进行。
2 结果与分析
2.1 NaCl胁迫对3个品种脱毒苗生理指标的影响
2.1.1 NaCl胁迫对3个品种脱毒苗中CAT活性的影响 由表1可知,盐胁迫对3个马铃薯品种脱毒苗CAT活性的影响规律基本一致(P<0.05)。随着盐浓度的升高首先表现出34 mmol·L-1的盐浓度处理的脱毒苗CAT活性升高,其他处理降低,其中大西洋和克新1号降低幅度较大,而青薯168中CAT活性降低幅度较小。克新1号品种脱毒苗在34 mmol·L-1盐浓度时,活性显著高于对照处理(CK),表现出较好的应激反应,但随着盐浓度的增高,其他3个处理的盐浓度CAT活性均低于CK,其应激能力下降,耐盐程度为68 mmol·L-1。大西洋品种也表现出相同的规律,只是34 mmol·L-1盐浓度处理的脱毒苗CAT活性与CK无显著差异,而与其他处理达显著水平,耐盐程度为68 mmol·L-1。青薯168苗子生长弱在34 mmol·L-1盐浓度处理时,表现临界反应,CK与34 mmol·L-1处理之间无显著差异,但与其余各处理之间达显著水平,耐盐的程度为68 mmol·L-1。因此,无论哪个品种,34 mmol·L-1盐浓度处理,CAT活性增高或保持未处理盐浓度水平,随后下降。68 mmol·L-1处理CAT急剧下降,清除自由氧基的能力下降,耐盐能力下降。

表1 盐浓度对马铃薯脱毒苗CAT 活性的影响
注:同列标不同字母者为差异显著(P<0.05),下同。
Note: Means with different small letters in same column means significance at 0.05 level. The same as below.
2.1.2 NaCl胁迫下3个品种中POD活性变化 从表2可知,盐胁迫对3个马铃薯品种脱毒苗POD均有影响,在34 mmol·L-1盐浓度处理时,克新1号和大西洋马铃薯中的POD活性升高,而青薯168 POD活性降低;随后,另外几个盐浓度处理3个品种均随着盐浓度的升高,POD活性表现出降低的趋势。从克新1号品种来看,17、68 mmol·L-1盐浓度处理的脱毒苗POD活性无显著差异,却显著高于0、136;102、136 mmol·L-1之间存在显著差异,68、102 mmol·L-1盐浓度处理之间无显著差异,但它们与对照处理之间存在显著差异,136 mmol·L-1时POD活性显著低于0处理,耐受盐程度为102 mmol·L-1。从大西洋品种来看,盐浓度各处理之间均存在显著差异,POD活性顺序为34 mmol·L-1>68 mmol·L-1>0>102 mmol·L-1>136 mmol·L-1,102 mmol·L-1时POD活性显著低于0处理,POD活性出下降,耐受盐程度为68 mmol·L-1。青薯168对照处理POD活性显著高于其他处理,34 mmol·L-1有高于其他3个处理,能耐受盐的的程度为34 mmol·L-1。因此,克新1号耐盐性强于大西洋,大西洋强于青薯168。
2.1.3 NaCl胁迫下3品种EC的变化 如表3所示,3个品种不同盐浓度处理对EC影响表现出相同的规律,随着盐浓度增加,EC不断增加。3个品种不同盐浓度各处理之间存在显著差异,说明随着盐浓度处理增大,脱毒苗的细胞膜渗透率加大,随着盐浓度的增加对叶片质膜造成了伤害,盐浓度超过102 mmol·L-1时,已高达68 %以上,严重影响了马铃薯脱毒苗的生长,136 mmol·L-1时,影响到马铃薯脱毒苗的存活。马铃薯能耐受盐的的程度为68 mmol·L-1。
2.1.4 NaCI胁迫下马铃薯脱毒苗叶片脯氨酸含量的变化 从表4可知,随着盐浓度的增加,脯氨酸含量逐渐升高。克新1号和大西洋,在盐浓度为136 mmol·L-1时,脯氨酸含量显著高于对照处理,与其它盐浓度处理之间无显著差异。青薯168各浓度的盐胁迫处理之间不显著。
2.1.5 不同品种脱毒苗盐处理后对CAT、POD、脯氨酸、和EC的影响 从3个品种来看,青薯168 CAT活性显著高于克新1号和大西洋,但后二者之间无显著差异(图1-A),然而,青薯168CAT活性在盐0处理时就高与其它2个品种,随着盐浓度的升高,反而降低(表1),说明青薯168清除自由氧基的能力弱于克新1号和大西洋;POD活性3个品种之间存在显著差异,克新1号显著高于大西洋,大西洋显著高于青薯168(图1-B),说明3个品种的抗逆性强克新1号>大西洋>青薯168;脯氨酸含量3个品种之间存在显著差异,克新1号与大西洋之间无显著差异,但于青薯168之间有显著差异(图1-C),说明青薯168抗逆性能力弱于克新1号和大西洋;EC 3个品种之间有显著差异,EC青薯168>大西洋>克新1号,说明3个品种的细胞膜透性,青薯168>大西洋>克新1号(图1-D)。总之,盐胁迫下,由于品种不同保护酶系统的平衡能力不同,从综合指标来看,克新1号反应平衡能力>大西洋>青薯168。
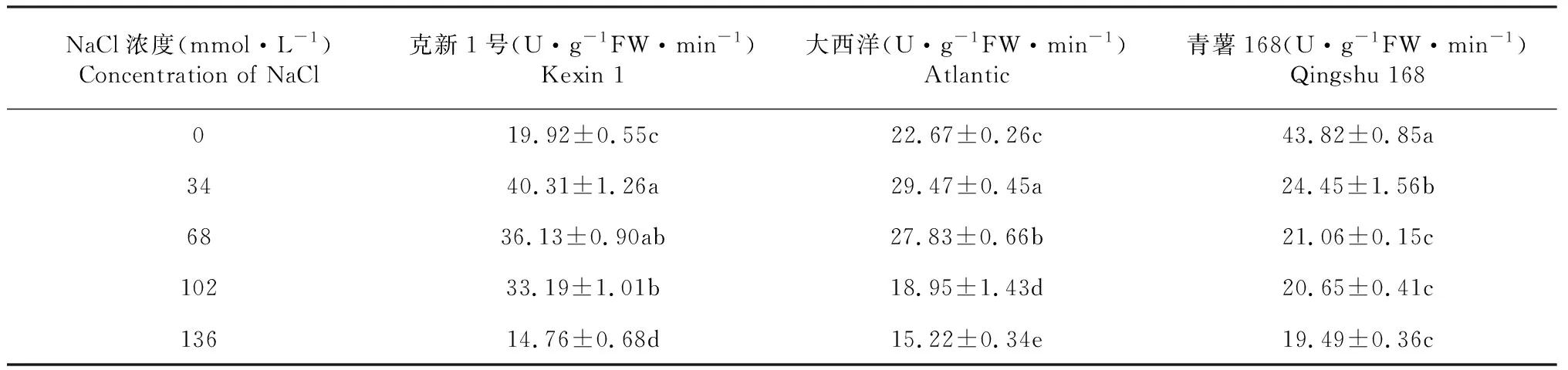
表2 盐浓度对马铃薯脱毒苗POD活性的影响

表3 盐浓度对马铃薯脱毒苗EC的影响
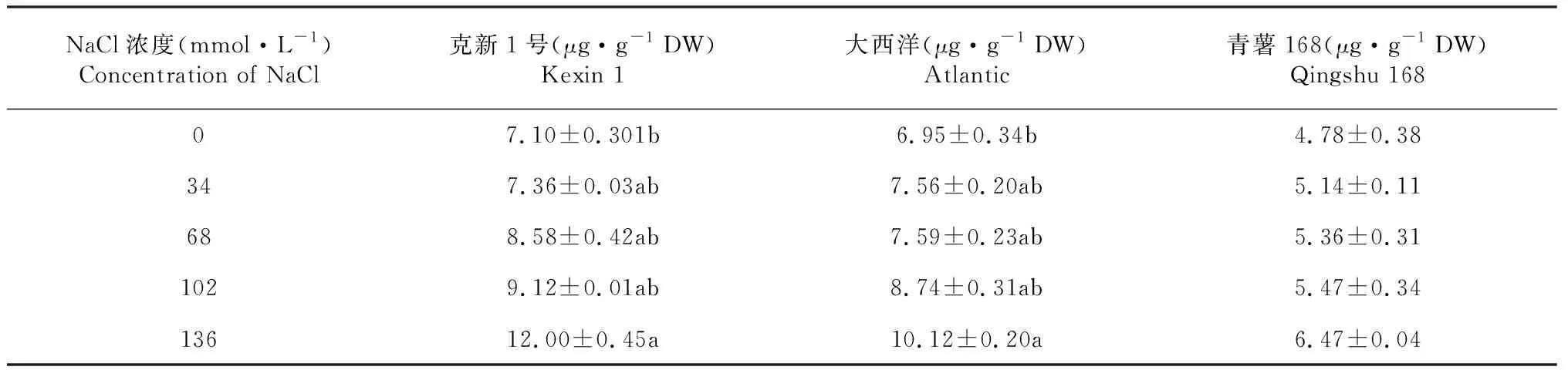
表4 盐胁迫对马铃薯脱毒苗叶片脯氨酸含量的影响
2.2 NaCl胁迫对不同马铃薯品种农艺性状的影响
由图2-A可以看出,不同盐浓度处理对株高有显著的影响(P<0.05),随着盐浓度的增加,株高显著降低。无NaCl处理的3个品种株高最高,但由于品种的遗传特性不同,株高出现差异,克新1号高于大西洋,大西洋高于青薯168。随着盐浓度的增加,株高降低。克新1号和大西洋株高随盐浓度上升则迅速下降,青薯168下降缓慢,最后株高均达到3cm左右。盐胁迫抑制了3个品种的增高。
由图2-B可知,不同盐浓度处理对茎粗有显著的影响(P<0.05),随着盐浓度的增加,茎粗显著增加。无NaCl处理的3个品种茎粗最低。盐浓度136 mmol·L-1处理时,各品种茎粗达到最大。由于品种的遗传特性不同,其茎粗产生差异,大西洋茎粗最粗,其次为克新1号,最差为青薯168。盐胁迫在本试验浓度范围内有利于茎粗的增加。
由图2-C可知,不同盐浓度处理对叶片数有显著的影响(P<0.05),随着盐浓度的增加,叶片数显著减少。无NaCl处理的3个品种叶片数最多,叶片数最高达到大西洋10片,最低大西洋5片,但由于品种的遗传特性不同,其叶片数有一定差异,大西洋高于克新1号,克新1号高于青薯168。随着盐浓度的增加,叶片数降低。克新1号和大西洋株高随盐浓度上升则下降幅度较快,青薯168(3片)下降缓慢,叶片数最后均达3片左右。盐胁迫抑制了3个品种叶片数的增加。
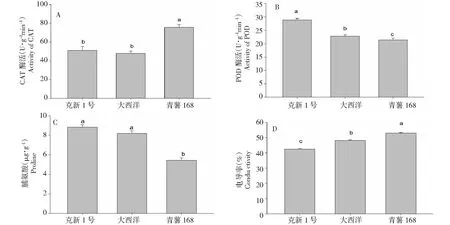
图1 品种对马铃薯脱毒苗CAT、POD、MDA 和 EC的影响Fig.1 Effects of different varieties of potato virus-free seedlings under salt stress on CAT, POD, proline and EC
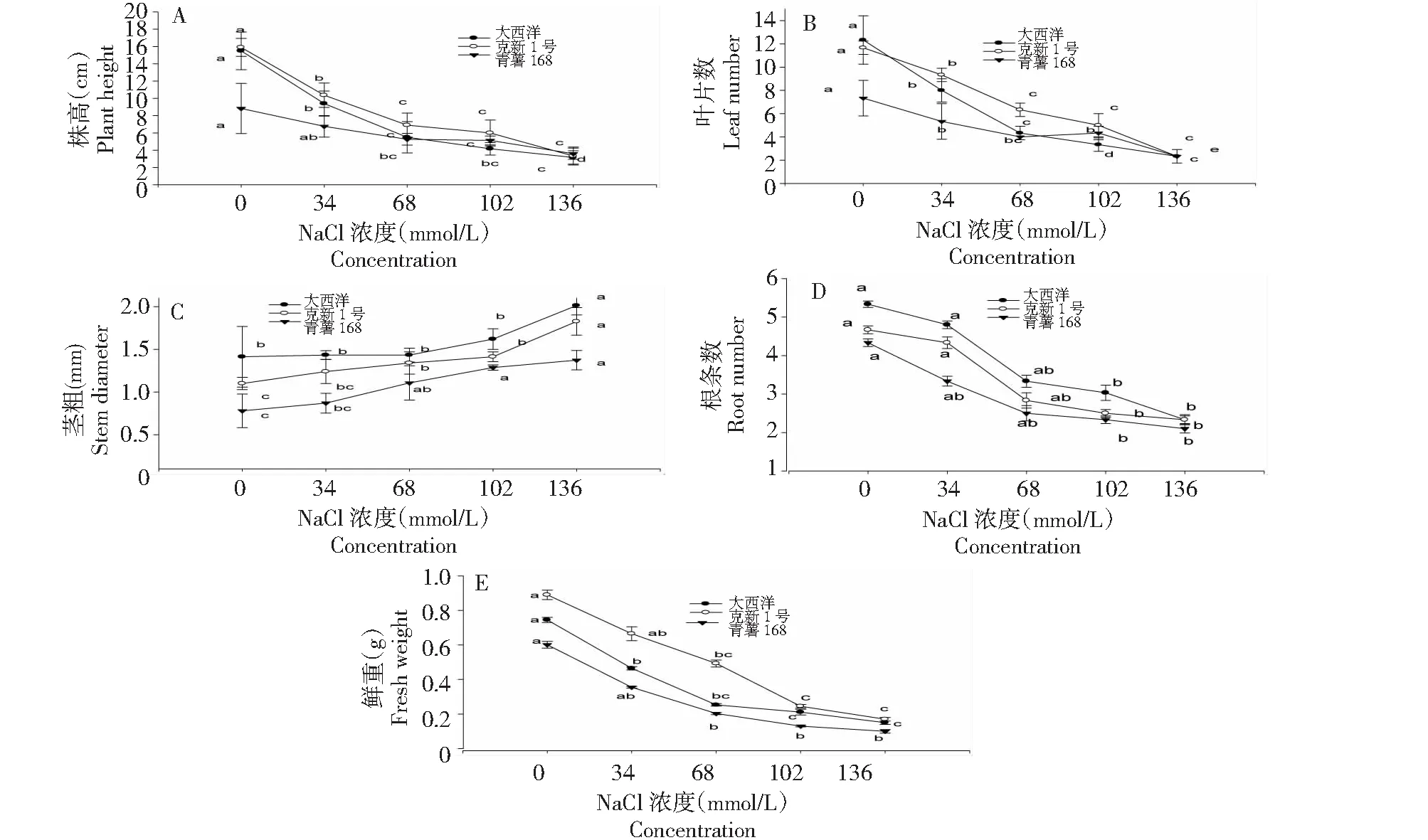
图2 盐浓度对马铃薯品种农艺性状的影响Fig.2 Effects of salt concentration on agronomic propertiesties of virus-free shoots of potato
由图2-D可知,不同盐浓度处理对根条数有显著的影响(P<0.05),随着盐浓度的增加,根条数显著减少。无NaCl处理的3个品种根条数最多,根条数最高的克新1号,最低是青薯168,由于品种不同,根条数有一定差异。3个品种无NaCl处理的根条数均显著高于102和136 mmol·L-1盐浓度处理的,68 mmol·L-1盐浓度处理的与以上浓度处理均无显著差异,除青薯168外,其余2个品种34 mmol·L-1盐浓度处理与无NaCl处理结果相同。盐胁迫抑制了3个品种的根条数的增加。
由图2-E可知,不同盐浓度处理对鲜重有显著的影响(P<0.05),随着盐浓度的增加,鲜重显著减少。无NaCl处理的3个品种鲜重最高,鲜重最高的克新1号,最低是青薯168,由于品种不同,鲜重有一定差异。3个品种无NaCl处理的鲜重均显著高于68、102和136 mmol·L-1盐浓度处理的,后三者之间无显著差异,34 mmol·L-1盐浓度处理的与以上浓度处理均无显著差异,盐胁迫抑制了3个品种鲜重的增加。
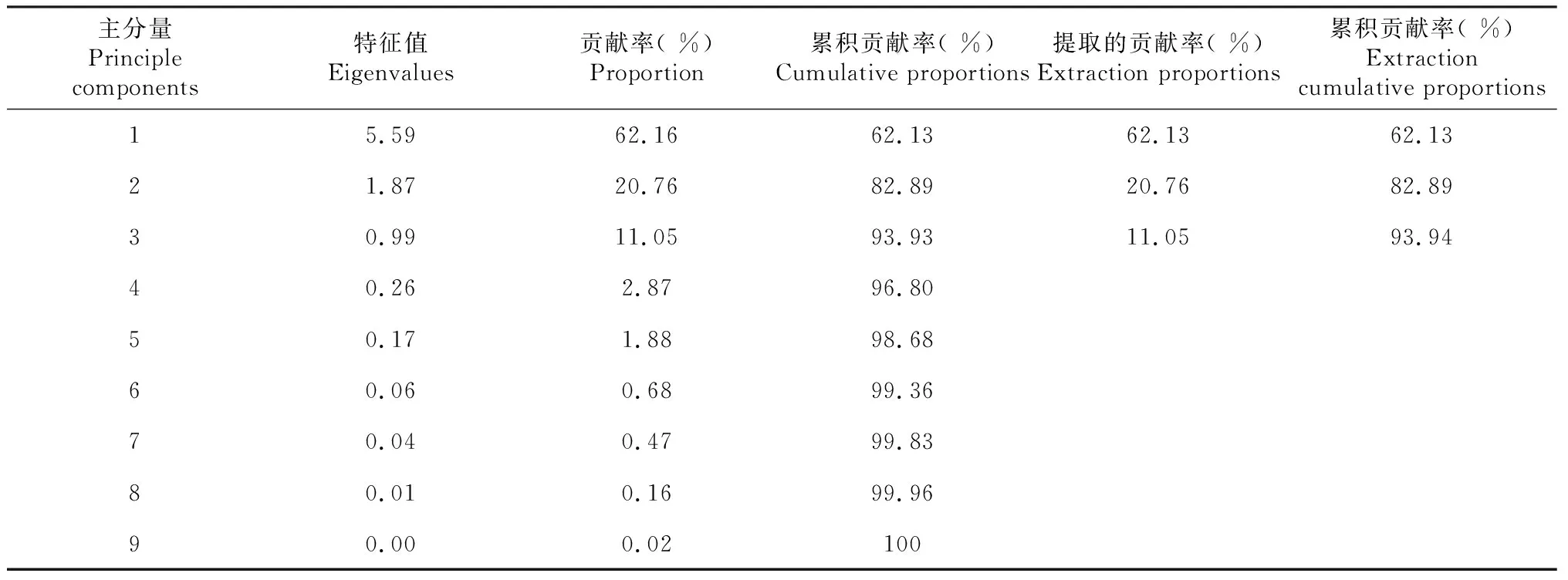
表5 特征值和累积贡献率
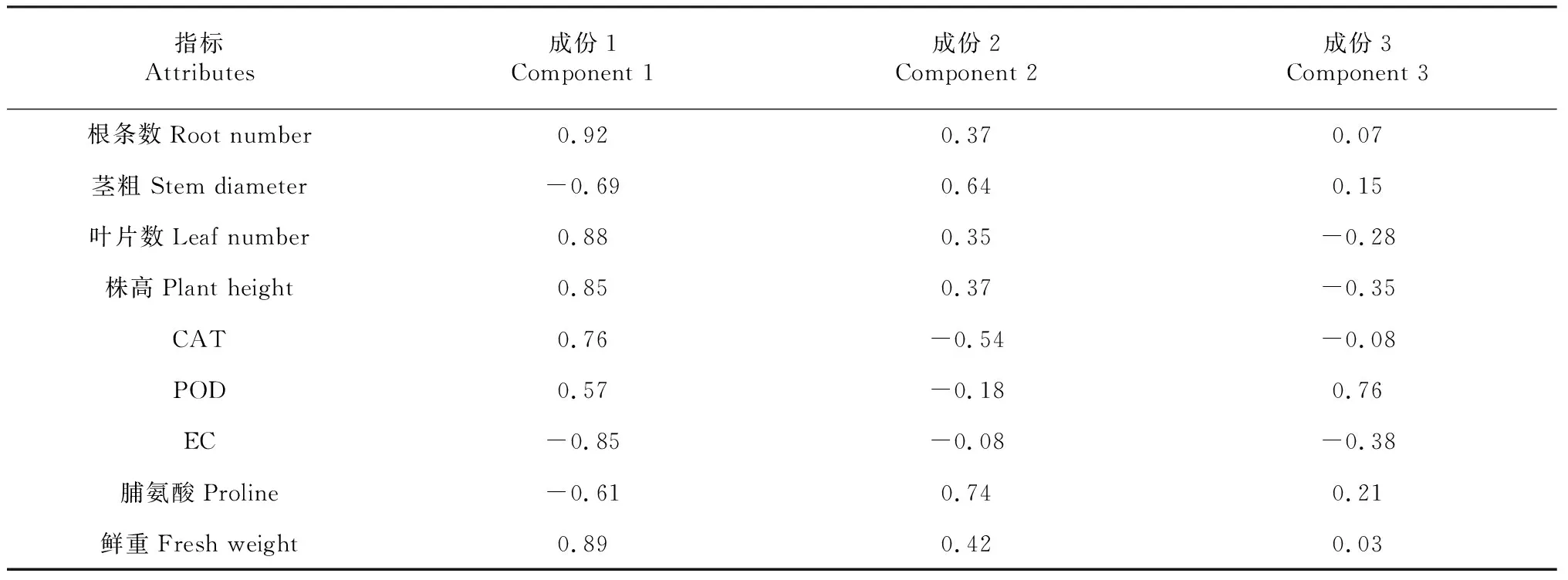
表6 初始因子载荷矩阵
因此,随着盐浓度的增加,马铃薯株高降低、茎粗增加、根条数、叶片数、鲜重减少,马铃薯脱毒苗生长受到显著抑制;且克新1号、大西洋较青薯168耐盐。
2.3 不同浓度盐胁迫和不同品种的生化及农艺性状指标的主成分分析
由表5可知, 本实验有9个成份,按方差贡献率的大小把各特征值提取了第1主成份、第2主成份、第3主成份,3个主成份的累积贡献率为93.93 %>85 %,因而本实验有3个主成份,其余特征值的意义不明确,不能使用。那么9个指标成份变成了3个新的指标成份,第1个是根条数主成份,第2个是茎粗主成份,第3个是叶片数主成份,这3个主成份互不相干,但又反应了原来多指标的信息。
表6是将输入的各指标原始数据经统计软件进行了无量纲化处理,并对提取的成份进行了矩阵,所得的结果,即初始因子载荷矩阵。
对主成份的特征值开方,得特征根。用初始因子载荷矩阵值除以相对应的主成份特征根,便得到特征根的特征向量,见表6。
由表7特征根的特征向量,构成了原来多指标的线性组合。
设第1主成份根条数为y1、第2主成份为茎粗y2、第3主成份为叶片数y3,则y1=0.16x1-0.29x2+......+0.38x9;在y1的线性组合中,x1根条数的系数较小外,其次是除EC几个生理指标,但茎粗和EC的符号为负。盐胁迫首先直接作用的植物器官就是根,它即影响植物根形态的建成,又影响其他器官的形成,要想增加根条数,就得提高作物产量、叶片数和株高,降低EC,所以选用抗耐盐品种,农艺性状指标是关键。y2=0.27x1+0.15x2+......+0.30x9,y2,茎粗除脯氨酸影响最大外,其余3个生化指标符号均为负。要想增加茎粗,就得提高茎粗、株高、叶片数、脯氨酸,降低POD、EC、CAT。y3=0.07x1+0.58x2+......+0.03x9,叶片数主成份以POD、EC、鲜重、株高、叶片数影响最大,要想增加叶片数,就得增加株高和POD,降低EC。通过表7可以看出,EC值对3个主成份影响稳定,均表现为负值,也就是说电导率越大,品种的抗逆性下降。从3个主成份包涵的信息分析,抗盐性的强弱,取决于叶片数、株高的长势优劣及EC值的降低。
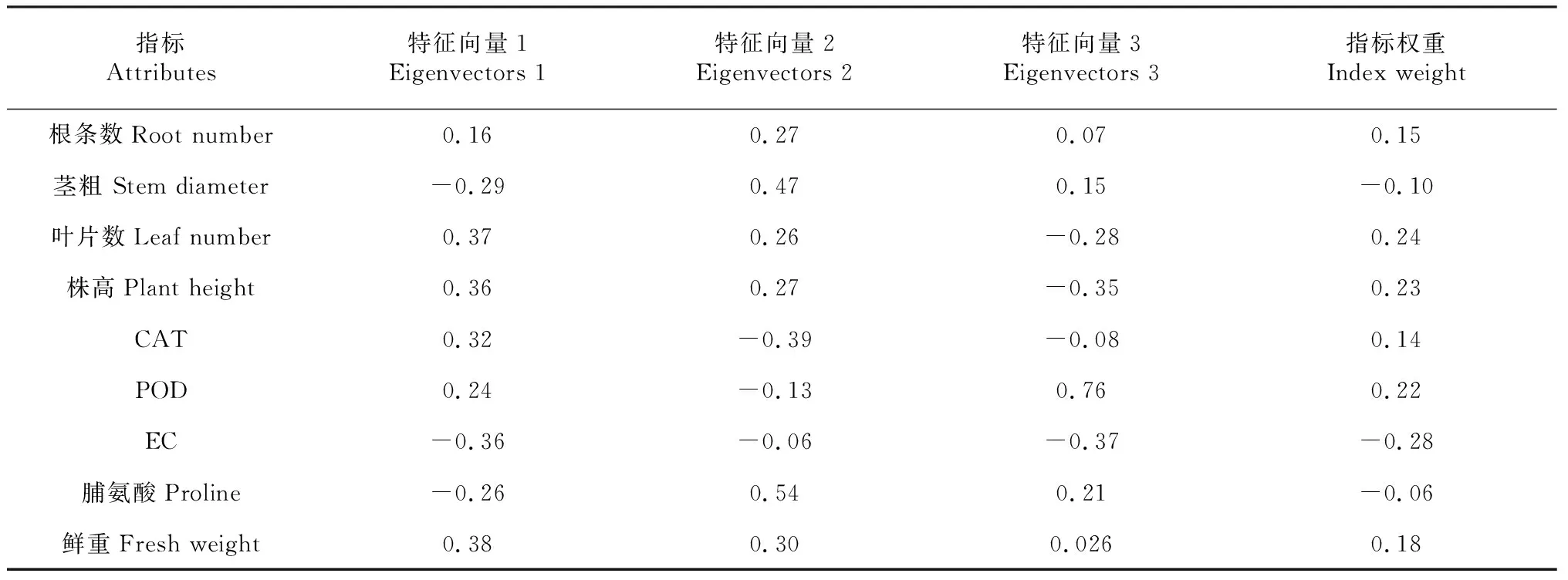
表7 特征向量及指标权重

表8 NaCl处理和不同品种综合得分
指标权重=[(特征根的特征向量×对应提取方差贡献率)÷累积贡献率]÷∑[(特征根的特征向量×对应提取方差贡献率)÷累积贡献率]。在盐胁迫下,电导率、叶片数、株高和POD指标权重最大,分别为:0.28、0.24、0.23和0.22。POD测定较为繁琐,在实际应用中不宜操作可淘汰。电导率、叶片数、株高可作为筛选鉴定马铃薯耐盐性品种的有效指标。
将各指标值乘相应的指标权重系数,得不同品种不同盐浓度综合得分,同时将不相同品种的不同盐浓度综合相加得品种的综合得分。由表8可知,综合得分顺序克新1号>大西洋>青薯168。克新1号、大西洋品种在34 mmol·L-1胁迫时得分超过0处理,说明机体活力加强,该品种有一定的耐盐性,青薯168得分略低于0处理,随着盐浓度的增加得分持续下降,抗盐能力下降,耐盐能力较差。由此说明马铃薯脱毒苗克新1号的、大西洋耐盐值为68 mmol·L-1,青薯168耐盐值为34 mmol·L-1。
3 讨 论
马铃薯的耐盐基因是受多效基因控制的数量性状遗传,通过转基因技术创造耐盐品种困难大,离实际应用相差甚远[25],耐盐品种筛选就成为解决此问题的有效方法。但用于评价植物耐盐性的指标不完全一致。龚家栋[16]认为可用直线回归方程的截距大小来确定各品种耐盐性;王新伟[26]、张景云[30]认为马铃薯试管苗的生长和生物学产量指标可以用来评价其耐盐性。张俊莲[10]认为植株生长高度是较存活率灵敏的马铃薯盐逆境反应指标。本实验随着盐浓度的增加,马铃薯株高降低、茎粗增加、根条数、叶片数、鲜重减少,马铃薯脱毒苗生长受到显著抑制,与众多学者的结果相一致[10,17,20]。盐胁迫改变了植株的形态,抑制了其生长发育,是判断耐盐性的重要指标。
盐胁迫使植物体内的活性氧增加,代谢产物增加,细胞膜功能发生改变甚至破坏。自1975年Fridovich[27]提出生物自由基伤害学说以来,多数学者从能清除植株体内积累的活性氧及自由基的POD、SOD和CAT保护酶及代谢产物MDA,脯氨酸等入手,研究在逆境条件下的变化规律和防御机制。 通过大量的实验表明,生理生化指标可以评价植物耐盐性[10],但有些学者认为利用生理生化指标鉴定马铃薯的耐盐性的过程操作复杂,鉴定结果波动性大,利用效果不佳[28]。本实验表明马铃薯在能耐受盐胁迫的条件下,POD和CAT活性迅速提高,以清除植物体内大量的自由氧基,维持细胞膜的稳定性。克新1号和大西洋在34 mmol·L-1盐胁迫时,POD、CAT和脯氨酸呈上升趋势,与前人的研究结果一致。而青薯168的POD、CAT活性开始下降,因品种的抗盐能力不同而表现不同,与前人的研究结果不同[2,17,21]。孙晓光[19]认为在马铃薯研究中,SOD波动性大,规律性不强,本实验未涉及此指标。3个品种的脯氨酸含量随着盐浓度的增加而增加,随盐浓度的升高而升高与张景云[30],张俊莲[10]的结果一致。但作为植物细胞渗透调节剂的脯氨酸含量增加,并不能说明该品种的抗盐能力,它受测定时间等因素的影响[10]。而张俊莲当盐度超过马铃薯的耐受力时,脯氨酸含量的高低就无意义了[22]。
过量的盐浓度盐胁迫对马铃薯造成了盐害,使马铃薯脱毒苗自由基代谢失衡,活性氧下降,电导率增加,细胞膜的通透性增加,与孙晓光[19]、张瑞久[18]、崔焱森[22]表现出相同的变化规律。电解质外渗率的高低可以反映出细胞膜受损的状态,相对电导度可作为鉴定马铃薯耐盐性强弱的指标[17]。
Chauhan[29]等认为马铃薯的耐盐极限为4.0 ds/m,龚家栋[16]认为马铃薯耐盐极限值还无法定论。马铃薯商品薯的生产要经历不同种级的种薯繁育阶段,才能进入大田生产。因此不同生长发育阶段其耐盐能力不同,最脆弱的阶段就是幼苗阶段,对幼苗有显著抑制作用[13]。而以脱毒幼苗为实验体系时,其耐盐能力更低,多数学者认为,NaCl 的临界胁迫浓度为 70 mmol/L左右[17,19-22],本实验通过主成份分析马铃薯脱毒苗克新1号、大西洋耐盐值为68 mmol·L-1,与前人结果基本一致,但青薯168耐盐值为34 mmol·L-1,与前人不同,因此,其值还受品种的影响。
纵观前人实验,虽然都测定了农艺性状指标和生化指标,也表现出一定的规律,但指标繁多,无法科学取舍,因此,本实验把众多的指标利用主成份分析法,使各指标失去量纲,能在同一尺度下进行综合评价,筛选出电导率、叶片数、株高可作为耐盐品种筛选的评价指标。

