银杏花粉黄酮苷的恶味乳杆菌B2生物转化产物及其抗氧化活性评价
裘纪莹,魏朝治,2,陈相艳,杨金玉,张 翔,陈蕾蕾,王易芬,*,李大鹏*
(1.山东省农业科学院农产品研究所,山东省农产品精深加工技术重点实验室,农业部新食品资源加工重点实验室,山东 济南 250100;2.山东农业大学食品科学与工程学院,山东 泰安 271018)
银杏花粉是银杏雄株的花粉,其主要活性成分为黄酮类化合物[1-2]。银杏花粉总黄酮含量约为21.40 mg/g[3],远高于油菜蜂花粉(14.306 mg/g)、玉米蜂花粉(5.445 mg/g)、苹果蜂花粉(8.462 mg/g)等蜂花粉产品[4]。银杏花粉黄酮主要以黄酮-O-糖苷的形式存在,其中黄酮苷元主要为山柰酚以及少量的槲皮素和异鼠李素,山柰酚约占3 种苷元总量的96.71%,其连接的糖主要为D-葡萄糖、L-鼠李糖或者两者的结合,并且多与黄酮苷元的3、7、4’位羟基相连[5]。
癌症、糖尿病、心脑血管疾病、老年痴呆症等疾病是目前人类的多发病,这些疾病的发生都与由自由基引起的氧化损伤有关[6]。黄酮类化合物是一种良好的天然来源抗氧化剂,广泛存在于植物界,尤其是中药材中,能够直接清除体内自由基、螯合金属离子、促进抗氧化因子再生和提高抗氧化酶的水平等,因而备受关注[7-9]。同时,其抗氧化活性与结构有着很大的关系,如羟基数目与位置、双键位置、糖苷键结构等[10]。
生物转化技术是近年来发展起来的,可以通过改变黄酮类化合物的化学结构从而改变其物理化学性质、提高其生物利用率和功能活性的方法。研究证实,通过生物转化,黄酮糖苷可被转化为苷元,更易被人体吸收利用,而且黄酮苷元清除人体自由基的活性明显优于黄酮糖苷[11-13]。本研究在前期筛选到一株生物转化银杏花粉黄酮苷菌株——恶味乳杆菌B2(Lacbacillus perolens B2)的基础上,研究其生物转化对银杏花粉黄酮组分及其体外2,2’-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)(2-2’-azino-bis-(3-ethyl-benzthia-zoline-6-sulfonic acid),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力和减缓由于H2O2损伤引起的小鼠巨噬细胞RAW264.7凋亡的影响,以期为深入利用银杏花粉资源、开发高活性抗氧化产品提供理论依据。
1 材料与方法
1.1 材料与试剂
银杏花粉采自山东郯城,干燥过100 目筛;L. perolens B2由山东省农业科学院农产品研究所食品微生物实验室从手工泡菜中分离,经过菌株鉴定并冻存保种;RAW264.7细胞购于美国模式菌种收集中心细胞库,冻存保种。
ABTS、DPPH、二甲基亚砜(dimethyl sulfoxide,DMSO)、噻唑蓝(methyl thiazolyl tetrazolium,MTT)美国Sigma公司;胎牛血清(fetal bovine serum,FBS)浙江天杭生物科技有限公司;DMEM细胞培养基 美国Gibco公司;甲醇、石油醚、乙酸乙酯、正丁醇等均为国产分析纯。
1.2 仪器与设备
NE-1001型旋转蒸发仪 日本东京理化器械株式会社;6132型核酸蛋白测定仪 德国Eppendorf公司;MK3型酶标仪 上海热电仪器有限公司;UV-160型紫外-可见分光光度计 日本岛津公司;HF90型CO2培养箱 上海力申科学仪器有限公司;TE2000倒置相差显微镜 日本尼康公司;1260型高效液相色谱仪 美国安捷伦公司。
1.3 方法
1.3.1 银杏花粉黄酮苷的生物转化
L. perolens B2接种于MRS肉汤培养基,37 ℃培养24 h,混匀并取一环于MRS平皿划线,37 ℃培养24 h,挑单菌落复划线于MRS平皿,传代2 次即为活化菌株。活化后的菌株取一环接种于5 mL MRS肉汤培养基,37 ℃培养24 h,调整菌液OD600nm为0.4,即为种子液。
1 kg银杏花粉加4 L去离子水,混匀后于121 ℃灭菌20 min。按2%的接种量接种种子液,混匀后于37 ℃培养箱静置培养72 h,所得发酵培养物即为转化产物。
1.3.2 银杏花粉及其转化产物的提取物及萃取物制备
银杏花粉原料及其生物转化产物分别以加热回流提取,具体条件为:乙醇体积分数70%,料液比1∶10,提取温度75 ℃,提取时间2 h,提取3 次。最后合并滤液,减压浓缩,并冷冻干燥,得到银杏花粉提取物(c-1)和转化产物提取物(c-2)。提取物加水重悬,石油醚与水1∶1(V/V)萃取3 次,上层石油醚相减压浓缩,冻干,得到银杏花粉石油醚萃取物(p-1)和转化产物石油醚萃取物(p-2)。下层水相依次加乙酸乙酯、正丁醇1∶1(V/V)萃取3 次,减压浓缩,冻干,分别得到银杏花粉乙酸乙酯萃取物(e-1)和正丁醇萃取物(n-1),以及转化产物乙酸乙酯萃取物(e-2)和正丁醇萃取物(n-2)。
1.3.3 提取物及萃取物的高效液相色谱检测
采用1260型高效液相色谱仪进行检测,配置二极管阵列检测器,具体操作及参数见文献[5],同一保留时间峰面积越大表示含量越高。
1.3.4 ABTS+·清除能力
参考文献[14-15]的方法并稍作修改。待测样品采用100%甲醇溶解并定容至2 mg/mL,其中p-1和p-2样品定容至4 mg/mL,并稀释制成不同质量浓度的待测液。以山柰酚为对照,测定c-1、c-2、p-1、p-2、e-1、e-2、n-1和n-2样品的ABTS+·清除能力。具体操作为:将7 mmol/L ABTS水溶液与2.45 mmol/L过硫酸钾溶液等体积混合,室温下避光反应16 h,使用前用无水乙醇稀释,在734 nm波长处测定吸光度,调整混合液的吸光度为0.80±0.05,制成ABTS工作液。将10 μL不同质量浓度的供试品溶液加入96 孔板,然后每孔快速加入290 μL ABTS工作液,轻微振荡混匀,立刻于黑暗中常温反应15 min,测定实验组在734 nm波长处的吸光度。以无水乙醇代替样品测定空白组吸光度,以无水乙醇代替ABTS工作液测定背景组吸光度。ABTS+·清除率按公式(1)计算。

式中:A1表示实验组吸光度;A0表示空白组吸光度;AB表示背景组吸光度。
根据测定的清除率计算半抑制浓度(half maximal inhibitory concentration,IC50)以比较样品之间ABTS+·清除能力。
1.3.5 DPPH自由基清除能力
待测样品采用100%甲醇溶解并定容至2 mg/mL,其中p-1和p-2样品定容至4 mg/mL,并稀释制成不同质量浓度待测液。以山柰酚为对照,测定c-1、c-2、p-1、p-2、e-1、e-2、n-1和n-2样品的DPPH自由基清除能力。具体操作为:称取一定量的DPPH用纯甲醇溶解并定容至终浓度100 μmol/L,4 ℃避光保存。DPPH自由基清除率的测定和计算方法参考文献[2]。将不同质量浓度的样品溶液与DPPH溶液等体积混合,室温下避光静置30 min后测定实验组在517 nm波长处的吸光度,测定DPPH溶液与无水甲醇等体积混合的空白组吸光度,以及对应样品溶液与无水甲醇等体积混合的背景组吸光度。DPPH自由基清除率按公式(2)计算。

式中:A1表示实验组吸光度;A0表示空白组吸光度;AB表示背景组吸光度。
根据测定的清除率计算IC50以比较样品之间DPPH自由基清除能力。
1.3.6 对H2O2损伤RAW264.7细胞的保护作用
1.3.6.1 细胞培养
RAW264.7细胞生长于含10%胎牛血清的培养液中,37 ℃、5% CO2环境下传代培养,实验用细胞为30 代内。实验时取对数生长期细胞接种于96 孔板,调整每孔细胞数约为6×104个。96 孔板于37 ℃、5% CO2下培养12 h使细胞贴壁,移去培养基,磷酸盐缓冲液清洗1 次,用于下一步实验。
1.3.6.2 H2O2损伤模型的建立
H2O2损伤模型的建立按照文献[16]的方法并稍作修改。已接种RAW264.7细胞的96 孔板中加入100 μL含有不同浓度(0.1、0.2、0.3、0.4、0.5、1.0 mmol/L)H2O2溶液的培养基,每个样品做4 个复孔。以加入100 μL DMEM培养基的孔为空白组,37 ℃、5% CO2下培养24 h。每孔加入10 µL 5 mg/mL MTT溶液,继续培养4 h。弃上清液,加入150 µL DMSO,轻轻振荡使紫色结晶溶解,室温反应10 min后用酶标仪于490 nm波长处测定OD值。细胞抑制率按公式(3)计算。

式中:OD1表示实验组OD值;OD0表示空白组OD值。
1.3.6.3 银杏花粉样品质量浓度的筛选
待测样品采用DMSO溶解并定容至2 mg/mL,并用DMSO进一步稀释制成不同质量浓度待测液。在已接种RAW264.7细胞的96 孔板中加入100 μL含有不同质量浓度(10、20、30、40、50、100 µg/mL)c-1、c-2、e-1、e-2样品的培养基,每个样品做4 个复孔。以加入100 μL DMEM培养基的孔为空白组,37 ℃、5% CO2下培养24 h。每孔加入10 µL 5 mg/mL MTT溶液,继续培养4 h。弃上清液,加入150 µL DMSO,轻轻振荡使紫色结晶溶解,室温反应10 min后用酶标仪于490 nm波长处测定OD值,并按公式(3)计算细胞抑制率。
1.3.6.4 银杏花粉样品对H2O2损伤RAW264.7细胞的保护作用
在已接种RAW264.7细胞的96 孔板中加入100 μL含有0.2 mmol/L H2O2溶液和不同质量浓度(5、10、15 µg/mL)c-1、c-2、e-1、e-2样品的培养基,每个样品做4 个复孔。以加入100 μL DMEM培养基的孔为空白组,以加入含0.2 mmol/L H2O2的DMEM培养基的孔为损伤组,37 ℃、5% CO2下培养24 h。每孔加入10 µL 5 mg/mL MTT溶液,继续培养4 h。弃上清液,加入150 µL DMSO,轻轻振荡使紫色结晶溶解,室温反应10 min后用酶标仪于490 nm处测定OD值,并按公式(3)计算细胞抑制率。
1.4 数据统计分析
2 结果与分析
2.1 银杏花粉及其生物转化产物的提取物和萃取物制备结果
前期筛选到一株L. perolens B2可生物转化银杏花粉黄酮苷,并对其发酵条件进行了优化。采用优化后的发酵条件对银杏花粉进行发酵得到生物转化产物,对银杏花粉原料以及生物转化产物进行提取和萃取,各部位的得率如表1所示。

表1 银杏花粉及其生物转化产物的提取物和萃取物的得率Table1 Yields of the crude extract, its biotransformation product and their fractions from Ginkgo biloba pollen
从表1可知,银杏花粉通过生物转化,提取物及其各相萃取物的得率均大幅度提高。这是由于银杏花粉具有坚硬的孢壁[17],活性成分被牢牢包裹在内部,同时其被花粉内部的蛋白、多糖等其他大分子成分包裹,活性成分不容易被提取。而乳酸菌可以分泌复杂的酶系[18-20],分解孢壁中的部分成分,从而使孢壁形成孔洞,有利于活性成分的溶出。同时,乳酸菌具有分解蛋白质、多糖等大分子成分的能力,从而可以使花粉更好地释放活性成分,提高活性成分提取物的得率,因此也相应提高了各相萃取物的得率。
2.2 提取物及萃取物的高效液相色谱图分析
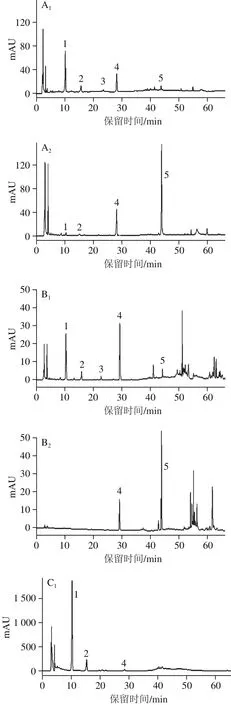

图1 银杏花粉及其生物转化产物的提取物及萃取物的高效液相色谱图Fig.1 High performance liquid chromatography of the crude extract,its biotransformation product and their fractions from G. biloba pollen
研究报道银杏花粉主要抗氧化组分为黄酮类化合物,其中含量较高的为山柰酚-3,4’-双-O-β-D-葡萄糖苷、山柰酚-3-O-β-D-葡萄糖基-7-O-α-L-鼠李糖苷、山柰酚-3-O-β-D-葡萄糖苷、山柰酚-3-O-α-L-鼠李糖苷和山柰酚,根据参考文献[5],上述黄酮类化合物分别对应图1标注的色谱峰1~5。通过比较图1A中c-1和c-2的高效液相色谱图发现,生物转化产物提取物中组分1、2、3的含量下降,其中山柰酚-3,4’-双-O-β-D-葡萄糖苷(峰1)含量明显降低,同时组分4、5含量升高,尤其是山柰酚(峰5)含量明显升高。可见,通过L. perolens B2的生物转化,银杏花粉中的组分1、2、3被转化为组分4、5。文献[21]报道乳酸菌可分泌β-D-葡萄糖苷酶,因此可能是因为筛选的L. perolens B2可分泌β-D-葡萄糖苷酶,并且酶活力较高,组分1、3通过葡萄糖苷键的断裂释放出组分5。同理,组分2可被转化为组分4,但可能L. perolens B2的α-L-鼠李糖苷酶活力较低,从而导致组分4有积累的现象。图1B为石油醚相萃取物,黄酮组分峰面积大幅降低,表明其对黄酮类化合物没有富集作用,但可萃取出提取物中的油溶性杂质。图1C为正丁醇相萃取物,n-1样品中富集了大量的组分1、2,而n-2样品中组分1、2的含量很少,表明通过生物转化,上述化合物被充分转化为其他组分。图1D为乙酸乙酯相萃取物,e-1样品中主要富集了组分4,而e-2样品中不仅富集了组分4,更富集了大量的组分5。本研究结果与文献[22-23]基本一致,由于萃取溶剂的极性不同,根据“相似相溶”原理,乙酸乙酯相萃取物中的黄酮组分主要为黄酮醇及极性较低的黄酮苷,而正丁醇相中的黄酮组分主要为极性较高的黄酮苷。
2.3 体外抗氧化活性评价

图2 银杏花粉及其生物转化产物的提取物及萃取物对ABTS+ ·(A)和DPPH自由基(B)的清除作用Fig.2 ABTS+· (A) and DPPH radical (B) scavenging activities of the crude extract, its biotransformation product and their fractions from G. biloba pollen
通过L. perolens B2的生物转化,转化产物的提取物和各相萃取物对ABTS+·和DPPH自由基的体外清除能力均有所提高(图2)。其中e-2样品对ABTS+·的清除率远高于c-1(P<0.05),同时,c-2、n-2、e-1、e-2和p-2样品对DPPH自由基的清除率均高于c-1(P<0.05),其中e-2样品的DPPH自由基清除率最高。可见,乙酸乙酯相是银杏花粉抗氧化活性物质的富集部位,这与文献[24-25]的报道一致。同时通过L. perolens B2的生物转化,银杏花粉的体外抗氧化能力得到进一步提高,但与银杏花粉中的主要黄酮苷元——山柰酚相比仍有明显差距[26]。后续采用银杏花粉及其转化产物的提取物(c-1、c-2)和乙酸乙酯相萃取物(e-1、e-2)开展进一步的细胞抗氧化研究。
2.4 对H2O2损伤RAW264.7细胞的保护作用分析
2.4.1 H2O2损伤模型构建结果
如图3所示,随着浓度的升高,H2O2对RAW264.7细胞的抑制率不断提高。与对照组相比,0.1、0.2 mmol/L的H2O2对RAW264.7细胞增殖没有显著影响(P>0.05);当浓度达到0.3 mmol/L时,H2O2对RAW264.7细胞的抑制率超过40%,对细胞增殖影响显著(P<0.05)。由于采用过低浓度的H2O2易造成操作误差,或对细胞的氧化损伤不明显,故选择0.2 mmol/L H2O2进行细胞损伤模型的构建。
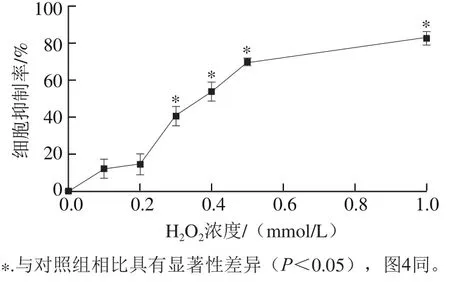
图3 H2O2对RAW264.7细胞的毒性Fig.3 Cytotoxic effects of H2O2 on RAW264.7 cells
2.4.2 银杏花粉样品的质量浓度筛选结果

图4 银杏花粉样品对RAW264.7细胞的毒性Fig.4 Cytotoxic effects of G. biloba pollen on RAW264.7 cells
由图4可知,与对照组相比,10、20 μg/mL样品对RAW264.7细胞增殖没有显著影响(P>0.05),当质量浓度达到30 μg/mL时,4 种样品对细胞增殖均具有显著的抑制作用(P<0.05)。同时,当e-2样品质量浓度为20 μg/mL时,对细胞的抑制率超过20%,表明该质量浓度的e-2样品可能具有一定的细胞毒性,故选择5、10、15 μg/mL的样品质量浓度进行后续实验。
2.4.3 银杏花粉样品对H2O2损伤RAW264.7细胞的保护作用分析

图5 银杏花粉样品对H2O2损伤RAW264.7细胞的保护作用Fig.5 Protective effects of G. biloba pollen against H2O2-induced damage in RAW264.7 cells
研究低、中、高质量浓度(5、10、15 μg/mL)的c-1、c-2、e-1和e-2样品对H2O2损伤RAW264.7细胞的保护作用,结果见图5。供试的4 个样品均可减缓由H2O2损伤导致的RAW264.7细胞凋亡,并且存在正向的剂量依赖关系,当质量浓度达到15 μg/mL时,4 个样品的保护能力都达到最强,与损伤组相比差异显著(P<0.05)。转化产物提取物及乙酸乙酯相萃取物的保护能力均强于对应银杏花粉样品,其中e-2样品的保护能力最强,当e-2样品质量浓度为15 μg/mL时,细胞抑制率为负,几乎能够完全保护RAW264.7细胞不受H2O2的损伤。
3 结 论
山柰酚具有抗氧化、抗炎、抗肿瘤、抗抑郁等众多功效[27-30],本实验证实,通过L. perolens B2的生物转化,银杏花粉中的山柰酚-3,4’-双-O-β-D-葡萄糖苷、山柰酚-3-O-β-D-葡萄糖基-7-O-α-L-鼠李糖苷、山柰酚-3-O-β-D-葡萄糖苷等主要黄酮苷被转化为以山柰酚为代表的黄酮苷元,同时提取物及各相萃取物的得率、体外抗氧化活性及对H2O2诱导损伤的RAW264.7细胞的保护作用均显著提高。其中生物转化产物的乙酸乙酯相萃取物的抗氧化活性最高,说明生物转化后的抗氧化活性成分主要为富集于乙酸乙酯相的山柰酚。本研究为银杏花粉资源的深入利用及开发高活性抗氧化产品提供了理论依据。

