野山杏果肉总有机酸对高脂血症大鼠血脂及相关基因表达的影响
阿依姑丽·艾合麦提,王妙颖,彭禛菲,冯雅丽,王小燕,古扎丽努尔·艾尼
(新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
高脂血症是常见的心血管疾病,是动脉粥样硬化等心脑血管疾病形成的一个主要危险因子[1-2]。据报道,全球每年死于心脑血管疾病的患者大约有1 200万 人。有研究表明,我国成年人中血脂异常患者已达1.6亿 人,患病率为18.6%[3],对脂质代谢紊乱性疾病的预防和治疗能够改善外周动脉的病变和心脑血管疾病的发生[4]。因此,对高脂血症的早期预防和将血脂控制于正常范围就显得十分重要。由于目前有效控制血脂的药物大多为化学药品,其有不同程度的副作用[5],而以植物为基础的非药物饮食疗法相对安全[6];因此其越来越受到重视。
新疆的伊犁和哈密地区分布着丰富的野山杏资源,因其具有良好的防风固沙作用,加上国家的相关政策扶持,其种植栽培面积不断扩大[7],目前已超过26万 km2;因此,对新疆野山杏这一特色资源的开发和利用具有重要的意义。对于野山杏果肉前期研究的结果表明,野山杏含有大量的膳食纤维、黄酮类[8-10]和丰富的有机酸类成分[11],野山杏果肉总黄酮和膳食纤维具有良好的降血脂、抗氧化和保肝作用[9-10],野山杏的总有机酸质量分数高达14.50%~27.77%,相比总黄酮(5.39%)高很多[12],并且在临床上应用野山杏果肉的水煎液治疗脂肪肝可以使病情得到一定程度的改善(可以减轻或改善76.19%的脂肪肝)[13],这些研究结果提示野山杏果肉中的总有机酸是其重要的活性成分。通过研究发现野山杏果肉总有机酸(total organic acids from wild apricot,TOAWA)在体外呈现一定的抑制过氧化脂质活性[14]以及降低高脂血症小鼠的血脂浓度和保护肝脏的作用[15]。本研究通过考察TOAWA对高脂血症大鼠血脂浓度、血清载脂蛋白(apoprotein,Apo)质量浓度及肝脏中与脂质代谢相关基因表达量的影响,探明TOAWA的降血脂机理,旨在为将TOAWA开发为降血脂的保健食品功能因子,将野山杏开发为降血脂的功能性食品原料提供科学依据。
1 材料与方法
1.1 动物、材料与试剂
总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglycerides,TG)试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)试剂盒、ApoA-I试剂盒、Apo-B试剂盒 南京建成生物工程研究所;血脂康胶囊 成都地奥九泓制药厂;717阴离子交换树脂、水合氯醛、羧甲基纤维素钠、胆固醇、胆酸盐、丙基硫氧嘧啶、1,2-丙二醇、吐温-80、无水乙醇(分析纯) 上海山浦化工有限公司;Prime Script II 1st Strand cDNA反转录酶试剂盒、SYBR Green Real Time PCR Master mix、聚合酶链式反应(polymerase chain reaction,PCR)引物 宝生物工程大连有限公司;Trizol、AL2000 DNA Marker南京钟鼎生物技术有限公司;焦碳酸二乙酯 美国Sigma公司。
野山杏(Prunus armeniaca L.)产自新疆哈密伊吾县苇子峡乡。健康雌雄各半的SD大鼠,体质量(150±20)g,由新疆医科大学实验动物中心提供,许可证号:SCXK(新)2016-0003。
1.2 仪器与设备
酶标仪 美国BIO-RAD公司;紫外-可见分光光度计日本岛津公司;涡漩混合器 海门市其林贝尔仪器制造有限公司;荧光定量PCR仪 德国Roche公司;台式高速冷冻离心机 美国BECKMAN公司;紫外透射仪、恒温水浴锅 美国Amersham Pharmacia公司;雪花状制冰机日本SANYO公司;超声波药物处理机 济宁新百特工程机械有限公司;旋转蒸发仪 上海亚荣生化仪器厂;真空抽滤泵 北京莱伯泰科仪器有限公司;电热恒温鼓风干燥箱 上海精宏实验设备有限公司;0~4 000 r/min离心沉淀器 金坛市医疗器械厂;电子天平 梅勒特托利多仪器(上海)有限公司。
1.3 方法
1.3.1 TOAWA的制备
野山杏果肉干粉用蒸馏水80 ℃回流提取两次,合并提取液,减压浓缩,浓缩液用717型强碱性阴离子交换树脂作为吸附柱,稀HCl溶液作洗脱液进行分离纯化,再用正丁醇萃取分离,减压回收正丁醇,残渣干燥即得淡棕色的总有机酸纯品,采用电位滴定法[16]测定其含量为845.4 mg/g。
1.3.2 高脂乳剂及样品溶液的制备
按文献[17]制备高脂乳剂,将总有机酸和血脂康分别用质量分数0.5%羧甲基纤维素钠溶液配成相应的质量浓度。
1.3.3 动物分组、造模与给药
SD大鼠60 只,随机分为6 组,每组10 只,雌雄各半,分为空白组、模型组、阳性组以及TOAWA低、中、高剂量组。空白组灌胃0.5%羧甲基纤维素钠溶液(10 mL/(kg·d)),其余5 组均于每天上午灌胃高脂乳剂(10 mL/(kg·d)),其中阳性组和3 个不同剂量TOAWA组均于下午在灌胃高脂乳剂的基础上,分别灌胃血脂康(0.2 g/(kg·d))和低、中、高3 个剂量(0.1、0.2、0.4 g/(kg·d))的TOAWA,实验周期60 d,为及时调整给药剂量,大鼠每5 d称体质量一次,于末次给药后禁食12 h,腹腔注射10%水合氯醛麻醉,心脏采血,分离血清用于血清生化指标的测定,脱臼处死,摘取肝脏称质量,并按下式计算肝脏指数;同时快速分离肝右小叶供制作组织切片使用,剩余的肝脏剪下1.0~1.5 g迅速用4 ℃生理盐水洗净置于液氮中,用于提取肝脏DNA。

1.3.4 血清生化指标测定
取1.3.3节制备的血清,按照试剂盒方法测定TC、TG、HDL-C、LDL-C浓度以及ApoA-I、Apo-B质量浓度,并计算ApoA-I/Apo-B,考察TOAWA对实验大鼠血脂浓度及Apo质量浓度的影响。
1.3.5 肝脏组织切片的制作和组织学检查
取1.3.3节中分离的肝右小叶用生理盐水洗净,用体积分数10%中性甲醛溶液固定,制作病理切片并进行苏木精-伊红染色,生物显微镜(400×)观察各组肝组织切片病理学变化。
1.3.6 肝脏组织总RNA提取及反转录合成cDNA
取1.3.3节肝脏组织,采用Trizol法提取和纯化肝脏组织中的总RNA[18-19],使用GelStain染色,采用琼脂糖凝胶电泳技术检测RNA的完整性。取RNA样本,采用Prime Script II 1st Strand cDNA反转录酶试剂盒反转录合成cDNA。合成的目标产物cDNA置于-70 ℃保存。
1.3.7 实时荧光定量PCR测定肝脏组织中与脂质代谢相关基因的mRNA表达
取1.3.6节中反转录合成的cDNA样本,根据基因序列设计特异性引物,通过实时荧光定量PCR,采用SYBR GREEN染料法,以β-actin为内参基因作定量检测,并用2-△△Ct法对数据进行分析。实时荧光定量PCR采用两步法,程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,循环40 次;72 ℃单点检测信号。溶解曲线:95 ℃ 0 s;65 ℃ 15 s;95 ℃ 0 s,连续检测信号。大鼠肝脏过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor-α,PPAR-α)和低密度脂蛋白受体(low-density lipoprotein receptor,LDL-R)引物的设计见表1。
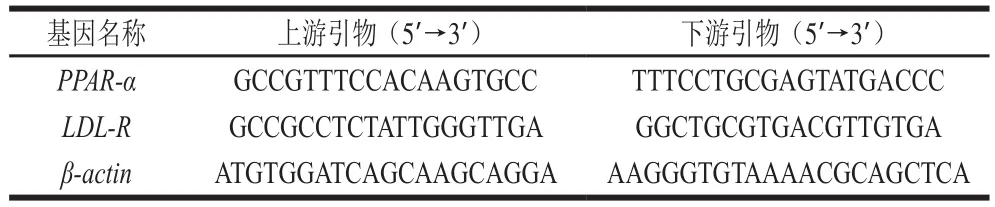
表1 基因引物序列Table1 Primer sequences of the genes
1.4 数据统计与分析
2 结果与分析
2.1 TOAWA对实验大鼠体质量和肝脏指数的影响
图1 实验大鼠的体质量增长曲线Fig.1 Growth curve of experimental rats

图2 TOAWA对实验大鼠肝脏指数的影响Fig.2 Effect of TOAWA on liver index of experimental rats
图1 显示各组实验大鼠的体质量之间无明显差异。图2显示,与空白组相比,模型组大鼠的肝脏指数极显著升高(P<0.01),说明高脂乳剂使得肝脏被脂肪浸润,损伤肝脏;与模型组比较,TOAWA低、中、高剂量组和阳性组均可极显著降低肝脏指数(P<0.01),说明TOAWA能够明显减轻肝脏的脂肪浸润,改善肝功能。
2.2 TOAWA对实验大鼠血脂浓度的影响
图3显示,与空白组相比,模型组TG、TC和LDL-C浓度极显著升高(P<0.01),HDL-C浓度极显著降低(P<0.01),表明成功诱导构建大鼠高脂血症模型。与模型组比较,TOAWA低、中、高剂量组与阳性组均可显著降低TC、TG和LDL-C浓度,明显升高HDL-C浓度,提示TOAWA能调节高脂血症大鼠血脂浓度,高剂量组的作用效果更为明显。
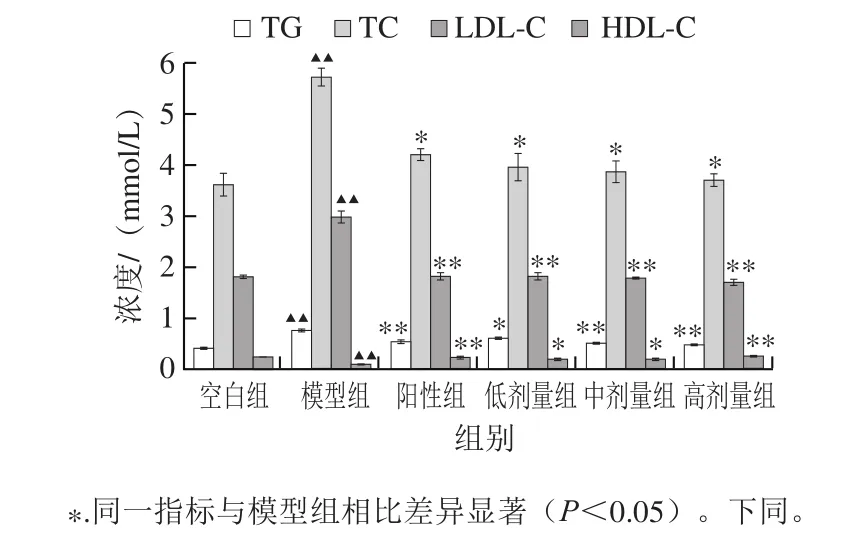
图3 TOAWA对高血脂大鼠血清中血脂浓度的影响Fig.3 Effect of TOAWA on serum lipid level of hyperlipidemic rats
2.3 TOAWA对实验大鼠血清Apo质量浓度的影响
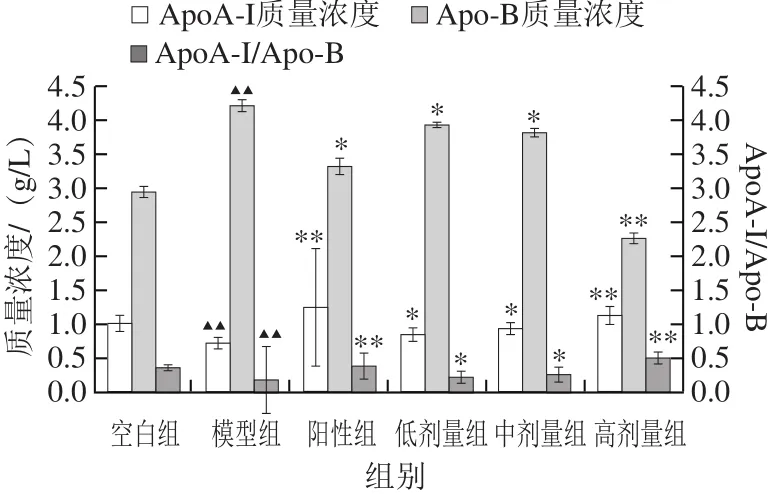
图4 TOAWA对高血脂症大鼠血清Apo质量浓度的影响Fig.4 Effect of TOAWA on serum apolipoprotein level of hyperlipidemic rats
图4 显示,与空白组相比,模型组ApoA-I质量浓度和ApoA-I/Apo-B极显著降低(P<0.01),Apo-B质量浓度极显著升高(P<0.01),表明模型组大鼠血清Apo的质量浓度异常。与模型组比较,TOAWA高剂量组与阳性组可极显著升高ApoA-I质量浓度和ApoA-I/Apo-B(P<0.01),显著降低Apo-B质量浓度,低、中剂量TOAWA能够不同程度地升高ApoA-I质量浓度和ApoA-I/Apo-B,降低Apo-B质量浓度,提示TOAWA通过调节高脂血症大鼠血清Apo质量浓度而影响血脂浓度,高剂量组的作用效果更为明显。
2.4 大鼠肝脏组织的病理学观察
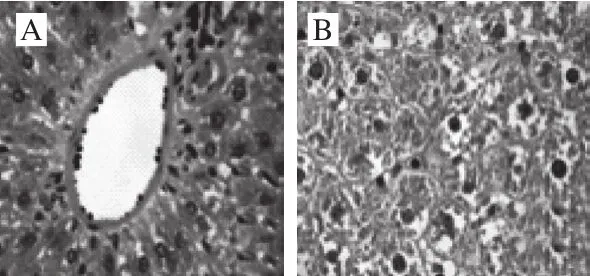

图5 TOAWA对大鼠肝脏组织病理学变化的影响(×400)Fig.5 Effect of TOAWA on pathological changes of liver tissue in rats (× 400)
图5 显示空白组肝细胞以中央静脉为中心呈放射状且排列规律、整齐、肝窦正常,周边肝细胞结构正常,未见细胞膨胀及病理形态变化;与空白组相比,模型组可见肝脏体积变大,肝细胞索结构紊乱,肝细胞之间连接松散,含有较多的白色脂肪油滴,形成了空泡,细胞核被挤向一侧,呈现明显的脂肪性病变;给予不同质量浓度TOAWA和血脂康灌胃后,TOAWA低、中、高剂量组的脂肪变性有不同程度的改善,细胞形态开始恢复,其中高剂量组的脂肪病变减少更为显著,大部分细胞恢复到接近正常形态;阳性组肝索和肝窦结构清晰,中央静脉周围肝细胞恢复放射状且排列整齐,脂肪油滴明显减少,肝脏切片基本恢复到正常状态。
2.5 大鼠肝脏组织的RNA电泳检测结果

图6 大鼠肝脏组织的RNA电泳检测结果Fig.6 Electrophoretic detection of RNA extracted from rat liver tissue
图6 显示,肝脏中RNA提取成功,采用GelStain染色及琼脂糖凝胶电泳技术检测到RNA完整度好,可以继续进行后续的实时荧光定量PCR实验。
2.6 大鼠肝脏组织中脂质代谢相关基因的mRNA的表达
图7显示,与空白组相比,模型组的PPAR-α和LDL-R基因表达量降低,说明高脂模型组的脂质代谢能力降低;与模型组相比,TOAWA低、中、高剂量组和阳性组PPAR-α和LDL-R基因表达量有明显的升高,特别是高剂量组与空白组几乎无差异,说明高剂量组大鼠脂质代谢能力恢复到正常水平。
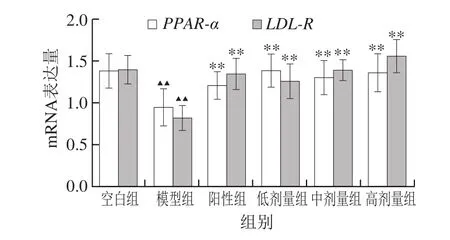
图7 大鼠肝脏PPAR-α和LDL-R基因mRNA表达量Fig.7 PPAR-α and LDL-R mRNA expression in liver of rats
3 讨 论
随着人们生活水平的提高,饮食结构发生了改变,饮食中蛋白和脂肪的比例增加,运动量相对减少[20],导致血中脂肪聚积,引起脂质代谢紊乱,而脂质代谢紊乱诱发的高脂血症是导致心脑血管疾病蔓延和恶化的重要风险因素[21]。血清TC、TG、LDL-C浓度等指标中一种以上超过正常最高限值,而HDL-C浓度低于正常最低限值是高脂血症的具体表现。因此,使血清TC、TG及LDL-C浓度降低或HDL-C浓度升高均可使高脂血症得到一定程度的改善。本研究结果表明,给予TOAWA干预能够使实验大鼠血清TC、TG、LDL-C浓度降低和HDL-C浓度升高,呈现良好的降血脂作用。
PPAR-α作为重要的脂类代谢调控因子,主要分布在肝脏中,其能够促进脂肪酸从血浆转运蛋白上释放并被细胞吸收[22-23],增加了脂肪酸的利用率,减少了TG的合成。肝脏中PPAR-α基因表达的上调可使肝脏对脂质的代谢能力增强,使TG浓度显著降低,同时,其能够增加肝脏脂肪酸的氧化,进一步减少TG的合成和分泌,从而降低血脂浓度[24-26]。LDL-R是体内清除胆固醇的主要途径,肝细胞中的LDL-R在血脂代谢,特别是胆固醇代谢过程中发挥重要作用,而LDL-R的数量和活性在分子水平受基因表达的调控[27],高脂饮食可抑制肝脏LDL-R基因转录,使其表达量降低,从而减少LDL-R的数量[28]。本研究结果表明,TOAWA通过上调肝脏中PPAR-α基因的表达水平减少TG的合成和分泌,从而降低血清中TG浓度;通过上调肝脏中LDL-R基因的表达水平增加肝脏对胆固醇的降解,从而降低血清TC浓度。
ApoA-I为调节HDL-C的主要Apo,能够清除胆固醇和防止周围组织脂质沉积,参与胆固醇从外周到肝脏的逆向转运过程,呈现抗动脉粥样硬化作用[29-30]。肝脏中的TG除可在线粒体、微粒体等部位进行氧化供能外,还可以通过组装至Apo-B中,形成极低密度脂蛋白(very low density lipoprotein cholesterol,VLDL)分泌入血液,使动脉粥样硬化的风险增加,肝脏VLDL组装和分泌障碍也可导致脂肪肝的发生[31-32]。本研究结果表明,TOAWA通过提高血清ApoA-I的质量浓度和ApoA-I/Apo-B使血清中HDL-C浓度升高,增加了胆固醇自外周向肝脏的逆向转运和在肝脏中的降解,清除了血清胆固醇,使得血清胆固醇浓度进一步降低;通过降低血清Apo-B质量浓度,抑制了VLDL组装和分泌,从而使得LDL-C的合成减少。
综上所述,TOAWA通过上调肝脏中PPAR-α和LDL-R基因、提高血清ApoA-I质量浓度和ApoA-I/Apo-B、降低Apo-B质量浓度以及改善肝功能等多个途径发挥降血脂的作用,使高脂血症实验大鼠血清学指标恢复到接近正常水平。

