辛伐他汀对帕金森病大鼠的治疗作用及其作用机制
陈 冬,欧阳存,张淑琴,邓立军,胡 昉
(江汉大学附属武汉市第六医院神经内科 430015)
帕金森病(parkinson disease,PD)主要是因中脑黒质区多巴胺能神经元进行性丢失而诱发的中枢神经系统退行性疾病。但现阶段PD的发病机制尚不明晰[1]。多巴胺受体激动剂替代疗法是现阶段治疗PD的重要方法,虽可在一定程度上缓解PD临床症状,但无法阻止PD病程的进展[2]。此外,该类药物的长期应用还可诱发多种不良反应。以辛伐他汀为代表的他汀类药物是高脂血症临床治疗的重要药物,具有抗氧化、改善内皮功能、抗增生、抗炎、抗凝和稳定斑块等多种作用[3],可透过血脑屏障,在临床上被广泛用于降低血浆胆固醇水平。最新的流行病学研究发现,辛伐他汀还可通过神经保护效应发挥治疗神经变性疾病的作用[4]。然而,关于辛伐他汀对神经退行性疾病的影响和机制还未被完全阐明。本研究旨在探讨辛伐他汀对PD大鼠的治疗作用及其作用机制,现报道如下。
1 材料与方法
1.1材料 (1)实验动物:选取SD雄性成年大鼠54只,体质量220~250 g,平均(234.1±8.2)g,光照间隔时间12 h、相对湿度45%~60%、温度23~25 ℃、自由进食进水。(2)实验仪器与药品:阿普吗啡、脂多糖(LPS)购于美国Sigma公司;C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)试剂盒购于南京建成生物研究所;抗离子钙结合蛋白1和酪氨酸羟化酶购于美国R&D公司;兔抗大鼠多克隆抗体购于南京凯基生物有限公司;大鼠定位仪购于上海高鸽公司;酶标仪购于美国BD公司。
1.2方法
1.2.1动物分组、造模及处理方法 选取SD雄性成年大鼠54只,采用随机数字表法分为对照组、模型组、治疗组各18只,模型组和治疗组采用LPS诱导法建立PD大鼠模型,大鼠立体定位黑质区2 μL LPS注射(5 μg/μL);对照组大鼠黑质区注射等量生理盐水。治疗组分别于造模前1 h及造模后每天17点腹腔注射辛伐他汀5 mg/kg,连续14 d,模型组和对照组给予等量生理盐水腹腔注射[5]。
1.2.2观察指标 (1)行为学观察方法:大鼠连续给药14 d后,腹腔注射阿普吗啡0.05 mg/kg,记录大鼠的旋转圈数和方向;以大鼠后右侧肢为支点,毁损对侧开始旋转,5 min记录1次,连续观察30 min[6]。(2)Western blot检测各组大鼠黑质区一氧化氮合酶(iNOS)表达:行为学观察结束第2天,大鼠断头处死,冰冻切片机取黑质区,称重后裂解液匀浆并离心取上清液;BCA试剂盒检测蛋白浓度;蛋白质样品(50 μg)SDS-PAGE电泳并转至PVDF膜,2 h脱脂奶粉封闭后加入一抗并4 ℃过夜;加入二抗后摇床2 h孵育,转至PVDF膜上DAB显色[7]。(3)ELISA检测各组大鼠血清CRP、TNF-α、IL-6水平:大鼠断头处死,冰冻切片机取黑质区,称重后裂解液匀浆并离心取上清液,检测CRP、TNF-α、IL-6水平,实验操作严格按照试剂盒说明书进行。(4)免疫组织化学(IHC)染色:取大鼠黑质区和纹状体,石蜡切片后抗离子钙结合蛋白抗体、胶质纤维酸性蛋白及酪氨酸羟化酶IHC染色法检测各组大鼠黑质区脑源性神经营养因子(BDNF)及其受体(TrKB)、神经肽Y(NPY)的表达,最后结果使用Image-Pro图形软件进行分析[8]。

2 结 果
2.1各组大鼠行为学观察 对照组、模型组、治疗组大鼠旋转圈数分别为(2.80±1.10)、(154.20±13.80)、(87.60±10.30)圈/分,治疗组和模型组大鼠的旋转圈数明显多于对照组(P<0.05),而治疗组的旋转圈数明显少于模型组(P<0.05)。
2.2各组大鼠血清炎症因子水平比较 治疗组和模型组大鼠的血清CRP、TNF-α、IL-6明显高于对照组(P<0.05),而治疗组的血清CRP、TNF-α、IL-6水平明显低于模型组(P<0.05);见表1。
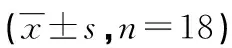
表1 各组大鼠血清炎症因子水平比较
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较
2.3各组大鼠黑质区iNOS表达水平比较 对照组、模型组、治疗组大鼠黑质区iNOS表达水平分别为(0.22±0.08)、(0.65±0.12)、(0.42±0.10)/NADPG%,治疗组和模型组大鼠的黑质区iNOS表达强度明显高于对照组(P<0.05),而治疗组的黑质区iNOS表达强度水平明显低于模型组(P<0.05)。
2.4各组大鼠黑质区BDNF、TrKB、NPY表达水平比较 治疗组和模型组大鼠的黑质区BDNF、TrKB、NPY表达强度明显低于对照组(P<0.05),而治疗组的黑质区BDNF、TrKB、NPY水平明显高于模型组(P<0.05),见表2。
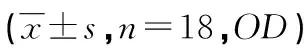
表2 各组大鼠黑质区BDNF、TrKB、NPY表达水平
a:P<0.05,与对照组比较;b:P<0.05,与模型组比较
3 讨 论
PD是一类神经退行性疾病,临床症状多样,存在认知功能障碍、疲劳症状等非运动症状及部分运动症状。但由于PD相关机制尚未明晰,导致现阶段临床缺乏有效的治疗手段。有研究已证实辛伐他汀等他汀类药物可以在改善神经退行性疾病方面发挥显著的治疗作用[9],但目前对其神经保护作用的具体机制尚不明确。相关研究发现,他汀类药物可经过免疫分子机制降低对神经元的损伤进而改善痴呆的临床表征[10];张阳等[11]通过多项临床和基础实验对他汀类药物从分子层面进行了总结,认为其具有抗氧化、抗炎和神经保护等多项功能,进而降低PD、脑血管病和癫痫等神经性疾病的发病率。本研究通过LPS建立大鼠PD模型,探讨辛伐他汀对PD大鼠的治疗作用及其作用机制,希望能够为临床PD的治疗提供数据参考。本研究结果显示治疗组和模型组大鼠的旋转圈数明显多于对照组(P<0.05),而治疗组的旋转圈数明显低于模型组(P<0.05)。该结果从行为学角度研究认为辛伐他汀能明显改善PD大鼠的临床表征。
有基础实验发现,黑质多巴胺神经元的退行性病变与TNF-α和炎症因子具有密切联系,并认为TNF-α与IL-6的表达可损伤DA神经[12]。CRP是机体非特异性免疫机制的一部分,可激活补体的经典途径,增强白细胞的吞噬作用,调节淋巴细胞或单核/巨噬系统功能,促进巨噬细胞组织因子的生成[13]。本研究发现治疗组和模型组大鼠的血清CRP、TNF-α、IL-6明显高于对照组(P<0.05),治疗组的血清CRP、TNF-α、IL-6水平明显低于模型组(P<0.05)。该结果提示辛伐他汀可通过炎性反应水平改善PD大鼠的临床症状。
SHALBAY等[14]研究发现,AD、PD等多种疾病和神经系统功能损伤均存在iNOS的表达。本研究发现治疗组和模型组大鼠的黑质区iNOS表达强度明显高于对照组(P<0.05),治疗组的黑质区iNOS表达强度水平明显低于模型组(P<0.05)。上述结果提示辛伐他汀可通过对激活的神经胶质细胞介导的氧化应激反应产生抑制作用。治疗组和模型组大鼠的黑质区BDNF、TrKB、NPY表达强度明显低于对照组(P<0.05),但治疗组的黑质区BDNF、TrKB、NPY水平明显高于模型组(P<0.05)。该结果说明辛伐他汀可通过改善BDNF、TrKB、NPY的活性达到治疗PD大鼠的效果。相关研究发现,TrKB受体可通过自动磷酸化与配体BDNF共价结合激活细胞内信号转导途径;轴突切断后,脊髓内运动神经元可出现TrKBmRNA表达增加[15],提示BDNF有可能通过其受体TrKB受体发挥再生与存活效应。
综上所述,辛伐他汀能明显降低PD大鼠的炎性反应水平、改善BDNF、TrKB、NPY的活性及降低iNOS表达,从而达到治疗PD大鼠的效果。

