二甲双胍干预肥胖儿童高胰岛素血症的临床疗效分析
姜丽红,朱凯凯,郑荣秀,杨箐岩,刘戈力 △
研究表明,胰岛素抵抗(IR)与肥胖相关的代谢异常及心血管风险有关[1]。若不加管理,胰岛素抵抗儿童有可能进展为2型糖尿病(T2DM)和早期动脉粥样硬化[2]。尽管部分肥胖儿童血糖尚在正常范围内,但需要高水平的胰岛素以维持正常血糖。持续的高胰岛素血症是IR的表现。高胰岛素血症可促使脂肪组织脂质沉积,进而加重肥胖。因此解除IR、治疗高胰岛素血症是治疗儿童肥胖和预防T2DM的关键步骤。
二甲双胍被美国食品药品管理局批准用于治疗成人和10岁以上儿童T2DM,近年来超适应证用于治疗儿童肥胖[3-4]。二甲双胍作为一种不作用于胰腺的降糖药及胰岛素增敏剂[5],其在治疗儿童IR和肥胖伴高胰岛素血症方面的作用越来越受到重视。小儿内分泌协会胰岛素抵抗共识声明建议,生活方式干预作为第一线治疗,并建议二甲双胍治疗应限制在选定的情况下[6]。目前关于肥胖合并高胰岛素血症儿童在应用二甲双胍后,空腹及糖负荷后各时点血糖和胰岛素变化的研究不多,因此本研究将探讨二甲双胍结合生活方式干预肥胖儿童高胰岛素血症的临床效果,进而为临床上更好地治疗儿童肥胖及相关代谢紊乱提供参考。
1 对象与方法
1.1 研究对象 选取2015年1月—2016年12月在我院儿科内分泌门诊就诊的肥胖儿童82例为研究对象,年龄8~16岁,平均(11.8±1.8)岁,男58例,女24例。所有患儿均有高胰岛素血症,其中18例诊断为糖耐量受损(impaired glucose tolerance,IGT),75例存在IR。诊断标准:(1)肥胖的诊断标准根据2004年中国肥胖问题工作组制定的标准诊断:体质量指数(BMI)在同年龄、同性别第95百分位数(P95)以上,均排除其他内分泌和遗传代谢疾病及其他疾病所致的病理性肥胖。(2)高胰岛素血症的诊断标准:空腹胰岛素(FINS)≥15 mU/L和(或)糖负荷后2 h胰岛素≥75 mU/L和(或)糖负荷后峰值胰岛素≥150 mU/L。(3)IGT诊断根据1999年WHO的标准,即空腹血糖(FPG)<7.0 mmol/L并且7.8 mmol/L≤糖负荷后2 h PG<11.1 mmol/L。
1.2 人体参数测定与计算 由专人负责测定身高(Ht)、体质量(Wt)、腰围(WC)、臀围(HC),计算BMI、腰臀比(WHR)、腰身比(WHtR)。
1.3 生化指标测定 所有儿童空腹8~10 h后,清晨经肘正中静脉取血,检测FPG、FINS。口服无水葡萄糖(1.75 g/kg,最大剂量75 g),每克加水2.5 mL,于3~5 min内服完。口服葡萄糖负荷后0.5、1、2、3 h时取血,采用氧化酶法测定各时点血糖,分别记做0.5 h-PG、1 h-PG、2 h-PG、3 h-PG;同时采用放射免疫法测定各时间点胰岛素浓度,分别记做0.5 h-INS、1 h-INS、2 h-INS、3 h-INS。
1.4 IR及胰岛β细胞功能评估 基础状态下稳态模型胰岛素抵抗指数(HOMA-IR)=(FPG×FINS)/22.5;糖负荷后总体胰岛素敏感指数(WBISI)=10 000(/FINS×FPG×平均胰岛素×平均血糖)1/2。其中平均血糖、平均胰岛素分别以各时间点测得的血糖及胰岛素计算平均值。稳态模型胰岛素分泌指数(HOMA-β)=20×FINS(/FPG-3.5);早期胰岛素分泌指数(ΔI30/ΔG30)=(0.5 h-INS-FINS)(/0.5 h-PG-FPG);胰岛素曲线下面积(AUCI)=FINS/2+1 h-INS+2 h-INS+3 h-INS/2。其中HOMA-IR>2.8定义为IR。
1.5 生活方式及药物干预 所有患儿均给予饮食、运动指导。(1)指导高胰岛素血症患儿清淡饮食,减少热量摄入。适宜食品:燕麦面、荞麦面、玉米面等含多种微量元素、维生素和食物纤维,有利于控制血糖。豆类及其制品:富含蛋白质、维生素以及无机盐、多不饱和脂肪酸等控制血脂。绿色食品:菠菜、芹菜、苦瓜等含有水溶性维生素、纤维素等有利于降低餐后血糖。(2)改变进食行为。如减慢进食速度,增加咀嚼次数,避免进食时看电视、玩手机等。(3)改变静态生活模式。每天保证至少30 min~1 h的有氧耐力运动,选择适宜、中等强度的有氧运动,如快走、慢跑、跳绳、球类、骑自行车、游泳等,每次运动后心率>120次/min,坚持锻炼,循序渐进。(4)口服盐酸二甲双胍片(0.5 g/片,中美上海施贵宝制药有限公司),随餐服用,对于胰岛素水平>300 mU/L的患儿,500 mg/次,3次/d,否则,500 mg/次,2次/d。
1.6 统计学方法 采用SPSS 18.0统计软件对数据进行分析。符合正态分布的计量资料采用均数±标准差(±s)表示,不符合正态分布的计量资料先进行对数转换再做统计学分析;使用单因素重复测量资料的方差分析或配对t检验对治疗前后各指标的整体变化进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后人体参数变化 二甲双胍治疗12个月后,BMI、WC、WHR、WHtR均较治疗前下降,具体表现为BMI在各时点均逐渐降低;WC和WHR在3、6、12个月时均低于治疗前,但该3个时点差异无统计学意义;而WHtR在治疗6个月前逐渐降低,然后至12个月时不再下降。具体见表1。
Tab.1 Comparison of BMI,WC,WHT and WHtR before and after metformin treatment表1 二甲双胍治疗前后不同时间BMI、WC、WHR、WHtR比较 (n=82,±s)

Tab.1 Comparison of BMI,WC,WHT and WHtR before and after metformin treatment表1 二甲双胍治疗前后不同时间BMI、WC、WHR、WHtR比较 (n=82,±s)
*P<0.05,**P<0.01;a与治疗前比较,b与3个月比较,c与6个月比较,P<0.05
时间治疗前3个月6个月12个月F BMI(kg/m2)30.81±4.49 29.50±4.42a 27.80±3.44ab 27.00±4.21abc 6.492**WC(cm)91.96±11.52 89.88±11.21a 89.18±10.09a 89.01±10.15a 3.857*WHR 0.92±0.05 0.88±0.04a 0.89±0.04a 0.86±0.05a 3.779*WHtR 0.58±0.09 0.56±0.07a 0.55±0.10ab 0.54±0.09ab 3.533*
2.2 治疗前后空腹及糖负荷后各时间点FINS水平的变化 与治疗前相比,6个月时各时间点FINS水平均有明显下降,至12个月时,FINS、1 h-INS、2 h-INS进一步降低(均P<0.05),而0.5 h-INS、3 h-INS与6个月时水平差异无统计学意义(P>0.05),见表2。
Tab.2 Comparison of insulin levels at different time points before and after metformin treatment表2 二甲双胍治疗前后各时间点胰岛素的变化(n=82,±s)
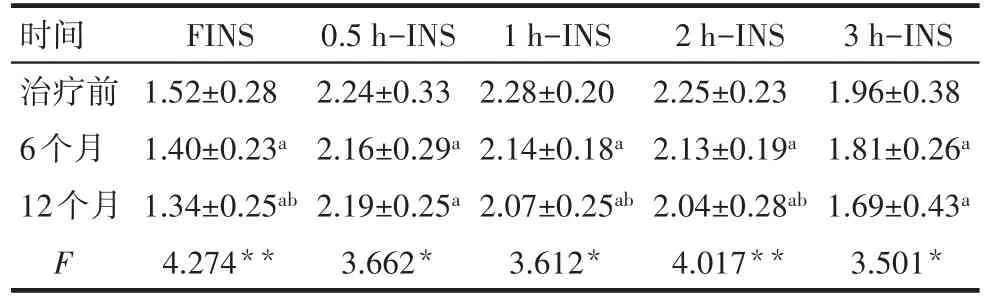
Tab.2 Comparison of insulin levels at different time points before and after metformin treatment表2 二甲双胍治疗前后各时间点胰岛素的变化(n=82,±s)
*P<0.05,**P<0.01;a与治疗前比较,b与3个月比较,c与6个月比较,P<0.05;表中数据均为采用对数变换后的数值
时间治疗前6个月12个月F FINS 1.52±0.28 1.40±0.23a 1.34±0.25ab 4.274**0.5 h-INS 2.24±0.33 2.16±0.29a 2.19±0.25a 3.662*1 h-INS 2.28±0.20 2.14±0.18a 2.07±0.25ab 3.612*2 h-INS 2.25±0.23 2.13±0.19a 2.04±0.28ab 4.017**3 h-INS 1.96±0.38 1.81±0.26a 1.69±0.43a 3.501*
2.3 治疗前后空腹及糖负荷后各时间点血糖水平的变化 治疗6个月时,2 h-PG较初始时无降低,12个月时,较治疗前和治疗6个月均降低(均P<0.05);余时间点空腹及糖负荷后血糖水平差异均无统计学意义(均P>0.05),见表3。
Tab.3 Comparison of blood glucose levels at different time points before and after metformin treatment表3 二甲双胍治疗前后各时间点血糖的变化(n=82,mmol/L,±s)
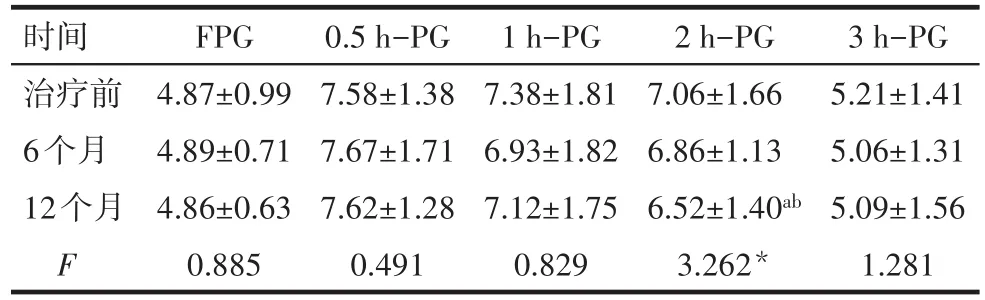
Tab.3 Comparison of blood glucose levels at different time points before and after metformin treatment表3 二甲双胍治疗前后各时间点血糖的变化(n=82,mmol/L,±s)
*P<0.05;a与治疗前比较,b与3个月比较,c与6个月比较,P<0.05
时间治疗前6个月12个月F FPG 4.87±0.99 4.89±0.71 4.86±0.63 0.885 0.5 h-PG 7.58±1.38 7.67±1.71 7.62±1.28 0.491 1 h-PG 7.38±1.81 6.93±1.82 7.12±1.75 0.829 2 h-PG 7.06±1.66 6.86±1.13 6.52±1.40ab 3.262*3 h-PG 5.21±1.41 5.06±1.31 5.09±1.56 1.281
2.4 胰岛素抵抗、胰岛素敏感性相关指标分析 与治疗前相比,二甲双胍治疗6个月后,HOMA-IR、HOMA-β、AUCI下降,WBISI升高(均P<0.05);与6个月时相比,二甲双胍治疗12个月时HOMA-IR继续降低,WBISI继续升高(均P<0.05),HOMA-β和AUCI与6个月时无变化;ΔI30/ΔG30在各时点均无明显变化(P>0.05),具体见表4。
3 讨论
3.1 二甲双胍可改善肥胖儿童体质量 肥胖可以增加IR的风险,是儿童及成人IR的最常见原因。伴IR的肥胖儿童发展为代谢综合征、T2DM和心血管疾病的风险增加。IR或胰岛素敏感性降低是指胰岛素在介导葡萄糖摄取、转运和储存过程中的功能受损,在T2DM中起着重要的病理生理作用。Freemark等[7]观察到在无生活方式干预的情况下,口服二甲双胍组的肥胖儿童BMI平均下降0.5 kg/m2,安慰剂组的肥胖儿童BMI平均上升0.9 kg/m2。本研究通过生活方式指导联合二甲双胍治疗,结果显示口服二甲双胍1年后可降低BMI,与Garnett等[8]的研究结果一致。在本研究中,治疗3个月、6个月、12个月期间,BMI持续下降,提示二甲双胍对体质量的影响或许可以持续12个月。研究发现,内脏及肌细胞内的脂质沉积与胰岛素敏感性降低有关[9]。因此,内脏肥胖是向IR和T2DM发展的一个重要危险因素,WC、WHR和WHtR可以间接评估腹部内脏和皮下脂肪,为评价中心性(腹型)肥胖的重要指标。本研究结果显示,WC及WHR与治疗前相比降低,但3个月、6个月、12个月无明显变化;与治疗前相比,WHtR降低,但6个月、12个月之间无明显变化。由此可以看出,二甲双胍不但可以减轻体质量,更重要的是可减少腹部脂肪堆积。
Tab.4 Comparison of index of insulin resistance and insulin sensitivity before and after metformin treatment表4 二甲双胍治疗前后胰岛素抵抗、胰岛素敏感性相关指标分析 (n=82,±s)

Tab.4 Comparison of index of insulin resistance and insulin sensitivity before and after metformin treatment表4 二甲双胍治疗前后胰岛素抵抗、胰岛素敏感性相关指标分析 (n=82,±s)
*P<0.05,**P<0.01;a与治疗前比较,b与3个月比较,c与6个月比较,P<0.05
时间H O M A-I R H O M A-β W B I S I Δ I 3 0/Δ G 3 0 A U C I治疗前6个月1 2个月F 0.8 5±0.3 1 0.7 3±0.2 7 a 0.6 7±0.2 8 ab 5.2 2 3**2.7 8±0.3 8 2.6 6±0.3 5 a 2.5 6±0.3 6 a 3.7 1 9*0.8 1±0.2 4 0.9 3±0.2 0 a 1.0 0±0.2 2 ab 4.0 0 7*1.8 1±0.2 5 1.7 5±0.3 1 1.7 2±0.2 8 1.8 7 1 2.5 9±0.2 2 2.4 8±0.1 7 a 2.4 7±0.2 2 a 3.5 3 0*
3.2 二甲双胍可改善肥胖儿童胰岛素敏感性 Freemark等[7]观察到肥胖儿童口服二甲双胍治疗6个月后,空腹胰岛素水平从(31.5±3.3)mU/L降至(19.2±1.5)mU/L,相比之下,安慰剂组空腹胰岛素水平没有改变。另有研究发现二甲双胍在降低空腹胰岛素水平及HOMA-IR方面较单独生活方式干预更有效,可以显著改善IR,并伴随着胰岛素敏感性的改善[9]。本研究结果显示,高胰岛素血症肥胖儿童二甲双胍治疗后HOMA-IR下降,WBISI升高。说明二甲双胍治疗1年后,IR改善的同时伴随着胰岛素敏感性的提升,与上述研究结果一致。肥胖儿童IR、高胰岛素血症可能与外周组织胰岛素受体亲和力降低、各种细胞因子水平增高以及皮质醇分泌增加等因素有关。虽然二甲双胍精确的生化机制仍未被完全阐明,但研究表明其可通过活化腺苷酸活化蛋白激酶(AMPK)来降低循环中葡萄糖、血脂水平,减少脂肪堆积,从而增加胰岛素敏感性,增强外周葡萄糖的利用。信号通路分析发现,二甲双胍能够激活AMPK从而抑制转化生长因子(TGF)-β1/Smad3信号通路,改善脂肪组织纤维化导致的IR[10]。另外,二甲双胍可能通过促进内皮型一氧化氮合酶(eNOS)蛋白表达,增加NO含量,从而改善血管内皮细胞功能[11]。
ΔI30/ΔG30能较好地反映胰腺早期分泌功能,AUCI可以代表二相代偿分泌。本研究结果显示,二甲双胍治疗后AUCI下降,虽然从正常糖耐量到糖耐量受损及T2DM伴随着胰岛β细胞分泌功能的减退,但肥胖高胰岛素血症儿童处于胰岛β细胞功能减退之前的分泌亢进期。因此,AUCI的下降并不能说明胰岛β细胞代偿功能减退,而是提示二甲双胍的治疗改善了胰岛素的高分泌状态,即随着胰岛素敏感性的增加,代偿分泌的胰岛素减少。
肥胖患者早期时相胰岛素分泌较非肥胖患者高,同时伴有胰岛素分泌的后延[12]。本研究中ΔI30/ΔG30在治疗前后并明显变化,考虑可能与FINS、0.5 h-INS水平均有所下降有关。二甲双胍干预6个月后,FINS、0.5 h-INS、1 h-INS、2 h-INS、3 h-INS均明显下降,12个月时,FINS、1 h-INS、2 h-INS继续降低,HOMA-β、AUCI均下降,可以看出治疗过程中胰岛素高峰提前至0.5 h,提示二甲双胍治疗后胰岛素分泌高峰提前,治疗后伴随分泌模式的改善。
应用二甲双胍治疗可以防止糖耐量受损患者进展为T2DM。本研究纳入的患儿中,18例存在IGT,即2 h-PG存在异常,余时间点血糖尚在正常范围内;治疗12个月后2 h-PG较前降低。经二甲双胍干预后,18例IGT儿童有13例血糖恢复到正常水平,另外5例2 h-PG有不同程度的降低,表明二甲双胍药物干预结合生活方式对IGT人群有显著效果。
3.3 二甲双胍的超说明书使用 82例肥胖患儿中有4例年龄小于10岁,分别为8、8.3、9.5和9.9岁,均出现非酒精性脂肪肝炎。在使用二甲双胍前与患儿家长充分沟通,并参考了相关文献[3-4]。因为二甲双胍主要存在肝肾功能损伤的不良反应,故给予药物治疗前除外病毒性肝炎(甲乙丙戊)和自身免疫性肝炎患儿。在应用二甲双胍的同时加用多烯磷脂酰胆碱,在第1个月时复查肝肾功能,随后分别于3、6、12个月复查,其中2例非酒精性脂肪肝患儿治愈,另2例转氨酶较入组时明显下降。
综上所述,在调整饮食结构、加强运动的基础上,肥胖高胰岛素血症儿童每天服用二甲双胍1.0~1.5 g,为期1年,可减轻体质量,提高胰岛素敏感性,减轻IR。当然,本研究样本量相对较少,观察时间仅为1年,需要多中心大样本长期随访,从而进一步论证二甲双胍对于肥胖儿童高胰岛素血症治疗的有效性和安全性。

