用于心肌钙蛋白I检测的微流控芯片*
李兆萌, 刘 冲, 李 扬, 徐朋朋, 王 堃, 李经民
(1.大连理工大学 机械工程学院,辽宁 大连 116024;2.大连理工大学 辽宁省微纳米技术及系统重点实验室,辽宁 大连 116024)
0 引 言
急性心肌梗塞的早期诊断对于此类疾病的治疗具有重要意义[1]。在急性心肌梗塞最初发作的3~6 h内[2],人体血液中的一种肌钙蛋白—心肌钙蛋白I(分子量22.5kDa(1Da=1.660 538 921×10-27kg/mol))的浓度从10 ng/mL左右迅速上升至50 ng/mL[3],最终能够高达550 ng/mL[4]。心肌钙蛋白I的这种高浓度状态将持续保持6~8天,这为急性心肌梗塞的诊断提供了一个较长的窗口期[5]。与肌酸激酶同工酶、肌红蛋白等其他生化标志物相比,心肌钙蛋白I具有突出的心肌损伤特异性,被视为诊断急性心肌梗塞的金标准[6]。因此,在急性心肌梗塞的早期阶段,对于浓度升高的心肌钙蛋白I的高灵敏度检测方法显得特别迫切。
电化学酶传感器在疾病诊断方面具有操作简单、精度较高等优点[7]。微带阵列电极不仅保持了单个微带电极IR降小、扩散电流密度大和RC常数小等优点,并极大地提高了电流强度[8]。在医学检测中,要求检测样本体积小,且为了避免交叉感染需要使用一次性装置,因此检测通常和微机电系统(micro-electro-mechanical system,MEMS)相结合[9]。
本文设计了一种简单可靠、灵敏迅速的电化学免疫传感器,用于人体心肌钙蛋白I的浓度检测。这种传感器由聚二甲基硅氧烷(polydimethylsiloxane,PDMS)沟道片和集成了微带阵列电极的玻璃片组成。传感器所产生的电化学信号强度正比于心肌钙蛋白I的浓度,可用于人体急性心肌梗塞的早期诊断。
1 实验部分
1.1 微流控芯片设计
微流控芯片由一片PDMS沟道片(20 mm×6 mm×2 mm)和一片玻璃电极片(34 mm×11 mm×2 mm)组成,如图1(a)所示。PDMS沟道片内部沟道的深度为50 μm,宽度为500 μm,长度为12 mm,体积为0.3 μL。玻璃电极片由工作电极、参比电极和对电极三电极系统组成,电极材料均为Au,如图1(b)所示。其中,工作电极由25对微型梳指交叉电极组成,每个梳指的宽度为40 μm,长度为2 mm,间隔为80 μm。由于进行电化学检测时,只使用梳指交叉电极的一半进行工作,故工作电极仍为微带阵列电极。参比电极和对电极均为长2 mm、宽1 mm的长方形结构;电极末端焊盘长度为8 mm,宽度为1 mm。

图1 微流控芯片和玻璃电极片
1.2 微流控芯片制造
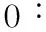
玻璃电极片的制作过程(图2)为:(a)在一片Pyrex耐热玻璃上,依次溅射一层10 nm厚的铬薄膜和200 nm厚的金薄膜;(b)在金薄膜表面旋涂一层BP212光刻胶,转速为2 600 r/min,在85 ℃下前烘处理30 min;(c)利用曝光机在掩膜下对光刻胶进行紫外曝光,将光刻胶浸入0.5 % NaOH溶液中,进行显影,在85 ℃下烘处理30 min;(d)利用1 g I2,5 g KI和50 mL H2O的混合溶液,腐蚀金薄膜;(e)利用H4CeN2O3和HClO4的混合溶液腐蚀铬薄膜;利用丙酮去除掉残余的光刻胶,得到金电极。
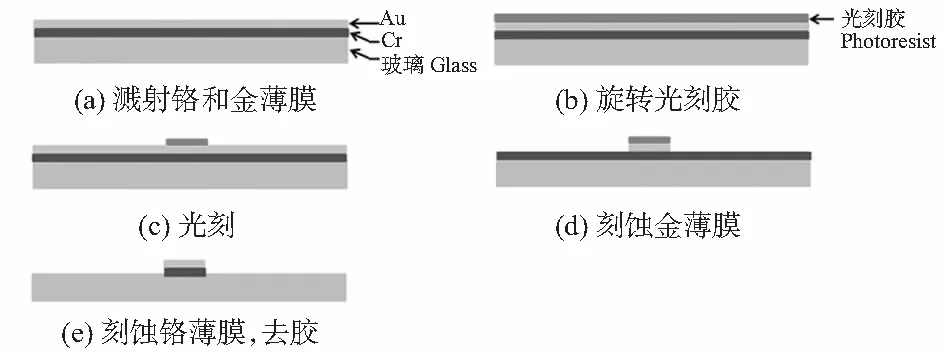
图2 玻璃电极片制作流程
1.3 检测原理
微流控芯片检测心肌钙蛋白I的为:首先,对和电极组装之后的PDMS沟道进行硅烷化修饰,在其表面形成羧基基团,并将蛋白G固定于修饰好的硅烷层上。蛋白G可以和心肌钙蛋白I包被抗体的Fc片段进行特异性结合,使得心肌钙蛋白I包被抗体的Fab片段裸露出来并保持特定的方向。检测时,包被抗体和心肌钙蛋白I抗原充分结合并将其固定[10],固定之后的心肌钙蛋白I抗原和心肌钙蛋白I检测抗体(用碱性磷酸酶标记)进行特异性结合,使得三者之间形成三级夹心结构[11]。
实验以对氨基磷酸苯酯(phenyl phosphor amidate,PPA)作为反应底物,对氨基磷酸苯酯(phenyl p-aminophosphate,PPAP)在碱性磷酸酶(alkaline phosphatase,AP)的催化作用下生成对氨基磷酸苯酚(phenol p-amino phosphate,PAP),PAP在正电位作用下会生成醌亚胺(quinone-imine,PQI)[12]。利用循环伏安法进行检测时,测得的循环伏安曲线中氧化峰的峰值和生成的PAP的浓度成正比,进而可以标定参与反应的心肌钙蛋白I的浓度。
1.4 试剂材料
蛋白G(由G型链球菌分离而得,可以和抗体的Fc片段特异性结合)、对氨基磷酸苯酯购于英国Abcam公司。高锰酸钾(KMnO4)、7—辛烯基三氯硅烷(C8H15Cl3Si)、三氨基甲烷盐酸盐(Tris-HCL sodium)、牛血清蛋白(bovine serum albumin,BSA)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的小鼠免疫球蛋白G(IgG)购于美国Sigma-Aldrich公司。磷酸盐缓冲液(phosphate buffer solution,PBS)购于北京雷根生物技术有限公司。人体心肌钙蛋白I抗原(cTnI)、小鼠心肌钙蛋白I单克隆包被抗体(M18)、小鼠心肌钙蛋白I单克隆检测抗体(M4)于美国Fitzgerald公司购买。AP试剂盒购于英国Innova Biosciences公司,可以对小鼠心肌钙蛋白I单克隆检测抗体(M4)进行标记。
1.5 实验过程
为了能够将心肌钙蛋白I包被抗体固定于PDMS沟道内表面,需要对沟道内表面进行硅烷化。硅烷化过程是利用C8H15Cl3Si,KMnO4溶液等对通道进行修饰,产生羧基基团。硅烷化后形成的羧基基团可以将蛋白G固定,剩余的羧基空位用牛血清蛋白溶液进行封闭。为了验证抗体在PDMS沟道内表面的固着特性,实验采用FITC标记的小鼠免疫球蛋白G和沟道内表面修饰后形成的蛋白G层进行有效结合,通过在激光共聚焦显微镜下图像的荧光强度进行表征。具体方法如下:在对微流控芯片修饰形成蛋白G层之后,将FITC标记的小鼠免疫球蛋白G注入PDMS沟道中,保持10 min,用磷酸盐缓冲液将没有固定的小鼠免疫球蛋白G冲洗掉。将经过以上处理的芯片置于激光共聚焦显微镜下,采用10倍物镜,激发波长设置为488 nm,观察PDMS沟道内表面的荧光强度。
实验的核心部分为验证微流控芯片对于心肌钙蛋白I的电化学免疫分析功能,具体操作流程如下:1)对微流控芯片修饰形成蛋白G层后,将心肌钙蛋白I包被抗体(30 μg/mL)注入芯片中;2)将分析物心肌钙蛋白I(10 ng/mL)注入芯片中;3)将碱性磷酸酶标记的心肌钙蛋白I检测抗体(10 μg/mL)注入芯片中;4)对芯片注入对氨基磷酸苯酯溶液(溶解在三氨基甲烷盐酸盐中,4 mmol/L),利用电化学工作站检测此时的循环伏安曲线。电化学工作站的扫描电压范围为-0.15~0.15 V,扫描频率为100 mV/s。由于对氨基磷酸苯酯溶液在碱性条件下容易被氧化,并对光照非常敏感,故需要每天新鲜配置,且实验需要在黑暗的环境下进行。
2 结果与讨论
2.1 抗体在PDMS沟道内表面的固着特性
为了验证抗体在PDMS沟道内表面的固着特性,本研究采用3组芯片进行对比试验,以证明蛋白G与抗体的特异结合性能。1)芯片为空白组,不进行任何处理;2)芯片在PDMS沟道内表面硅烷化之后,直接固定BSA,不进行蛋白G修饰;3)芯片在PDMS沟道内表面硅烷化之后,进行蛋白G层修饰,剩余空位用牛血清蛋白溶液进行填补。分别向3组芯片中注入FITC标记的小鼠免疫球蛋白G,保持10 min,然后用PBS冲洗。将3个芯片分别在激光共聚焦显微镜下观察荧光强度。
图3(a)为第(1)组检测不到荧光,因为FITC标记的小鼠免疫球蛋白G不能直接在PDMS沟道内表面固着。图3(b)显示第(2)组荧光强度有了稍微的增加,这表明牛血清蛋白可以和PDMS沟道内表面硅烷层上的羧基结合,阻止了小鼠免疫球蛋白G和沟道上羧基的结合。微弱的荧光强度说明FITC标记的小鼠免疫球蛋白G可能和形成的牛血清蛋白层发生了不明确的物理吸附。图3(c)显示了第(3)组芯片具有较强的荧光强度,这是由于FITC标记的小鼠免疫球蛋白G的Fc片段和蛋白G层发生了有效结合,证实了抗体在PDMS沟道内表面的有效固着。
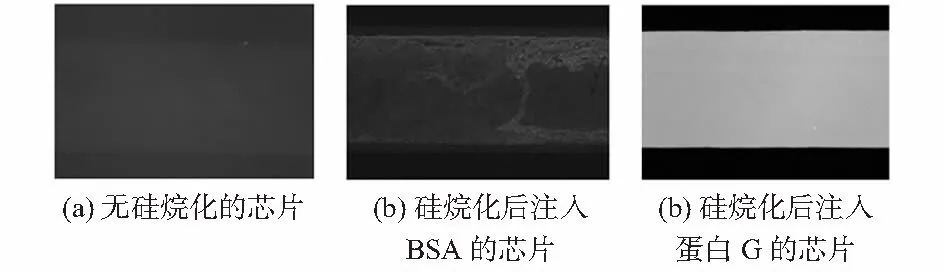
图3 PDMS沟道内表面共聚焦显微镜图像
2.2 微流控芯片电化学免疫分析的性能评估
为了证实微流控芯片内部的酶反应过程,对芯片电化学免疫分析的性能进行评估,本实验同样设计了3组芯片,利用电化学工作站对其性能进行表征。1)对没有硅烷化的芯片直接注入磷酸盐缓冲液,测得此时的循环伏安曲线作为一个背景信号。2)在对微流控芯片修饰形成蛋白G层之后,按照上述实验步骤,将包被抗体(30 μg /mL)通过蛋白G修饰层固定于硅烷化的PDMS沟道内表面,然后在芯片中依次注入心肌钙蛋白I(10 ng/mL)、AP标记的检测抗体(10 μg/mL),用磷酸盐缓冲液冲洗,测得此时的循环伏安曲线作为一个对比信号。3)在第二组的基础上,对芯片注入对氨基磷酸苯酯溶液(溶解在三氨基甲烷盐酸盐中,4 mmol/L),保持1 min,利用电化学工作站检测此时的循环伏安曲线。
如图4曲线A和B所示,第(1)组和第(2)组芯片各自的氧化还原反应产生的电流很弱,几乎没有峰值。表明这2组芯片中并没有电活性物质产生,因而不会发生氧化还原反应。第(3)组芯片利用循环伏安法测得的氧化电流峰值为586 nA,(曲线C)。这表明在PDMS沟道内部对心肌钙蛋白I包被抗体、心肌钙蛋白I和心肌钙蛋白I检测抗体发生了成功有效的固着,并且标记的AP和底物对氨基磷酸苯酯发生了反应。
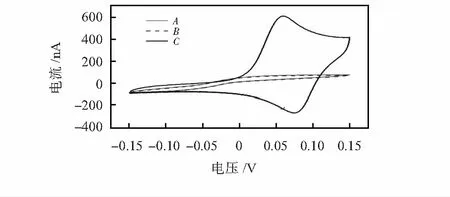
图4 不同芯片的循环伏安检测曲线
2.3 心肌钙蛋白I的循环伏安曲线和检测范围
本文对微流控芯片的灵敏度和检测范围进行了确定。图5给出了检测芯片对于不同浓度的心肌钙蛋白I的循环伏安检测曲线以及相应的校准曲线,利用循环伏安法测得的氧化电流峰值随着心肌钙蛋白I浓度的增大而增大。其中,心肌钙蛋白I包被抗体的浓度为30 μg/mL,碱性磷酸酶标记的心肌钙蛋白I检测抗体的浓度为10 μg/mL,心肌钙蛋白I的检测浓度范围为1~1 000 ng/mL,所有修饰和检测过程均按上述步骤进行。根据校准曲线计算所得到的心肌钙蛋白I理论最低检测限为0.4 ng/mL。
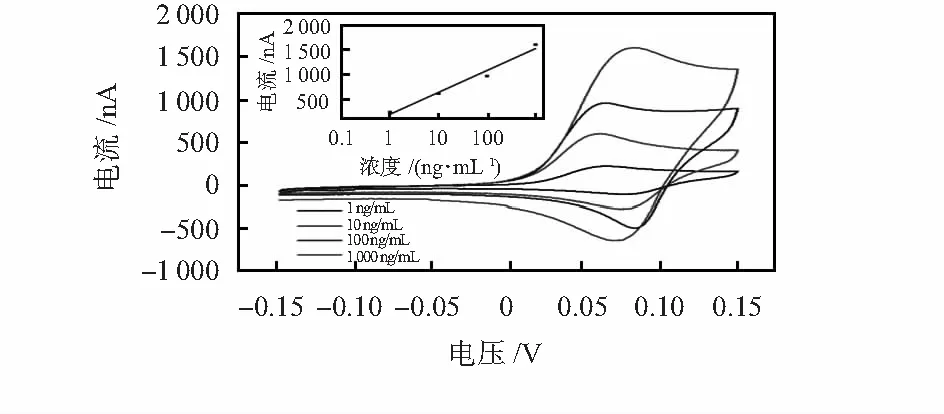
图5 心肌钙蛋白I循环伏安曲线(插图为相应的校准曲线)
3 结 论
研制了一种用于检测人体急性心肌梗塞早期阶段心肌损伤标志物,即心肌钙蛋白I的电化学生物芯片。通过研究证明,该芯片具有良好的电化学检测性能和较高的检测灵敏度。芯片所需检测样品体积为0.3 μL,从注入心肌钙蛋白I到获得电化学信号时长大约为8 min,心肌钙蛋白I的理论最低检测浓度为 0.4 ng/mL。整个芯片的制造与发展成熟的微加工技术相兼容,因此可以低成本批量化生产,这对于此类疾病的快速诊断具有重要意义。

