益胃消瘀颗粒改善大鼠胃黏膜肠上皮化生的作用研究
田锋亮,李延萍,杨小军,刘 宇,陈万群
(1.重庆市中医院消化科 400021;2.重庆市中医院 400021)
胃黏膜肠上皮化生(gastric intestinal metaplasia,GIM)是指胃黏膜中出现类似小肠或大肠黏膜的上皮细胞,由胃固有腺体颈部未分化细胞转化而来,GIM的诊断需要病理明确:光镜下出现胃黏膜组织肠上皮的杯状细胞、吸收细胞、潘氏细胞和PAS阳性的具有刷状缘的细胞。它是一种癌前病变,可增加胃癌发病的风险,胃癌经历了慢性胃炎-萎缩性胃炎(atrophic gastritis,AG)-肠上皮化生(IM)-异型增生-胃癌多步骤复杂的发展过程[1]。有研究认为化生在某种条件下是可逆转或被清除的[2],对GIM的治疗成为胃癌早期干预的突破点,目前尚无有效的西药治疗慢性AG(CAG)及GIM,某些中药及相关制剂对AG伴IM的研究报道较多,本课题组前期研究结果显示,益胃消瘀颗粒(Yiwei Xiaoyu particulate matter,YWXY)治疗AG及癌前病变有效[3],本实验采用N-甲基-N’-硝基-N-亚硝基胍(N-methyl-N’-nitro-N-nitrosoguanidine,MNNG)造模的AG伴IM大鼠,给予YWXY治疗,观察大鼠胃组织的病理改变,检测其对胃蛋白酶原(PG)Ⅰ/Ⅱ、肿瘤坏死因子-α(TNF-α)、胃黏膜NF-κB、Bcl-2、Fas、Bax、Smad4、骨形成蛋白4(BMP4)等相关肿瘤因子的影响,探讨YWXY治疗GIM及抑制癌变的可能机制。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级雄性SD大鼠60只,体质量180~200 g,8周龄,由陆军军医大学实验动物中心提供,动物生产许可证号为SCXK-PLA-20120031,并经试验动物伦理审查委员会审查通过。
1.1.2药物及配制 YWXY有红参、三七、白术、薏苡仁、法落海、娑罗子、浙贝母等组成,由本院制剂室制作。MNNG试剂购于TCL公司。MNNG用去离子水配成1 g/L的储备液(每周配制1次),4 ℃冰箱避光保存,用前以自来水稀释为50 mg/L的溶液,装入避光饮水瓶内给大鼠自由饮用。法莫替丁购于阿拉丁公司,配制成含0.004%法莫替丁的粉末状饲料,胃复春购于杭州胡庆余堂药业有限公司。
1.1.3主要试剂与仪器 所有ELISA试剂盒购自厦门慧嘉公司,NF-κB及β-actin 引物购自上海百力格生物工程公司。抗体NKX6.3(DF6461)和BMP4(AF0302)购自Affinity公司。CFX96定量PCR仪购自美国Bio-Rad公司;WB成像系统购自英国SYNGENE公司;蛋白电泳仪和转膜仪购自美国Bio-Rad公司。
1.2方法
1.2.1动物造模与分组 将60只雄性大鼠,分成对照组、模型组及YWXY高、中、低剂量组和胃复春组,每组10只,对照组常规喂养,其余50只采用MNNG诱导造模。MNNG每24小时更换1次药液,造模期间不再给予其他饮水。造模6个月抽检3只大鼠病理提示仅存在胃黏膜萎缩,未见IM,7个月再次抽检3只大鼠病理均提示胃黏膜萎缩伴IM,剩余存活大鼠即为有效动物。造模成功标准:参照《中药新药临床研究指导原则》(2002)[4]中GAG的病理诊断标准,经病理确诊:(1)固有腺体萎缩;(2)黏膜肌层增厚;(3)可有IM或假幽门腺上皮化生;(4)固有膜炎症;(5)可有淋巴滤泡形成。
1.2.2用药 造模成功后,对照组、模型组继续正常喂养,不给任何药物;YWXY低、中、高剂量组,分别给予YWXY 0.75、1.50、2.25 g·kg-1·d-1给药,每日分2次喂;胃复春组,按0.45 g·kg-1·d-1给药,喂养3个月后将动物处死。
1.2.3ELISA法检查大鼠血清及胃组织PG Ⅰ/Ⅱ、TNF-α的水平 实验结束后,全部大鼠禁食24 h,用10%水合氯醛溶液腹腔内注射麻醉大鼠,腹主动脉取血约10 mL,分离血清,-20 ℃低温保存,检测血清PG Ⅰ/Ⅱ、TNF-α水平。摘离全胃,沿大弯侧剪开,冷生理盐水漂洗内容物,再沿小弯侧剪开,一半用滤纸吸干水分,钝刀片从胃窦侧刮取胃黏膜50~100 mg,放入适量磷酸缓冲液中,电动匀浆器制成10%匀浆(低温),离心(3 000 r/min)10 min,分离上清液,-20 ℃保存,检测组织中PG Ⅰ/Ⅱ、TNF-α水平;一半置10%中性福尔马林液中固定24 h后沿大小弯方向剪成约2 mm的条状物,顺序石蜡包埋,取一部分5 mm切片,行HE染色,观察病理组织学改变。胃黏膜及血清PG Ⅰ/Ⅱ、TNF-α测定按试剂盒说明操作。
1.2.4RT-qPCR检测胃黏膜标本中NF-κB、Bcl-2、Fas及Bax的表达 提取大鼠胃组织总RNA,进行RT-qPCR扩增,NF-κB引物上游:5′-TTC AAC ATG GCA GAC GAC GA-3′,下游:5′-AGG TAT GGG CCA TCT GTT GAC-3′;Bcl-2引物上游:5′-CTG GTG GAC AAC ATC GCT CT-3′,下游 :5′-GCA TGC TGG GGC CAT ATA GT-3′;Fas引物上游:5′-TGT CAG CCT GGT GAA CGA AA-3′,下游 :5′-AGG CGC ACC TTC TGC ATT TA-3′;Bax引物上游:5′-GCG AAT TGG CGA TGA ACT GG-3′,下游:5′-CCC AGT TGA AGT TGC CGT CT-3′。反应条件为95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火45 s,熔解曲线:60~95 ℃,共40个循环。反应结束后,将原始数据、扩增曲线和熔解曲线等信息从定量软件中导出进行分析,得出各个样本目的基因的ct值,用相对定量2-△△Ct法分析结果。
1.2.5Western blot检测Smad4、BMP4蛋白表达 从胃组织中抽提蛋白质,BAC法测定总蛋白水平。取50 μg总蛋白与上样液混合,上样前100 ℃煮沸5 min。将蛋白加人点样孔,电泳初始电压80 V,溴酚蓝染料的前缘进入分离胶上缘后提高电压至100 V,当溴酚蓝染料到达分离胶底部时停止电泳。恒流30 mA,电转120 min。转移结束后,取出PVDF膜并标记膜的方向。用含5%脱脂奶粉的TBST封闭,室温振荡60 min。TBST漂洗液洗膜8 min,共3次,将膜移入杂交器皿中,加入用一抗稀释液按1∶1 000进行稀释的抗体(Smad4和BMP4),封口后4 ℃孵育过夜;用TBST漂洗液摇荡洗膜10 min,共3次,将PVDF膜移入另一新的杂交器皿中,加入二抗稀释液稀释的辣根过氧化物酶标记的二抗(1∶2 000),37 ℃振荡60 min。加入ECL显色液进行显色并拍照,用IPP软件分析目的条带灰度值,经内参β-actin校正后进行统计学分析。

2 结 果
2.1各组大鼠胃黏膜病理组织学结果 对照组大鼠胃黏膜上皮完整,固有层见密集排列的腺体,腺体大小、形态规则,散在少量淋巴细胞,未见胃黏膜萎缩。模型组大鼠胃黏膜显示慢性炎症,黏膜腺体减少,排列紊乱,可见囊性扩张的腺体,腺上皮可见不同程度的IM,固有层淋巴细胞灶性浸润,黏膜肌层增厚。YWXY高剂量组大鼠可见胃黏膜萎缩程度减轻,腺体增多,排列规则,散在淋巴细胞、浆细胞浸润。YWXY中剂量组大鼠胃黏膜萎缩程度减轻,腺体排列规则,IM明显减少,可见淋巴细胞、浆细胞散在浸润,小血管扩张充血纤维组织增生。YWXY低剂量组大鼠胃黏膜仍见萎缩,但较模型组稍减轻,黏膜腺体稍增加,囊性扩张腺体减少,排列稍规则,IM减少,可见固有层淋巴细胞灶性浸润,小血管扩张充血。胃复春组大鼠胃黏膜萎缩程度减轻,黏膜腺体增多,排列稍规则,有散在的淋巴细胞浸润,见图1。
2.2各组大鼠血清及胃黏膜组织PGⅠ、PGⅡ及TNF-α水平比较 与模型组比较,对照组和YWXY高、中、低剂量组及胃复春组血清PGⅠ水平明显升高(P<0.01);对照组及YWXY高、中剂量组胃黏膜PGⅠ水平明显升高(P<0.01)。血清PGⅡ模型组下降,与对照组、YWXY低剂量组及胃富春组比较,差异有统计学意义(P<0.05)。模型组血清及胃黏膜TNF-α水平明显升高,与其他各组比较,差异均有统计学意义(P<0.05),见表1。
2.3各组大鼠胃黏膜组织NF-κB、Bcl-2、Fas及Bax表达水平比较 模型组胃黏膜NF-κB、Bcl-2表达明显升高,与其他各组比较,差异均有统计学意义(P<0.05);模型组Fas表达下降,与对照组、YWXY高剂量组及胃复春组比较,差异有统计学意义(P<0.05);模型组Bax表达明显低于其他各组(P<0.01),见表2。
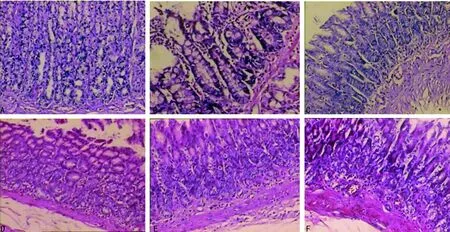
A:对照组;B:模型组;C:YWXY高剂量组;D:YWXY中剂量组;E:YWXY低剂量组;F:胃复春组
表1 各组大鼠血清和胃黏膜PGⅠ、PGⅡ及TNF-α水平比较
a:P<0.01,b:P<0.05,与模型组比较

表2 各组大鼠胃黏膜组织NF-κB、Bcl-2、Fas及Bax表达水平比较
a:P<0.01,b:P<0.05,与模型组比较
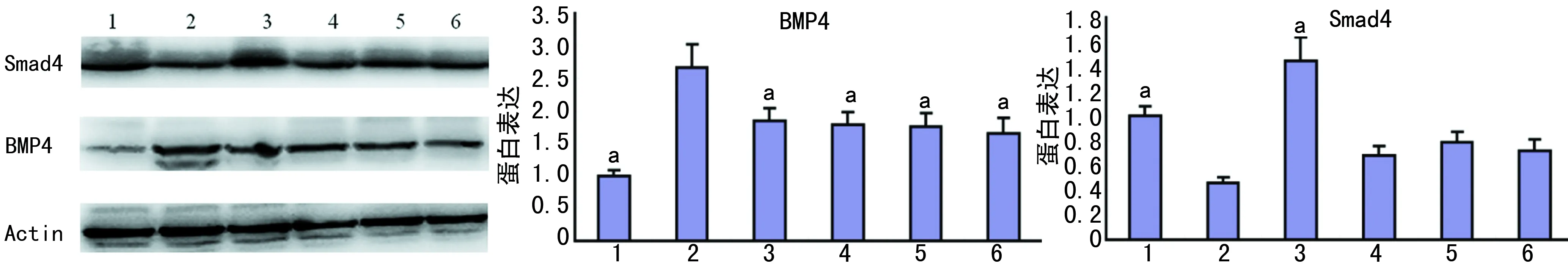
1:对照组;2:模型组;3:YWXY高剂量组;4:YWXY中剂量组;5:YWXY低剂量组;6:胃复春组;a:P<0.05,与模型组比较
2.4各组大鼠胃黏膜组织Smad4、BMP4表达水平比较 与对照组比较,模型组Smad4明显下降(P<0.01);与模型组比较,YWXY高剂量组Smad4明显升高(P<0.01)。与对照组比较,模型组BMP4明显升高(P<0.01);与模型组比较,YWXY高、中、低剂量组及胃复春组明显下降(P<0.05),见图2。
3 讨 论
西医认为AG伴IM是胃癌前病变,随着病情进展,会导致胃癌的发生,而GIM通过有效的治疗,部分患者病情能够得到控制和逆转,在中医学中没有“CAG伴IM”这一病名,根据本病常见的胃脘痞满、胃中嘈杂、痞或不痛、纳食减少等相关临床表现,将其归属于“胃痞”“胃脘痛”等范畴之中,中医认为本病病机为本虚标实之证,以脾阳气虚、胃阴虚为本,以气郁、湿热、痰浊、瘀血为标,本病病位在脾胃,与肝的关系密切,辨证采用理气、化湿、清热、活血、补虚、通阳等法治疗[5-7]。根据本病特点,本研究自拟YWXY治疗AG伴IM,药方由红参、三七、白术、薏苡仁、法落海、娑罗子、浙贝母等组成,具有益气温阳、行气化湿、活血化瘀之效。结果发现YWXY能够改善大鼠胃黏膜萎缩IM的程度,且效果优于胃复春片。
PG是胃液中胃蛋白酶没有消化活性的前体物质,其中PGⅠ主要由胃腺的主细胞和黏液颈细胞分泌,PGⅡ主要由胃体和胃底黏膜的泌酸腺的主细胞分泌。在浅表性胃炎-AG-胃癌的发展过程中,均伴随着PG的变化,PG可以作为治疗和预防干预过程中重要的监测指标。本研究提示模型组大鼠血清、胃黏膜PGⅠ及PGⅡ与对照组比较均下降(P<0.05),YWXY高、中、低剂量组及胃复春组均能提高血清PGⅠ水平(P<0.01),而YWXY高、中剂量组能够提高胃组织PGⅠ水平(P<0.01),YWXY低剂量组及胃富春组提高血清PGⅡ水平(P<0.05),胃组织PGⅡ水平各组大鼠比较差异无统计学意义(P>0.05)。结果说明AG伴IM大鼠血清及胃黏膜的PG1 水平下降,YWXY可以通过提高PGⅠ水平修复受损胃黏膜,是其治疗AG伴IM的可能作用机制。
NF-κB是一种能与免疫球蛋白κ轻链基因的增强子κB序列特异结合的蛋白因子,NF-κB 可通过提高凋亡抑制蛋白的表达,肿瘤细胞凋亡被延缓或抑制,从而加速癌症的发展,NF-κB的激活,可诱导炎性递质和免疫相关基因的转录与表达,如TNF-α,而TNF-α进 一步 活 化NF-κB, 目前认为TNF-α促肿瘤作用的机制是多途径的,可能与其过度表达并与受体结合通过多条信号通路抑制细胞凋亡及促进细胞增殖,TNF-α可以调节端粒酶活性,通过NF-κB中的p65导致人类端粒酶催化亚基(hTERT)从细胞质易位到核,最终推动细胞无限增殖[8];通过NF-κB途径诱导激活的胞苷脱氨酶大量产生,引起肿瘤相关基因如p53和c-myc基因突变[9]。本研究提示,模型组大鼠胃黏膜NF-κB表达较对照组明显升高(P<0.01),YWXY高、中、低剂量均能够抑制NF-κB的表达,与模型组比较,差异有统计学意义(P<0.01)。与对照组比较,模型组血清及胃黏膜TNF-α水平均明显升高(P<0.01);与模型组比较,YWXY高、中、低剂量组及胃复春组血清及胃黏膜TNF-α水平均明显下降(P<0.05)。结果说明AG伴IM大鼠NF-κB、TNF-α表达升高, YWXY能够抑制胃黏膜NF-κB的表达,降低大鼠血清及胃黏膜TNF-α水平,可能是其治疗AG伴IM,预防癌变的作用机制之一。
Bcl-2是一种凋亡抑制基因,其激活后可转录生成亲脂性膜蛋白,主要是通过抑制线粒体依赖性凋亡通路被激活的功能达到抑制细胞凋亡和延长细胞寿命的作用。Bax基因则是凋亡促进基因,与Bcl-2基因同属一族,它不但可以拮抗Bcl-2的凋亡抑制作用,而且还可直接促进细胞的凋亡。当细胞受到凋亡诱导因子刺激后,Bcl-2/Bax的比率决定细胞的凋亡程度。Fas是细胞表面可以传递死亡信号的受体,其作为一种细胞膜抗原,主要功能是介导细胞凋亡,具有抵抗Bcl-2蛋白抑制细胞凋亡的作用。胃癌癌前病变中,已经存在细胞凋亡的异常和相关基因的改变,Bcl-2基因表达增高,Fas、Bax基因表达减低,细胞凋亡受到抑制,这可能是胃癌癌前病变向胃癌发展的机制之一[10-12]。本研究显示,模型组大鼠胃黏膜Bcl-2表达 明显高于对照组(P<0.01),YWXY高、中、低剂量组及胃复春组明显低于模型组(P<0.05);胃黏膜Fas模型组与对照组比较表达下降(P<0.01),YWXY高剂量组与模型组比较表达升高(P<0.05);胃黏膜Bax模型组与对照组比较表达下降(P<0.01),YWXY高、中、低剂量组及胃复春组与模型组比较表达升高(P<0.01)。结果说明AG伴IM大鼠Bcl-2表达升高,Fas、Bax表达下降,YWXY能够抑制胃黏膜Bcl-2的表达,促进Fas、Bax的表达,促进了增殖细胞的凋亡,有效抑制细胞异常增殖,可能是其在预防胃黏膜萎缩IM继续发展、癌变的作用机制。
Smad4基因位于人染色体18q21,其所编码的Smad4蛋白是BMP通路的重要级联分子,在信号转导、调节靶基因的转录过程中发挥着重要的作用[13]。胃癌组织中Smad4表达阳性率明显低于正常胃组织,胃癌组织中Smad4的表达与组织分化程度、淋巴结转移、临床分期有关[14]。BMP4属于转化生长因子β(TGF-β)超家族成员之一,在肿瘤形成过程中具有重要作用[15],马松林等[16]研究认为BMP4能促进胃癌细胞的迁移及侵袭,其机制可能与上调Snail表达有关,BMP4通过它们经典的信号传导子Smad4在胃细胞系中上调Cdx2的表达[17]。本研究提示,模型组大鼠Smad4明显低于对照组(P<0.01),YWXY高剂量组明显高于模型组(P<0.01);模型组BMP4明显高于对照组(P<0.01),YWXY低、中、高剂量组明显低于模型组(P<0.01)。说明YWXY能够促进Smad4的表达,抑制BMP4的表达,是其抑制胃黏膜萎缩IM向癌变发展的可能机制。
综上所述,本研究证实YWXY能够改善大鼠胃黏膜萎缩IM的程度,提高PGⅠ水平,可能通过降低TNF-α水平,抑制胃黏膜NF-κB、Bcl-2、BMP4的表达,促进Fas、Bax、Smad4的表达,抑制胃黏膜萎缩IM向癌变发展。

