铜与毒死蜱复合污染对淡水绿藻的毒性效应
徐冬梅,柯 薇,王彦华
铜与毒死蜱复合污染对淡水绿藻的毒性效应
徐冬梅1,柯 薇1,王彦华2*
(1.浙江树人大学生物与环境工程学院,浙江 杭州 310015;2.浙江省农业科学院农产品质量标准研究所,浙江 杭州 310021)
重金属及农药残留在水环境中被频繁检测出,其复合污染对环境生物的联合毒性有别于单因子的生物效应.以淡水绿藻为受试生物,比较分析了有机磷农药毒死蜱(Chlorpyrifos)和重金属铜的单一及复合暴露对蛋白核小球藻急性毒性、细胞通透性及抗氧化应激的影响.铜、毒死蜱72小时单一暴露对小球藻的EC50分别为0.68和12.71μmol/L,藻细胞叶绿素含量随污染物浓度的增大而降低,细胞通透性随污染物浓度的增大而增强,藻细胞活性氧和抗氧化酶被显著诱导.利用相加指数法(Additive Index, AI)确定铜、毒死蜱联合暴露对小球藻急性毒性的联合作用类型为拮抗作用,这与小球藻ROS产生量及抗氧化酶等指标的显著性水平分析结果一致.
铜;毒死蜱;淡水绿藻;急性毒性;通透性;氧化应激
有机磷杀虫剂毒死蜱是一种高效、广谱含氮杂环类杀虫杀螨剂.作为高毒有机磷农药的主要替代品,近年来毒死蜱全球销量在所有杀虫剂中稳居前三,居有机磷杀虫剂第一位,该农药在我国的年产量现已超过4万t[1].随着使用量的增加,毒死蜱母体及代谢产物有可能通过多种途径进入水体,目前已在世界各国地表水环境检测到较高浓度毒死蜱的存在[2-4].尽管毒死蜱比已禁止使用的有机磷农药对人畜的毒性要低,但对于多数水生生物而言,毒死蜱仍属于高毒性物质并且可以通过生物积累和生物放大作用对水体食物链产生影响[5-7].同时,我国现阶段环境污染的实际情况是有机农药和重金属污染物在多种环境介质中(包括水环境、土壤环境)大量共存,从而产生复合效应,可以大大改变彼此的生理活性或毒性,其复合污染构成了生态环境和人类健康的潜在威胁,这引发了人们对其联合毒性作用的担忧.重金属铜是植物生长和人体生命活动必需的微量元素,然而铜在环境中的过量累积不仅会导致暴露生物的毒性效应[8],还会对人体健康造成不良影响[9].目前有关重金属与农药共存条件下对水生生物的复合污染效应仍鲜见报道.
淡水绿藻作为水环境监测评价的重要指示生物,广泛应用于环境污染的生态毒性评价.铬等重金属类能够诱导栅藻体内活性氧自由基(ROS)的产生及脂质过氧化等藻细胞毒性[10],已有研究发现供试40种农药中以光合作用抑制类除草剂对淡水绿藻的毒性最强[11].本文选用水环境中常见的代表性有机磷农药毒死蜱和重金属铜为研究对象,以水生态初级生产者淡水绿藻为受试生物,系统研究毒死蜱、铜单一及复合暴露对蛋白核小球藻急性毒性、细胞膜通透性、叶绿素含量及抗氧化应激的影响,探究毒死蜱、铜联合作用的毒性效应和生态风险,解析二者联合毒性的作用机制.以期为复合污染物的水环境生态风险评价提供科学依据.
1 材料与方法
1.1 实验材料
供试蛋白核小球藻购自中国科学院水生生物研究所,毒死蜱原药由南京红太阳集团有限公司提供(纯度>95%),荧光素二乙酸酯(FDA)和2',7'-二氯荧光黄双乙酸盐(H2DCFDA)购自sigma Aldrich公司,抗氧化酶等试剂盒购自南京建成生物工程研究所,试验所用硫酸铜等其余试剂均为分析纯,水为二次亚沸蒸馏水.
1.2 藻细胞的预培养
在无菌条件下将藻种接种至水生4号培养基中,于PRX-350B型智能人工气候箱中恒温光照培养至对数生长期,并进一步扩大培养.培养条件为温度25℃,光暗比12h:12h,光照3000~4000lx静止培养,每天定时摇动5~6次,以减少藻细胞贴壁现象.预培养3代,镜检细胞正常,进入对数生长期进行试验.
1.3 藻类毒性试验及相关指标测定
将处于对数生长期的蛋白核小球藻接种到100mL锥形瓶中,实验初始藻细胞密度约7.0×105个 / mL,总体积50mL.根据预实验的结果设置毒死蜱、铜单一暴露和毒性1:1复合暴露浓度如表1所示,每个处理3次重复.

表1 铜、毒死蜱单一及复合暴露的试验设计
藻细胞于污染物中暴露72h后测定相关指标.叶绿素含量测定参照文献[12];藻细胞膜通透性参照Dorsey 等报道的加入荧光素二乙酸酯(FDA)后检测荧光值的方法[13];活性氧自由基(ROS)含量通过加入2',7'-二氯荧光黄双乙酸盐(H2DCFDA)探针来测定[14].藻细胞抗氧化酶超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和脂质过氧化产物丙二醛(MDA)含量采用南京建成生物工程研究所的试剂盒进行测定.
1.4 数据分析
采用SPSS17.0进行数据的分析与处理,对藻细胞膜通透性、叶绿素含量等的差异用方差检验,并用Duncun'sNew Multiple Test做浓度之间的多重比较,显著性水平为<0.05.采用Marking 的相加指数法评价铜、毒死蜱对小球藻急性毒性的联合作用类型.为生物毒性相加作用之和,=m/1+m/1(1).式中1、1和m、m分别为A、B毒物的毒性(EC50)和混合物毒性中各毒物的毒性(EC50).然后用以下公式将转换成相加指数(AI):当£1时,AI=(1/)−1.0 (2);当>1时,AI=(−1)+1.0 (3).最后用相加指数AI评价毒物的联合效应.AI>0时为协同作用;AI<0则为拮抗作用;AI=0为相加作用.
2 结果与分析
2.1 铜、毒死蜱单一及复合暴露对绿藻的急性毒性
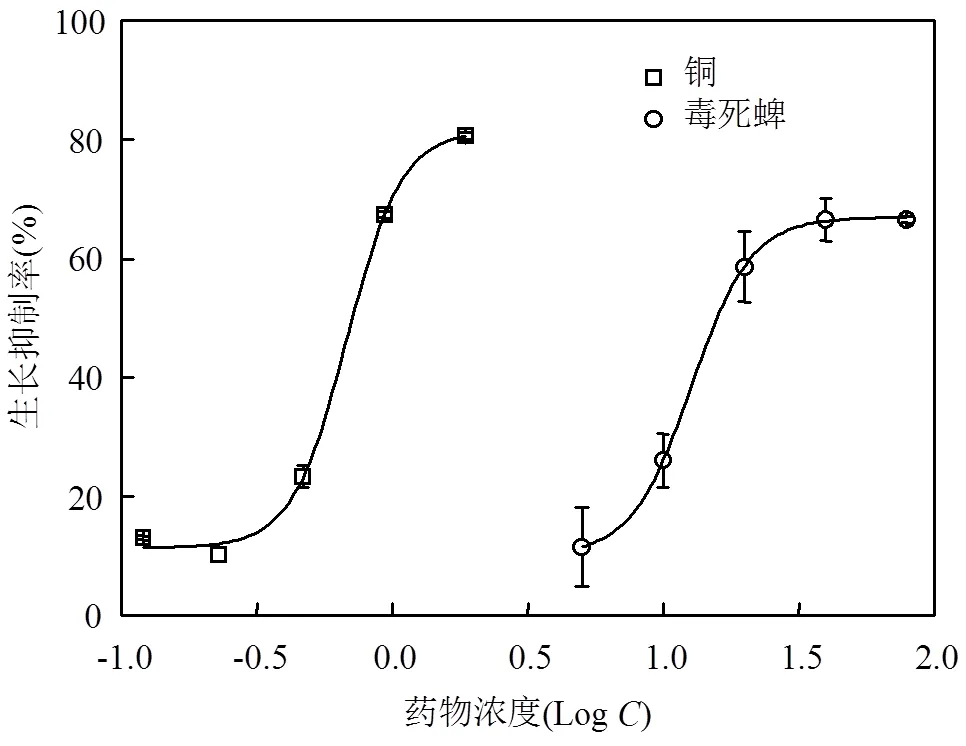
图1 铜、毒死蜱对淡水绿藻72h急性毒性效应的剂量效应拟合曲线
利用非线性最小二乘拟合(NLSF)模块下的DseRes模型拟合工具对藻细胞72h生长抑制数据进行非线性拟合,进而求得铜、毒死蜱对藻生长抑制率的浓度-效应曲线(图1)及其单一、复合暴露的EC50值和相关参数(表2).由表2数据可见,铜、毒死蜱单一暴露对小球藻72h-EC50分别为0.68和12.71μmol/L;而毒性1:1复合暴露的铜、毒死蜱对小球藻EC50-72h分别为0.46和10.52μmol/L.相加指数法求得铜、毒死蜱复合暴露对小球藻急性毒性的相加指数AI<0,由此判断二者联合作用类型为拮抗作用.证明水环境中多种污染物联合作用的复杂性.修瑞琴等采用相加指数法评价砷与镉、锌离子对斑马鱼的联合毒性发现,As3+与Cd2+、Zn2+共存时的联合毒性均为拮抗作用,而Cd2+与Zn2+的联合毒性主要为毒性剧增的协同作用[15].本文的结果表明重金属铜和农药毒死蜱联合暴露于藻细胞产生了交互作用.
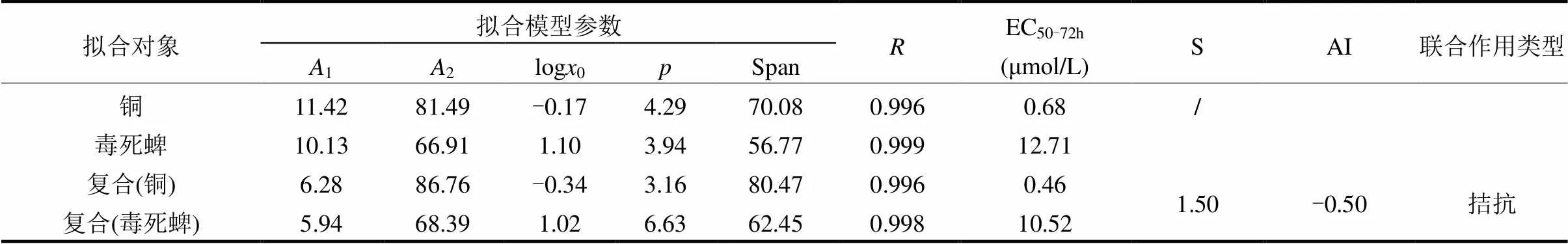
表2 DseResp模型参数、EC50值和联合作用类型
注:2、1分别为拟合曲线的上、下渐近线;log0为拟合曲线中点(平均校正死亡率=50%处)的纵坐标;为拟合曲线中点(平均校正死亡率=50%处)的斜率;Span=abs(1-2).
2.2 铜、毒死蜱对藻细胞叶绿素含量和通透性的影响
绿藻的光合作用色素主要是叶绿素a、叶绿素b、叶黄素和胡萝卜素.其中叶绿素a是评价环境污染物对藻类光合作用呼吸速率影响的理想指标;而叶绿素b的含量则可以作为测定藻类光合作用和呼吸速率的一个补充[16].铜、毒死蜱暴露72h后小球藻叶绿素a(Chla)和叶绿素b(Chlb)含量见表3.低浓度即0.1μmol/L铜、5.0μmol/L毒死蜱单一暴露组和铜:毒死蜱0.14:2.50复合暴露的藻细胞叶绿素含量较对照有所增加,此后随着铜、毒死蜱暴露浓度的增大,Chla和Chlb含量显著下降.其中铜单一暴露的小球藻叶绿素b在整个试验浓度范围内变化均不显著,而其余作用组随铜、毒死蜱单一及复合暴露浓度的增加,叶绿素含量下降明显.总体而言,铜、毒死蜱单一暴露对藻细胞Chla的影响程度大于二者的复合作用;而Chlb则表现出稍有不同的变化趋势.

表3 铜、毒死蜱单一及复合暴露对藻细胞叶绿素含量的影响
没有荧光活性的荧光素二乙酸甲酯(FDA)难以通过完整的细胞膜,其可被体内脂酶代谢生成具有荧光活性的荧光素,荧光素的荧光强度可用以表征细胞膜的完整性和通透性[17].单位时间内测定的荧光强度越大,表明藻类细胞的代谢活性越高,细胞膜的通透性越强[18].铜、毒死蜱单一及复合暴露72h后对藻细胞通透性的影响如图2所示.由图可见,随着作用浓度的增加,铜、毒死蜱单一及复合暴露增大了藻细胞的通透性.其中最大暴露浓度组,即铜0.8μmol/L,毒死蜱40μmol/L,铜:毒死蜱1.10: 20.00μmol/L暴露组藻细胞通透性分别为对照的2.3,3.3和3.0倍.

图2 铜、毒死蜱对藻细胞通透性的影响
2.3 铜、毒死蜱对藻细胞活性氧含量和抗氧化反应的影响
重金属、农药污染对水生生物的毒性作用机制之一,是导致生物体内产生大量的ROS,造成生物体的氧化损伤,并且促发抗氧化系统如超氧化物歧化酶(SOD)等的活性[19].铜、毒死蜱单一及复合暴露的ROS 产生量如图3所示.由图3可见,0.1~0.8μmol/L铜和5~40μmol/L毒死蜱单一暴露的藻细胞ROS诱导产生量随污染物浓度增大而增大的趋势较二者复合暴露更为明显,其中最大浓度组的铜、毒死蜱单一及复合暴露诱导藻细胞ROS产生量分别为对照组的2.6、2.8和3.1倍.
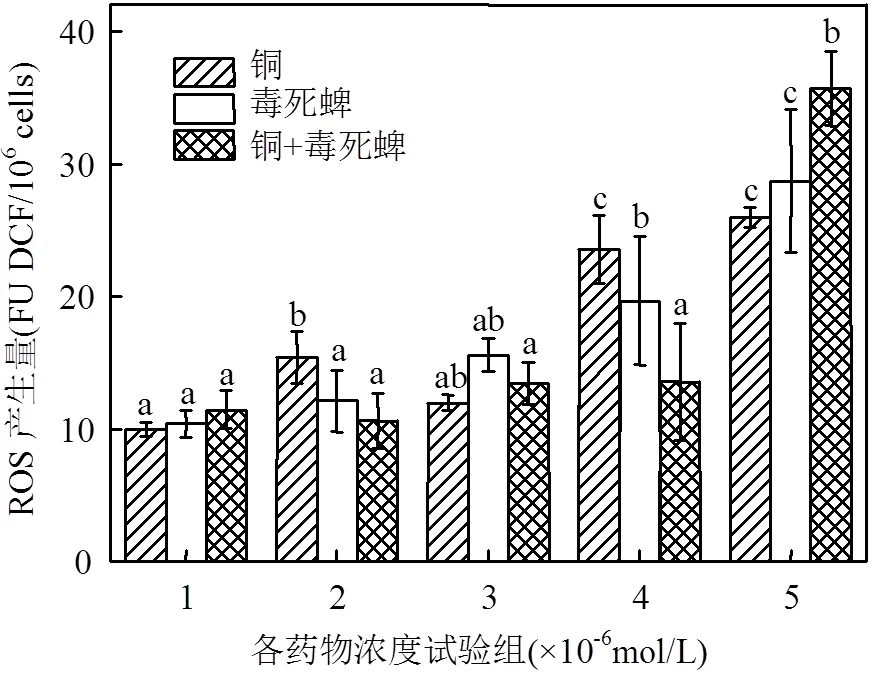
图3 铜、毒死蜱对藻细胞活性氧产生量的影响
由图4、图5污染暴露下小球藻SOD、GSH-Px活性影响可见,铜、毒死蜱单一暴露的小球藻SOD、GSH-Px活性被显著诱导,尤其以铜、毒死蜱单一暴露对GSH-Px活性的激活效应更为明显.相比之下,铜、毒死蜱复合暴露的SOD和GSH-Px激活作用不显著.
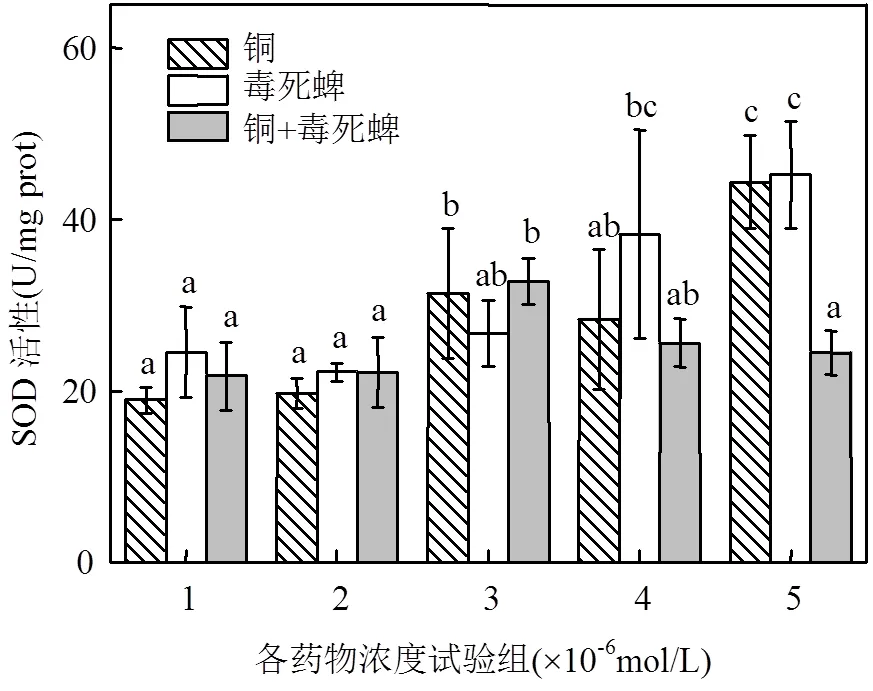
图4 铜、毒死蜱对藻细胞SOD活性的影响
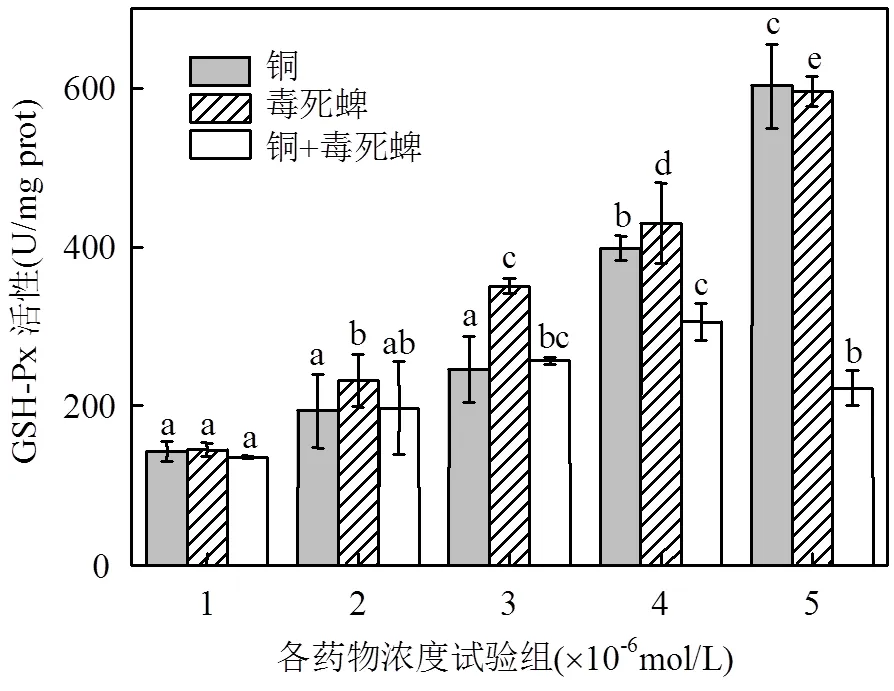
图5 铜、毒死蜱对藻细胞GSH-Px活性的影响
图6铜、毒死蜱对藻细胞脂质过氧化产物MDA含量的影响结果表明,铜单一暴露诱导藻细胞MDA的产生最为明显,而毒死蜱单一和铜、毒死蜱复合情况下藻细胞MDA产生量与对照相比差异并不显著.
3 讨论
复合污染已经成为各类环境介质中普遍存在的现象.当前重金属、农药仍然是水环境中两类常见的污染物,其复合污染构成了对水生态环境和人类健康的潜在威胁[20].由于很多健康毒理效应无法用单一污染物的作用机理来解释,多元复合污染物对环境生物的联合毒性有别于单因子的生物效应已在众多研究中得到证实[21-22].胡晓娜等研究证明, Zn2+的存在降低了除草剂异丙甲草胺对斜生栅藻的生长抑制作用,异丙甲草胺与Zn2+的联合毒性作用为低浓度相加,高浓度拮抗的作用类型[23].重金属铜与除草剂2,4-滴丙酸复合污染诱导斜生栅藻产生ROS和抗氧化酶活性高于重金属和农药各自单一暴露的情形[17].本文应用相加指数法研究发现铜、毒死蜱以毒性1:1复合暴露对小球藻急性毒性的联合作用类型为拮抗作用.由多重比较分析结果,发现铜、毒死蜱复合暴露对小球藻ROS产生量及抗氧化酶等指标影响的显著性水平小于二者各自单一作用的情形,在一定程度上支持了铜、毒死蜱复合暴露对小球藻的毒性为拮抗作用的结论.与谢荣等应用相加指数法获得的有机磷农药丙溴磷和重金属铜毒性1:1复合暴露对海洋微藻(三角褐指藻、盐藻和青岛大扁藻)的联合毒性类型相同[24].这可能是由于毒死蜱竞争铜与酶蛋白的结合点位,从而在一定程度上抑制了铜毒性作用的结果.吴宗凡等应用等效线图解法的独立作用模型预测了重金属、有机磷农药复合暴露对卤虫急性毒性,发现不同配比的重金属、有机磷农药对卤虫的联合作用类型均为拮抗作用[25].在复合污染胁迫下,农药与重金属联合暴露的生物毒性类型主要取决于农药对重金属生物可利用性的影响.此外,污染物对生物的毒害效应还取决于污染物浓度水平的组合关系,因此,对于复合污染的研究,也应重点考虑污染物的浓度组合及浓度组合的交互作用[26].
4 结论
4.1 随着铜、毒死蜱单一暴露浓度的增大,藻细胞叶绿素含量降低,细胞通透性增强,活性氧和抗氧化酶活性被显著诱导.
4.2 铜、毒死蜱联合暴露对小球藻急性毒性的联合作用类型为拮抗作用,这与污染暴露下小球藻ROS产生量及抗氧化酶等指标的显著性水平分析结果一致.
[1] 吴 涛,李培国,蒋志秋.毒死蜱技术进展及市场发展趋势[J]. 精细与专用化学品, 2012,20(4):29-32.
[2] Campillo J A, Albentosa M, Valdés N J, et al. Impact assessmentof agricultural inputs into a Mediterranean coastal lagoon(Mar Menor, SE Spain) on transplanted clams (Ruditapesdecussatus) by biochemical and physiological responses [J]. AquaticToxicology, 2013:142-143(3): 365-379.
[3] Lizotte R EJr, Knight S S, Btyant C T. Sedimentquality assessment of Beasley Lake: bioaccumulationand effects of pesticides in Hyalellaazteca [J]. Chemistryand Ecology, 2010,26(6):411-424.
[4] Li H Z, Mehler W T, Lydy M J, et al. Occurrence and distribution of sediment -associated insecticides inurban waterways in the Pearl River Delta, China [J]. Chemosphere, 2011,82(10):1373-1379.
[5] 张家禹,刘丽丽,李国超,等.毒死蜱对斑马鱼胚胎氧化应激效应研究[J]. 中国环境科学, 2016,36(3):927-934.
[6] Daam M A, Van Den Brink P J, Nogueira A J A. Impact of single and repeated applications of the insecticide chlorpyrifos on tropical freshwater plankton communities [J]. Ecotoxicology, 2008,17(8): 756-771.
[7] Levin E D, Swain H A, Donerly S, et al. Developmentalchlorpyrifos effects on hatchling zebrafish swimming behavior [J]. Neurotoxicology and Teratology, 2004,26(6):719-723.
[8] Klok C, Goedhart P W, Vandecasteele B. Field effects of pollutants in dynamic environments. A case study on earthworm populations in river floodplains contaminated with heavy metals [J]. Environmental Pollution, 2007,147(1):26-31.
[9] Chen J X, Myerburg M M, Passero C J, et al. External Cu2+Inhibits Human Epithelial Na+Channels by Binding at a Subunit Interface of Extracellular Domains [J]. Journal of biological chemistry, 2011, 286(31):27436-27446.
[10] Kováčik J, Babula P, Hedbavny J, et al.Physiology and methodology of chromium toxicity using algaas model object [J]. Chemosphere, 2015,120:23-30
[11] Ma J Y, Xu L G, Wang S F. Toxicity of 40herbicides to the green alga[J]. Ecotoxicology and Environmental Safety, 2002,51:128-132.
[12] 周永欣,章宗涉.水生生物毒性试验方法 [M]. 北京:农业出版社, 1989:180-182.
[13] Dorsey J, Yentsch C M, Mayo S, et al. Rapid analytical technique for the assessment of cell metabolic activity in marine microalgae [J]. Cytometry, 1989,10(5):622-628.
[14] Knauert S, Knauer K. The role of reactive oxygen species in copper toxicity to two freshwater green algae [J]. Journal ofPhycology, 2008,44(2):311-319.
[15] 修瑞琴,许永香,高世荣,等.砷与镉、锌离子对斑马鱼的联合毒性实验[J]. 中国环境科学, 1998,18(4):349-352.
[16] Xia Y L, Liu D D, Dong Y, et al. Effect of ionic liquids with different cations and anions on photosystem and cell structure of[J]. Chemosphere, 2018,195:437-447.
[17] Wen Y Z, Chen H, Shen C S, et al. Enantioselectivity tuning ofchiral herbicide dichlorprop by copper: roles of reactive oxygenspecies [J]. Environmental Science and Technology, 2011,45(11):4778-4784.
[18] Cai X Y, Liu W P, Sheng G Y. Enantioselective degradation and ecotoxicity of the chiral herbicide diclofop in three freshwater alga cultures [J]. Journal of Agricultural and Food Chemistry, 2008,56(6): 2139-2146.
[19] Chen Z W, Wang J, Chen H, et al. EnantioselectivePhytotoxicity of Dichlorprop to Arabidopsis thaliana: The Effect of Cytochrome P450Enzymes and the Role of Fe [J]. Environmental Science and Technology, 2017,51(20):12007-12015.
[20] 谢文平,覃顺枫,马丽莎,等.海南淡水养殖环境中有机氯农药及重金属残留情况分析[J]. 环境化学, 2017,36(6):1407-1316.
[21] Breitholtz M, Nyholm J R, Karlsson J, et al. Are individual NOEC levels safe for mixtures? A study on mixture toxicity of brominated flame-retardants in the copepod Nitocraspinipes [J]. Chemosphere, 2008,72(9):1242-1249.
[22] Otitoloju A A. Evaluation of the joint-action toxicity of binarymixtures of heavy metals against the mangrove periwinkle(L.) [J]. Ecotoxicology and Environmental Safety, 2002,53(3):404-415.
[23] 胡晓娜,张淑娴,陈彩东,等.异丙甲草胺与锌共存对斜生栅藻毒性手性差异影响[J]. 环境科学, 2014,35(1):292-298.
[24] 谢 荣,唐学玺,李永祺.有机磷农药和重金属对海洋微藻的联合毒性研究[J]. 海洋环境科学, 1999,18(2):16-20.
[25] 吴宗凡,刘兴国,王高学.重金属与有机磷农药二元混合物对卤虫联合毒性的评价及预测[J]. 生态毒理学报, 2013,8(4):602-608.
[26] 周启星,程 云,张倩茹,等.复合污染生态毒理效应的定量关系分析[J]. 中国科学(C辑). 2003,33(6):566-573.
Toxiceffects of the co-exposure to Cu and chlorpyrifos toward the freshwatergreen algae.
XU Dong-mei1, KE Wei1, WANG Yan-hua2*
(1.College of Biological and Environmental Engineering, ZhejiangShuren University, Hangzhou 310015, China;2.Institute of Quality Standards for Agricultural Products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China)., 2018,38(11):4348~4353
The residues of various heavy metals and pesticideshave been frequently detected in water environments, however, theirjoint toxicity is different from individual single toxicity. We evaluated the effects of single and co-exposure of organophosphorus pesticide chlorpyrifos and heavy metal Cu on acute toxicity, cellular permeability and anti-oxidative stress of freshwater green algae. The 72h-EC50for single exposure of Cu and chlorpyrifos to chlorella were 0.68 and 12.71μmol/L, respectively. The chlorophyll content of algal cells was decreased accordingly with the increasing concentration of Cu and chlorpyrifos, however, the cell permeability was increased with the higher concentrationof Cu and chlorpyrifos. The reactive oxygen species (ROS) and antioxidant enzymes were significantly induced in algae cells. As revealed by the additive index method, the joint effec of Cu and chlorpyrifos on acute toxicity wasin antagonistic mode, in consistent with the ROS production and antioxidant enzyme in chlorella vulgaris.
Cu;Chlorpyrifos;freshwater green algae;acute toxicity;permeability;oxidative stress
X503.2
A
1000-6923(2018)11-4348-06
徐冬梅(1974-),女,吉林长春人,教授,博士,主要从事生态毒理学方面的研究.发表论文40余篇.
2018-04-08
浙江省自然科学基金资助项目(LY18B070005);农业部农药残留检测重点实验室开放课题(2015PRG05);浙江树人大学中青年学术团队项目
* 责任作者, 副研究员, wangyanh79@163.com

