锰矿石人工湿地中去除双氯芬酸的机理研究
翟 俊,戴元贵,马宏璞,李媛媛,翟豪冲
锰矿石人工湿地中去除双氯芬酸的机理研究
翟 俊*,戴元贵,马宏璞,李媛媛,翟豪冲
(重庆大学,三峡库区生态环境教育部重点实验室,重庆 400045)
以双氯芬酸为目标有机药物污染物,探究其在以锰矿石为填料并接种了异化金属还原菌(,简称GS-15细菌)的垂直流人工湿地中的去除过程.结果表明,双氯芬酸在锰矿石人工湿地中的平均去除率最高为23.56%.采用XRD和XRF对反应前后的锰矿石进行物相和元素相对含量分析,得出锰(Mn)是参与降解双氯芬酸的关键响应元素.GS-15细菌利用锰矿石发生异化还原对双氯芬酸的氧化降解是锰矿石人工湿地对双氯芬酸的主要去除途径.此外,利用液质联用技术(LC-MS/MS)对降解产物进行鉴定,发现双氯芬酸被降解生成了5-羟基双氯芬酸、双氯芬酸-2,5-亚氨基琨和1,3-二氯苯三种降解产物,该研究成果对有机药物废水的深度处理提供新的方法和理论指导.
锰矿石;人工湿地;双氯芬酸;异化金属还原
新兴有机污染物如双氯芬酸等在水环境中普遍存在,虽然其浓度一般较低,但由于大部分有机药物都具有难降解、难处理的特点,以至于其长期存在于水环境中,会给环境中的生物带来潜在的、慢性的毒性影响[1].人工湿地作为生态友好型污水处理新技术,具有稳定、长期、有效去除污染物等特点[2],目前,研究者发现人工湿地系统在处理新兴有机污染物方面也具有一定的潜能,但其作用机理尚不明晰[3-4].由于人工湿地多处于厌氧或缺氧环境,人工湿地中新兴污染物的厌氧微生物降解成为消减新兴污染物的关键过程.异化金属还原过程是指异化金属还原微生物在厌氧条件下以高价金属氧化物作为电子受体化有机物的过程[5].金属元素(锰、铁等)在地壳中的丰度较高,使得异化金属还原广泛存在于厌氧有机物的降解过程[6].因此,细菌和金属氧化物的相互作用成为了地球化学领域的重要研究领域.
近年来,研究者在对异化还原菌研究中发现,异化金属还原过程对复杂有机物的降解有较好的作用.Ivanov等[7]利用富集培养的兼性厌氧铁还原菌对污水中雌激素的去除效果进行研究,报道了对有机物雌二醇的去除率达92%.但此类研究多集中于实验室单一菌种批次实验,对新兴污染物的去除机理以及高价铁锰氧化和微生物降解的贡献还鲜有研究.由此,在厌氧环境中通过人工投加锰矿物作为电子受体,探究结合异化金属还原反应降解有机药物的过程,分析有机药物在高价金属氧化物存在条件下对有机药物的去除机理,具有重要的科学意义和应用价值.
选取双氯芬酸为目标污染物,以天然锰矿石作为人工湿地填料,将异化金属还原菌(GS-15细菌)与人工湿地处理技术相结合,通过设置3组不同(锰矿石组、锰矿石加MnO2组和锰矿石加GS-15细菌组)的实验,探究其在垂直流人工湿地中的去除行为,以期为新兴污染物废水的深度处理提供新的方法和理论指导.
1 材料与方法
1.1 主要试剂与仪器
主要试剂:双氯芬酸(纯度>98.0%,色谱纯)和细菌(简称GS-15细菌)分别购自日本梯希爱公司和美国ACTT公司.
主要仪器:高效液相色谱仪(High Performance Liquid Chromatography,型号:Agilent 1260,安捷伦科技有限公司)、质谱仪(Mass Spectrograph,型号: Agilent 6410B MS QQQ,安捷伦科技有限公司).

表1 目标化合物的理化性质
1.2 装置设计
实验装置由有机玻璃制成的3套圆柱状垂直流人工湿地模拟系统组成(图1,直径150mm,高1000mm),水流为向上流,采用连续运行模式.该3套圆柱状垂直流人工湿地装置均填充天然锰矿石(粒径为6~10mm,MnO2含量约为11.26%),并且共用一个总容积约60L的进水箱.氮气罐和湿地装置与进水箱之间均采用硅胶管连接.在恒温实验室内运行该实验装置.使用黑色牛皮纸包裹装置,以防止光照对目标物质的降解[8].同时在垂直流人工湿地系统的填料区域内设置四个取样口(直径10mm,间距160mm),用于探究目标污染物的沿程去除效果.

图1 实验装置示意
1.3 装置运行与采样分析方法
实验选取适应性强的风车草(, CA)作为湿地植物.用人工配制的生活污水进行连续培养,每次配制含目标污染物浓度约0.50mg/L的进水.通过曝氮气严格控制进水箱为厌氧环境,采用3台蠕动泵调节进水流量.在3个不同水平条件下,同时探究锰矿石人工湿地分别对目标污染物的去除效果,每组稳定运行2个月,每6d测定一组数据.
填料中目标污染物吸附量的测定: ①从锰矿石人工湿地系统中取出全部填料,混合匀称,暗处晾干称重; ②分别取3份等量的锰矿石,分别置于250mL的锥形瓶中,每一个锥形瓶中加入一定量的甲醇,并恰好浸没矿石,在超声波清洗仪里超声1h后,置于200r/min的空气恒温振荡器中振荡24h; ③将上述溶液转移、浓缩至近干,再用甲醇定容至5mL,高效液相色谱测定.
植物中目标污染物吸收量的测定: ①从锰矿石人工湿地系统中取出全部植物,并暗处晾干,然后将根茎叶分别剪开称重; ②用一定量的甲醇分三次对湿地植物根组织进行洗脱,每一次洗脱2h; ③将洗脱后的溶液进行浓缩,再用甲醇定容至5mL,高效液相色谱测定; ④将植物的根茎叶组织分别剪碎,再分别从中随机取出20g,捣碎研磨后,转移至250mL的锥形瓶中,加入200mL甲醇,置于200r/min的空气恒温振荡器中振荡24h, ⑤然后以2000r/min的速度离心15min,利用0.22μm的有机滤膜过滤上清液,滤液浓缩至近干后用甲醇定容至5mL,高效液相色谱测定.
2 结果与讨论
2.1 锰矿石人工湿地对双氯芬酸的去除效果
3个实验组中,双氯芬酸在锰矿石人工湿地中的去除效果如图2所示.结果表明,双氯芬酸在锰矿石人工湿地中的平均去除率最高为23.56%.针对三个不同水平条件下双氯芬酸的去除效果进行F检验发现,锰矿石组(平均去除率11.35%)和锰矿石加MnO2组(平均去除率10.63%)对双氯芬酸的去除均无显著性影响(>0.05),而锰矿石组和锰矿石加MnO2组对双氯芬酸的去除效果均极显著地小于锰矿石加GS-15细菌组(平均去除率23.56%)对双氯芬酸的去除效果(<0.01).

图2 锰矿石人工湿地对双氯芬酸去除率随时间的变化
2.2 锰矿石人工湿地不同深度对双氯芬酸的去除效果
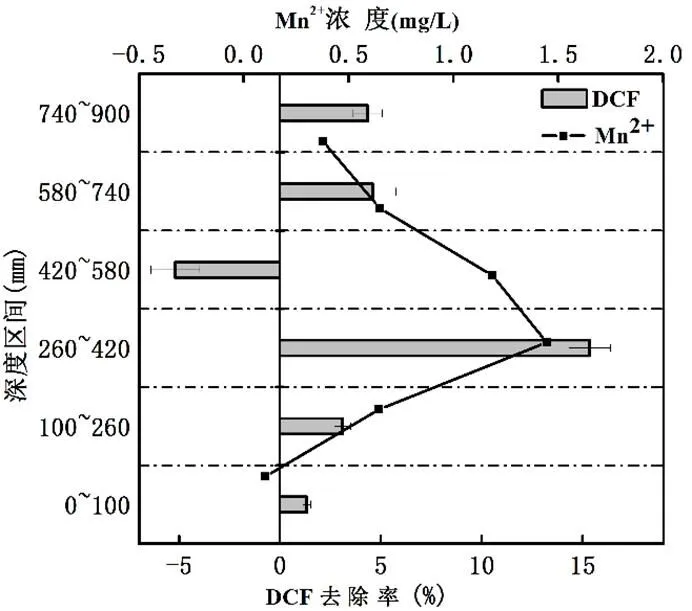
图3 二价锰离子浓度变化及其锰矿石人工湿地对双氯芬酸去除率的沿程变化
锰矿石人工湿地的二价锰离子变化及其双氯芬酸去除率的竖向沿程变化如图3所示.由于在锰矿石加GS-15细菌组中人工湿地系统的填料区域260mm位置处加入了异化金属还原GS-15菌,该部位对双氯芬酸的去除率显著增高,相对应的该部位的二价锰离子浓度也是整个锰矿湿地最高的,而其他深度区间对双氯芬酸的去除率和锰离子的浓度变化均无显著性差异(>0.05).由此,异化金属还原菌加入能显著提高双氯芬酸的去除效率.
2.3 锰矿石人工湿地对双氯芬酸去除机理
2.3.1 湿地反应前后锰矿石特性表征分析 对反应前后锰矿石的成分进行XRD分析(图4),发现锰矿石成分中主要由钙硬锰矿和钙锰辉石组成.但由于反应过程当中锰矿石参与反应的量相对较少,通过对比锰矿石反应前后的物相变化,发现二者之间没有显著差异.而Liu等[9]认为纳米级的锰矿石具有非常大的比表面积,可以有效去除有机药物.从XRF图(图5)中可以看出,锰矿石中共含有11种金属元素和3种非金属元素.分析比较锰矿石反应前后元素含量的变化,结果表明,锰(Mn)在矿石中的金属元素含量最高,并且反应前后的相对减小量约7.27%.在厌氧环境反应体系中,Mn(IV)被还原成Mn(II),所以Mn是参与降解双氯芬酸的关键响应元素.

图4 反应前后锰矿石XRD的测试结果
2.3.2 锰矿石人工湿地对双氯芬酸去除作用的分析 锰矿石人工湿地系统对双氯芬酸的去除过程主要包含锰矿石的直接吸附、植物对双氯芬酸的吸收截留以及人工湿地系统中锰矿石、植物、细菌协同降解作用(图6).其中,植物的吸收及锰矿石的吸附对双氯芬酸的截留作用均比较小,湿地中大部分双氯芬酸的去除是由于生物化学过程降解的(96.08%).而在锰矿石加GS-15细菌组中,84.00%的双氯芬酸去除是在0~420mm区域(富含外加GS-15细菌)完成.这也说明植物对双氯芬酸的降解作用比较小.同时,锰矿石组与锰矿石加MnO2组对双氯芬酸的去除率均显著小于锰矿石加GS-15细菌组对双氯芬酸的去除率(<0.05).Zhang等[10]研究结果表明生物氧化锰滤池对双氯芬酸的去除率大于填充天然沸石的滤池,并且该研究进一步阐述了随着反应的进行天然锰矿石中的锰氧化物对双氯芬酸的氧化降解作用逐渐减弱,原因在于还原性活性位点的饱和.据此可知,设置锰矿石加MnO2有助于与锰矿石组形成对比,而在锰矿石加GS-15组,GS-15细菌的加入能显著提高双氯芬酸的去除效率.因此,在锰矿石、细菌与植物对双氯芬酸的协同降解作用中,GS-15细菌利用锰矿石发生异化还原的过程对双氯芬酸的降解起到了主导作用.
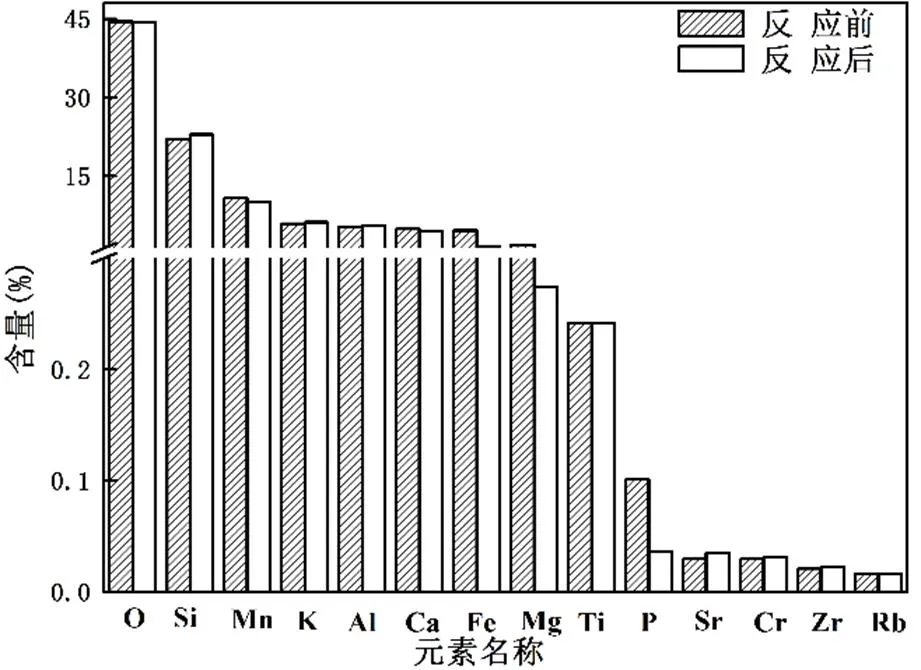
图5 反应前后锰矿石XRF的测试结果
2.3.3 锰矿石人工湿地系统对双氯芬酸的降解产物分析 对出水中DCF的降解产物通过液质联用技术进行检测,分析出三种可能的降解产物,其色谱分离时的保留时间分别为r1=9.834min,r2= 10.074min和r3=13.219min,质荷比分别为/=312、310和149.Huguet和Forrez等研究学者报道双氯芬酸被生物锰氧化物降解生成了质荷比为312的5-羟基双氯芬酸和质荷比为310的双氯芬酸-2,5-亚氨基琨[11,13].同时结合文献[11-15],由此推断双氯芬酸在锰矿石人工湿地中可能也被氧化降解为5-羟基双氯芬酸(P1,5OH-DCF)、双氯芬酸-2,5-亚氨基琨(P2,DCF- 2,5-IQ).对/=149的降解产物P3进行二级质谱分析以及通过与相应标准品的质谱数据进行对比可推断其为1,3-二氯苯.
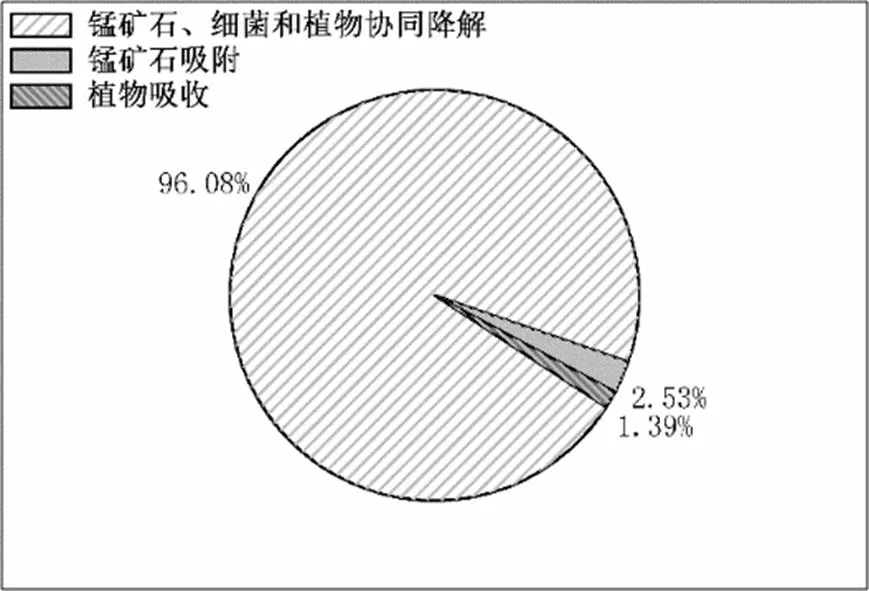
图6 锰矿石人工湿地中不同作用对双氯芬酸去除的贡献率

表2 双氯芬酸的降解产物
根据降解产物的鉴定结果可推断出DCF在锰矿石人工湿地内可能的氧化降解途径,如图7所示.DCF首先通过羟基化生成5OH-DCF,随后进一步脱氢氧化生成DCF-2,5-IQ.而1,3-二氯苯则可能是由DCF、5OH-DCF或者DCF-2,5-IQ分子上含氯原子一侧苯环上的C-N键断裂得到.为了验证1,3-二氯苯的这3种产生途径是否可行,利用Gaussian软件对DCF、5OH-DCF和DCF-2,5-IQ分子中的该位置的C-N键的键参数进行了计算.计算结果表明,DCF、5OH-DCF和DCF-2,5-IQ分子上含氯原子一侧苯环上的C-N键的平均键长分别为1.38438nm,1.38713nm和1.39280nm.由此可见, DCF-2,5-IQ苯环上C-N键的平均键长最长,键能最小,最容易发生断裂.在此基础上,利用ABEEMσπ/ MM模型对DCF-2,5-IQ及其降解产物的分子能量进行计算,其优化值分别为-47329.711eV, -31328.028eV和-16034.032eV.DCF-2,5-IQ降解生成1,3-二氯苯(1,3-DCB)的反应热等于-32.348eV,反应热小于零,表明该反应在一定条件下能够自发进行.因此, DCF-2,5-IQ分子中含氯一侧的C-N键断裂产生1,3-二氯苯的途径是可能的.

图7 双氯芬酸的降解途径
需要注意的是,随着目标污染物双氯芬酸在锰矿石人工湿地装置中被氧化降解为其他产物,该系统中有机药物的生物毒性也会发生相应的变化. Wang等[16]揭示了1,3-二氯苯的生物毒性高于双氯芬酸.Salaeh等[17]报道了DCF氧化降解生成的5OH-DCF和DCF-2,5-IQ都具有一定的生物毒性.但随着反应的进行,其复合生物毒性先增加后减小至低于母体化合物.目前锰矿石人工湿地系统对DCF氧化降解的产物能否被体系中过量的Mn(IV)继续异化金属还原尚不清晰.故该研究对进一步评估双氯芬酸对环境的潜在生物毒性影响具有重要意义.
3 结论
3.1 双氯芬酸在锰矿石加GS-15细菌组(平均去除率23.56%)的去除效果极显著地大于锰矿石组和锰矿石加MnO2组(平均去除率分别为11.35%和10.63%) (<0.01).
3.2 GS-15细菌利用锰矿石发生异化还原对双氯芬酸的氧化降解是锰矿石人工湿地对双氯芬酸的主要去除途径.
3.3 结合反应后双氯芬酸的降解产物,获得了以锰矿石驱动的异化金属还原菌介导下锰矿石人工湿地对双氯芬酸的降解途径.
[1] Vieno N, Sillanpää M Fate of diclofenac in municipal wastewater treatment plant - a review [J]. Environment International, 2014, 69(30):28.
[2] Vergeles Y, Vystavna Y, Ishchenko A, et al. Assessment of treatment efficiency of constructed wetlands in East Ukraine [J]. Ecological Engineering, 2015,83:159-168.
[3] Li Y, Zhu G, Ng W J, et al. A review on removing pharmaceutical contaminants from wastewater by constructed wetlands: design, performance and mechanism. [J]. Science of the Total Environment, 2014,s468–469(1):908-932.
[4] Liu R, Zhao Y, Doherty L, et al. A review of incorporation of constructed wetland with other treatment processes [J]. Chemical Engineering Journal, 2015,279:220-230.
[5] 刘志丹,周 良,杜竹玮,等.异化金属还原菌的研究进展 [J]. 微生物学通报, 2005,32(5):156-159.
[6] Lovley D R, Holmes D E, Nevin K P Dissimilatory Fe(III) and Mn(IV) reduction.[J]. Advances in Microbial Physiology, 1991,55(2):259-87.
[7] Ivanov V, Lim J JWJ, Stabnikova O, et al. Biodegradation of estrogens by facultative anaerobic iron-reducing bacteria. [J]. Process Biochemistry, 2010,45(2):284-287.
[8] 景瑞瑛,杨 扬,戴玉女,等.布洛芬和双氯芬酸在不同构型人工湿地中的去除行为研究 [J]. 环境科学, 2016,37(7):2577-2585.
[9] Liu W, Sutton N B, Rijnaarts H H M, et al. Pharmaceutical removal from water with iron- or manganese-based technologies: A review [J]. C R C Critical Reviews in Environmental Control, 2016,46(19/20): 1584-1621.
[10] Zhang Y, Zhu H, Szewzyk U, et al. Removal of pharmaceuticals in aerated biofilters with manganese feeding [J]. Water Research, 2015, 72:218-226.
[11] HuguetMélissa, Deborde Marie, PapotSébastien, et al. Oxidative decarboxylation of diclofenac by manganese oxide bed filter [J]. Water Research, 2013,47(14):5400-5408.
[12] Lee Hyun-Jeoung, Lee Eunhwa, Yoon Sung-Hwa, et al. Enzymatic and microbial transformation assays for the evaluation of the environmental fate of diclofenac and its metabolites [J]. Chemosphere, 2012,87(8):969-974.
[13] Forrez I, Carballa M, Verbeken K, et al. Diclofenac oxidation by biogenic manganese oxides [J]. Environmental Science & Technology, 2010,44(9):3449-3454.
[14] Kosjek Tina, Heath Ester, Pérez Sandra, et al. Metabolism studies of diclofenac and clofibric acid in activated sludge bioreactors using liquid chromatography with quadrupole–time-of-flight mass spectrometry [J]. Journal of Hydrology, 2009,372(1–4):109-117.
[15] Galmier M J, Bouchon B, Madelmont J C, et al. Identification of degradation products of diclofenac by electrospray ion trap mass spectrometry [J]. Journal of Pharmaceutical and Biomedical Analysis, 2005,38(4):790-796.
[16] Wang C, Lu G H, Li Y M. QSARs for the Chronic Toxicity of Halogenated Benzenes to Bacteria in Natural Waters [J]. Bulletin of Environmental Contamination & Toxicology, 2005,75(1):102-108.
[17] Salaeh S, Perisic D J, Biosic M, et al. Diclofenac removal by simulated solar assisted photocatalysis using TiO2-based zeolite catalyst; mechanisms, pathways and environmental aspects [J]. Chemical Engineering Journal, 2016,304:289-302.
Mechanisms of diclofenac removal in manganese ore constructed wetland.
ZHAI Jun*, DAI Yuan-gui, MA Hong-pu, LI Yuan-yuan, ZHAI Hao-chong
(Key Laboratory of the Three Gorges Reservoir Region’s Eco-Environment, Chongqing University, Chongqing 400045, China)., 2018,38(11):4056~4060
This study investigated diclofenac (DFC) removal in a vertical flow constructed wetland, in which manganese ores were used as substrates, and dissimilatory metal reducing bacteria (GS-15) were added as inoculum. The results indicated that maximum average removal of DFC was 23.56% in this wetland. After analyzing the manganese ores by XRD and XRF before and after the experiments, Mn was identified as the key element participating DFC removal. The main DFC removal pathway in the wetland is the dissimilatory Mn(IV) reduction. In this process, DFC was degraded by GS-15using manganese ores as the electron acceptor. In addition, LC-MS/MS analysis was used to identify the degradation intermediates of DCF. Three intermediates are identified, namely 5-hydroxydiclofenac (5-OH-DCF), diclofenac-2, 5-iminoquinone (DCF-2, 5-IQ), and 1,3-dichlorobenzene (1,3-DCB). The results of this research provide new insight and theoretical guidance on the advanced technologies for pharmaceutical treatment in wastewater.
manganese ores;constructed wetlands;diclofenac;dissimilatory metal reduction
X52
A
1000-6923(2018)11-4056-05
翟 俊(1977-),男,江苏溧阳人,教授,博士,从事废水处理理论与技术研究.发表论文50余篇.
2018-04-18
国家自然科学基金项目(51478062)
* 责任作者, 教授, zhaijun@cqu.edu.cn

