花生胚胎发育晚期丰富蛋白基因AhLEAL的克隆及其在非生物胁迫下的表达分析
陈 娜,程 果,陈明娜,姜健美,潘丽娟,陈 静, 王 通,王 冕, 杨 珍,迟晓元*,禹山林*
(1.山东省花生研究所,山东 青岛 266100; 2.青岛市出入境检验检疫局,山东 青岛 266001;3.青岛诚誉食品检测有限公司 山东 青岛 266108)
生物胁迫和非生物胁迫严重影响植物的生长和产量。非生物胁迫是世界范围内农作物减产的主要原因,导致多数主要农作物平均产量下降50%以上[1-2]。使作物在不利的生长条件下生长并达到一定的产量非常重要。尽管植物中有关生物胁迫和非生物胁迫的研究已经很多,但是许多方面仍不清楚。
胚胎发育晚期丰富蛋白(Late embryogenesis abundant,LEA)最早发现于棉花和小麦中[3-5]。目前许多植物中均克隆到了LEA基因,根据表达模式和序列差异LEA蛋白可至少分为6组[2, 6-7]。例如模式植物拟南芥中的51个LEA蛋白共分为9组(LEA_1,LEA_2,LEA_3,LEA_4,LEA_5,Dehydrin,SMP,Pv-LEA18和AtM)[8-9]。LEA在胚胎发育后期大量产生,占整个细胞蛋白的4%以上[10],后期脱水时达到最大值[11]。目前的研究表明,LEA蛋白主要参与植物应答脱水相关的非生物逆境胁迫,包括耐盐、抗旱、抗冻等生物学过程。拟南芥中一些LEA蛋白已被证明参与了干旱和低温冷冻胁迫的应答[12-15]。但是拟南芥LEA基因的表达不完全受高盐、干旱等失水相关胁迫的调控,同一组LEA基因的表达也并不一致[8, 16]。水稻、小麦和玉米等农作物中也均有LEA蛋白提高转基因植株耐旱性、耐盐性或耐低温能力的报导[17-22]。也有少量研究表明,植物LEA蛋白参与应答抗病等生物胁迫[23]。许多研究也报导了拟南芥可能的作用机理,如通过保留水分维持细胞在干旱胁迫下的正常结构,维持离子平衡或诱导其他蛋白的保护作用[2, 6-7,24]。尽管已有上千个植物LEA蛋白基因得以分离,但对该类基因的生物学功能的研究仅限于少数几种植物中的成员。花生是我国重要的油料作用,总产量居我国油料作物之首,也是我国具有国际竞争力的农产品之一[25]。环境温度、土壤湿度等均可影响花生生长发育和产量[26-28]。然而花生中有关非生物胁迫调控的分子生物学研究较少,处于刚刚起步的阶段。虽然一些基因已经被证明可能参与了花生非生物胁迫的调控并得到了克隆[29-33],但是花生抗逆基因的挖掘还有许多工作要做。
本研究对花生中一个胚胎发育晚期丰富蛋白基因AhLEAL进行了克隆及非生物胁迫下表达模式研究,结果证明该基因在花生中对低温、干旱、高盐和ABA胁迫均有明显响应,表明该基因可能通过依赖ABA的方式参与了花生对非生物胁迫抗性的调控。
1 材料与方法
1.1 植物材料
花生(ArachishypogaeaL.)品种为花育33号,该品种是由本项目组创制的亲本杂交后选育到的高产抗逆新品种。将种子播种在营养土与蛭石(质量比2∶1)的混合土中,萌发后在光照16 h(28℃)/黑暗8h(22℃)的光照培养箱中生长,待幼苗生长至三叶期后进行处理。低温处理:将花生幼苗置于光照培养箱中,温度设定为4℃;NaCl、PEG6000(聚乙二醇,polyethylene glycol)和ABA处理:将花生幼苗从土中拔出,小心冲洗干净根部土后直接浸泡到200 mmol·L-1NaCl、20% PEG6000或100 μmol·L-1ABA溶液中。均在处理0、1、3、6、12、24、48和72 h后分别取叶片和根,液氮冷冻保存,作为后续试验材料。
1.2 试验试剂
总RNA提取试剂盒、TOP10感受态购自天根生化科技有限公司。核酸染料Super Gelred购自US Everbright®Inc。LATaqDNA聚合酶,pMD18-T载体,荧光定量PCR用SYBR Premix Ex Taq聚合酶购自大连宝生物。M-MLV反转录酶购自Promega。凝胶回收试剂盒、质粒提取试剂盒购自Omega公司。
1.3 RNA提取与cDNA合成
样品总RNA的提取用天根的RNeasy Mini Kit,详细方法参考其使用说明。合成cDNA前要将提取的RNA用DNaseI处理以去除DNA污染。用M-MLV反转录酶进行cDNA的合成,每25 μL反应体系中加入2 μg RNA;反转录反应体系在42°C进行1 h,之后置于冰上冷却5 min。
1.4 基因全长的扩增
根据cDNA文库中已知的花生胚胎发育晚期丰富蛋白的全长序列,设计扩增该基因全长的引物,引物序列如下:5'-CCCTCAAATAATCACAATAC-3'和5'-AGAACAGAGTGGCAGAGT-3'。以反转录cDNA为模板,通过普通RT-PCR扩增该基因。PCR反应条件如下:94°C 2min;94°C 30s,55°C 30s,72°C 1min;35个循环;72°C 10min。
1.5 序列分析
将所测得的序列利用NCBI网站(http://www.ncbi.nlm.nih.gov)上的BLAST工具进行基因序列的相似性及同源性查找,并利用这些序列进行基因同源性的比较,cDNA全长序列的开放阅读框(open reading frame,ORF)分析用www.ncbi.nlm.nih.gov网站ORF finder在线分析。根据所测得基因的cDNA序列推导其氨基酸序列,并利用序列分析工具对其进行分析:采用Protparam(http://web.expasy.org/protparam/)预测蛋白的基本物理化学性质;蛋白的结构功能域在NCBI的CDSS(Conserved Domain Search Service)数据库上进行分析;蛋白的二级结构预测采用SOPMA Secondary Structure Prediction Method (https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl);利用Protcomp (http://linux1.softberry.com/berry.phtml?group=programs&subgroup=proloc&topic=protcomppl)分析蛋白质的亚细胞定位情况。
1.6 多序列比对分析
选取GenBank中不同物种的胚胎发育晚期丰富蛋白,采用DNAman软件的multiple alignment进行多序列比对分析,创建一个不同来源的LEA多序列的比对结果。
1.7 荧光定量RT-PCR进行基因表达分析
进行荧光定量PCR时,先将cDNA样品稀释到8 ng·μL-1,每反应体系中加2 μL稀释后的cDNA。荧光定量PCR仪采用Roche的LightCycler 2.0。反应条件: 95°C 10s; 95°C,5s;60°C,30s;72°C,10s;40个循环;绘制溶解曲线,温度每10s升高0.5°C。本试验所用的内参基因为Actin11,每个样品重复3次,取平均值,采用delta-delta Ct方法分析数据,误差线为3次重复的标准偏差。荧光定量所用引物如下:Actin11引物为5'-TTGGAATGGGTCAGAAGGATGC-3'和5'-AGTGGTGCCTCAGTAAGAAGC-3';AhLEAL引物为5'-TAACTAACAAACTCGTC CTT-3'和5'-AACTATGGCATTGAATTGAA-3'。
2 结果与分析
2.1 AhLEAL基因的克隆
本研究通过序列分析从已有cDNA文库中获得花生胚胎发育晚期丰富蛋白基因全长,根据已知序列设计引物,通过普通RT-PCR扩增得到该基因。该基因全长为555 bp,开放阅读框ORF为291 bp,编码97个氨基酸(图1)。核苷酸序列比对表明,该基因与花生中已注册基因AhARG2(XM_016113504)同源性为100%,与AhLEA6-1(HM543588)同源性为99%。

图1 AhLEAL基因的核苷酸及氨基酸序列 Fig.1 Nucleotide sequence and deduced amino acid sequence of AhLEAL
在NCBI网站上对该基因编码的蛋白进行Blast分析,发现该蛋白与沙冬青(Ammopiptanthusmongolicus)、牧豆树(Prosopisjuliflora)和柠条锦鸡儿(Caraganakorshinskii)等植物中的胚胎发育晚期丰富蛋白同源性达到近65%(图2)。将该基因命名为AhLEAL(ArachishypogaeaLate-embryogenesisabundantprotein-likeprotein)。
2.2 AhLEAL蛋白理化性质及结构分析
利用ProtParam分析显示,AhLEAL的理论分子量为10.19 kDa,理论等电点为10.06,平均亲水系数 (grand average of hydropathicity, GRAVY)是-0.494,说明该蛋白为亲水性蛋白;通过蛋白质亚细胞定位工具预测,这个蛋白可能定位于细胞液和多种细胞器包括线粒体、内质网和叶绿体中。蛋白质二级结构预测结果显示,AhLEAL中α螺旋占50.52%,β折叠占12.37%,延伸链占6.19%,无规则卷曲占30.93%;保守结构域预测结果表明该蛋白有LEA_3保守结构域。
2.3 AhLEAL基因在非生物胁迫下的表达变化
2.3.1AhLEAL基因在花生根和叶片中低温胁迫下的表达变化
图3可看出,无论在叶片还是根中,AhLEAL在转录水平上的表达对低温响应非常明显。在低温处理1 h后AhLEAL的表达就有所上调,随着低温处理时间的延长,AhLEAL的表达逐渐增高,至处理72 h表达量达到最高(图3)。与未处理的材料相比,AhLEAL在叶片中的表达量最高达到100倍以上(图3a),在根中最高可达12倍以上(图3b)。

图2 AhLEAL与其他物种胚胎发育晚期丰富蛋白氨基酸序列比对 Fig.2 Comparison of deduced amino sequence of AhLEAL with LEAs from other species注:Ah:Arachis hypogaea 花生;Ck:Caragana korshinskii柠条锦鸡儿;Am:Ammopiptanthus mongolicus 沙冬青蛋白序列号(Protein Sn):PjLEA: ABG66530; CkLEA1: AGN90999; AmLEAL: AAW31666; AhLEA: ACF74336
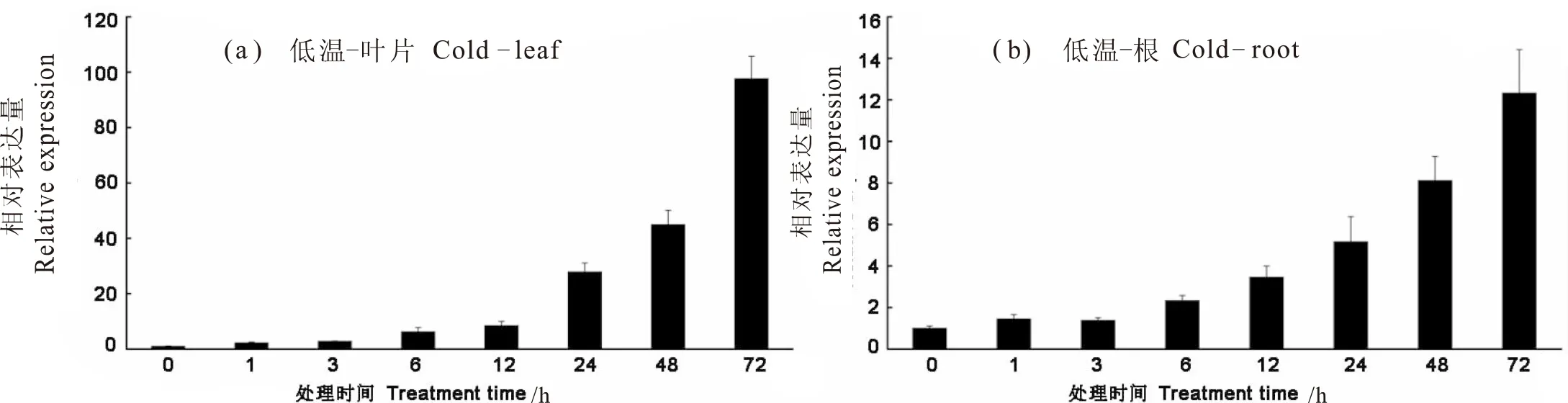
图3 AhLEAL基因在花生叶片和根中在低温胁迫下的表达模式分析 Fig.3 Expression analysis of AhLEAL in root and leaf under cold stress
2.3.2AhLEAL基因在花生根和叶片中干旱胁迫下的表达变化
AhLEAL在花生叶片和根中对干旱胁迫响应不明显(图4)。在花生根中干旱处理后表达略有增加,至处理的6 h表达量达最高,随后又有所下降(图4b)。
2.3.3AhLEAL基因在花生根和叶片中高盐胁迫下的表达变化
AhLEAL在花生叶片和根中对高盐胁迫响应明显(图5)。无论在花生叶片或根中,该基因的表达均在盐胁迫1 h即开始上调,至6 h表达量达到最高,随后有所降低。在根中的最大上调倍数(50倍以上)要高于叶片中(10倍以上)。
2.3.4AhLEAL基因在花生根和叶片中ABA胁迫下的表达变化
AhLEAL的表达在花生叶片和根中均受ABA的明显诱导(图6),无论在花生叶片或根中,该基因的表达均在ABA胁迫1 h后表达量即达到最高,随后有所降低。在根中的最大上调倍数(25倍以上)要高于叶片中(6倍以上)。

图4 AhLEAL基因在花生叶片和根中在干旱胁迫下的表达模式分析 Fig.4 Expression analysis of AhLEAL in root and leaf under drought stress
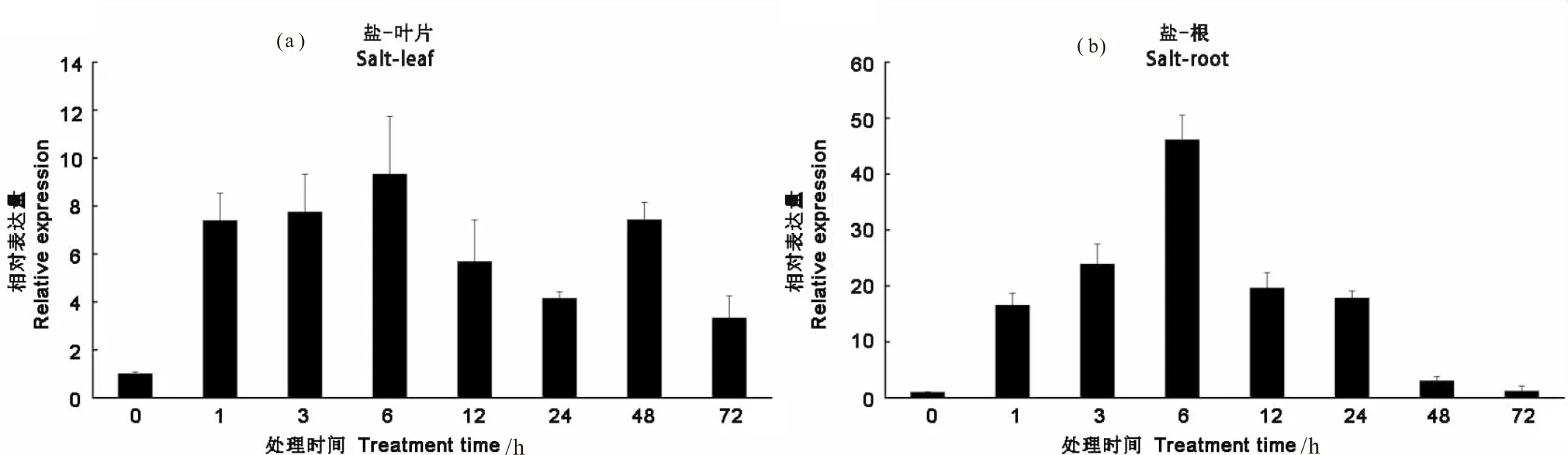
图5 AhLEAL基因在花生叶片和根中在高盐胁迫下的表达模式分析 Fig.5 Expression analysis of AhLEAL in root and leaf under salt stress
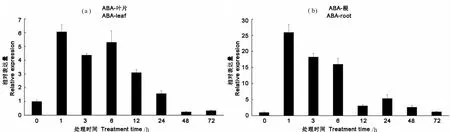
图6 AhLEAL基因在花生叶片和根中在ABA胁迫下的表达模式分析 Fig.6 Expression analysis of AhLEAL in root and leaf under ABA stress
3 讨 论
作为重要的油料作物,低温、高盐和干旱等非生物胁迫严重影响花生的生长和产量[31,34]。鉴定参与花生非生物胁迫调控的关键基因,是通过基因工程技术培育高产抗逆花生种质的基础。目前,花生基因组测序工作已经完成,序列拼接与组装工作正在进行中,然而大部分基因的功能尚未得到验证,因此功能基因的克隆与鉴定仍是目前花生中非生物胁迫研究工作的重要组成部分。
LEA蛋白是植物中广泛存在的一类小分子亲水性蛋白。经过三十多年的研究,越来越多的证据表明,植物LEA蛋白广泛地参与应答非生物逆境胁迫(尤其是失水胁迫)的生理过程中,并在提高植物抗逆性方面发挥重要的功能,但是该类蛋白确切的生化功能和作用机制仍不完全清楚。
LEA蛋白的序列分析表明,该类蛋白通常具有高度的亲水性,半胱氨酸(Cys C)/色氨酸(Trp W)含量较低或缺失,或甘氨酸(Gly G)、丙氨酸(Ala A)、谷氨酸(Glu E)、赖氨酸(Lys K)、精氨酸(Arg R)、苏氨酸(Thr T)几种氨基酸含量较高等[35]。从图1 AhLEAL编码氨基酸序列来看,AhLEAL蛋白中甘氨酸、丙氨酸、谷氨酸、赖氨酸和精氨酸含量均较高,以上氨基酸占该蛋白氨基酸组成的近50%;而半胱氨酸/色氨酸很少,整个序列中仅包含1个色氨酸。氨基酸序列组成说明AhLEAL也具有高度的亲水性。拟南芥LEA蛋白成员亚细胞定位分析表明,LEA蛋白广泛分布于不同的细胞器内,暗示LEA蛋白可在细胞的不同部位参与调控细胞的抗逆性[36]。亚细胞定位预测分析表明,花生AhLEAL也是定位于多个细胞器内,与拟南芥中研究相符。
已有研究表明,LEA蛋白主要在种子发育后期积累,并且该蛋白的表达对多种胁迫如干旱、紫外线、盐、低温和损伤均有响应[37]。甜椒中一个非典型的LEA蛋白基因CaLEA6在PEG、ABA和盐胁迫处理下表达升高,该基因在烟草中超表达能够提高转基因植物对干旱和盐胁迫的抗性[38]。大麦中的LEA-3组基因HVA1基因在水稻、玉米、燕麦、桑树和菜豆中异源超表达均不同程度地提高了转基因植物的抗旱性或耐盐性[20]。此外,小麦和大麦的脱水素基因在提高作物耐盐/抗旱、耐寒性方面也有深入研究[21]。玉米LEA蛋白成员ZmLEA3参与应答低温胁迫,在烟草中转基因超表达提高烟草耐寒性[22]。本研究结果表明,花生AhLEAL在花生叶片和根中对低温和盐胁迫均有明显响应,在根中对干旱胁迫也有明显响应,这表明该蛋白在花生非生物胁迫适应性中可能有重要功能,与前人研究结果一致。今后还需通过转基因手段确定AhLEAL在植物抗逆性中的功能。
荧光定量PCR结果还表明,AhLEAL在花生叶片和根中对ABA均有较为明显的响应。植物对非生物胁迫的逆境适应性调控路径有ABA-dependent的方式和ABA-independent的方式[39],推测该蛋白在根中通过ABA-dependent方式起作用。甜椒CaLEA6的表达受ABA的诱导[38]。水稻中LEA_2和LEA_3组中的LEA基因的表达对ABA胁迫也有强烈响应[40]。Dehydrins(DHNs)属于LEA蛋白家族的2组成员,Cao等的研究表明,橡胶树HbDHN2的表达受ABA的极大诱导[41]。本实验结果也表明LEA蛋白与ABA信号途径关系密切。
本研究初步证明了花生胚胎发育晚期丰富蛋白基因AhLEAL的表达受各种非生物胁迫诱导,可能参与了花生非生物胁迫抗性调控过程。下一步将通过遗传转化将该基因转入花生或拟南芥中,对该基因在非生物胁迫适应性中的功能做详细分析,对其可能的作用机制做深入研究。

