花生鞘脂Δ8去饱和酶基因(AhSLD2)的克隆与表达分析
李昊远,郝翠翠,陈明娜,陈 娜,王 冕,潘丽娟, 王 通,禹山林,侯艳华,迟晓元*
(1. 哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209;2. 山东省花生研究所,山东 青岛 266100; 3. 青岛科技大学海洋科学与生物工程学院,山东 青岛 266042)
农业是对环境最为依赖的脆弱产业,我国是农业大国,每年由于受干旱、低温、污染等灾害的影响,造成的损失达数十亿元。随着全球气候恶化,损失还在加剧。花生是广泛种植的油料作物,虽然花生的耐贫瘠耐干旱性较强,但花生对环境的依赖性依然较强,低温、高盐等逆境胁迫会使花生产量和品质大幅下降[1],不仅给农民造成严重的经济损失,也给我国的食用油安全带来不良影响,因此对花生品种进行抗逆性改良具有重要意义。
鞘脂是一类脂肪酸的衍生物,由1分子鞘氨醇骨架、1分子极性基团和1分子脂肪酸长链组成[2]。鞘脂存在于所有动物、植物和真菌中,在一些原核生物和病毒中也有发现[3]。鞘脂是生物膜结构的重要组成成分[4],占高等植物脂质的10%左右[5],是植物细胞内膜系统的主要脂质成分,在质膜和液泡膜中含量丰富。鞘脂也是重要的调控分子,作为代谢物介导细胞程序性死亡和脱落酸依赖性信号转导的过程、植物对缺氧的响应和病原体攻击的响应等过程[6-8]。研究表明,鞘脂与植物的抗逆性相关[9],对22个植物物种的调查研究显示,抗寒物种中的顺式t18∶1鞘脂含量明显高于其他物种。
鞘脂Δ8去饱和酶(SLD)是催化t18∶0鞘脂长链碱基(LCB)C8位去饱和生成t18∶1鞘脂的一类酶。该家族的酶结构相对保守,都含有N-末端细胞色素b5结构域和三个组氨酸保守域结构。SLD最先从向日葵中分离得到[10],随后相继在拟南芥、烟草等植物中分离得到。拟南芥叶中85%~90%的鞘脂都含有由SLD产生的顺式或反式Δ8双键。研究还发现,不同的SLD催化产物中的顺式和反式产物的比例不同[11]。前人已从拟南芥、烟草、油菜等植物分离得到了SLD,并对其生物学功能进行了研究,但是在花生中研究较少。
本研究从花生中克隆得到了AhSLD2基因,并对基因序列信息及编码的氨基酸序列信息进行分析,利用荧光定量PCR对该基因在花生中的表达特性进行分析。研究为花生抗逆性改良提供基因资源,为阐明花生抗逆分子机制提供理论基础。
1 材料与方法
1.1 植物材料
花生品种为花育33号,将花生种子种于混合土中(营养土∶蛭石=2∶1),置于光照培养箱中培养,培养周期:16 h(28℃)光照,8h(22℃)黑暗。待花生幼苗生长到三叶期时,分别采集根、茎、叶、子叶和下胚轴,在盛花期采集花。待开花下针后,分别采集其下针后10、20、30、40、50和60 d的种子。
花生生长到三叶期后分别对根和叶进行多种非生物胁迫处理。高盐处理:200 mmol/L NaCl分别对根和叶处理0、1、3、6、12、24、48、72 h;干旱处理:20% PEG6000分别对根和叶处理0、1、3、6、12、24、48、72 h;脱落酸(ABA)处理:100 μmol/L ABA分别对根和叶处理0、1、3、6、12、24、48、72 h;低温处理:4 ℃处理花生叶片0、1、3、6、12、24、48 h,花生根在低温条件下基因表达量无变化,因此本研究仅低温处理叶片。高盐、干旱处理均以清水作为对照,ABA处理以相同浓度乙醇作为对照。
1.2 总RNA的提取与cDNA的合成
花生总RNA的提取与cDNA的合成参照实验室之前的方法进行[12-13]。从已知的花生cDNA文库中找到了1个可能编码AhSLD2基因的全长序列,利用Primer 5软件设计基因全长引物。引物序列为SLD2-R: 5'-TAggATCCATgCAggTTgTTgAgAAg-3',SLD2-F:5'-TTgAATTCTCAACCATgAgTgTggAA-3'。以合成的cDNA为模板进行扩增。PCR反应条件如下:94 ℃ 5 min;94 ℃ 1 min,58 ℃ 1 min,72 ℃ 10 min,30个循环。利用琼脂糖凝胶电泳检验扩增产物并进行胶回收,将回收的产物测序。将测序得到的序列进行拼接,得到AhSLD2基因全长序列,提交到GenBank中。
1.3 序列分析
对得到的AhSLD2基因序列信息进行分析,开放阅读框利用NCBI网站(http://www.ncbi.nlm.nih.gov)的ORF finder工具查找;AhSLD2基因编码蛋白质的理化性质和二级结构利用在线网站ExPASy进行分析(http://www.expasy.org/tools/protparam.html);利用TMHMM工具(http://www.cbs.dtu.dk/services/TMHMM/)对AhSLD2基因编码蛋白质的跨膜结构进行预测。利用Phyre2数据库预测蛋白质的三级结构,导入PyMOL软件中进行编辑(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)。
1.4 多序列比对与系统发育分析
利用NCBI数据库中Blast P工具查找与AhSLD2蛋白相似的其他植物中SLD蛋白序列,利用bioedit将挑选的蛋白序列比对分析,比较AhSLD2和其他植物中SLD蛋白的相似性和保守结构域。
对AhSLD2的进化关系进行分析,从NCBI和phytozome植物数据库中下载花生野生种(Arachisipaensi,Ai和Arachisduranensis,Ad)拟南芥(Arabidopsisthaliana,At)、大豆(Glycinemax,Gm)、蒺藜苜蓿 (Medicagotruncatula,Mt)、毛白杨(Populustomentosa,Pt)、棉花(Gossypiumraimondii,Gr)、柱花草(Stylosantheshamata,Sh)、胶球藻(Coccomyxasubellipsoidea,Cs)等SLD蛋白序列,进行Clustal W比对,根据Neighbour-Joining方法构建系统发育树。
1.5 荧光定量PCR
荧光定量PCR反应条件参照陈娜等[12-13]的方法进行,每处理3次重复,内参基因为Actin11,实验数据利用2-△△Ct方法分析。荧光定量PCR引物采用Beacon Designer 7软件设计,qSLD2-F: 5' -GTTCATCGCTTATCATCCT- 3',qSLD2-R:5' -GAGACCTCAGAGACATTG-3'。
2 结果与分析
2.1 AhSLD2基因的克隆
从花生叶片中克隆获得AhSLD2基因,其全长为1819 bp,5'非编码区为287 bp,3'非编码区为185 bp,开放阅读框(ORF)为1347 bp,编码448个氨基酸,将AhSLD2基因的序列信息提交到Gene bank中,登录号:KF358457。AhSLD2蛋白的理化性质分析结果显示,AhSLD2由448个氨基酸残基组成,理论分子量是51.9 kDa,理论等电点为8.41,带负电的氨基酸有34个(Asp + Glu),带正电的氨基酸有38个(Arg + Lys),在酵母和大肠杆菌中表达的半衰期分别大于20 h和10 h。不稳定系数是40.46,属于不稳定蛋白;脂肪系数为88.10。总平均疏水性为-0.013,依据氨基酸分值越高疏水性越强,分值越低亲水性越强的规律,说明该蛋白可能为亲水性蛋白。TMHMM跨膜预测结果显示AhSLD2含有3个跨膜螺旋,跨膜螺旋中的氨基酸残基数为93,存在明显的跨膜结构(图1)。图2是预测的AhSLD2蛋白的3D结构图,利用NCBI CD-search工具预测的催化位点在图中标出,分别是HIS-159/163/196/199/200/376/377和GLN-373。

图1 AhSLD2垮膜结构预测 Fig.1 Transmembrane domain prediction of AhSLD2
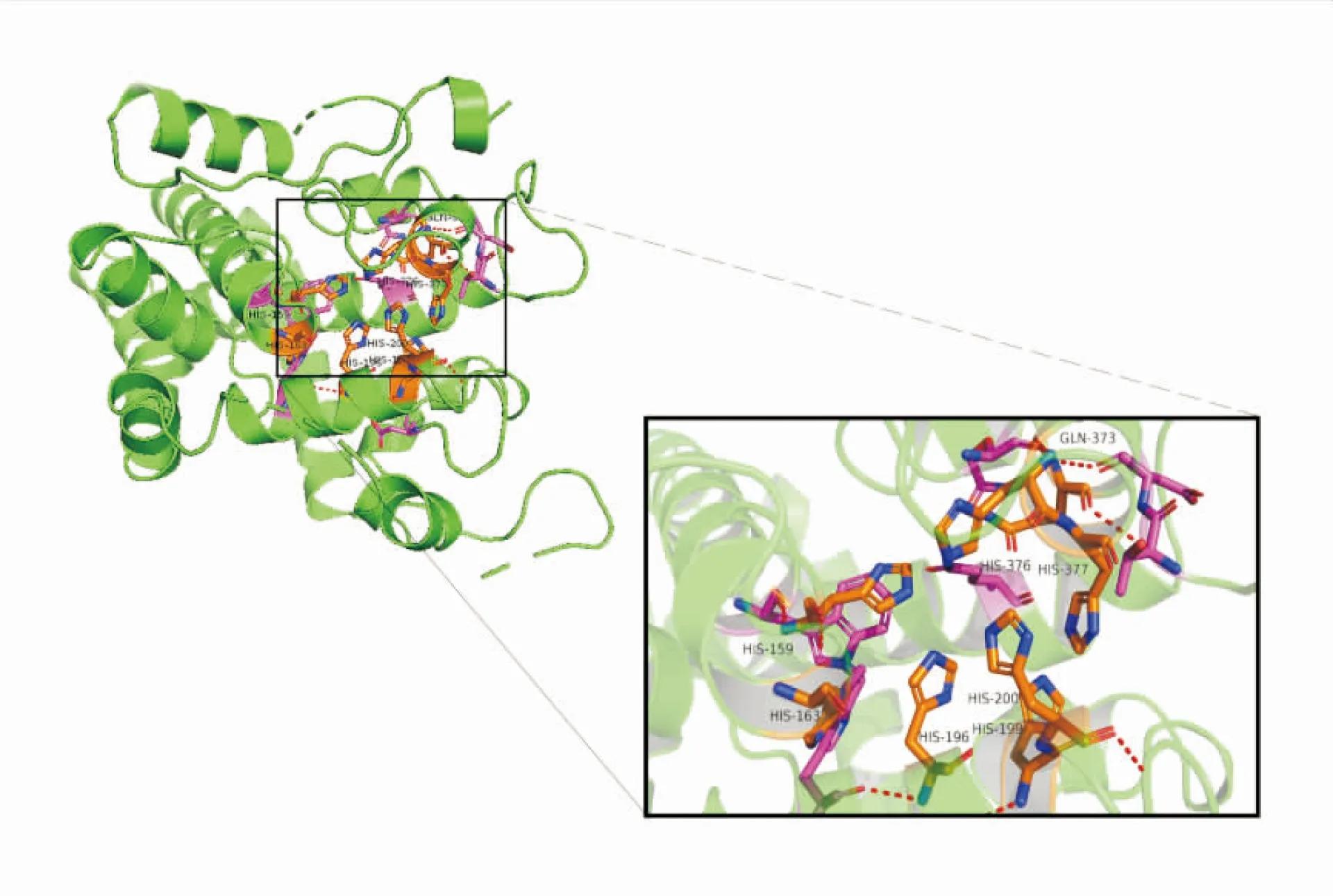
图2 AhSLD2三维结构图 Fig.2 The 3D structure of AhSLD2
2.2 AhSLD2蛋白序列比对分析
AhSLD2与其他植物中SLD序列比对结果显示(图3),AhSLD2含有细胞色素b5保守结构域和三个组氨酸保守域结构。AhSLD2与蒺藜苜蓿MtSLD(AET02855)的相似性达到84%,与拟南芥中AtSLD1(NM_116023)和AtSLD2(NM_130183)的相似性分别为74%和73%,与大豆GmSLD(XP_003550268)和玉米ZmSLD(XP_020406791)的相似性分别为60%和57%,初步证明本研究从花生中分离得到的AhSLD2属于植物SLD家族。
2.3 AhSLD2蛋白系统发育分析
将花生AhSLD2蛋白与其他植物中的SLD家族蛋白进行比对,构建系统发育树(图4),系统发育树分支根据产物鞘脂t18∶1的顺反异构体的比例分为3类(Z>E,E>Z,E),藻类SLD催化的产物仅含有(E)t18∶1鞘脂,位于整个发育树的根部,推测其他植物SLD可能由藻类进化而来。花生AhSLD2与双子叶大豆GmSLD1/2和蒺藜苜蓿MtSLD聚在一起,与其他单子叶植物分开,从AhSLD2在系统发育树中的位置推测AhSLD2催化的产物可能主要是(E)t18∶1鞘脂。

图3 AhSLD2蛋白序列比对(b5保守结构域用下划线标出,三个组氨酸保守域结构用黑点标出) Fig.3 AhSLD2 protein sequence alignment(b5 conserved domains are underlined and three histidine box structures are marked with black dots)(Gene bank登录号AdSLD: XP_015956938, AiSLD: XP_016190948, AtSLD1: NM_116023, AtSLD2: NM_130183, GmSLD: XP_003550268, MtSLD: AET02855, ZmSLD: XP_020406791)
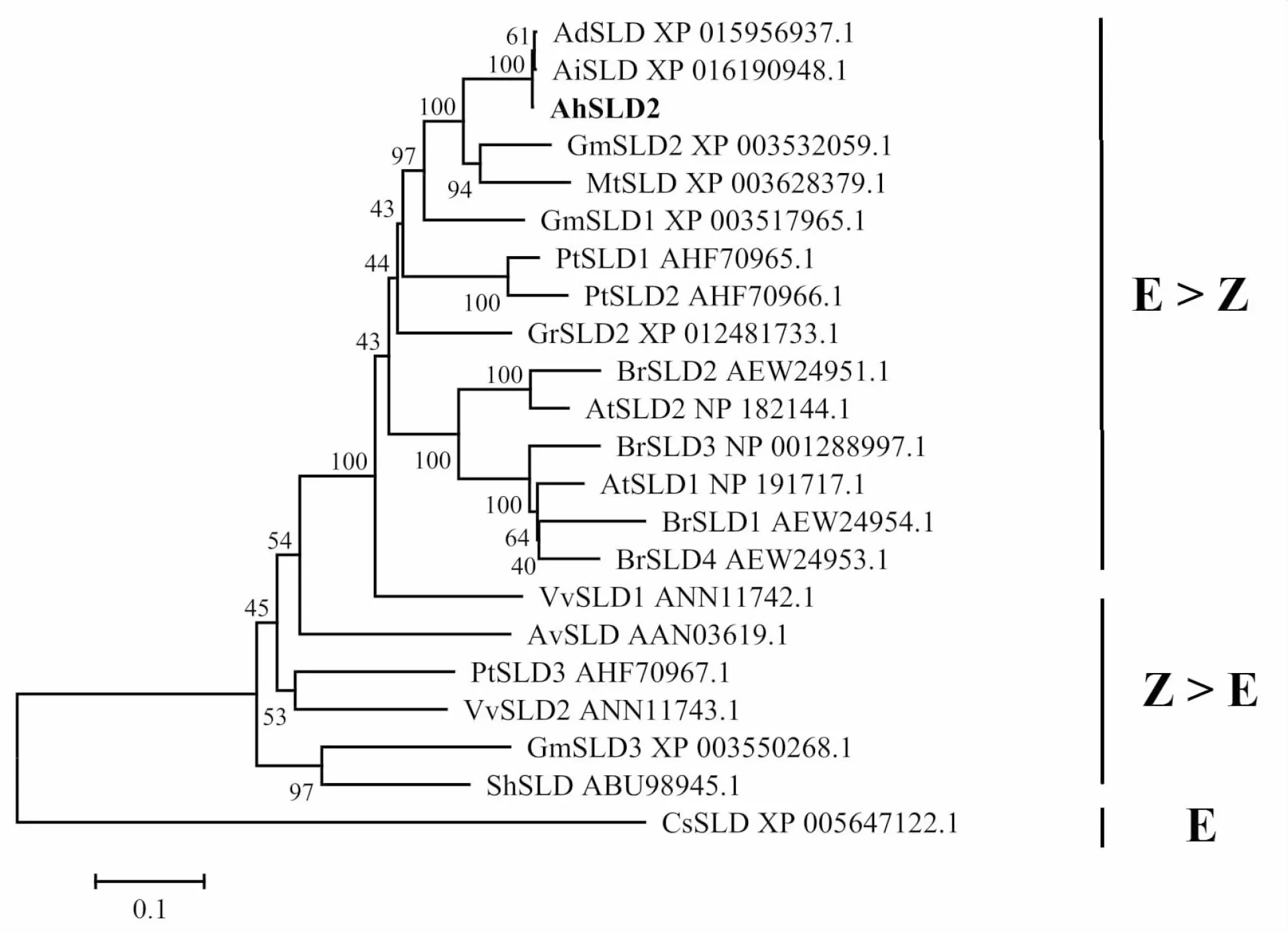
图4 AhSLD2蛋白系统发育树 Fig.4 Phylogenetic analysis of AhSLD2
2.4 AhSLD2基因表达特性分析
AhSLD2基因在花生不同组织和不同发育时期的表达特性如图5,AhSLD2基因在花生根、茎、叶、花和成熟种子(60 DAP)中都有表达,但在茎中的表达量显著高于其他组织。AhSLD2基因在开花下针10 d后的表达量最高,是其他时期的2倍左右。
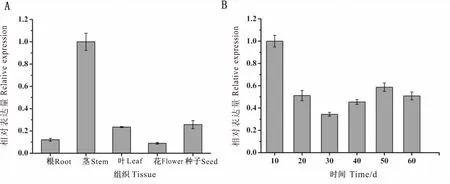
图5 AhSLD2基因在花生不同组织和种子发育时期的表达特性 Fig.5 Expression analysis of AhSLD2 in five peanut tissues and at six stages of seed
AhSLD2基因在不同逆境处理下的表达特性如图6,在干旱处理1 h后AhSLD2在花生根中的表达量达到最大,为空白对照的21倍,随后表达量逐渐下调至初始水平,而AhSLD2在叶片中的表达量无明显变化。高盐处理下,AhSLD2基因在花生根和叶中具有相似的表达模式,都是先上调后下调,高盐处理3 h后叶中表达量达到最高,比对照上调了2.5倍,处理6 h后根中表达量达到最高,比对照上调了3.8倍。低温处理下24 h,叶片中AhSLD2基因表达量达到最高,为0 h对照的3.2倍。ABA处理1 h后,AhSLD2基因在根中显著上调,为0 h对照的14倍,处理3 h后又迅速下调至初始水平,而AhSLD2基因在叶中的表达量随ABA处理时间延长逐渐降低。
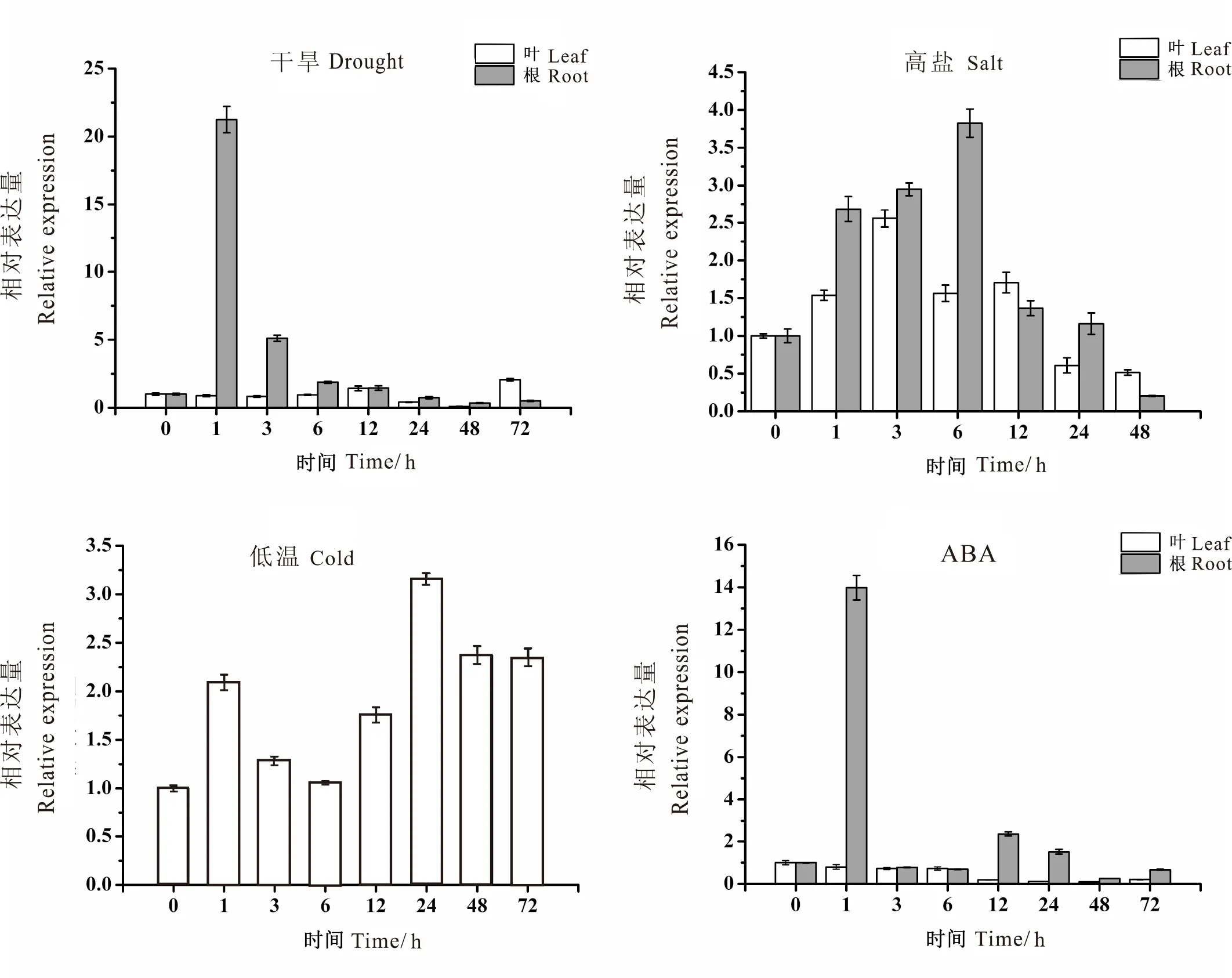
图6 AhSLD2基因在不同逆境处理下的表达特性 Fig.6 Expression analysis of AhSLD2 under adverse stress
3 结论与讨论
本研究从花生中克隆得到了AhSLD2基因,开放阅读框为1347 bp,编码448个氨基酸,属于跨膜蛋白。在前人的研究中也证实拟南芥、烟草等植物中的SLD位于内质网膜上[11],与本文预测的结果相符。蛋白质序列比对和系统发育树结果显示,AhSLD2与蒺藜苜蓿MtSLD(AET02855)的相似性最高84%,与拟南芥AtSLD1和AtSLD2的相似性分别为74%和73%。研究人员从芜菁中分离得到了4个BrSLD基因,通过蛋白序列分析发现它们与拟南芥AtSLD的相似分别为89%、90%、86%和74%[14],与本文得到的AhSLD2基因相比相似度更高。荧光定量结果显示,AhSLD2基因具有明显的组织特异性,在茎中的表达量最高,并且在发育初期的表达量高于其他时期。在四种逆境处理下,AhSLD2对干旱和ABA处理最敏感,且它们的表达模式相似,干旱和ABA处理1 h后AhSLD2基因在根中的表达量达到最高,分别上调21倍和14倍,随后表达量又显著下调至初始水平,结果说明AhSLD2基因可能参与花生对干旱和ABA处理下的调控作用,另外对低温和高盐胁迫也有响应,但不明显。研究人员对拟南芥中SLD的功能进行研究,发现SLD1和SLD2双突变体相比于野生型气孔直径更大,失水更快,更不耐干旱[15]。本文也证明了在花生中AhSLD2基因可能主要参与干旱胁迫下的调节。研究也表明,SLD会改变酵母菌的鞘脂成分,从而增强酵母菌的耐铝性[16]。今后,将花生AhSLD2基因转入酵母菌中,对AhSLD2蛋白的生物学功能进行更为深入的研究。

