姜黄油的抑菌活性及抑菌机理
,,
(河北科技大学生物科学与工程学院,河北石家庄 050000)
随着生活水平的不断提高,人们对食品添加剂中的防腐剂提出了更高的要求,不仅希望其防腐效果明显,同时希望其更加安全无毒害,因此使用天然防腐剂代替化学合成防腐剂已成为发展趋势。研究发现,精油是天然抗菌剂,具有广谱的抑菌活性,对有细胞壁和无细胞壁的革兰氏阳性、阴性菌均有抑制作用[1]。唐裕芳等[2]发现,苍术挥发油对3种细菌(大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌)、4种真菌(酵母、青霉、黑曲霉、黄曲霉)均具有良好的抑制作用,且与浓度呈依赖关系;张有林等[3]发现,百里香精油对细菌的抗菌性均表现为敏感型;干信等[4]也发现,花椒挥发油也具有良好的抑菌效果,不仅能抑制革兰氏阴性菌,也能抑制革兰氏阳性菌。
姜黄油为姜科植物姜黄(CurcumalongaL.)的块状根茎经水蒸气蒸馏得到的挥发油,所含成分极其复杂,一般有数十种至数百种组分[5]。主要为萜类化合物、芳香族化合物,如姜黄烯、倍半萜烯、姜黄酮等物质[6]。姜黄油具有抑菌、抗氧化、抗癌、抗炎、止咳等功能[7-8]。研究表明,植物精油的抑菌机理是精油及成分作用到微生物的细胞膜,当微生物的膜结构受损,微生物的膜透气性增加,从而导致细胞内部离子和内含物发生外泄或微生物的酶系统受到损伤,从而导致细胞死亡[9-12]。Lv、Yang等[13-14]研究也证明了这一点。胡小军、吴斌、Charoenkul等[15-17]对姜黄油的抑菌活性进行了研究,但并没有对其抑菌机理进行进一步的分析。
本文主要研究了姜黄油对枯草芽孢杆菌、蜡样芽胞杆菌、藤黄八叠球菌和沙门氏菌四种供试菌的抑菌活性,并对其抑菌机理进行了初步的探究,为开发姜黄油的生物学活性提供理论基础。
1 材料和方法
1.1 材料与仪器
姜黄根茎 由河北泽华生物科技有限公司提供,自然晾晒干燥,至其中水分含量为10%后,用粉碎机打碎,过40目筛,得到姜黄粉,使用前放置在80 ℃左右干燥箱中烘干,至水分含量低于0.5%,放于干燥器中备用;革兰氏阳性菌:枯草芽孢杆菌(Bacillussubtilis)、蜡样芽胞杆菌(Bacilluscereus)、藤黄八叠球菌(Sarcineluted.),革兰氏阴性菌:沙门氏菌(Salmonella) 均由河北科技大学食品科学系提供;姜黄 2014年产于印度卡纳塔克邦;无水乙醇(分析纯) 天津市光复精细化工研究所;叔丁醇、戊二醛 天津博迪化工股份有限公司;葡萄糖 天津百世化工有限公司;吐温80 天津市永大试剂有限公司;考马斯亮蓝、DNS试剂 上海宝曼生物科技有限公司;磷酸缓冲溶液(PBS,pH=7.0) 石家庄茂财生物科技有限公司。
S-4800-1场发射扫描电子显微镜 日本HITACHI;Adventurer分析电子天平 美国奥豪斯仪器有限公司;EPOCH2全波长酶标仪 美国博腾仪器有限公司;D-1-70型自动控制压力蒸汽灭菌锅 北京发恩科贸有限公司;打孔器、电导仪 上海雷磁新泾仪器有限公司;KQ5200DE数控超声清洗器 昆山市起生仪器有限公司;7HZ-82A水浴恒温振荡器 常州荣华仪器制造有限公司。
1.2 实验方法
1.2.1 姜黄油及培养基的制备 姜黄油的制备:通过离子液体[BMIM]PF6酶法辅助提取姜黄油,其中离子液体添加量为18%,纤维素酶添加量为1.4%,液料比为10∶1,酶解温度为50 ℃,酶解时间90 min。提取得到的姜黄油为橙黄色透明液体,具有典型的姜黄气味[18]。
姜黄油储备液的制备:配制质量分数为0.002%的吐温80溶液,稀释姜黄精油至体积分数为50 μL/mL,4 ℃贮藏备用。
牛肉膏蛋白胨培养基的制备:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,定容到1000 mL,调节pH在7.4~7.6之间。其中固体培养基补加15~20 g的琼脂。
1.2.2 抑菌圈(DIZ)的测定 参考Sharma等[19]的方法,采用打孔法测定DIZ大小。向培养皿(90 mm)中倒入20 mL已灭菌的牛肉膏蛋白胨培养基,冷却,待其凝固后,分别加入100 μL的枯草芽孢杆菌、蜡样芽孢杆菌、藤黄八叠球菌、沙门氏菌4种菌液(浓度调整为1×107cfu/mL),均匀涂布,静置5 min。用打孔器在培养基等位置处,打成直径5 mm的三个圆孔,其中两个孔加入10 μL的姜黄油,另一个孔加入0.002%吐温80作为阴性对照。静置5 min,37 ℃培养12 h后,用游标卡尺测量抑菌圈大小。
抑菌圈(mm)=药品组抑菌圈-阴性对照组抑菌圈
1.2.3 最低抑菌浓度(MIC)的测定 以0.002%的吐温80生理盐水为对照组溶剂,采用二倍稀释法,将姜黄油按不同的浓度梯度稀释,使其在培养基中的终浓度分别为0.1、0.2、0.4、0.8、1.6、3.2、6.4、12.8、25.6 μL/mL,以相同质量浓度的吐温80做阴性对照,分别将4种菌体溶度调整为1×107cfu/mL后,接种于培养基中,于37 ℃培养12 h,测定其OD600。当吸光度没有明显变化时对应的姜黄油浓度记为MIC。
1.2.4 生长曲线的测定 对照生长曲线:将枯草芽孢杆菌、和蜡样芽胞杆菌、藤黄八叠球菌和沙门氏菌稀释成1×107cfu/mL后,于37 ℃的恒温培养箱中进行培养,培养期间每隔1 h取样,用酶标仪在600 nm处测其OD值,记录数据。
样品组生长曲线:将1×107cfu/mL的4种供试菌菌液,加入到含0、0.5、0.75 MIC浓度的姜黄油培养基中培养,培养期间每隔1 h取样,用酶标仪在600 nm处测光密度值(OD值),记录数据。
1.2.5 菌体形态的测定 参考冯雅静[20]的方法并进行修改。将培养至对数生长期的枯草芽孢杆菌和沙门氏菌加入到含0、1 MIC姜黄油的培养基中,使菌种浓度为1×107cfu/mL,摇床培养(37 ℃,200 r/min),在4 h分别取样5 mL,4500 r/min离心10 min,收集菌体沉淀,PBS洗涤3次。加入适量的戊二醛于4 ℃环境中放置4 h,然后采用30%、50%、70%、90%乙醇及无水乙醇(每次离心10 min)进行梯度洗脱,最后加入2.5%叔丁醇置换出乙醇,将处理好的样品平铺于灭菌的培养皿中,放于超净台上自然风干,后镀膜进行电镜观察。
1.2.6 电导率的测定 参考Diao等[21]的方法。将4种供试菌接种于液体培养基中,37 ℃培养12 h,4000 r/min离心10 min,弃上清液,用5%葡萄糖溶液洗至菌液的相对电导率与5%葡萄糖溶液的相对电导率相当,此菌液作为等渗菌。向5%葡萄糖溶液中分别加入不同浓度的姜黄油(0、1 MIC),混匀,测其相对电导率记为L1。取等渗菌液分别加入不同浓度的姜黄油(0、1 MIC),37 ℃下培养 6 h,每1 h取出测定相对电导率,记为L2。将悬于5%葡萄糖溶液的菌液沸水浴5 min 冷却后,测定相对电导率记为L0。菌种膜通透性的相对电导率根据如下公式计算。
相对电导率(%)=(L2-L1)/L0×100%
1.2.7 姜黄油对细胞内容物渗漏的影响 菌体活化后用PBS清洗3次,重悬于PBS中,混匀。将混匀的菌悬液分成2等份,加入不同浓度的姜黄油,使姜黄油在菌悬液中的终浓度分别为0、1 MIC。混匀后,将菌悬液置于37 ℃,200 r/min培养3 h,5000 r/min离心 15 min。取离心后的上清液0.2 mL,用紫外可见分光光度计在260 nm下测定吸光值(用PBS作空白调零)。再取离心后的上清液0.5 mL,加入5 mL 的考马斯亮蓝试剂,5 min后,调分光光度计波长至595 nm处,以0.5 mL蒸馏水,5 mL的考马斯亮蓝试剂管为调零点,测样品管的吸光值,通过标准曲线y=0.0054x+0.0034(R2=0.9993),计算待测样品的蛋白质含量[22]。最后取处理好的上清液 0.5 mL,加入1.5 mL的蒸馏水,再加入1.5 mL DNS,摇匀,在沸水浴中准确加热10 min,取出,用冷水迅速冷却至室温,调分光光度计波长至540 nm,以2 mL蒸馏水+1.5 mL DNS管为调零点,测定OD值,通过标准曲线y=0.1461x+0.0624(R2=0.9995),计算待测样品的还原糖含量。以上处理均重复3次。
1.3 数据统计与分析
本文中所有实验均平行3次。所有数据均以平均值(mean)±标准差(SD)表示。用SPSS 17.0软件进行统计分析,组间数据比较采用单因素方差分析(One-way ANOVA),以p<0.05表示差异有统计学意义。
2 结果与分析
2.1 姜黄油抑菌性能的测定结果
通过测定4种菌的抑菌圈直径的大小和最低抑菌浓度,判断其对姜黄油的敏感程度。DIZ值越大,抑菌效果越好。最低抑菌浓度(MIC)值越小,抑菌效果越好,说明在较低的质量浓度下,就可以抑制微生物的生长[23]。由表1可以看出,姜黄油对4种供试菌均有较好的抑菌效果,其中对沙门氏菌的抑菌效果最好,其抑菌圈为15.3 mm,MIC值为0.4 μL/mL,其次是枯草芽孢杆菌>蜡样芽胞杆菌>藤黄八叠球菌。
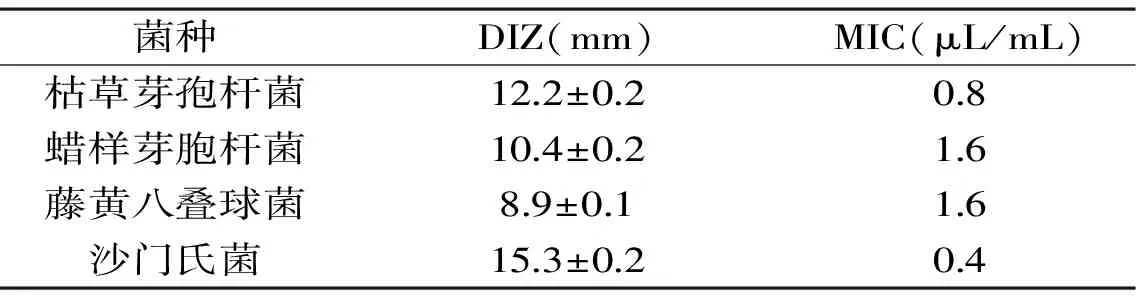
表1 姜黄油对4种供试菌的抑菌性能Table 1 Antibacterial activity of turmeric oil to four tested strains
2.2 4种菌生长曲线的测定结果
菌液的OD600值可以用来衡量菌液中细菌数目的多少,因此,OD600值变化可以反映姜黄油对细菌的抑制和杀灭作用的大小[24]。图1为4种细菌在不同浓度姜黄油作用下所表现的生长曲线图。从图1中可以看出,空白组呈现典型的S型,说明细菌正常生长状况良好。当添加了不同浓度的姜黄油后生长曲线变化明显,OD600值也随时间的延长而升高,但是增加幅度相比空白组明显减小。姜黄油对4种供试菌的生长均有很好的抑制作用,并且其抑制作用与剂量成依赖关系。姜黄油能够抑制4种菌体的生长,12 h后生长处于稳定期,细菌的活性完全被抑制。由此说明,姜黄油能减弱供试菌的生长速度,延缓其生长期,在稳定期时能抑制多半的细菌生长。
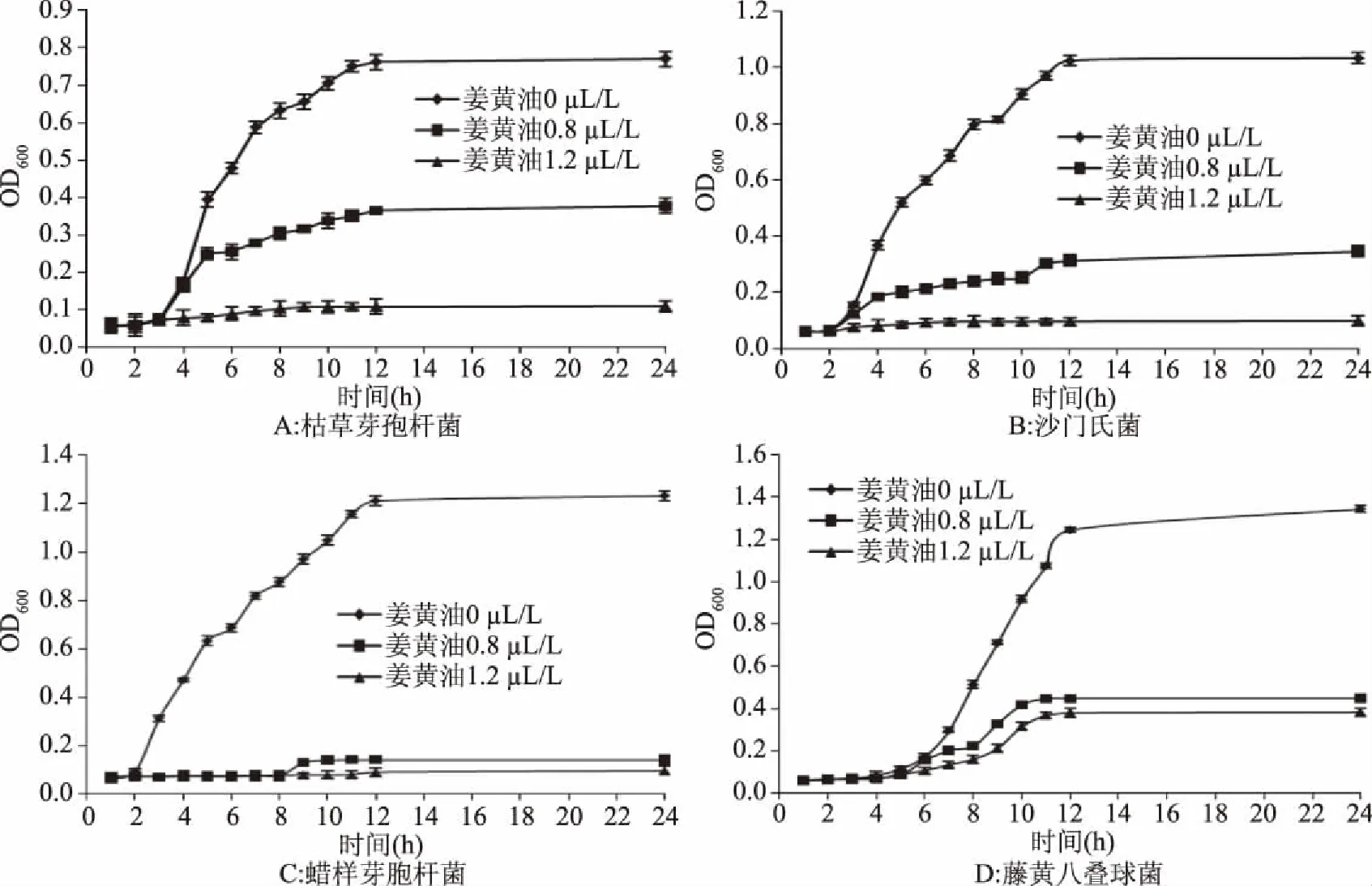
图1 不同浓度姜黄油对4种供试菌生长曲线的影响Fig.1 Effects of different concentration of turmeric oil on growth curve of four tested strains
2.3 姜黄油对两种代表性菌体形态的影响
试验选取了其中最具代表性且抑菌效果最好的两株菌,一个为革兰氏阳性菌即枯草芽孢杆菌,一个为革兰氏阴性菌即沙门氏菌,观察其在姜黄油处理前后的细胞形态变化,扫描电镜微生物超微结构的观察结果见图2。由图2A、图2C可知,当枯草芽孢杆菌和沙门氏菌没有被姜黄油处理时,菌体形态两端钝圆,呈现典型的短杆状,大小比较整齐[25]。菌体表面光洁平整,圆润充盈饱满,细胞表面没有出现损坏也没有发现细胞内物质流出。经过精油处理4 h后,由图2B、2D可明显看出,菌体外部出现损伤,菌体不再充盈圆润,表面不再平整,部分细胞形态破损严重,已经不能呈现完整的菌体形态,同时,能够看到大量的破碎粘连或凹陷,这也是造成细胞内容物泄露的出口。这些损伤性的变化,可能是由于姜黄油引起了胞膜组分的溶解和转变,导致细胞出现形态学上的改变,进而容易导致细胞内容物泄露、受损、发生代谢紊乱和死亡[26]。扫描电镜图从形态学方面表明了姜黄油的抑菌机理。
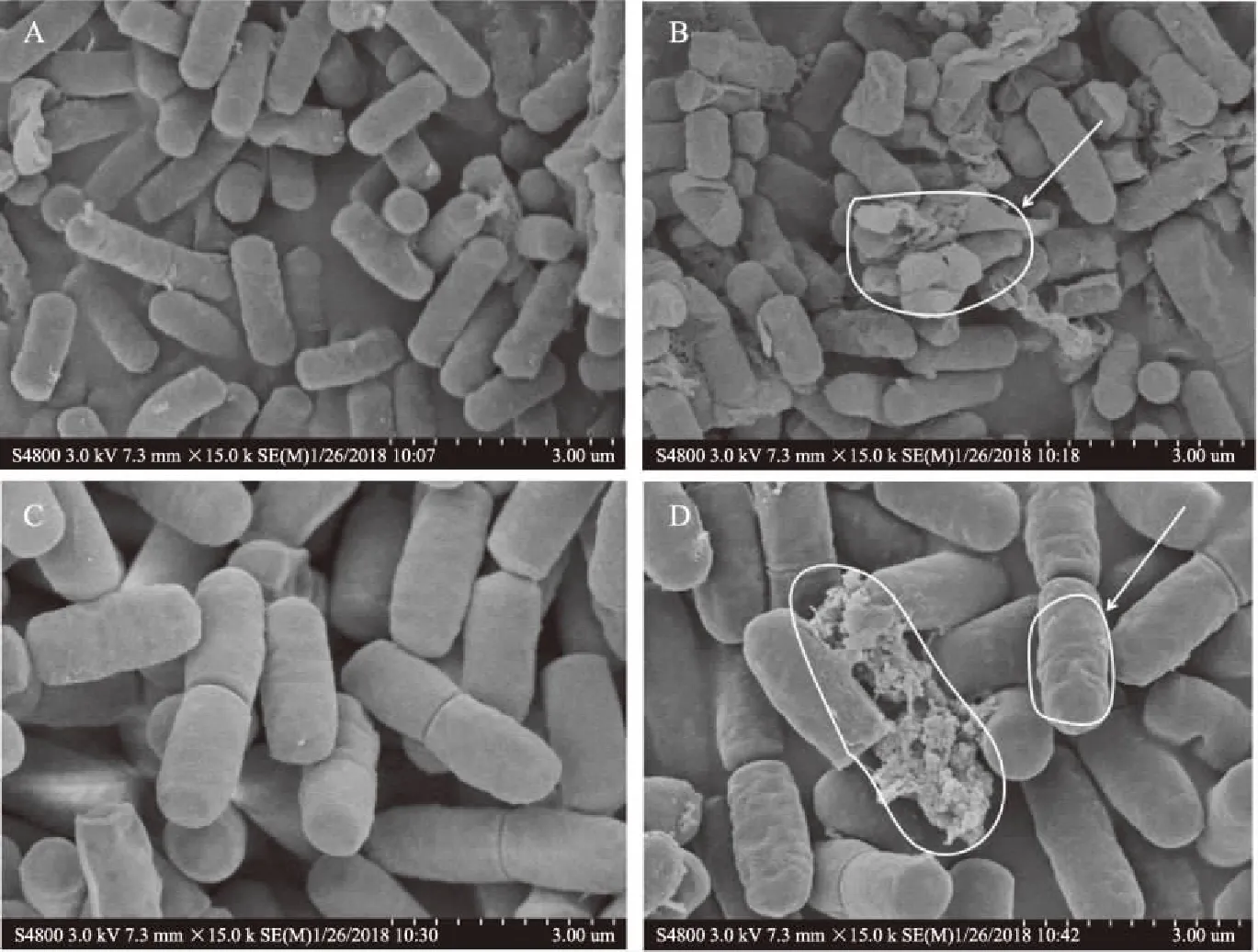
图2 枯草芽孢杆菌和沙门氏菌的扫描电镜图Fig.2 Scanning electron micrographs of Bacillus subtilis and Salmonella注:A:未处理的枯草芽孢杆菌;B:1 MIC处理的枯草芽孢杆菌;C:未处理的沙门氏菌;D:1 MIC处理的沙门氏菌。
2.4 电导率的测定结果
细胞膜是细菌的一个屏障,既可以阻挡外源物质的进入,也可以防止内部物质的流出[27]。当细胞膜受到损坏,胞内物质就会释放出来,小分子如钾离子、钠离子、磷酸根离子等电解质外泄至培养液中,使培养液的电导率上升。菌液电导率的变化反映了细菌细胞膜通透性的变化[28]。由图3可以看出,0 MIC姜黄油处理的4种菌的电导率变化不明显,在开始的两个小时电导率呈升高的趋势,可能是由于正常菌体的细胞自身溶解和死亡所致[29]。当经1 MIC姜黄油处理后,枯草芽孢杆菌、蜡样芽胞杆菌和沙门氏菌这3种供试菌的电导率明显增长,且在前2 h内电导率升高最大。这说明在前2 h内,姜黄油明显破坏了供试菌的细胞壁,使其通透性增加,将细胞内离子外泄到细胞外,致使菌悬液电导率明显升高。2~10 h处于升高缓慢并逐渐趋于稳定的状态,10 h后处于稳定状态。藤黄八叠球菌电导率的增长并不是很明显,但也有一定的增长。姜黄油之所以能够促使供试菌培养基的电导率升高,主要是由于姜黄油能够作用于菌体的细胞壁,攻击细胞膜,使其细胞受损,离子稳态失衡,影响菌体的代谢,最终导致菌体死亡[30]。
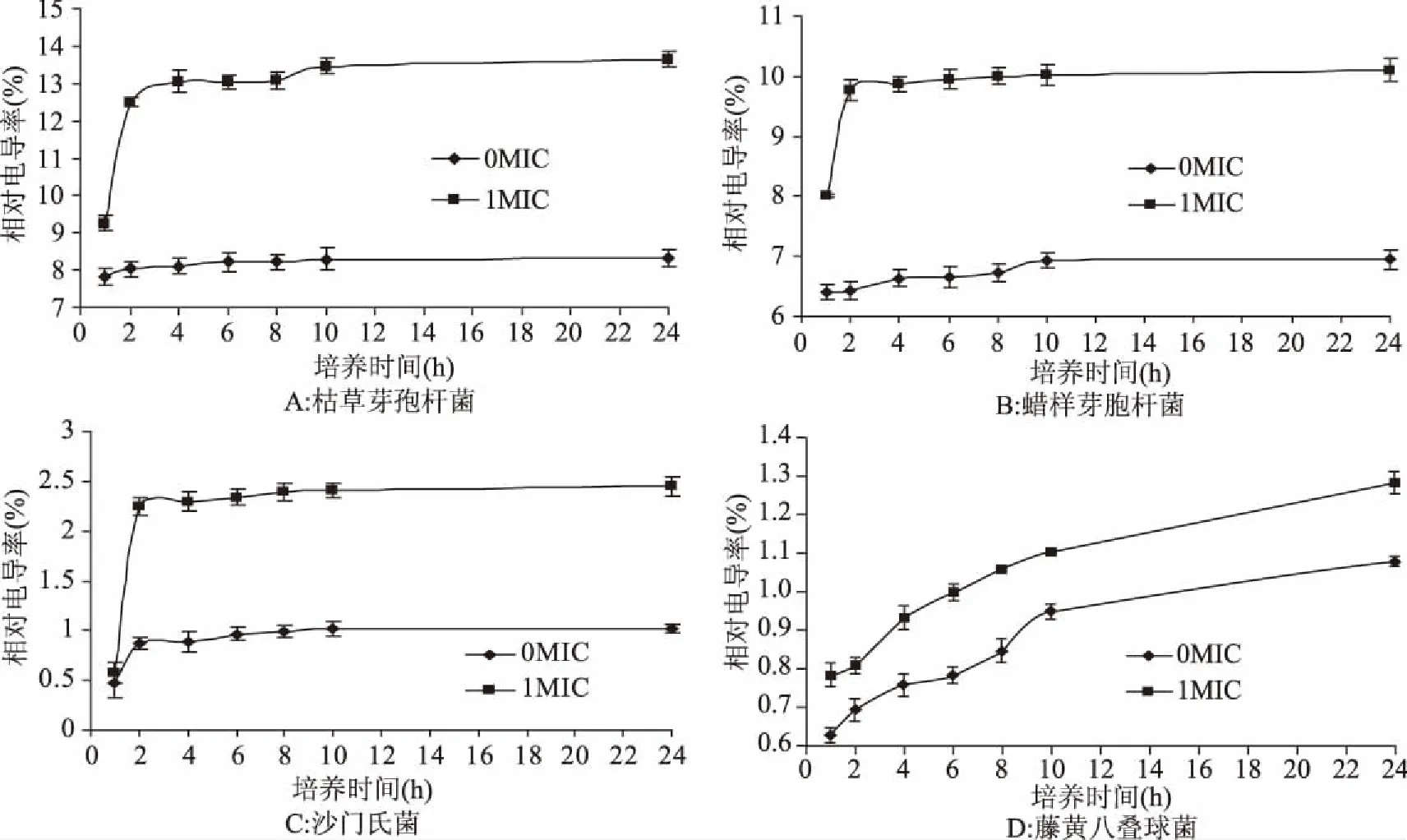
图3 不同浓度姜黄油对4种供试菌电导率的影响Fig.3 Effects of different concentration of turmeric oil on the conductivity of four tested strains
2.5 姜黄油对细胞内容物渗漏的影响
核酸、蛋白质类的大分子物质贯穿于整个胞膜和胞质当中,是重要的单位结构物质。菌体核酸、蛋白质等内容物质的释放,说明细胞膜完整性遭到了破坏,表明抑菌物质对菌体膜完整性产生了影响,细胞膜的完整性是菌体正常生长代谢的一个主要影响因素。测定结果如表2所示,加入1 MIC的姜黄油后,4种供试菌的OD260(核酸)明显升高,还原糖的含量也明显升高,蛋白质的含量呈倍增长。此内容物释放趋势与Shen等[31]的结果相同。其中,姜黄油对沙门氏菌的破坏最严重,其内容物质泄露最为严重,与其抑菌效果的结果一致。表明姜黄油导致细胞内容物的泄漏,影响细胞的正常生长,从而抑制了细菌的繁殖,是其抑制菌体生长的原因之一[31]。
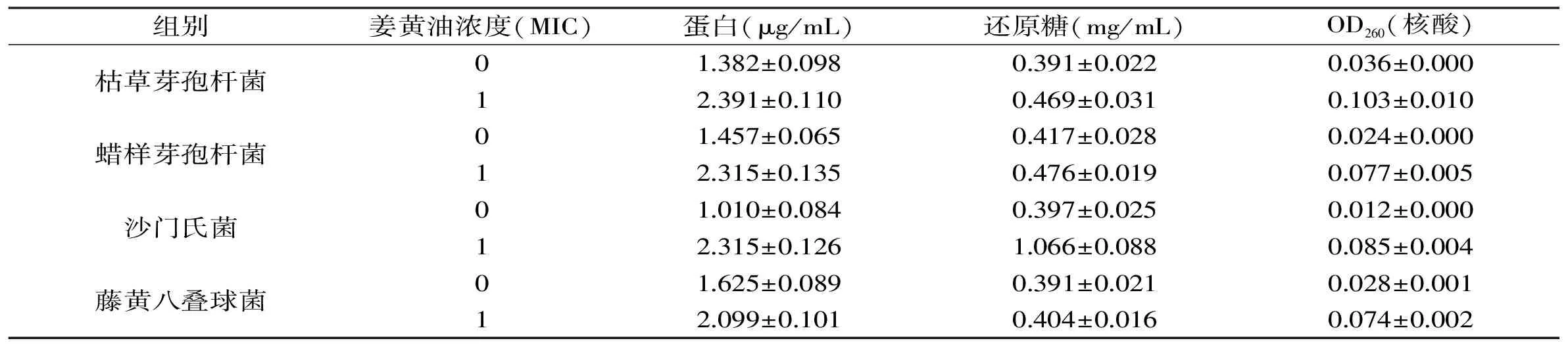
表2 姜黄油对4种供试菌细胞内容物的影响Table 2 Effects of turmeric oil on cell contents on four tested strains
3 结论
本文选择姜黄油做抑菌物质,研究了姜黄油作用于4种供试菌的抑菌性,得出结果:姜黄油对沙门氏菌和枯草芽孢杆菌有很好的抑菌效果,其最低抑菌浓度分别为均为0.4、0.8 μL/mL,抑菌圈大小分别为15.3、12.2 mm。姜黄油对4种供试菌的生长均有明显的抑制作用,培养基中电导率明显增加。扫描电镜图显示,姜黄油破坏了菌体细胞的形态,细胞表面褶皱,胞体扭曲,凹陷;姜黄油影响了菌体胞膜的通透性,小分子物质泄漏,离子稳态瓦解;由于姜黄油的作用,细胞膜完整性遭到破坏,大量核酸、蛋白质释放,菌体生长繁殖受阻。本实验为姜黄油作为高效、低成本的抑菌剂更好地应用于食品产业提供了理论依据。

