成人孤立性左室心肌致密化不全的少见MRI表现
恽虹, 陈铟铟, 刘豪, 张利军, 曾蒙苏, 金航, 杨姗
孤立性左室心肌致密化不全(isolated left ventricular noncompaction,ILVNC)是一种少见的、目前尚未明确分类的心肌病[1],其形态学特征为左室心腔内大量粗大突起的肌小梁,小梁间陷窝与左室心腔相通,且不合并存在其他心内先天畸形。ILVNC临床表现缺乏特异性,主要依靠影像学诊断,但心超及心脏MR对此疾病均各自缺乏统一且公认的诊断标准。有研究显示,除了ILVNC之外,在其他几种不同病因导致的左室收缩功能障碍的患者中(包括扩张型心肌病、肥厚型心肌病、瓣膜病变及心肌炎),超过30%的患者可以检测到左室心腔内肌小梁明显增多,并可达到诊断ILVNC的超声诊断界值[2],由此可见超声对此疾病诊断敏感性较高,容易导致过度诊断。而心脏磁共振成像凭借其高分辨率、大视野、多方位成像,在诊断ILVNC方面具有无可比拟的优势。现阶段对ILVNC的典型影像学表现虽有所加深,但对其少见或不典型表现尚缺乏甄别能力。本研究通过回顾性分析经心超及心脏MR共同确诊的20例成人ILVNC的MR少见表现,加深对此疾病的了解,提高临床对该病的鉴别诊断水平。
材料与方法
1.研究对象
回顾性分析2009年8月-2017年12月因心血管病相关症状于复旦大学附属中山医院心内科就诊,经心超怀疑或初步诊断为心肌致密化不全,后行心脏MR检查确诊的20例ILVNC的病例资料。ILVNC的诊断采用目前较为公认的、Peterson等提出的MR诊断标准:①病变心肌节段心内膜下肌小梁增多、粗乱、呈栅栏样改变,左心室心肌由两层结构组成,外层是薄的致密化心肌(compaction myocardium,C),内层是较厚的非致密化心肌(non-compaction myocardium,NC);②粗大的肌小梁间有深陷的隐窝,并与左心室腔相通;③舒张末期最大NC/C比值>2.3[3];④没有合并其他心脏异常。右室心肌致密化不全诊断标准借用超声标准,即右室致密化不全心肌厚度超过总体厚度的75%[4]。因心律失常及心功能较差、无法配合屏气扫描,导致图像移动伪影重,无法进行评估及测量的,不纳入分析。20例ILVNC患者中,男13例,女7例,年龄15~68岁,平均(39±3)岁。1例最终行心脏移植术,术后病理显示心房及心室心肌内膜下纤维化,心肌间质内见少量炎性细胞浸润,可见心肌胶原化及脂肪变性,符合心肌致密化不全病理改变。
2.心脏磁共振成像
心脏MR图像均在Siemens MAGNETOM Aera 1.5T MR仪上采集,利用18通道体线圈和脊柱线圈,心电门控采用无线矢量心电门控技术。采用仰卧位头先进体位和屏气法扫描。具体扫描过程及参数如下:①冠状面黑血半傅立叶单次激发(half-fourier single shot turbo spin echo,HASTE)序列,行胸部大体轮廓扫描,确定心脏大血管大致位置;②采用Dot-Engine自动定位系统,先扫描横轴面、冠状面真实稳态自由进动TrueFISP序列,然后在心脏的近似短轴方向获取多个层面,系统自动标识左房、主动脉根部、左室、右室及左室心尖部(如位置不准确,则采取手动调整),得到左室短轴(包括心底至心尖)、标准四腔心、两腔心及左室流入流出道定位扫描标准图像;③左室短轴位快速自旋回波(turbo spin echo,TSE)序列T1WI及T2WI脂肪抑制成像,扫描层面包括左室心底部、左室中部及左室心尖部;④左室短轴位(6~8层、覆盖全心)、四腔心、两腔心层面TrueFISP电影序列;⑤14名患者行增强扫描,方法为经肘静脉注入马根维显0.2 mmol/kg,8~10 min后采用PSIR segmented序列,自心底部向心尖做连续无间隔短轴切面成像(TI 300 ms)。
3.图像分析及测量
所有患者心脏MR图像均传至Siemens后台工作站进行测量。根据美国心脏学会(American Heart Association,AHA)将左心室划分为17节段(左室心底水平6段、中部水平6段、心尖水平4段及心尖段),对17节段中有NC的节段进行计数及测量[5]。所有图像测量由两名经验丰富的心脏影像专科医生分别执行,于左心室短轴舒张末期电影序列上分别测量除心尖段外的所有16节段NC/C的比值,于标准四腔心电影序列舒张末期测量心尖段NC/C比值,对于比值大于2.3的节段计入阳性。最终对比两位医生的评判结果,对于阳性判断不一致的节段采取共同测量及商议后决定最终是否为阳性。
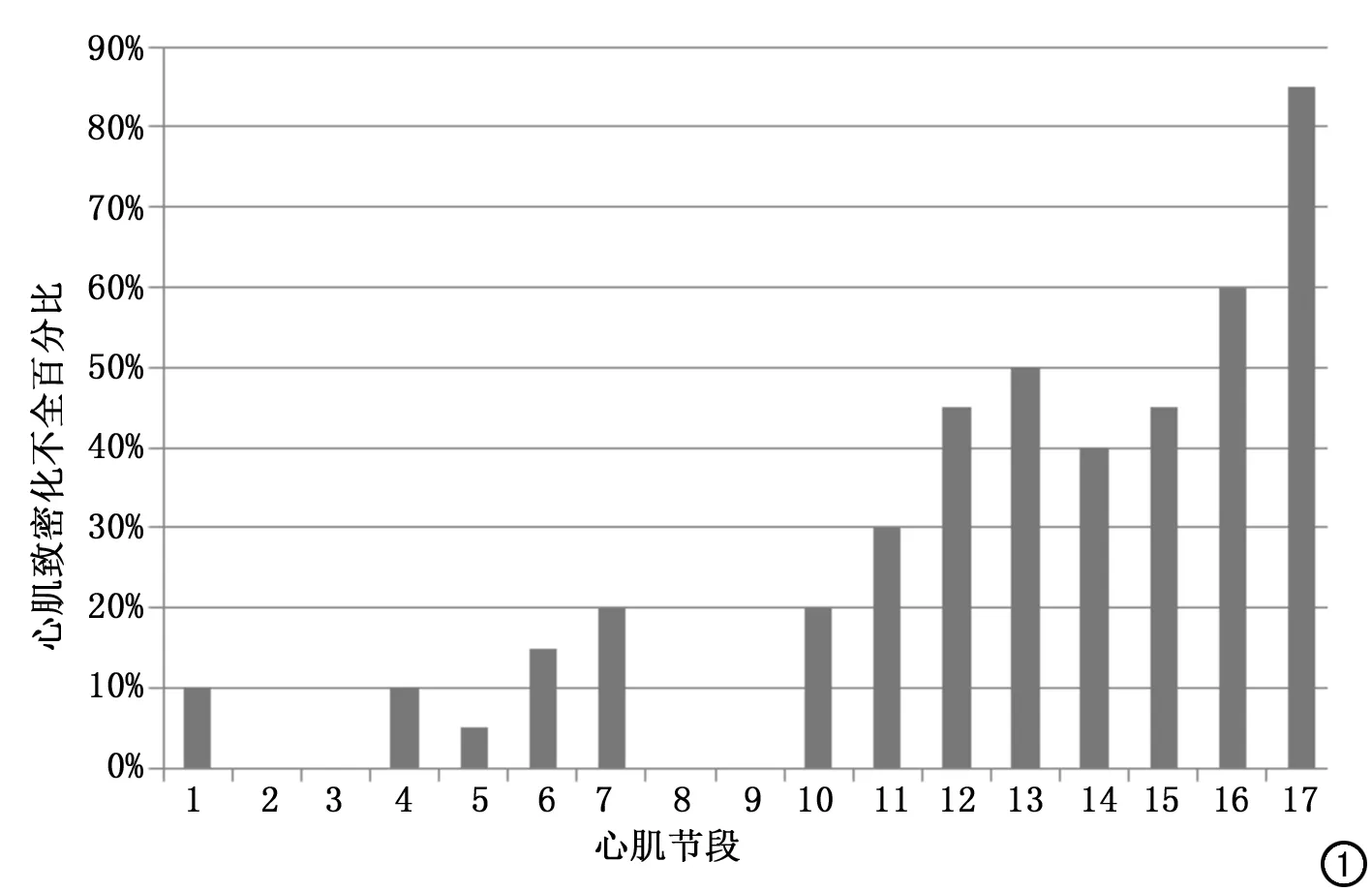
图1 患者水平各节段心肌致密化不全百分比。

患者性别/年龄临床症状心电图心超MR表现(EF)MR延迟强化1男/15胸闷窦性心律,完全性左束支阻滞左室增大,左室壁于乳头肌水平以下变薄,内膜线不完整,代之以疏松小梁结构,伴收缩活动减弱,心尖部呈矛盾运动,ILVNC可能左室乳头肌以远腔内见多个粗大肌小梁,心尖向外膨隆、突出,形成一收缩腔,舒张末约62mm×43mm,收缩末约57mm×35mm,室壁与心肌其余节段同步运动(50%)左室心尖未见明确异常强化2女/49胸闷窦性心律,完全性左束支阻滞左室上下径增大,左室腔内于乳头肌水平以下见丰富海绵样心肌,呈蜂窝状,心尖圆钝,收缩活动减弱至消失,ILVNC可能左室乳头肌以远腔内见多个粗大肌小梁,心尖向外膨隆、突出,形成一收缩腔,舒张末约50mm×45mm,收缩末约32mm×37mm,室壁与心肌其余节段同步运动(54%)未做增强3男/53窦性心律,QRS电轴右偏左室下壁二尖瓣至乳头肌水平心肌肌部变薄,且见丰富肌小梁,收缩活动稍减弱,局限性IL-VNC可能左室下壁局部心肌向外轻度膨隆,见3~5个粗大小梁突入腔内,室壁活动度减弱,但与其他节段心肌收缩舒张同步(59)%左室各节段未见异常强化
结 果
临床症状方面,20例均有不同程度的胸闷、心悸,1名青少年患者症状最为严重,眩晕、乏力7个月、双下肢浮肿3月、右侧肢体浮肿20天余来院检查,心脏MR及胸部血管MR成像显示左室心尖部血栓及右锁骨下静脉、上腔静脉血栓形成。20例患者心电图均显示异常,但缺乏特异性,包括左室肥大、ST段改变、束支传导阻滞、预激综合征、房扑、频发房早及偶发室早。14例患者左室射血分数(ejection fraction,EF)值低于50%(70%,14/20),9例患者有不同程度的心包积液(45%,9/20),极少量及少量心包积液8例,中等量心包积液1例;3例患者同时有单侧或双侧少-中等量胸腔积液(15%,3/20);3例患者同时有心包积液及胸腔积液,EF值均低于50%,其中1例后期行心脏移植手术。
按17节段分段法,20例患者共340个节段,经两名医生共同判断、满足NC/C比值>2.3的非致密化节段共87个节段(25.59%,87/340),其中心尖段(第17段)受累最多,共17个节段(85.0%,17/20),其次第16段受累12个(60.0%,12/20),第13段受累10个(50.0%,10/20),所有患者的心室底部及中部水平室间隔的第2、3、8、9段均未受累。在患者水平,各个节段受累情况百分比见图1。14例共238个节段行增强扫描,其中6例、84个节段出现延迟强化,其中致密化不全节段29个,正常心肌节段55个;6例致密化不全节段共63个,致密化不全心肌节段强化比例为46.0%(29/63);延迟强化方式以心内膜下强化为主,部分呈透壁样强化,1例为右室插入点处心肌内斑片状强化灶,与肥厚型心肌病相似。
20例患者中,有3例较疑难病例,其中2例致密化不全节段单独累及心尖、且伴心尖膨出(图2、3),1例单独累及心底下壁第4节段(图4),心超为可疑ILVNC诊断,后行心脏MRI后由放射科与超声科医生共同阅片讨论后诊断为ILVNC,3例患者临床及主要影像资料见表1。2例ILVNC影像表现较特别,表现为心尖膨出、心尖水平及心尖部心内膜下见多发粗大肌小梁突入腔内,其中1例行增强扫描,心肌各节段包括膨隆的心尖均未见明确异常延迟强化改变。两名患者均否认既往心肌炎病史,冠脉CTA未见明显狭窄性改变,排除冠心病及心肌炎后所致心肌纤维化合并过度小梁化,后综合心超及MRI表现,诊断为心肌致密化不全。1例患者为单独第4段/心底水平下段致密化不全,同前类似,表现为数个粗大肌小梁突入腔内,局部心肌变薄,相应节段稍向腔外膨出伴收缩舒张活动变弱,增强扫描病变节段及其余节段均未见异常强化,最终诊断为致密化不全(图4)。1例患者MRI各个序列均可见心内膜下斑片及线条状低信号影,后行胸部CT见心内膜下散在斑片状高密度影,综合MRI及CT考虑心肌致密化不全合并心内膜下广泛钙化(图5)。1例患者出现侧壁致密化不全。上述3例心尖段均未受累。2例心尖部血栓,1例位于心内膜下,1例位于心尖致密化不全的粗大肌小梁间隙内,增强后Cine电影序列致密化不全心肌节段内对比剂填充后,与其内无强化的低信号血栓对比增强,显示更为清晰(图6)。
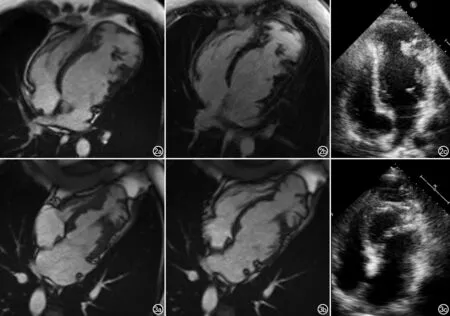
图2 男,15岁。a) MR四腔心电影序列舒张末期,左室扩大,心尖部向外膨隆,心尖部腔内多发粗大肌小梁向腔内突起; b) 增强后左室各节段包括心尖部均未见明确异常强化; c) 心超:左室壁乳头肌以下室壁变薄,内膜线不完整,代之以疏松小梁结构伴收缩活动普遍减弱。 图3 女,49岁。a) MR四腔心电影序列舒张末及收缩末期示左室心尖变薄、活动明显减弱至消失,向外膨隆,腔内见粗大小梁结构,其余心肌节段活动度未见异常; b) MR四腔心电影序列收缩末期示; c) 心超:四腔心左室壁乳头肌以下见丰富海绵样心肌,呈蜂窝状,心尖部圆钝、膨隆,收缩活动减弱至消失。
讨 论
本研究显示成人ILVNC的MRI表现除去心室肌内粗大紊乱的肌小梁结构、小梁间深隐窝、舒张末期NC/C>2.3的典型征象之外,还可出现心尖部多个粗大肌小梁伴心尖部室壁瘤样膨出、左室局灶性致密化不全改变、心尖不受累、心内膜下广泛钙化灶及致密化不全心肌陷窝内血栓形成等多个少见及伴随征象。
心肌致密化不全的发病机制目前尚未明确,较为公认的理论是在胚胎发育第5~8周,受到不明原因影响,导致心肌由疏松的网状结构向致密心肌组织发育的进程停滞[6]。正常胚胎心肌致密化的进程顺序为心底水平向心尖水平、心外膜向心内膜进展,后致密化的部位容易受到干扰而造成致密化异常终止,此理论可以解释为何大部分LVNC病例心尖受累最为显著。本组病例与既往研究结果一致,即心尖段受累最为显著,室间隔受累最轻。但也有理论指出ILVNC可能为后天获得性病变。有报道3名婴儿胚胎期心超未探及致密化不全改变,但在出生后却出现左心功能衰竭及心律不齐,后心超诊断为致密化不全,为ILVNC为后天获得性改变的理论提供了病例支持[7]。有学者提出,冠状动脉微循环功能障碍或心肌代谢紊乱可导致心肌缺血或微梗塞,心肌炎、心内膜炎所致纤维化以及心脏前或后负荷增高,均有可能导致肌小梁反应性增生,继发心肌致密化不全[8]。在本组病例中,存在3例致密化不全节段未累及心尖节段病例,其中1例见散在心内膜钙化,提示既往可能有慢性心内膜感染病史,其余2例致密化节段仅局限于心底下壁及左室外侧壁,局部心肌活动度不同程度降低,心尖段均未受累,3例病例侧面支持了心肌致密化不全可能为后天获得的可能。
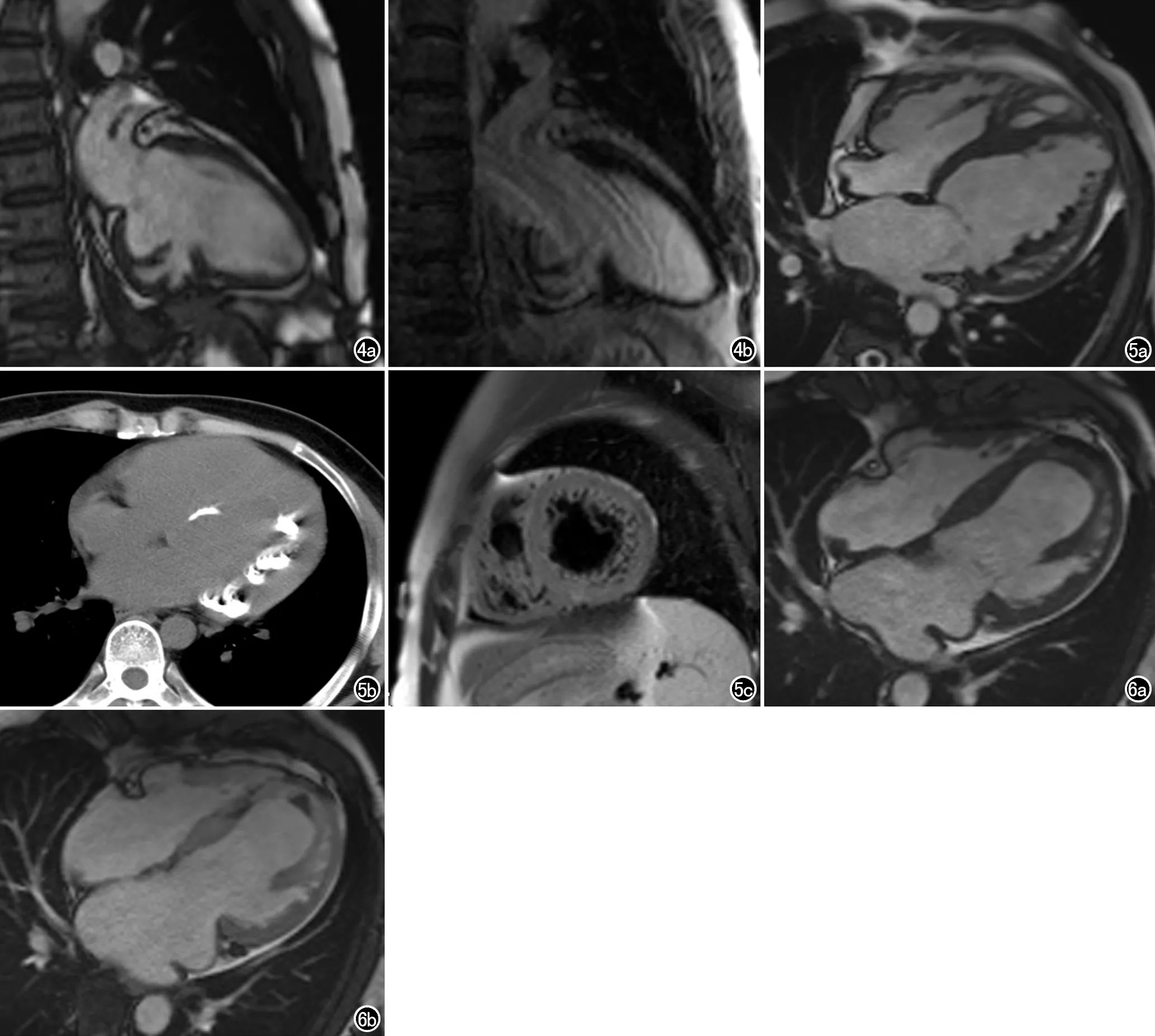
图4 男,53岁。a) 左室心底下壁室壁变薄,收缩活动减弱,见丰富肌小梁结构; b) 增强后未见明显异常强化。图5 男,33岁。a) 左室侧壁多节段心内膜下见丰富肌小梁,心尖段未见累及,心内膜下见多发斑点及斑片状低信号灶; b) CT平扫示左室心内膜下多发钙化灶,部分呈斑点、斑片状,部分呈细线状; c) MR短轴T2WI脂肪抑制序列,心腔内丰富肌小梁呈等信号,可排除心腔内血管瘤伴钙化可能。图6 男,49岁。a) 左室心腔扩大,左室乳头肌以远心腔内见丰富肌小梁,心尖部小梁间隙内隐约见斑片状低信号; b) 增强后电影序列,心肌轻度强化,对比剂填充于肌小梁之内,可见其内低信号血栓形成,较平扫显示清晰、易于识别。
此外,本组有3例特殊病例,2例表现为心尖室壁瘤样膨出伴较多粗大肌小梁突入腔内,1例表现为局灶性左室下壁稍向外膨隆伴心腔内粗大肌小梁,形态学上需与左心室憩室及室壁瘤进行鉴别。左心室憩室是先天性左室局部心肌数量减少或缺失,在左室压力作用下局部心肌向外异常的膨出,按部位分为心尖型及非心尖型。心尖型为一手指样收缩腔与心室相通,口通常很窄,多伴随中线畸形(心包、膈肌或腹膜缺如),较易识别;非心尖型为一较大收缩腔,与心腔连接口较宽,文献报道多为个案,但憩室内壁少见粗大肌小梁,与心肌致密化不全存在一定差异。室壁瘤多继发于心肌梗塞,腔内无肌小梁,MR延迟扫描呈透壁强化,室壁呈矛盾运动,而本组3例病变心肌与其余节段心肌呈同步运动,即收缩期变小,舒张期扩大,与室壁瘤不难鉴别。本组3例影像学表现较特殊,回顾既往文献未见类似MR报道,但Stöllberger早先曾提出,在心超检查中,左室心尖至乳头肌水平1个成像平面上肌小梁数如多于3个可以诊断为ILVNC[9],本组病例可符合此诊断标准。此标准是Stöllberger基于474名正常心脏的尸检结果得出的,后期被进一步修正,加入了双层心肌结构厚度比值的诊断标准[10]。本组2例病例表现为心尖室壁瘤样膨出伴多发粗大肌小梁突入腔内,非致密心肌未形成致密化不全心肌层,即没有完整的心内膜线将其连续。有研究显示ILVNC患者可能存在微循环功能障碍或代谢紊乱引起的心肌慢性缺血或微小梗塞,在排除了其他几类较为常见的心肌病之后,我们推测此2例的MRI表现可能就是由于上述原因导致的致密化不全心肌节段收缩舒张活动度降低,加之持续受到左室血流的冲击致使心尖逐步向外膨出,出现类似室壁瘤样的改变;同时膨出的左室壁将原本连续的粗大肌小梁扩张,出现致密化不全心肌呈数个孤立的粗大肌小梁突入腔内而内膜面不连续的情况。
此外,本组14例患者,6例共84个节段出现延迟强化,致密化不全节段及正常心肌均有累及,大部分以心内膜下延迟强化为主,部分病例出现透壁延迟强化,这与既往文献报道一致[11]。推测可能是由于冠状动脉微循环缺陷导致的非致密化心肌血管化过程受损,不仅局限于致密化不全心肌节段,还可能引起正常心肌节段的收缩舒张功能下降,尤其在高负荷情况下引起心内膜下心肌缺血,继而出现心肌坏死、纤维化及疤痕,严重的可继发恶性心律失常。
ILVNC的鉴别诊断主要是扩张型心肌病(dilated cardiomyopathy,DCM)合并过度小梁化,在既往心超及MR研究中均有涉及。二者存在心脏扩大、重量增加、冠状动脉通畅、心肌纤维呈不均匀性肥大的共同病理特点,鉴别有一定难度。有超声研究明确提出,左心室心尖段明显呈致密化不全改变及至少2个游离壁节段收缩期的NC/C 值>2可将ILVNC与DCM进行鉴别[12];也有MRI研究提出,DCM患者左心室射血分数较ILVNC低,心腔扩大更为明显,ILVNC致密化不全的节段数比DCM合并过度小梁化节段多,ILVNC心尖段(第17节段)均受累,而DCM患者心尖段未见受累[13]。虽然结合本组病例可以看出,心尖段在ILVNC中也有未累及的情况,利用心尖段是否受累来鉴别二者确实有不足之处,但不可否认在临床工作的多数情况下,心尖段是否受累对于二者的鉴别存在一定提示作用。此外,已有研究指出,ILVNC患者即使延迟强化未见阳性结果,但其心肌平扫的T1值已明显延长,与正常对照组相比差异有统计学意义,即心肌弥漫性纤维化发生在延迟强化之前,这一点也与扩张型心肌病相似,但二者在T1值上是否存在差异尚需进一步研究[14]。其次,ILVNC需要与心尖肥厚型心肌病、缺血性心肌病及左室假腱索进行鉴别,前两者利用MRI、必要时结合冠脉造影可以很好区别,超声心动图可以观察到假腱索起止点,能有效鉴别ILVNC与假腱索。
在成像技术方面,心脏MR检查较心超具有更高的空间分辨力,可以在不注入对比剂的情况下,获得心肌与心腔内血液良好的信号对比。在前期研究中,笔者已经提出,TSE-T2WI脂肪抑制像对于显示粗大肌小梁间隙内慢血流所致的高信号具有重要作用,真实稳态进动序列TrueFISP具有良好的血池-心肌对比、较高的SNR、运动伪影少和快速成像的优势,在显示心肌形态及舒缩活动度时具有无可比拟的优势,故ILVNC的MR诊断标准均推荐使用在左室短轴位TrueFISP舒张末期进行测量[15]。值得进一步提出的是,ILVNC患者易产生血栓,血栓既可能存在于心腔内、心内膜下,也可能存在于致密化不全心肌小梁间隙内。本组1例病例,注入对比剂后行增强后TrueFISP四腔心电影成像,致密化不全心肌的粗大肌小梁陷窝内对比剂填充后信号增高,显示其内存在团块状低信号充盈缺损,结合超声考虑为慢性机化性血栓,但增强前电影序列未检出血栓。因此,笔者提出对于ILVNC的临床检查,推荐行增强后电影序列扫描,一方面可节约扫描时间,另一方面对比剂填充后可帮助检出隐藏于粗大肌小梁之内的血栓。
在本研究中,NC/C的数值未运用于统计数据中,因为几乎所有ILVNC患者均存在心律不齐,电影序列存在不同程度搏动伪影,短轴位舒张末期致密心肌与致密化不全心肌的测量存在较大误差。此外,即使同一节段心肌也可能存在厚薄不均的情况,因此本研究未将NC/C的具体数据进行统计分析,只将心肌分为受累与未受累两类进行影像描述与分析。本组有5例ILVNC同时累及右室,右室心肌致密化不全目前尚缺乏统一的MRI诊断标准,诊断多借用超声标准,同时右室壁较薄,无论在厚度测量还是延迟强化评判方面均存在一定难度,未在本文中进行进一步探讨。本组仅1例患者最终行心脏移植,得到病理诊断结果,这也是目前对心肌致密化不全缺乏深入影像研究的主要原因。此外,ILVNC的T1-mapping成像研究未纳入本文,本组病例中6位行平扫T1-mapping成像,由于致密心肌较薄、心律不齐等原因,最终样本量较小,无法进行统计学分析,在今后针对ILVNC的研究中、包括ILVNC与DCM的鉴别诊断中,T1-mapping仍存在进一步深入研究的空间。

