经皮全内镜下颈后路椎间盘切除术在颈椎融合术后邻近节段退变病的应用初探
杨立进,陈博来,林涌鹏,李永津
(1.广州中医药大学,广东 广州 510405;2.广东省中医院/广州中医药大学第二附属医院脊柱骨科,广东 广州 510120)
颈椎前路融合术(anterior cervical discectomy and fusion,ACDF)是治疗颈椎退行性疾病的有效方式,自20世纪50年代Cloward和Robinson等首次报道以来,ACDF便被广泛使用于临床,逐渐成为外科治疗颈椎退行性疾病的标准术式。近年来,随着病例的增加及随访时间的不断延长,邻近节段退变病(adjacent segment disease,ASD)作为融合术后的一种远期并发症,导致患者症状复发甚至需再次手术,备受到国内外学者广泛关注。目前对于颈椎ASD手术方案的选择值得研究。本研究回顾性分析我科采用经皮全内镜下颈后路椎间盘切除术治疗的8例ACDF术后ASD患者,旨在探讨其可行性和疗效。
1 资料与方法
1.1 一般资料 自2015年4月至2017年6月我院脊柱科收治颈椎前路融合术后ASD患者8例,其中男性6例,女性2例,年龄49~77岁,平均60.9岁。所有患者均有不同程度的颈肩部疼痛,伴/不伴上肢根性放射痛或麻木、感觉、运动功能的受累,均经规范保守治疗6周无效,或症状进行性加重。初次颈椎前路融合手术节段为:C4~5单节段1例,C5~6单节段3例,C4~5、C5~6双节段1例,C5~6、C6~7双节段2例,C3~4、C4~5、C5~6三节段1例,初次手术均在全麻下行责任节段的颈前路椎间隙减压植骨融合内固定术,术后临床症状改善明显,影像学提示减压充分、颈椎结构稳定。邻近节段退变发生在融合术后48~162个月,平均94.3个月,表现为神经根型颈椎病4例,脊髓型颈椎病3例,混合型颈椎病(脊髓型+神经根型)1例。术前颈椎X线片示内固定物位置良好、牢固且已植骨融合,无明显节段不稳,MRI和CT显示融合节段后方未见明显脊髓受压,融合节段近端或远端出现椎间盘突出,明显脊髓或相应神经根受压。
1.2 手术方法 全麻成功后,患者取仰卧位,经皮行手术节段椎间盘穿刺造影,C型臂透视确认造影成功,后转为俯卧位。Mayfield架固定患者头部,颈部保持轻度屈曲状态,手术床调至头高脚低位约20°。插入定位针,侧位X线透视确认手术节段。旁开后正中线约2 cm处切开皮肤,置入工作套管。X线透视确定管道前端位于患侧小关节突内侧缘,置入直径10 mm内窥镜,置入10 mm工作通道时,以上下关节突交界内侧缘为中心,若为肩上型突出,则工作通道稍向头端置入。在持续生理盐水灌注下,射频及髓核钳清理椎板表面软组织,显露上位椎体下椎板和下位椎体上椎板(V-Point点),直视下找到关节突与椎板交界点,并以此交界点为中心进行椎间孔背侧扩大成型,磨钻、枪钳切除部分椎板及关节突关节骨质,打开椎间孔,切除黄韧带,显露颈脊髓及相应神经根,探查椎间隙和突出髓核,彻底摘除突出的髓核组织,10 mm工作通道通常可以在一个手术视野内完成椎间孔扩大成型和椎间盘切除。致压物偏中央时,先切除突出物旁侧,然后摆动工作通道,髓核钳向中央继续探查,逐步切除。彻底止血,再次探查确认神经根松解后退出工作管道,手术切口用生物胶水黏合,术后第1天佩戴颈托下地活动,术后佩戴颈围保护2周。
1.3 评价指标 采用日本矫形外科协会(Japanese orthopedic association,JOA)评分评价术前及随访时的功能状态,颈部残障功能指数(neck disability index,NDI)评估对日常生活的影响程度,疼痛视觉模拟评分法(visual analogue scale,VAS)评价颈部、上肢疼痛。末次随访时根据Odom标准与JOA改善优良率评定临床疗效。术后JOA评分改善率:(术后评分-术前评分)/(17-术前评分)×100%。Odom标准,优:术前症状全部缓解,可进行日常活动;良:仍残留很少的不适症状,但没有明显影响工作;可:术前症状有部分改善,但日常活动显著受到限制;差:症状无改善或临床状况恶化。手术节段稳定性评价:过伸过屈位X线片测量手术节段的Cobb角,即手术节段上位椎体下缘和下位椎体上缘的夹角,动力位Cobb角之差为该节段的活动度(range of motion,ROM),ROM 13°定义为颈椎失稳。颈椎侧位X线片测量手术节段椎间高度(手术节段前缘椎间隙和后缘椎间隙高度之和的1/2)。记录手术时间、住院天数和手术相关并发症,如硬膜囊撕裂、神经根和血管损伤、伤口感染或伤口血肿等。

2 结 果
2.1 一般情况 手术节段共9节,单节段7例,双节段1例。C3~4节段1例,C4~5节段4例,C6~7节段2例,C5~6、C6~7双节段1例。所有病例均在全内镜下顺利完成手术,无病例更改手术方式。术中持续盐水灌洗,由于水压的作用及使用射频止血,术中出血量较少,术后无需放置引流管。手术时间为62~140 min,平均94.8 min,平均住院天数为4.8 d。
2.2 临床疗效评价 8例患者均获随访,术后随访(8±33)个月,平均(15.9±6.7)个月。术后1周VAS、NDI及JOA较术前显著改善(P<0.05),末次随访时VAS、NDI及JOA较术后1周进一步改善,差异有统计学意义(P<0.05)。术前、术后1周和末次随访时手术节段ROM及椎间高度比较,差异无统计学意义(P>0.05)。本组病例术中未出现脊髓神经和重要血管损伤,术后无伤口感染、血肿等并发症。根据Odom标准,末次随访时的优良率为87.5%(优5例,良2例,中1例,差0例),JOA评分改善率78.14%(见表1)。
2.3 典型病例 49岁男性患者,4年前因脊髓型颈椎病行C5~6ACDF,后因右上肢放射性疼痛半年余入院,门诊予以颈牵引、针灸、消炎止痛药口服等保守治疗半年效果差,入院后诊断为神经根型颈椎病(C5~6、C6~7),采用经皮全内镜下颈后路椎间盘切除术进行治疗,术后疼痛明显缓解。手术前后影像学资料见图1~6。
3 讨 论
颈椎ASD患者的再手术率为(2.1±22.0)%[1-4]。ASD一般是指脊柱融合术后融合节段的上方或下方出现椎间盘以及椎间小关节等退变,包括头端椎体退变和尾端椎体退变[5]。邻近节段病最先在腰椎融合术后被人们所关注,近年颈椎ASD的研究也逐渐增多。研究指出颈椎融合术后邻近节段退变率从(25±92)%不等[6-7]。Wang等[8]报道了582例单节段ACDF患者,6.2%(36/582)因ASD接受了再次手术,平均发病时间为8.5年,认为手术时年龄≤50岁和发育性椎管狭窄是ASD的危险因素。Eck等[9]回顾了672例ACDF的患者,发现再手术率为7.1%,其中常见的原因是邻近节段退变和假关节形成。Lawrence等[10]报道颈椎ASD的年发生率为(1.6±4.2)%。近年来,Lee[2]等报道颈椎融合术后每年有2%的患者因ASD再次手术治疗,并且预测10年内需再次手术的ASD患者有22%。

表1 手术前后临床疗效比较

图1 初次术前MRI、CT示C5~6节段脊髓受压明显,椎管狭窄 图2 初次术后X线片示C5~6ACDF 图3 术后4年MRI示C5~6、C6~7椎间盘突出并神经根受压
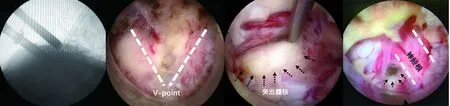
图4 术中工作管道透视,上位椎体下椎板和下位椎体上椎板(V-Point点)、突出的髓核组织及减压后的硬膜囊及神经根示意

图5 术后MRI示突出椎间盘已摘除 图6 术后CT示术区“钥匙孔”
对这些问题的关注促使了颈椎间盘置换术(cervical disc replacement,CDR)的设计和发展,人们希望这种技术能够保留颈椎活动度,降低邻近节段退变。然而CDR依然存在一些不足,包括假体不稳和移位、异位骨化、假体磨损和再次翻修等[2,6,11-14],且CDR与降低邻近节段退变的风险之间的意见并不统一。Zhong等[13]通过Meta分析发现因ASD需再次手术的患者中,CDR组为6%(108/1 762),低于ACDF组的12%(171/1 472),但是Skeppholm等[11]报道了715例患者,11%(79/715)的患者在随访期间再次手术,其中CDR组的再手术率较ACDF组高(15% VS 10%),且认为CDR再手术率及相关并发症较高。Nandyala等[14]分析了183 430例患者,ACDF组和CDR组的再手术率分别为2.0%和7.7%,CDR组的大多数患者主要由于假体的下沉和/或不稳而再次手术。其他研究表明两组在随访24个月甚至远期随访时的再手术率并没有显著差异[3,15]。
目前尚不清楚ASD是否由自然老化或融合术后的生物力学影响所引起。有研究指出邻近节段退变的发生受多种因素的影响[2-7,9],包括性别、手术时年龄≤50岁、吸烟史、融合的节段数目及位置、椎间隙的高度、后凸畸形及发育性椎管狭窄等。Hilibrand等[16]指出手术节段在C5~6(13.8%)时ASD的风险最高,其次是C6~7(13%),风险最低的是C2~3和C7T1,一个或两个节段融合的风险是3个及以上节段风险的1.8倍。Eck等[17]通过试验表明融合术后邻近节段活动度及所受应力明显增加,当固定融合C5~6后,屈伸时相邻水平的椎间盘内压力显著增加,C4~5压力增加73.2%,C6~7增加45.3%。总之,ASD的病因是多因素的,主要包括已经存在的邻近节段退变、易患退行性改变的风险、融合节段的生物力改变三类。
对于经规范保守治疗无效需要手术治疗者应精心计划,努力解决其症状。对于ASD选择手术方案时需要考虑多种因素,严格选择病例,精确的病例选择对于取得较好的疗效至关重要。手术方案可选择前路或后路,前路可选择经同侧或对侧,但是由于邻近节段瘢痕形成,解剖层次辨认不清,重要结构损伤的风险增加,如椎动脉、食管、气管和喉返神经的损伤。Beutler[18]等报道初次颈椎前路手术喉返神经损伤发生率为2.7%(9/328),再手术组其发生率升至9.5%(2/21),较初次手术更高。Jung等[19]对123例初次行ACDF术的患者进行了前瞻性研究,利用喉镜对比手术前后喉返神经损伤发生率,发现术前1.6%的患者存在无症状的单侧喉返神经麻痹,术后上升至10.8%。后路手术包括椎板成形术和椎板切除融合术,但会降低颈椎的活动度,与颈椎前路相比术中失血多,术后感染等并发症发生率高。Xu等[20]回顾了108例ASD的再手术患者,其中77例选择前入路,31例选择后入路,随后23例(23/77)前入路患者因复发的ASD需进行第三次手术,而后路患者只有4例(4/31)。Carreon等[21]报道了120例ACDF术后需翻修手术的患者,其中27例前路,93例行后路翻修,44%前路翻修患者术后11个月需要再次翻修,而后路翻修患者术后31个月时需再手术率为2.2%。Wang等[12]探讨了ASD的最佳手术方案和术后吞咽困难的发生率,回顾性研究了49例ACDF术后再次手术的ASD患者,前路38例(11例Zero-P,25例ACDF),后路11例,再手术ACDF组的术后吞咽困难发生率44%(11/25)明显高于Zero-P组7.7%(1/13)。如果相邻节段没有不稳的椎间盘突出导致脊髓或神经根病变,则可考虑椎板孔切开。
近年来随着脊柱微创理念及手术工具的迅猛发展,颈椎微创技术也不断更新,自2007年Ruetten等[22]报道了经皮全内镜下颈后路椎间盘切除术(posterior percutaneous endoscopic cervical discectomy,PPECD)治疗颈椎间盘突出症,优良率高达93%,较颈椎融合术具有创伤小、出血少、恢复快等优势,被多数脊柱专家所青睐。本研究中的8例ASD患者,运用经皮全内镜下颈后路椎间孔扩大成形椎间盘切除术治疗,无需改变或者延长内固定、无需混合式内固定,手术均顺利完成,临床疗效与文献报道相仿[23]。镜下打磨关节突进行椎间孔扩大成形,切开黄韧带后即可探查并取出压迫神经的髓核,手术时必须小心,在提供足够的减压范围的同时,尽可能多地保留小关节,若关节突打磨过多可能导致术后节段失稳,Kim等[24]对32例PPECD患者随访25个月后,对比手术前后的颈椎曲度、手术节段Cobb角及椎间隙高度,认为PPECD手术在保留50%以上小关节的前提下不会使颈椎曲度丢失。
本研究亦发现PPECD对手术节段的稳定性影响较小,手术节段椎间隙高度的变化差异无统计学意义。尸体解剖研究和生物力学实验表明[25],若想对神经根管进行充分减压,且不会导致颈椎稳定性丧失,术中需切除椎板外侧部分及关节突关节内侧部分各(4±5)mm,因此术中椎间孔背侧成型范围一般在(8±10)mm,因此10 mm工作通道可以在一个术野中完成探查和椎间盘切除,此可以大大减少术中管道的摆动,防止神经血管等组织的损伤,提高手术效率。此外,PPECD可能出现其他的并发症包括神经感觉异常、硬膜囊或神经根损伤、脑脊液漏、髓核残留需再次手术等[24,26]。且其学习曲线较陡峭,术中解剖结构辨识高,需要具备一定的颈椎开放手术和脊柱内镜手术经验,手术时间和并发症发生率会随着经验的增长而减少[27]。为了镜下能够准确找到突出髓核,手术前建议先进行颈椎间盘造影,再后路置入工作通道,随着后期经验的积累和熟练度的增加,可省略椎间盘造影,手术时间将进一步缩短。
本研究表明,经皮全内镜下颈后路椎间盘切除技术治疗颈椎融合术后邻近节段退变的早期临床疗效满意,更易于被再次手术患者接受,其近期临床疗效确切,并发症较少,可作为一种微创技术为治疗颈椎ASD提供了可行性。另外,本研究中病例数较少,随访时间较短,缺乏对照研究,还需要更多病例以及中、长期随访来研究证实。

