枯草芽孢杆菌TR21可湿性粉剂对香蕉根际土壤微生物的影响
樊胜南,喻国辉,陈燕红,黎永坚,陈川雁
(珠海市现代农业发展中心,广东 珠海 519075)
香蕉枯萎病是由尖孢镰刀菌古巴专化型(Fusarium oxysporum f.sp.cubense)引起的毁灭性病害,是一种典型的土传病害,病菌蔓延快,防治难度大。生产上常见的措施包括抗病品种选育、化学防治、生物防治和轮作等,生物防治具有环境污染小、安全程度相对较高并具有综合调控等优势,越来越受到青睐[1],可用于香蕉枯萎病防治的生防菌包括木霉(Trichoderma spp.)、假单胞菌(Pseudomonas spp.)、芽胞杆菌(Bacillus spp.)和放线菌(Actinomycetes)等[2]。近年来的研究显示香蕉根际微生物群落与枯萎病的发生关系密切。土壤病原菌浓度越高香蕉越容易发生枯萎病[3],发病级别越重的土壤病原菌数量也越高[4]。病原菌的存在还能够显著提高真菌数量及其比例,显著降低放线菌及其比例[5],发病严重的植株根际细菌和放线菌数量显著减少,真菌数量显著增加[6]。利用芽胞杆菌制备的有机肥能够防治粉蕉的病害[7],防治效果与土壤微生物群落发生改变有关,其中功能细菌在防治效果中具有重要作用[8]。枯草芽胞杆菌R31施用后能够增加中粉1号粉蕉根际细菌的总量,减少根际真菌、放线菌和镰刀菌的总量[9]。
枯草芽胞杆菌TR21是一株分离自石斛兰叶片的植物内生细菌[10],对多种植物病原真菌和细菌具有广谱拮抗活性,能够在香蕉体内定殖[11]并引起香蕉抗病酶[12]和相关基因[13]表达的升高,在大田试验中对香蕉枯萎病表现出一定的防效[14-16]。为了了解田间施用TR21对香蕉根际土壤微生物的影响,我们采集了施用TR21可湿性粉剂灌根处理前后不同时期的香蕉根际土壤,采用DGGE方法对根际土壤微生物多样性进行分析,以期为揭示该菌的防效机制和指导田间应用提供依据。
1 材料与方法
1.1 试验材料
1.1.1 土壤样品 试验共采集10个土壤样品。土壤样品于2015年采集自珠海市现代农业发展中心试验田,每个标样按照常规5点取样后混合作为1个标样。将土壤装入无菌塑料袋内封口,带回实验室4℃下保存备用。土样样品信息如下:土样51:对照区香蕉种植前土壤;土样52:生防菌处理区香蕉种植前土壤;土样71:对照区香蕉生长初期土壤;土样72:生防菌处理区香蕉生长初期土壤;土样101:对照区香蕉生长中期土壤;土样102:生防菌处理区香蕉生长中期土壤;土样b20:生防菌处理区发病植株根际土壤;土样b24:对照区发病植株根际土壤;土样j20:生防菌处理区健康植株根际土壤;土样j24:对照区健康植株根际土壤。
1.1.2 供试菌株 大肠杆菌(Escherichia coli DH5α)和枯草芽孢杆菌TR21可湿性粉剂由本实验室提供。
1.1.3 酶及主要试剂 过硫酸铵、EDTA、去离子甲酰胺、琼脂糖M、甲叉双丙烯酰胺、Tris、丙烯酰胺等试剂购自上海生工生物公司;DNA纯化试剂盒Wizard DNA Clean-up System购自Promega公司;土壤细菌DNA提取试剂盒Soil DNA Kit(50)、琼脂糖凝胶回收试剂盒E.Z.N.A Gel Extraction Kit和质粒抽提试剂盒Plasmid Mini Kit I(50)购自Omega Bio-Tek公司;pMD19-T载体、DNA分子量标准、Premix Ex Taq Version 2.0等购自TAKARA公司;硝酸银、氯仿等购自广州化学试剂厂。引物合成与测序由Invitrogen公司完成。土壤抽提缓冲液含100 mmol/L Tris-HCl、100 mmol/L EDTA-Na2、1.5 mol/L NaCl、1%CTAB、100 mmol/L Na3PO4,pH 8.0。
1.2 试验方法
1.2.1 土壤总DNA提取 称取0.5 g土样到灭菌50 mL离心管中,加入13.5 mL土壤抽提缓冲液和10 μL蛋白酶K,37℃、225 r/min摇床30 min。加入1.5 mL 20% SDS,65℃水浴2 h(每隔15~20 min摇匀1次),6 000 r/min离心10 min,上清转入另一个50 mL灭菌离心管中,原离心管中再加入4.5 mL土壤抽提缓冲液和0.5 mL 20%SDS。用玻璃棒搅匀,漩涡混匀器混匀10 s,65℃水浴10 min,6000×g离心10 min,合并上清。加等体积的酚-氯仿-异戊醇(25∶24∶1)抽提1次,6000×g离心5 min,取上清于另一灭菌离心管中。再加入等体积的氯仿-异戊醇(24∶1)抽提1次,6 000 r/min离心5 min后取上清于另一灭菌离心管中。在上清中加入0.1倍体积的3 mol/L NaAc(pH 5.2)混匀,加入0.6倍体积异丙醇室温沉淀DNA 1 h。室温16 000 r/min离心20 min,弃上清。DNA沉淀用70%乙醇洗涤1次,自然风干后将DNA沉淀溶于600 μL灭菌的TE缓冲液中,-20℃保存。
1.2.2 巢式PCR 参照欧阳娴等[17]的方法,第1次PCR:所用引物为细菌通用引物F27(5’AGAGTTTGATCCTGGCTCAG 3’)和 V3 高变区 R518(5’ATTACCGCGGCTGCTGG 3’)。第2次PCR:以第1次PCR产物为模板,引 物 为 F338GC(5’-CGCCC GCCGC GCGCG GCGGG CGGGG CGGGG GCACG GGGGG ACTCC TACGG GAGGC AGCAG-3’)和 R518。
1.2.3 变性梯度凝胶电泳(DGGE) 采用浓度为8%聚丙烯酰胺凝胶,变性梯度46%~54%,PCR纯化产物上样量400 ng,凝胶于60℃,80 V电泳12 h,银染,拍照。
1.2.4 DGGE电泳图谱分析 参照欧阳娴等[17]的方法,使用Quantity one V4.6软件对DGGE电泳图谱进行分析,再用Sorenson配对比较相似性系数Cs比较相似性。
1.2.5 DGGE主条带回收与基因克隆测序 将清晰可见的条带切下,用灭菌的去离子水清洗后,加入30 μL灭菌去离子水并将胶带捣碎,60℃温浴1 h,4℃静置16 h,3 000 r/min离心收集上清液。取1 μL上清液,用F338和R518引物进行PCR扩增,扩增程序同第2次PCR。PCR产物一部分用于再次DGGE电泳,验证条带是否是原来的条带,另一部分用1%琼脂糖凝胶电泳检测,凝胶条带用E.Z.N.A Gel Extraction Kit回收。然后取4.5 μL回收产物连接至p MD19-T载体,转入100 μL大肠杆菌DH5a感受态细胞,然后加入800 μL LB液体培养基37℃复苏培养1 h,5 000 r/min离心1 min后,去掉800 μL上清液,加入20 μg/mL的X-gal 40 μL和200 μg/mL的IPTG 7 μL混匀,然后均匀涂布于含50 μg/mL氨苄青霉素的LB平板上,37℃倒置培养过夜。用灭菌的牙签随机挑选阳性克隆子于5 mL含50 μg/mL氨苄青霉素的LB液体中,37℃、180 r/min振动培养过夜(14~16 h),12 000 r/min离心1 min收集菌体,用质粒提取试剂盒提取质粒。质粒用HindII和EcoRI进行双酶切鉴定无误后,送往Invitrogen公司(上海)测序,测序结果通过NCBI GenBank数据库比对。
2 结果与分析
2.1 土壤样品的变性梯度凝胶电泳(DGGE)分析
对10个土壤样品的扩增产物进行DGGE分析,结果见图1。从图1可以看出,10个土壤样品都分离到若干条带,且带型有所不同。在香蕉种植晚期的发病植株根际样品中,对照区(b24)条带比处理区(b20)少、且明亮条带多,与处理区健康植株根际样本j24相比,部分条带变弱或消失,显示发病后有部分条带消失。j20样品经芽胞杆菌TR21处理,其土壤微生物的多样性比j24有非常明显的提高,说明用芽胞杆菌TR21可湿性粉剂灌根可以提高土壤的微生物多样性。

图1 10个土壤样品16S rDNA V3 片段DGGE分析结果
2.2 DGGE图谱的物种丰度和微生物多样性指数分析
利用Quantity one软件对DGGE图谱进行识别条带的分析,得到图谱的物种丰度S值和生物多样性指数H值,如图2所示。图2显示,运用芽胞杆菌TR21处理可以提高土壤的生物多样性,随着时间的推移,处理区和对照区香蕉根际微生物的丰富度均逐渐升高,而多样性则逐渐减小。种植前,对照区的土样(51)生物多样性和丰富度高于处理区(52)。使用枯草芽胞杆菌TR21处理后,无论是在香蕉生长初期(71和72)还是中期(101和102),处理区(72和102)的生物多样性和物种丰富度均高于对照(71和101)。但在香蕉种植后期,施用过生防菌的发病植株根际土壤样品(b20),检测出来物种丰度(S)比对照(b24)高,但生物多样性(H)比对照低,健康植株根际土样(b20与b24)的物质丰富度和生物多样性与发病植株的特征一致。可见,生防菌处理后引起物种丰富度增加,但生物多样性降低。
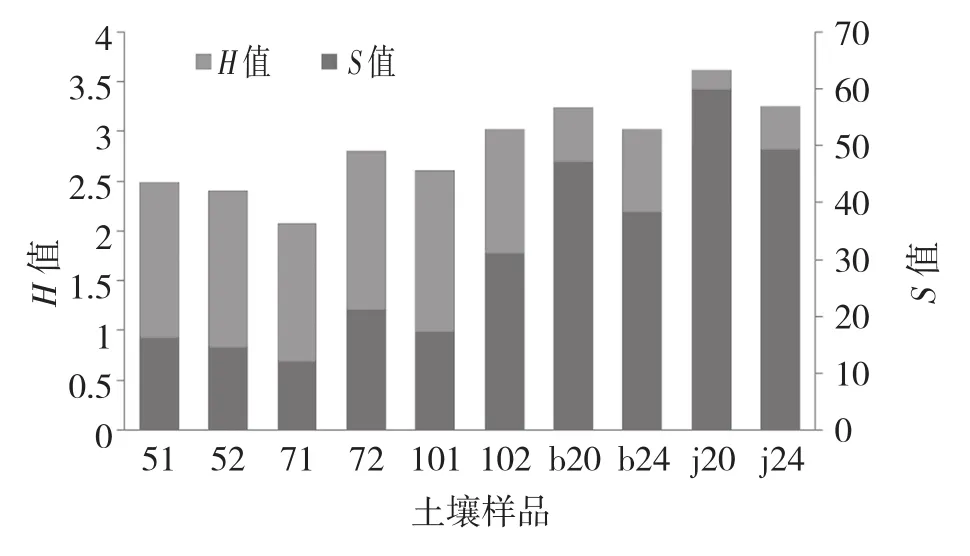
图2 10个土壤样品物种丰度和微生物多样性分析
利用Quantity one软件对DGGE图谱进行识别条带的分析得到DGGE的UPGMA聚类分析结果见图3。微生物种群多样性聚类分析显示j24和j20两个土样的微生物相似最高,达到68%,即香蕉种植后期用TR21处理过的健康植株根际土壤微生物与未使用TR21处理的健康植株根际土壤微生物相似性较高。此外,生防菌处理的发病土壤b20的微生物多样性接近未发病的健康土壤j24,相似性达到60%,而对照区的发病土壤样品b24与健康组土壤的相似度只有52%,说明枯草芽胞杆菌TR21处理对香蕉根际土壤的微生物生态改变较大,可以提高生物多样性,具有稳定土壤生物多样性的能力。

图3 10个土壤样品的16SrDNA V3片段DGGE条带的微生物种群多样性的聚类分析
2.3 发病土壤DGGE图谱主条带回收及序列比对
对DGGE图谱上的差异条带进行回收和测序,测序结果经NCBI Blast比对分析,结果见图4和表2。从表2可以看出,有9个条带与GenBank数据库中的非培养细菌克隆子相似,目前尚无菌属信息。其中条带9为生防菌处理区特有的条带,测序结果显示其为芽胞杆菌。

图4 回收条带示意图
3 结论与讨论
本研究利用PCR-DGGE法对香蕉种植不同时期TR21灌根处理与对照的香蕉植株根际土壤进行微生物多样性分析,发现随着种植时间的推移,处理和对照的根际土壤微生物丰度S值都逐渐升高,多样性指数H值却逐渐降低,说明随着香蕉种植时间的延长,根际微生物中少数物种的数量越来越突出,这与邓建波等的研究一致,这些微生物的变化这可能与香蕉根系分泌物对根际微生物产生的选择性有关[18]。发病香蕉根际土壤的物种丰富度S值小于健康香蕉根际土壤的S值,这与邓晓等[4,18]的研究结果一致;然而,用TR21处理过的根际土壤的物种丰度S值一直都大于对照,而生物多样性指数H值却比对照小,且经TR21处理的根际土壤芽孢杆菌增多,说明TR21的施用对土壤微生物群落产生了影响,在增加物种丰富度的同时,选择性增加了某些类群的数量,降低了群落的均匀度,从而导致S值增大、H值减小。

表2 DGGE图谱差异条带的核苷酸序列的比对结果
枯草芽胞杆菌TR21施用对香蕉枯萎病产生的防效可能与其对香蕉根际芽胞杆菌种群产生的影响有关。芽胞杆菌是香蕉根区土壤细菌的第一优势种群[19],数量和比重的变化与香蕉枯萎病的发生关系密切。相关研究显示,芽胞杆菌产生的脂肽Surfactin可以作为信号分子影响自身或其他芽胞杆菌的生物被膜形成[20],而生物被膜形成过程中产生的同类相残机制也会进一步影响到芽胞杆菌的种群分化和生物被膜形成[21],这两种影响生物被膜形成的方式是根际芽胞杆菌种间互作[22]和亲缘辨识的基础[23],也是解释芽胞杆菌施用能够调控和影响土壤芽胞杆菌的理论基础。例如,与TR21一同分离自石斛兰叶片的枯草芽胞杆菌R31,在田间也能够防治香蕉枯萎病[14-15],对香蕉根际可培养微生物计数发现,R31灌根能够显著增加根际芽胞杆菌含量[9],健康植株根际分离的优势种芽胞杆菌可以与R31相互识别并影响群游和生物被膜的形成[24]。本研究则通过PCRDGGE的方式进一步证实这种调控和影响的确存在,这将为进一步利用芽胞杆菌作为生防因子控制香蕉枯萎病提供了理论和实践依据。

