植物CMS不育基因的研究进展
杨慧丽,杨 露,张怀胜,林亚楠,李 冰,薛亚东
(河南农业大学农学院,河南 郑州 450046)
植物细胞质雄性不育(cytoplasmic male sterility,CMS)是指植物的生殖器官不能产生花药、花粉、雄配子体或虽有花粉但花粉无活性,但雌器官发育正常,可接受外来花粉正常结实的一种生物学现象。自Kolreuter 1763年观察到雄性不育现象以来,已在43科162属617个物种中发现了雄性不育现象[1-2]。细胞质雄性不育材料是研究核质互作的重要材料,同时是作物生产中的宝贵资源。杂种优势是指两亲本的杂交后代体型、生长率、产量、繁殖力及行为特征方面均比亲本优越的一种生物学现象,在全世界范围内的作物生产上,对于杂种优势的利用产生了巨大的经济效益,有一半以上的农作物种子如玉米、水稻、高粱、油菜和向日葵等都来源于杂交种,因此杂交育种对于世界粮食安全起到了巨大的作用。对于自花授粉作物,如果要生产杂交种子,就要把植株的雄穗去掉,防止自交。去雄包括人工去雄、机械去雄和化学去雄,但都需要投入大量的人力、物力、财力并且污染环境。然而,如果利用雄性不育系材料作亲本来生产杂交种子则免去了人工去雄这项体力劳动,细胞质雄性不育材料已在水稻、玉米等作物的杂交种生产中得到广泛的应用。利用CMS生产的种子具有更强的杂种优势,在产量、品质、抗逆性等方面都得到了显著的改良与提高[3]。尽管CMS在生产上已得到广泛的应用,但其机理的研究却相对滞后,例如水稻野败型不育系材料早在20世纪70年代就已发现并利用,但其不育基因WA352的功能与机理直到最近几年才被研究清楚[4-5]。另外,在研究细胞质雄性不育的过程中不断深入探究线粒体的功能,对理解核质间的互作及细胞器之间信号通路等方面都具有重要意义,同时也促进了细胞质雄性不育在杂种优势利用、不育化制种中的应用[6]。本文对近年来发现的细胞质雄性不育基因的研究进行了概述,并探讨了植物细胞质雄性不育研究的发展前景。
1 细胞质雄性不育系的来源及分类
植物细胞质雄性不育现象的产生不但与植物体自身内在的因素有关,有些也受环境因素如温度、光照等的影响。因此不育的表型是环境因素与植物体自身的细胞核基因组、细胞质基因组综合作用后而产生的结果。目前已被发现的细胞质雄性不育主要有3种来源:一是远缘杂交核置换造成的核质不亲和性,二是植物自然繁殖过程中的突变和基因重组,三是回交过程中亲本核恢复座位的丢失[52]。目前发现的众多不育材料在形态及细胞学上的败育表现主要有以下5种形式:一是雄蕊退化或变形;二是孢子囊退化,花药外形看似正常但不能产生花粉;三是小孢子退化,形成异常花粉与花粉败育;四是产生的花粉存在功能缺陷,不能正常萌发;五是产生的花粉虽然有活力但花药不开裂[8]。随着研究的不断拓展,越来越多不育材料的发现表明雄性不育现象在高等植物中普遍存在[7]。
尽管不育系种类繁多,遗传机理多样且复杂,就细胞质雄性不育的特点而言,主要分为孢子体不育和配子体不育两种类型。孢子体雄性不育是花粉的育性,受孢子体即植株的基因型所控制,植物的花粉是否正常生长发育所需要的营养物质是由孢子体供给的,而与花粉本身基因无关。配子体雄性不育是受配子体(花粉)基因型所决定。败育时间发生在雄胚子阶段,花粉可以形成小孢子但在形成雄配子体时,由于营养物质的缺乏而走向败育[50]。不管是植物体的孢子体还是配子体的花药组织发生雄性不育突变后均可以导致其发育异常,导致雄性不育的产生。研究发现细胞质雄性不育植株中,大多数的孢子体不育首先影响了花药的绒毡层结构和正在进行减数分裂的细胞,从而导致植物体花粉败育,相反配子体雄性不育类型中主要是影响了孢子体或花粉粒的发育而引起的败育[12]。
2 细胞质雄性不育与杂种优势
杂种优势是指两亲本杂交后,产生的杂交种子在生长势、生长率、品质、产量、抗逆性、繁殖力等其他方面均优于两亲本的一种生物学现象,生产实践中培育出的一些杂交品种与自交系品种相比产量可以提高15%~50%[13]。然而,在玉米、水稻、小麦等作物的杂交制种过程中,需要将母本植株的雄穗除去,以阻止其自身的花粉落在雌蕊的柱头而影响制种的纯度与质量。因此常规的杂交种生产过程中,需要消耗大量的人力、物力进行人工去雄,致使制种成本过高。雄性不育植株不能产生有活力的花粉,不能自交繁殖后代,但其雌器官发育正常,因此可在杂种生产中用来作母本,接受其他外源花粉授精而生产杂交一代种子。育种家们利用不育系的这一特性, 实现农作物的杂交育种和杂种优势的利用。因此,植物雄性不育材料是作物利用杂种优势的遗传基础,在农业生产中产生了重要的应用价值。随着对雄性不育的进一步研究,生产中利用雄性不育系材料做母来生产杂交种子则免去了人工去雄这项体力劳动,节约劳动成本,提高制种纯度与质量,最大幅度地利用杂种优势提高产量。利用细胞质雄性不育,我国水稻从普通杂交稻生产到“三系法”的杂交稻生产,再到 “两系法”杂交稻的生产, 使我国的水稻生产一直处于国际领先水平[14]。杂交水稻生产模式的突破、推广与利用正是得益于我国的农业科学工作者对雄性不育遗传材料的发现、研究、利用和推广。
生产上推广应用的“三系法”制种指的是细胞质雄性不育系、细胞质雄性不育保持系和细胞质雄性不育恢复系(图1)[16]。细胞质雄性不育系中有包含引起不育表型的细胞质基因和缺乏恢复育性的细胞核基因,在农业生产上被用作母本。细胞质雄性不育保持系的核基因组与不育系相同,但细胞质是正常的,农业生产上用于与不育系杂交来繁殖不育系从而保持不育系的不育表型。细胞质雄性不育恢复系包含正常的细胞质基因和具有恢复育性的核基因,农业生产上用来做父本与不育系杂交产生F1代杂交种子,这种杂交模式产生的F1代种子不仅育性得到了恢复而且具有比亲本更高的杂种优势,有利于农业生产中对于品质、产量等其他农艺性状的需求[16]。
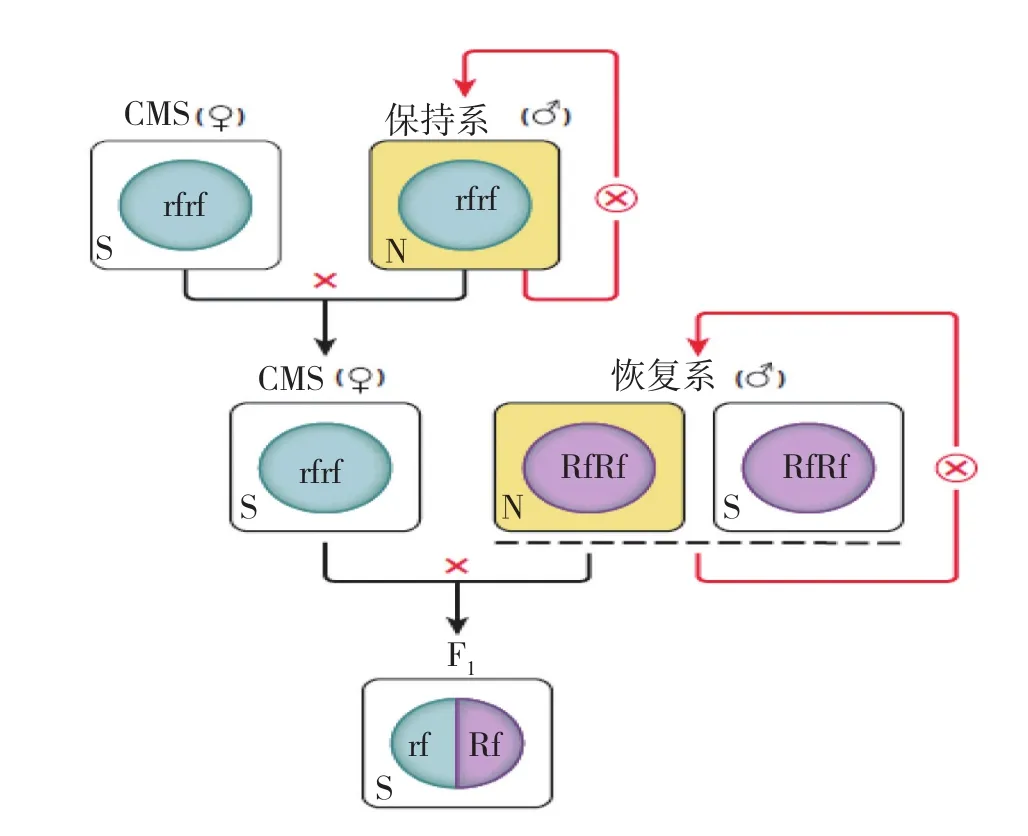
图1 细胞质雄性不育三系法在生产上的应用
自细胞质雄性不育材料发现以来,科研工作者们在利用于雄性不育材料改善与提高农业生产的同时,也对其分子生物学的功能与不育机制进行了大量的研究。细胞质雄性不育性状是通过胞质遗传的,细胞核基因与线粒体基因可能是决定细胞质雄性不育的关键因素。
随着现代生物测序技术的发展,近年来一些作物的线粒体基因组测序相继完成,发现高等植物线粒体基因组具有高度的重组型与可变性[17-19]。植物线粒体基因组的大小从200 kb到2 500 kb不等,基因组构型主要有开环、闭环、超螺旋、线状等。植物线粒体基因组包含大约60个基因,分别与电子传递链、核糖体蛋白、tRNA、核糖体核糖核酸相关,涉及到呼吸作用、能量传递等方面[20-21]。进一步对植物线粒体的蛋白组学分析发现,线粒体包含了超过1 000种蛋白,远远超过其自身的基因数目,其中大部分蛋白是由细胞核基因所编码,说明线粒体基因在行使其功能的同时,与核基因组存在着复杂的相互作用[21]。Levings等[22]首次证明了玉米 T 型细胞雄性不育系和正常胞质的线粒体基因组之间的不同,提出线粒体DNA的重组是导致不育表型的的原因。进一步的研究验证了植物线粒体DNA 的变异与CMS 相关,即线粒体基因组的变异、重组、特异的线粒体基因表达、线粒体基因重排等会导致植物出现雄性不育的表型[23-24]。
迄今为止,研究者已经在13种作物上发现了28个细胞质雄性不育相关基因[16]。这些不育基因主要来源是线粒体基因组内保守基因或非编码RNA的自我重排后产生的新的嵌合基因。这类重组后的orf或产生毒性蛋白危害细胞、或干扰线粒体正常功能引起线粒体能量代谢紊乱,造成绒毡层细胞异常凋亡,中断小孢子体的发育,从而导致植物的雄性不育[16]。
3 主要作物上发现的细胞质雄性不育基因
3.1 玉米CMS不育基因
玉米是世界上重要的粮食、经济、饲料、深加工农作物,同时也是最早利用细胞质雄性不育进行杂交种生产的作物之一。玉米的细胞质雄性不育主要分为CMS-T、CMS-S、CMS-C 3种主要类型。其中T 和C 型属于孢子体不育类型,败育彻底,败育发生在花粉小孢子形成过程中;S 型属于配子体不育类型,育性不稳定,败育发生在单核花粉期。玉米T型胞质不育相关基因T-urf13编码一个分子量为13 kDa的蛋白,命名为URF13,是玉米中第一个被发现的不育相关蛋白[25]。研究表明,通过删除或移码改变和影响urf13基因的表达能够使T 型不育系的不育表型得到恢复,明确了该基因与CMS-T的相关性[26]。URF13定位在线粒体内膜上,推测其在T 型不育系中的表达可能影响了线粒体内膜的通透性,导致电子传递与化学梯度的紊乱,进而引起花粉败育[27]。随后研究发现URF13在玉米各个组织中普遍存在,为组成型表达的模式,但其蛋白只在玉米T型不育系的花药中才产生毒性,可能存在某些特异的蛋白因子诱导了其在花药中特异毒性的产生。在有CMS-T类型的核恢复基因存在时,urf13的转录水平受到抑制,蛋白的表达丰度下降,不育的表型被抑制,育性得到恢复[28]。在玉米S型的细胞质雄性不育中发现一个R区域与其不育的表型存在联系。R区域内有两个重组后的线粒体嵌合基因orf335和orf77,在恢复基因RF3存在的情况下,该转录本被剪切并降解,从而使不育系的育性得以到恢复[29]。玉米C型细胞质雄性不育中与不育表型相关的基因可能与来源于线粒体atp9、coxII的重组嵌合基因atp6c相关,但目前并未得到进一步的证实[30]。
3.2 水稻CMS不育基因
水稻(Oryza sativa)是世界上最重要的粮食作物,其产量的稳定与提高直接关系到全世界的口粮安全。杂交水稻的大面积生产正是发掘和利用了水稻的细胞质雄性不育材料。我国水稻中目前发现的CMS依据不育细胞质的来源不同主要分为5类:包台型细胞质雄性不育(BT-CMS),红莲型细胞质雄性不育(HL-CMS),野生败育细胞质雄性不育(WA-CMS),Lead型细胞质雄性不育(LD-CMS),中国野生稻型细胞质雄性不育(CW-CMS)。目前生产上利用较多的为前3种类型。水稻不育基因的生产应用一直优先于分子生物学机制的研究,但随着第一个水稻线粒体基因组测序完成,水稻不育基因的研究得到了进一步发展[31]。野败型细胞质雄性不育(WA-CMS)是被最早发现与利用的一类不育胞质类型,也是推广面积与影响最大的一类不育胞质类型。1970年,袁隆平课题组在海南三亚南红农场发现了细胞质雄性不育野生稻,自此杂交水稻的生产发生了巨大变化。以野生败育材料为基础,成功选育了野败型细胞质雄性不育的保持系和不育系,打破了“自花授粉作物无法利用杂种优势”的束缚,使三系杂交稻得以推广利用,为世界的粮食生产作出了巨大的贡献[4]。人们在利用CMS-WA于杂交稻育种的同时,也对其分子生物学机制进行了不断的研究。根据已测序的水稻线粒体基因组,把水稻线粒体490 kb的基因组分成43个片段,每个片段特异的引物进行PCR扩增,并以这些扩增片段作为覆盖了全部线粒体基因组的43个片段的探针,对野败型细胞质雄性不育系、保持系及恢复系进行大量Northern blotting分析,对差异结果进行测序、比对与分析后发现不育系中存在一条特异的转录本[4]。对转录本进一步分析发现其由多个功能未知的线粒体片段重组后而产生的一个嵌合基因,编码352个氨基酸,位于线粒体rpl5基因的下游,是一个具有3个跨膜区的跨膜蛋白,实验证明这些跨膜区是其蛋白对大肠杆菌产生毒性的必须结构[5]。通过遗传转化含靶向线粒体信号肽的载体实验显示,该基因是导致CMS-WA不育表型的关键基因,并命名为WA352[5]。Wa352与玉米的T-urf13表达模式相似,为一个组成型表达基因,但是WA352蛋白特异性的在花粉母细胞期的花药绒毡层积累。以WA352为诱饵蛋白进行酵母双杂交筛选酵母文库,发现COX11(核基因编码的线粒体细胞色素c氧化酶的一个亚基)是WA352的互作蛋白,研究证明COX11不但与呼吸链的能量代谢有关还有清除细胞内活性氧的功能。WA352 蛋白在花粉母细胞期的绒毡层特异积累后与COX11 互作,两者结合后抑制COX11清除活性氧的功能,进而引起了绒毡层活性氧的爆发和细胞色素c从线粒体的释放。这些刺激信号诱发绒毡层过早的发生细胞程序性死亡,影响花粉正常发育,导致花粉败育而产生不育的表型[5]。水稻CMS-HL与CMS-BT的不育基因都与线粒体嵌合基因atp6-orf79转录本相关,其序列相似性达到98%。当ORFH79表达时,ATP与NADH的水平下降。在线粒体内,ORFH79与核编码的线粒体电子传递链复合物3的亚基P61互作,降低了复合物3的活性,导致ATP产量的下降而引起不育的表型[45-46]。
3.3 油菜CMS 不育基因
油菜是我国重要的油料作物同时也是重要的深加工作物,在国民经济生活中具有重要地位。目前油菜中的细胞质雄性不育应用较多的主 要 有 CMS-pol、CMs-nap、CMS-ogu 3种 类型[32]。波里马细胞质雄性不育(CMS-pol)是华中农业大学傅廷栋教授于1972年发现,这类不育系的典型特点就是在不同核背景下育性容易受温度的影响而产生育性的变化,因此CMS- pol的不育系又被分成低温不育、高温不育和稳定不育3种类型[33]。研究发现CMS-pol胞质的雄性不育基因为一个线粒体开放阅读框orf244与线粒体基因atp6的嵌合复合物,即orf224-atp6;在线粒体基因组上orf224位于atp6的上游,与atp6基因共转录[34]。CMS-nap胞质也是在1972年发现的,但在生产上没有被大面积推广利用,其主要原因一是此类胞质不育材料对温度十分敏感,育性不稳定;二是该型胞质不育材料的保持系少,仅有Bronowski能够保持CMS- nap 的不育表型。CMS- nap胞质的不育基因为orf222,与CMS-pol类型的不育基因orf224高度同源,两者编码的蛋白序列相似性高达到79%。不育基因orf222与线粒体基因nad5c以及orf139共转录,造成不育的表型[35]。CMS-ogu是首先在萝卜中发现然后导入到油菜的一种不育胞质,CMS-ogu的不育相关基因为orf138,编码一个大小约20 kDa的蛋白,并在线粒体内膜上形成一个大小约750 kDa的蛋白复合体,该蛋白是一种毒蛋白,可抑制大肠杆菌的生长[36]。
3.4 萝卜CMS不育基因
目前萝卜上发现的不育胞质类型主要有CMS-Don与CMS-Kos两种类型。两种类型胞质的不育基因同样是线粒体基因组重组产生的。CMS-Kos型的不育基因为orf125-atp8,与油菜CMS-ogu的不育基因orf138是同源基因,其基因序列与orf138相比,在编码区只存在两个氨基酸的替换与一段39 bp的缺失。与多个不育基因相似,orf125-atp8编码一个跨膜蛋白,对大肠杆菌具有毒性[37]。通过比较不育胞质与正常胞质整个线粒体基因组序列发现CMS-Don型的不育相关基因是orf463,编码含有12个跨膜域跨膜蛋白,研究发现同样对大肠杆菌有毒[38]。
3.5 向日葵CMS不育基因
向日葵中不育相关基因为atp1-orf522,是由于线粒体基因组在atp1位点重组过程中产生了一个1 kb 倒位与一个5 kb 的插入造成的。重组的结果是形成新编码区orf522,orf522与atpA基因编码一个大小约为15 kDa有毒性的膜蛋白,导致不育的表型[39]。
3.6 其他作物的CMS不育基因
小麦CMS-AP型的不育相关基因是orf256,位于线粒体基因cox1的上游,编码一个大小约7 kDa的蛋白,可能是影响了线粒体膜的功能而产生不育表型[40];菜豆的不育相关基因是一个重组后的嵌合基因atp1-orf98-orf239,编码一个大小约27 kDa的蛋白[41];辣椒CMSPeterson型的不育相关基因有cox2-orf456 与cox2-orf507,分别编码大小约为17 kDa与19.5 kDa的蛋白,决定着不育的表型[42-43]。
综上所述,相比水稻不育基因WA352,其他作物上关于不育基因的研究还不是很深入。通过对比不育胞质与正常胞质的DNA、RNA及蛋白找到一些差异,并定义和确定了与不育相关的一些基因,但这些相关不育基因的功能与导致花粉败育的机制还需要进一步的探索与研究[4]。目前已知的不育基因均与线粒体相关。线粒体基因组自身重组,或与核基因组发生重组后产生新的开放阅读框,新的阅读框编码的蛋白可导致细胞毒性的产生,从而引起线粒体膜系统的运输、代谢与功能的紊乱而杀死细胞,导致花粉生长异常或不萌发,最终导致败育的产生[44]。
4 细胞质雄性不育基因的相同点
4.1 细胞质雄性不育基因的来源相似性
目前发现的不育基因来源于线粒体基因组的重组,一般会与线粒体呼吸链的基因嵌合或重排,最终形成一个共转录的orf或单个有毒的orf。目前所鉴定的CMS不育基因多通过比较不育系与保持系之间线粒体基因(组)在基因组、转录组和蛋白组之间的差异最终确定为CMS基因。例如,水稻CMS-WA的不育基因WA352的发现就是通过野败型不育系、保持系、恢复系进行Northern blotting分析,通过整个基因组的比对而发现的;玉米CMS-T型细胞质雄性不育蛋白URF13是从蛋白水平通过比较CMS与可育材料间蛋白质组差异来确认的[44];水稻中CMS-HL中的ORFH79与CMS-BT中的ORF79为同源基因,且同源性很高,两者有相同的不育机制[46];高粱上CMS-A3的ORF107的N端31个氨基酸与ATP9 N端存在84%的相似性,C端49个氨基酸与水稻ORF79 C端具有80%的相似性[47];其他已经确认的CMS基因如萝卜里的CMS-Kos型的orf125和芸薹属植物里的CMS-Ogu型的orf138仅在编码区有两个氨基酸的替换与一个39 bp的缺失[37];甜菜CMS-G型中突变了的cox2引发不育表型,基因序列来自于线粒体基因[38]。
4.2 细胞质雄性不育基因的蛋白功能相似性
多数的不育系基因编码大小约为10~35 kDa的跨膜蛋白,至少包含有一个疏水区域。这些跨膜蛋白可以融合到线粒体内膜,破坏质子梯度从而影响能量的合成,导致败育的产生。即细胞质雄性不育基因的蛋白影响了花药细胞中线粒体的正常功能导致了植物孢子体或胚子体的雄性败育[16],如玉米中的CMS-T型的URF13是第一个被发现的CMS蛋白,研究显示URF13蛋白不但对大肠杆菌有毒且对另外的真核细胞也具有毒害作用。自玉米T-URF13后陆续报道的CMS蛋白,包括向日葵CMS-PET1的ORF522[39],萝卜CMS-Ogu的ORF138[37],芸薹属植物CMS-Hau的ORF288[49],水稻CMS-BT的ORF79都对大肠杆菌具有毒性作用[47]。水稻中CMS-WA的WA352同样是一种毒性蛋白,对大肠杆菌的转化结果显示有一定程度的毒性[44]。
5 细胞质雄性不育的研究展望
现代分子生物学技术革命日新月异,新技术正越来越大的影响着传统育种并推进着作物育种科学向前发展。新技术、新方法如基因组、转录组、蛋白组、代谢组、表观基因组、表形组等多水平的全面整合,可加快CMS机理研究。利用这些新技术,发现并鉴定多个细胞质雄性不育不育相关基因,进行了初步的分子生物学功能分析。这些研究对于理解CMS的功能机制提供了一些分子基础。然而对于大多数的CMS系统,CMS蛋白的作用机理是怎样产生不育的表型,以及是如何与CMS的恢复蛋白发生作用任然不清楚[4]。尽管水稻CMS-WA的不育基因经过大量的科学研究已揭示其功能机制,但在其他主要粮食作物如小麦、高粱、玉米等的研究则一直比较缓慢,它们的不育机理是否和水稻相同或相似还需要科研工作者付出更多的努力。目前细胞质雄性不育不育机制的理论认识仍然落后于其生产应用。CMS的利用与杂种优势的利用紧密相连,尽早阐述CMS的功能及不育机理有利于促进杂种优势的利用,提高作物产量,推动粮食安全生产起着巨大推动作用[16]。

