滇牡丹类黄酮7-O-葡萄糖基转移酶基因的鉴定与表达分析*
原晓龙,陈剑,陈中华,华梅,王娟,王毅
(云南省林业科学院,云南省森林植物培育与开发利用重点实验室,国家林业局云南珍稀濒特森林植物保护和繁育重点实验室,云南 昆明 650201)
滇牡丹(Paeoniadelavayi)是芍药科(Paeoniaceae)芍药属(Paeonia)牡丹组(Sect.Moutan)植物,是中国西南地区特有的多年生小灌木,是一种具极高观赏价值特色园艺作物育种资源,已被列为国家二级保护植物[1-2]。滇牡丹包含园艺品种花瓣中少有的黄色性状[3-5],可作为培育含黄色花基因观赏牡丹的重要育种材料。目前,对黄花滇牡丹花色素的分析发现其色素成分主要以糖苷形式存在,如异杞柳苷(Isosalipurposide,ISP)、山柰酚、槲皮素、异鼠李素、金圣草黄素、芹菜素葡萄糖苷等经过糖基化修饰的类黄酮糖苷[5-6]。黄酮类色素、萜类、激素及次生代谢产物的糖苷主要经糖基化修饰形成,糖基化反应是一种典型的后修饰反应,存在于植物天然次生代谢产物合成的最后一步[7],糖基化(Glycosylation)的修饰反应是由糖基转移酶(Glycosyltransferases,GTs,EC 2.4.x.y)催化的[8]。GTs具一定的底物特异性和位置特异性,依据其二磷酸尿苷(UDP)糖基供体的不同,可分为UDP-葡萄糖、UDP-鼠李糖和UDP-半乳糖等[9],如类黄酮2’-O-葡萄糖基转移酶可在四羟基查尔酮(THC)的2’碳位添加葡萄糖进行糖基化,增加THC稳定性和水溶性,并抑制外源性的糖苷酶的降解,使THC能够大量累积于植物液泡中[10-11];依据其碳位不同可分为3-O、5-O、7-O、3’-O等[8]。源于不同种类植物但具相同功能的糖基转移酶通常归属于同一亚组[6],如类黄酮7-O-葡萄糖基转移酶(flavonoid 7-O-glucosyltransferase,7GT)可将UDP-糖基供体转移到花色素的C7羟基(或羧基)上,7GT中已经过功能鉴定的类黄酮7-O-葡萄糖基转移酶基因有黄芩(Scutellariabacicalensis)的UBGT[12]、Glycyrrhizaechinata的UGT73F1[13]、洋葱(Alliumcepa)的UGT73J1[14]及拟南芥(Arabidopsisthaliana)中的AtGT2[15]。这些说明类黄酮7-O-葡萄糖基转移酶对类黄酮类物质具有一定的区域选择性。虽然对不同植物的7-O-葡萄糖基转移酶基因的克隆和功能鉴定有过一些报道,但尚未发现有关滇牡丹的类黄酮7-O-葡萄糖基转移酶的研究报道。
目前研究人员对滇牡丹的红色花瓣和黄色花瓣完成了转录组测序[16],并对其类黄酮生物合成途径进行了揭示,但关于滇牡丹花色素生物合成基因克隆及功能分析的文章报道较少,仅对滇牡丹3-O-葡萄糖基转移酶的基因进行过克隆和表达分析[17]。为了更好地研究滇牡丹花色素的形成机制,本项目组在滇牡丹红色、白色和黄色花瓣的转录组测序的基础上,成功克隆到滇牡丹7-O-葡萄糖基转移酶(Pd7GT)基因,并对其进行生物信息学分析、功能鉴定和转录模式分析,为通过基因工程技术培育具新性状的园艺观赏牡丹、研究色素形成机理奠定基础。
1 材料与方法
1.1 材料
滇牡丹花瓣、根、茎、叶等组织采集于云南省迪庆州香格里拉市高山植物园(99°35′21.5″E,27°57′6.9″N);其中,用于进行不同组织和不同发育时期花转录模式分析的各组织均采自同一株开黄色花的滇牡丹;而黄花、白花和红花均是在花开时期采集其整朵花。采集后,放入50mL离心管中,用液氮保存后带回实验室,放置于-80℃冰箱中备用。
EasyPfu DNA聚合酶(北京全式金)、反转录试剂盒(北京全式金)、植物总RNA提取试剂盒(Qiagen)。
1.2 方法
1.2.1 滇牡丹各组织RNA提取及cDNA合成
将带回的滇牡丹各组织部位、不同发育时期的花和不同颜色的花瓣置于液氮中研磨成粉末,在添加RNA提取液之前需要样品始终处于液氮环境中,按照植物总RNA提取试剂盒说明书的各步骤操作。提取后,用1%的琼脂糖凝胶电泳和NanoDropTM2000(Thermo USA)检测RNA的质量和浓度,完整且浓度合适的RNA置于-80℃冰箱中保存备用。用反转录试剂盒进行cDNA第一链合成,按照说明书进行具体操作。反转录cDNA -20℃冰箱中备用。
1.2.2 滇牡丹Pd7GT基因的克隆
以源于巨桉(Eucalyptusgrandis)的查尔酮7-O-GT(7-O-glucosyltransferase,GenBank登录号为XP_010066837)基因为模板,利用本地BLAST对滇牡丹花瓣的转录组数据进行搜索,获得滇牡丹的7-O-GT基因(Pd7GT)序列,根据该基因序列设计特异引物(Pd7GT1F:5’-ATGACGAAAGCAGAGTTAGT-3’;Pd7GT1R:5’-TCATACAAAATATGCCCTAA-3’)。以滇牡丹红花的花瓣cDNA为模板,以Pd7GT1F和Pd7GT1R作为引物,用EasyPfu DNA聚合酶扩增获得Pd7GT全基因片段。通过琼脂糖凝胶电泳将扩增产物纯化回收后,连接到克隆载体上,经过菌落PCR检测后,送至上海生工测序。
1.2.3 滇牡丹Pd7GT基因cDNA序列及其蛋白氨基酸的生物信息学分析
获得滇牡丹Pd7GT基因cDNA序列后,利用NCBI(http://www.ncbi.nlm.nih.gov/)上的ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)分析获得其蛋白氨基酸序列,借助于在线工具ProParam(http:/ /web.expasy.org /protparam/)预测Pd7GT蛋白的理化性质;用SignalP 4.1 server(http://www.cbs.dtu.dk/services/SignalP/)预测该蛋白信号肽的有无;亚细胞定位用Target P(http://www.cbs.dtu.dk/services/TargetP-1.1/output.php)预测分析,用NCBI中的CDD数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/)搜索Pd7GT蛋白结构功能域,通过NCBI对其cDNA和蛋白氨基酸序列进行同源序列搜索,选择与Pd7GT蛋白序列一致性较高的植物糖基转移酶蛋白序列,用MEGA 6.0中的Clustal W进行多序列比对后,采用邻位相接法,构建系统进化树。
1.2.4 滇牡丹Pd7GT基因的转录水平分析
用植物总RNA提取试剂盒提取滇牡丹根、茎、叶、花瓣、花蕊及不同花发育时期花芽(花完全由花萼包裹),花蕾(漏出红色花瓣),花开(花瓣全部展开),花谢(授粉后1d)4个时期的花瓣等8个组织的总RNA,用琼脂糖凝胶电泳和NanoDropTM2000分别测定RNA的质量和浓度后,进行反转录合成cDNA的第一条链。以特异引物TPd7GTF(5’-GATTCGTCCACCTCTCAT-3’)和TPd7GTR(5’-AATTGAAACAGATTGCAA-3’)检测滇牡丹Pd7GT基因在根、茎、叶及花不同发育时期的具体表达情况;在筛选了大量内参基因后,选择表达情况基本一致的ubiquitin作为内参基因,其引物序列为ubiquitinF(5’-ATGGGAACTGAGCAACGT-3’)和ubiquitinR(5’-AAACGCGTGAGGGATTTC-3’)。PCR扩增后用琼脂糖凝胶进行电泳检测,并利用凝胶电泳图像分析软件GENE-SNAPS分析其积分光密度,并计算目的基因/内参基因积分光密度的比值,用于柱形图的绘制,以用作相对定量表达分析。
2 结果与分析
2.1 滇牡丹RNA提取
采集得到的滇牡丹不同组织器官、不同发育时期花及不同颜色的花瓣,用液氮保存带回实验室,按植物总RNA提取试剂盒的说明提取总RNA,用1.2%琼脂糖凝胶电泳(图1)和NanoDropTM2000(Thermo USA)检测后,将适宜浓度的总RNA反转录成cDNA。

图1 滇牡丹各组织、各发育时期花和不同颜色花瓣RNA提取结果
2.2 滇牡丹Pd7GT基因全长的cDNA克隆及序列分析
以TPd7GTF和TPd7GTR作为特异引物,以滇牡丹cDNA为模板进行Pd7GT基因的克隆,将该目的片段通过克隆载体筛选后,送上海生工测序。该基因含有1 446bp的核酸片段,含完整的开放阅读框(GenBank登录号:KX394687),可编码481个蛋白氨基酸。
2.3 滇牡丹Pd7GT基因的生物信息学分析
用在线程序对Pd7GT基因的核酸及蛋白氨基酸进行生物信息学分析,用ORF Finder预测其开放阅读框、ProParam预测其理化性质、SignalP 4.1 server预测信号肽存在与否、TargetP预测该蛋白的作用位置,结果显示:组成该蛋白的氨基酸共481个,分子式为C2458H3845N659O703S18,相对分子质量54.45kDa,等电点(pI)6.10,带正电荷的氨基酸残基数量为63个,带负电荷的氨基酸残基数量为56个,脂肪族系数89.00,不稳定系数(Ⅱ)经计算其值为39.58,是一种稳定蛋白;该蛋白信号肽值(S-score)最大可能值为0.235,其值较低,Pd7GT蛋白不存在信号肽剪切位点,且无跨膜结构;该蛋白发挥作用的亚细胞位置在线粒体的可能性为0.038、存在于分泌途径的可能性为0.518、存在于细胞质基质的可能性为0.561,可靠等级为5,即可靠性较低,该蛋白可能存在于内质网或细胞质基质中;用NCBI 上ORF Finder推测得到的Pd7GT基因的481个蛋白氨基酸与葡萄(Vitisvinifera)、枣(Ziziphusjujuba)、巨桉(Eucalyptusgrandis)、毛果杨(Populustrichocarpa)等植物类黄酮7-O-糖基转移酶的蛋白序列进行同源序列比对,这5条蛋白序列具74.6%的一致性,发现Pd7GT蛋白的C端具有糖基转移酶所特有的PSPG盒子,其序列为GWAPQVMILEHEAVGGFVTHCGWNSTLEGISAGLPLVTWPIFAEQFYNEKL(图2)。

图2 滇牡丹Pd7GT同源蛋白的序列比对

图3 滇牡丹Pd7GT与其他植物同源蛋白的分子系统进化树
该序列中含糖基转移酶识别区(WAPQV)和糖基配体绑定位点(HCGWNS)。同时依据相关文献报道,将功能已知,且糖基配体比较明确的植物7GT蛋白从NCBI上下载下来,进行多序列比对后用邻位相接法构建系统进化树,结果显示:依据其糖基配体的不同可分为3组,分别是UDP-葡萄糖、UDP-鼠李糖和UDP-半乳糖,其中滇牡丹Pd7GT蛋白(KX394687)与可可(XP_007042481)、Herranniaumbratica(XP_021298085)、毛果杨(XP_006379195)、巨桉(XP_010066837)等以葡萄糖为糖基配体的类黄酮7-O-糖基转移酶聚为一类。
2.4 滇牡丹Pd7GT基因的转录模式分析
对滇牡丹各组织、各发育时期的花及不同颜色花瓣进行转录模式分析,具体表达情况见图4:Pd7GT基因在滇牡丹的不同组织中,各个部位均有表达,但其表达量差异显著,茎中的表达量最高、叶次之、根中最为微弱,其表达量从高到低依次为茎>叶>花>根(图4A);在不同花发育时期,Pd7GT基因的表达量随着花发育不断降低,其表达量花芽、花蕾 、花开逐渐减小,但到花谢期该基因表达量陡增,从高到低依次为花谢期>花芽期>花蕾期>花开期(图4A);在不同颜色的花瓣中,Pd7GT基因的表达量从高到低为黄花 >红花 >白花,其中该基因在红花和白花中表达量较微弱,在黄花中强烈表达。
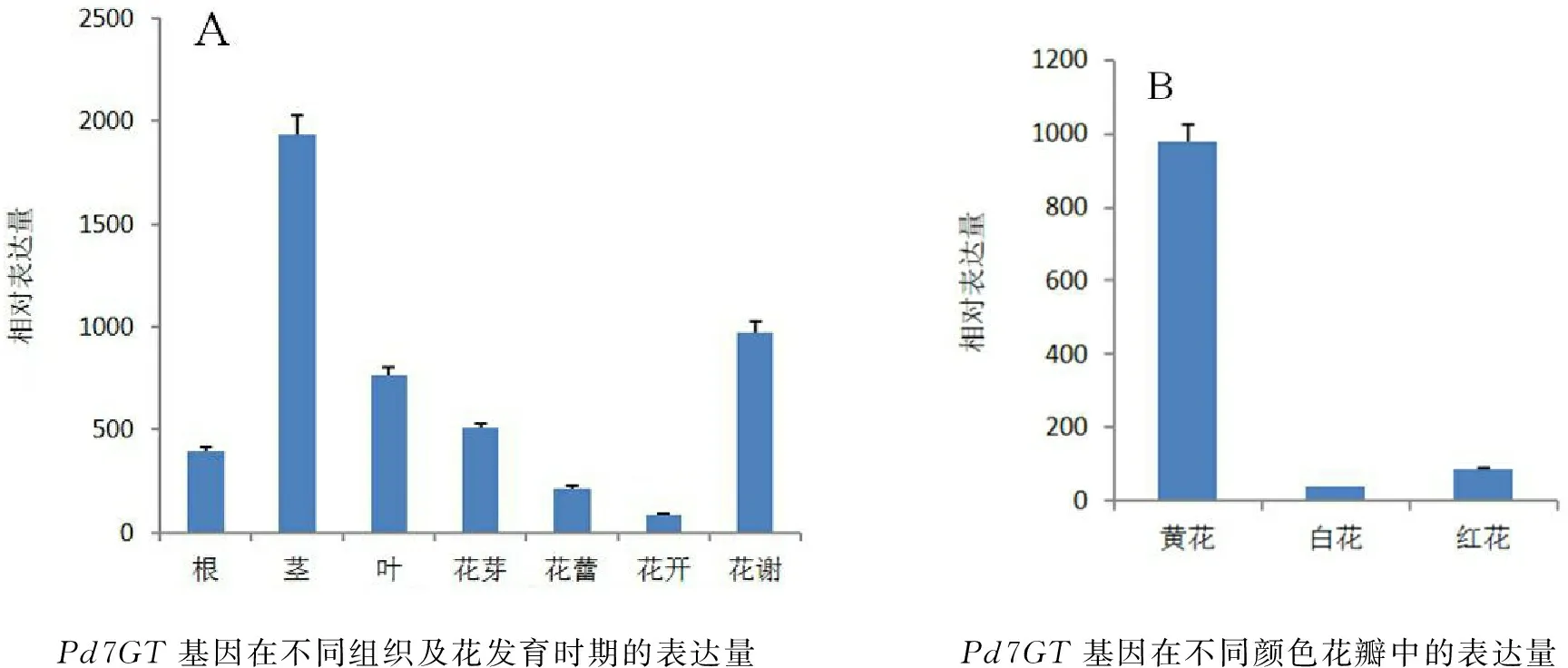
Pd7GT基因在不同组织及花发育时期的表达量Pd7GT基因在不同颜色花瓣中的表达量
图4Pd7GT基因在滇牡丹中的表达情况
Fig.4 The expression levels ofPd7GTgene
3 讨论
糖基转移酶是一个超酶家族,能将各种糖基配体从活化的供体上转移到受体上,几乎存在于所有有机体中[18]。植物中的糖基供体主要为UDP-葡萄糖[19- 20],还有少量的UDP-半乳糖[21]、UDP-鼠李糖[22]等;常见的糖基受体主要为单糖、低聚糖、多糖及非碳水化合物,如蛋白质、脂类及各种次生代谢产物[7];一般糖基化部分发生在受体分子的不同O(羟基、羧基)、N(氨基)、S(巯基)和不同碳位原子间,形成3-、5-、7-、2’-等糖苷或糖酯,进而增加受体分子的亲水性、稳定性、生物活性等,改变该物质在细胞内和有机体内的运输和储存[7,23- 24]。糖基转移酶对植物各方面均具有重要的作用,如生长发育、代谢调节、天然次生代谢产物合成和贮存、解除内外源毒素活性等[25]。本文克隆获得滇牡丹的7-O-葡萄糖基转移酶基因序列,并通过生物信息学分析的手段进行确认及表达模式分析。
通过生物信息学对滇牡丹Pd7GT基因进行分析,Pd7GT蛋白是一种不存在信号肽剪切位点、无跨膜结构,在细胞中的细胞质部位发挥作用的稳定蛋白,与糖基化反应发挥功能的部位一致;如黄酮类的花青素在合成天竺葵色素(Pelargonidin)、矢车菊色素(Cyanidin)、飞燕草色素(Delphididin)、芍药色素(Peonidin)、牵牛花色素(Petunidin)和锦葵色素(Malvidin)等前体物质后,紧接着在细胞质中进行糖基化修饰作用[7,11,26]。糖基转移酶超家族蛋白的一级结构在C端含有约44个保守氨基酸残基,即含有该家族识别区和糖基配体绑定位点的PSPG盒子[7],不同碳位(3-O、5-O、7-O等)及功能(转移糖基配体的种类)的糖基转移酶均具有该保守区域[26],Pd7GT蛋白亦含有此区域,可推测该蛋白是一种糖基转移酶。将功能已知的7-O-GT蛋白一起与Pd7GT进行聚类分析,该基因与糖基供体为UDP-葡萄糖聚为一支,综合分析Pd7GT基因编码的糖基转移酶将UDP-葡萄糖转移到受体分子的C7的羟基或羧基上;与其他碳位如3-O-GT等属于不同的基因[17];同时根据Pd7GT蛋白一级结构C端所含的44个保守区域和其糖基供体,该蛋白可归为尿苷二磷酸糖基转移酶(UGT)家族[20],具催化植物天然次生代谢产物的合成和促进植物的生长发育功能[25]。
糖基转移酶是一种分歧度极高的多源基因家族[20],可依赖于酶蛋白的氨基酸残基序列的相似性、催化特点及保守序列的有无等对其进行分类[18,27-28]。本研究中Pd7GT的聚类分析结果是以UDP-葡萄糖作为糖基供体添加到类黄酮的C7位羟基上,与其类似的还有UBGT在黄芩体内对其主要类黄酮类物质黄芩黄素的C7位点显示出最佳的亲和性[12];UGT73F1在Glycyrrhizaechinata对异黄酮formonetin具最佳亲和力,而对槲皮黄酮(quercetin)、山柰酚(kaeopferol)的亲和性最低[13];经过重组的UGT73J1可使洋葱中的槲皮黄酮 3-O-葡糖苷转化为槲皮黄酮3,7-O-双葡糖苷[14];拟南芥的AtGT2在体外大肠杆菌(Escherichiacoli)中表达时对圣草酚苷(eriodictyol)显示出极强亲和力[15]。糖基转移酶对受体的碳位点选择具有一定的专一性,如在三花龙胆(Gentianatriflora)[29]、荷兰鸢尾(Irishollandica)[30]等植物中催化花青素合成花青素3-O-糖苷的3GT,进一步催化花青素3-O-糖苷合成3,5-O-糖苷的5GT等;类黄酮的糖苷复合体可提高该类物质的稳定性和转运性,增加其在植物液泡内的积累。糖基转移酶的底物可是类黄酮,还可是萜烯类、激素及聚酮类等次生代谢物质[19],GT在植物次生代谢产物合成及调节、贮存及植物生长发育等方面具重要作用[25];在影响植物生长发育和抗性方面作用的发挥主要依赖于调节植物体内激素含量水平的方式[31];如研究人员在小麦(Triticumaestivum)中发现TaUGT73D1基因在雄蕊中表达量最高,而在雌蕊和雌蕊化的雄蕊中几乎不表达,这一现象是通过小麦的TaUGT73D1蛋白调控小麦内源激素ABA的含量来促使其雄蕊转化为雌蕊[31];花生中的AhUGT83A1-like基因在胁迫条件下能够增加游离态ABA的含量和表达水平增加[32]。而基因表达实验中,滇牡丹中Pd7GT基因在茎、叶和花芽中表达量较高,在花谢时期其表达量陡然升高,这一现象目前尚无法解释,但因为本研究中的内参基因是经过筛选,且其表达量基本一致,可排除内参基因的因素;究竟因何种原因造成这一现象需要进一步通过基因过表达或异源表达进行验证;而在不同颜色花瓣中,在黄花花瓣中表达量较大,可能与该基因促进黄酮类物质积累和合成有关。本研究为研究滇牡丹糖基转移酶异源表达、分子育种提供一定的基础,为未来通过基因工程培育具新颖花色和抗性的新品种提供必要材料。

