不同运动对糖尿病大鼠周围神经结构功能的影响及机制
税晓平 曹艳霞 李顺昌 孙君志 丁海丽 尚画雨 苏全生
1成都体育学院运动医学与健康学院(成都610041)
2四川中医药高等专科学校3绵阳市骨科医院
糖尿病将引起周围神经结构和功能发生改变,导致糖尿病周围神经病变(diabetic peripheral neuropathy,DPN),其主要临床表现为感觉功能障碍,并出现麻木、疼痛等表现,严重者会出现溃疡甚至截肢。目前还没有针对DPN的特效药物,在控制血糖的基础上,针对周围神经病变症状使用三环类抗抑郁药、局部镇痛药、非甾体类抗炎药、维生素B12和抗氧化剂ɑ-硫辛酸等[1]。药物治疗并不能清除病因和阻止病情发展,并且具有很大的副作用。运动疗法具有副作用低、经济成本小的优势,是糖尿病及其并发症的主要疗法之一,并与饮食疗法、胰岛素疗法被并称为糖尿病及其并发症的“三驾马车”。运动疗法对DPN的治疗机制尚不明确。本研究采用7周高脂高糖喂养配合一次性小剂量链脲佐菌素(STZ)注射诱导2型糖尿病大鼠模型[2],并分别采用有氧或抗阻两种不同运动形式进行干预,探讨不同运动对糖尿病周围神经结构功能的影响及机制。
1 材料与方法
1.1 实验动物
6周龄雄性SD大鼠(SPF级)60只,体重160~180 g,购买于成都达硕公司(动物编号20160811)。动物饲养于成都体育学院运动医学与健康学院动物实验房,分笼饲养,自由摄食饮水,室温控制在21℃~23℃,相对湿度40%~60%,用窗帘和灯光控制12 h∶12 h明暗循环。
1.2 动物分组
适应性喂养1周后,按照体重均衡原则分为对照组(pC,n=24)和造模组(pD,n=36)。pC组普通饲料喂养,pD组高脂高糖饲料喂养(常规饲料67%、猪油10%、蔗糖20%、胆酸钠1%、胆固醇2%)喂养,普通饲料和高脂高糖饲料均由成都达硕实验动物有限公司加工。喂养7周后,各组空腹12 h,进行尾部静脉采血测试空腹血糖(FBG)和胰岛素(FINS),按公式计算胰岛素抵抗指数(HOMA-IRI),HOMA-IRI=[FBG(mmol/L)×FINS(mU/L)/22.5]。与高脂高糖饲料喂养前比较,喂养7周后,pD组FBG(5.02±0.51 vs 6.97±1.04,P<0.05)、FINS(18.95±1.84vs35.17±4.63,P<0.01)和HOMA-IRI(4.23±0.41 vs 10.89±1.31,P<0.01)均明显升高,表现为典型的胰岛素抵抗[3]。高脂高糖喂养7周后,pD组大鼠左下腹一次性腹腔注射链脲佐菌素(STZ,30 mg/kg),注射72 h后尾部静脉取血测试非禁食血糖(NFBG),按2型糖尿病动物模型判断标准:在胰岛素抵抗基础上,NFBG≥16.7 mmol/L为成功模型[4]。pC组大鼠注射同等体积的枸橼酸缓冲液。36只糖尿病造模大鼠共成模26只,成模率72.2%。
26只糖尿病大鼠再次分为糖尿病模型组(D,n=8)、糖尿病有氧运动组(DA,n=9)和糖尿病抗阻运动组(DR,n=9)。pC组分为空白对照组(C,n=8)、单纯有氧运动组(CA,n=8)和单纯抗阻运动组(CR,n=8)。分组后各组分别继续普通饮食和高脂高糖饮食。
1.3 运动方案
有氧运动方案为跑台运动。参照Bedford[5]运动模型,以15 m/min适应性训练3天后,CA、DA组大鼠以速度20 m/min,60 min/d、5天/周,共8周。
抗阻运动方案为负重爬梯训练。据参考文献自制改良小动物爬梯[6],爬梯高1 m,每级阶梯间隔2 cm,训练时倾斜85°放置。适应性爬梯训练3天(负荷渐增至35%体重),必要时刺激大鼠尾部促使其运动。正式训练前测试CR、DR组最大负重(1RM),测试方法参照Hornerberger等[7]的抗阻训练模型,大鼠最初以尾部负重75%体重爬梯,后每次增加30 g负重,重复爬梯直至不能完成一次完整爬梯。每周重新测试1RM。正式抗阻训练按照负荷递增原则分别进行3次50%1RM、3次75%1RM、3次90%1RM及3次1RM负重爬梯训练。进行1RM负重训练时,若不能完成3次爬梯时以实际完成次数限(≤3次)。每次爬梯至顶部后休息2 min,5天/周,共8周。
1.4 主要仪器和试剂
小动物跑台DSPT-208,中国杭州段氏制作;动物负重抗阻爬梯,成都体育学院运动医学与健康研究所自制;稳豪倍易型血糖仪,美国强生公司;PowerLab V8数据采集分析系统,澳大利亚AD Instruments公司;JR-30鼠恒温实验台,成都泰盟。FINS试剂盒,美国Millipore公司(货号EZRMI-13K)。免疫组化及Western blot测试所使用抗体均购于美国Abcam公司,分别是抗MPZ抗体(货号ab31851)、抗MBP抗体(货号ab7349)、抗MAG抗体(货号ab46803)。
1.5 测试指标与方法
实验期间观察一般情况,定期称重,8周运动后禁食12 h,尾静脉取血测试FBG,进行糖耐量测试。糖耐量测试方法为实验动物禁食12 h后,以2 g/kg浓度腹腔注射20%葡萄糖溶液,分别测试注射前及注射后30 min、60 min、120 min四个时间点的血糖值,按公式作出变化曲线并计算曲线下面积(area under the curve,AUC),判断胰岛素抵抗情况。
8周运动后72 h,各组大鼠腹腔注射10%水合氯醛溶液(3.5 ml/kg)麻醉大鼠,迅速脱毛,仰卧位固定于恒温手术台,保持大鼠体温在37°,用PowerLab生理记录仪测试右侧坐骨神经传导速度。测试结束后取右侧坐骨神经迅速放入液氮速冻,并置于-80°冰箱保存。取左侧坐骨神经,平均分为两份,一份用于免疫组化检测和HE染色,另一份用于透射电镜观察。免疫组化检测外周髓鞘蛋白0(MPZ)、髓鞘碱性蛋白(MBP)和髓鞘相关糖蛋白(MAG)阳性表达(平均光密度);右侧坐骨神经用于Western blot检测MPZ、MBP和MAG蛋白的表达。HE染色、免疫组化实验和Western blot均在四川大学华西医院科研基地公共实验技术中心进行,透射电镜实验在四川大学华西基础医学与法医学院进行。
免疫组化法检查MPZ、MBP和MAG蛋白在髓鞘中的表达,切片常规进行脱蜡水化,抗原修复,阻断内源性过氧化物酶,免疫组化笔画圈,山羊血清封闭,按测试指标分别滴加一抗(MPZ 1∶200;MBP 1∶250;MAG 1∶100)于4℃冰箱过夜孵育,室温复温30 min后水洗,滴加二抗工作液覆盖组织37℃孵育1h后取出水洗,DAB试剂显色,复染细胞核,脱水,透明,中性树胶封片后显微镜下观察结果。在显微镜下,各髓鞘蛋白在切片上呈现出棕黄色或棕褐色为阳性表达,核呈蓝色。每张切片在400倍光镜下随机取5个不同视野,采用Image-Pro plus 6.0图像分析系统进行半定量分析平均光密度(IOD值),取5个不同视野IOD值的平均值代表该切片的值。
Western blot方法检测MPZ、MBP和MAG蛋白在髓鞘中的表达,取冻存坐骨神经,按每100mg加1 ml裂解液,超声破碎;4℃,12000g离心15 min;取上清,进行BCA蛋白定量;将蛋白样品调至等浓度,然后上样电泳和转膜;转膜结束后进行封闭与孵育抗体,其中一抗浓度为(MPZ 1∶500;MBP 1∶500;MAG 1∶500);采用HRP-ECL发光法显影和定影,获得Western blot条带。采用Image J 1.50i图像分析软件分析蛋白表达条带的灰度值;目的蛋白条带灰度值与内参蛋白GAPDH条带灰度值的比值为该蛋白的相对表达量。
1.6 数据统计
数据使用“均数±标准差”(x±s)表示,统计分析使用SPSS 19.0版统计软件和Graphpad Prism6进行处理。各组间比较采用单因素方差分析(One-Way ANOVA),方差齐性时用LSD方法进行各组均值多重比较,方差不齐时采用Tambane,S T2法进行两两比较。显著性差异标准P<0.05,非常显著性P<0.01。
2 研究结果
2.1 一般情况
实验期间,糖尿病大鼠毛色枯黄无光,精神萎靡,多饮,多食,体重下降,痛觉敏感,易惊吓。糖尿病各运动组状态较糖尿病组明显好转。在实验期间,因糖尿病慢性疾病状态导致的感染、运动损伤导致部分大鼠死亡,本实验各组最终纳入统计的样本均为7只。
2.28 周运动干预后各组体重、血糖和AUC值情况
表1显示,与C组比较,D组、DA组和DR组大鼠体重均非常显著下降(P<0.01);与D组比较,DA组和DR组大鼠体重显著增加(P<0.05),DA组和DR组两组间比较无统计学意义。与C组比,D组、DA组和DR组血糖显著性升高,其中D组具有极显著性差异(P<0.05,P<0.01);与D组相比,DA组和DR组大鼠血糖显著降低(P<0.05),其中DR组显著低于DA组(P<0.05)。与C组比,D组、DA组和DR组糖耐量线下面积非常显著升高(P<0.01);与D组相比,DA组和DR组糖耐量曲线下面积非常显著降低(P<0.01),其中DR组显著低于DA组(P<0.05)。
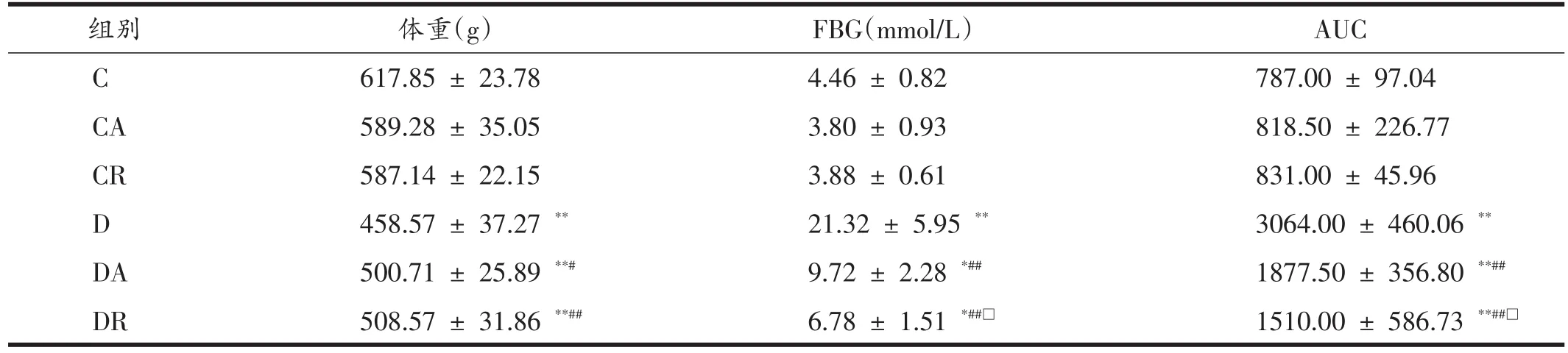
表1 8周运动干预后各组大鼠体重、血糖及AUC比较(n=7)
2.3 坐骨神经HE染色病理形态学变化
实验末,C组、CA组和CR组大鼠坐骨神经纤维形态正常,排列整齐、致密。D组大鼠坐骨神经组织出现区域大小不一,程度不一的髓鞘肿胀、断裂,髓鞘空泡变性,部分神经纤维脱髓鞘改变(图中黑箭头所示)。DA和DR组病变程度较D组明显减轻,髓鞘空泡变性减少,神经纤维脱髓鞘程度减轻。见图1。
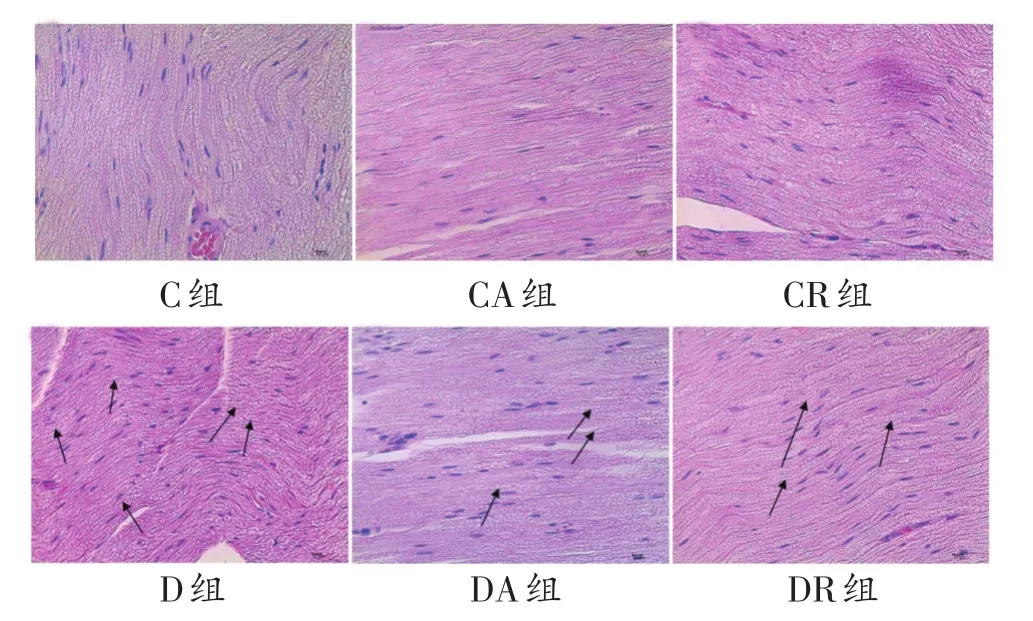
图1 8周运动干预后各组坐骨神经HE染色结果比较(400倍)
2.4 坐骨神经超微结构改变
实验末,C组、CA组和CR组坐骨神经纤维髓鞘均匀、致密有序、结构完整规则,髓鞘板层呈明暗相间的同心圆状排列,髓鞘厚薄均匀,形态无扭曲变形。D组髓鞘形态明显严重扭曲变形,有大量的空泡和裂隙,厚薄不均,板层结构松散,排列疏松紊乱,板层出现分离和皱缩,并向轴索形成凸起,呈典型的脱髓鞘病变。DA组和DR组髓鞘形态明显较D组改善,空泡和裂隙明显减少,板层结构较致密,排列较规则,板层分离和皱缩明显减轻,未向轴索形成明显的凸起,脱髓鞘病变明显改善。见图2。
2.58 周运动干预后各组神经传导速度(MNCV)情况
表2显示,与C组比,D组和DR组坐骨神经传导速度均明显下降(P<0.01,P<0.05);与D组相比,DA组和DR组坐骨神经传导速度均升高,其中DA组升高有统计学意义(P<0.05)。
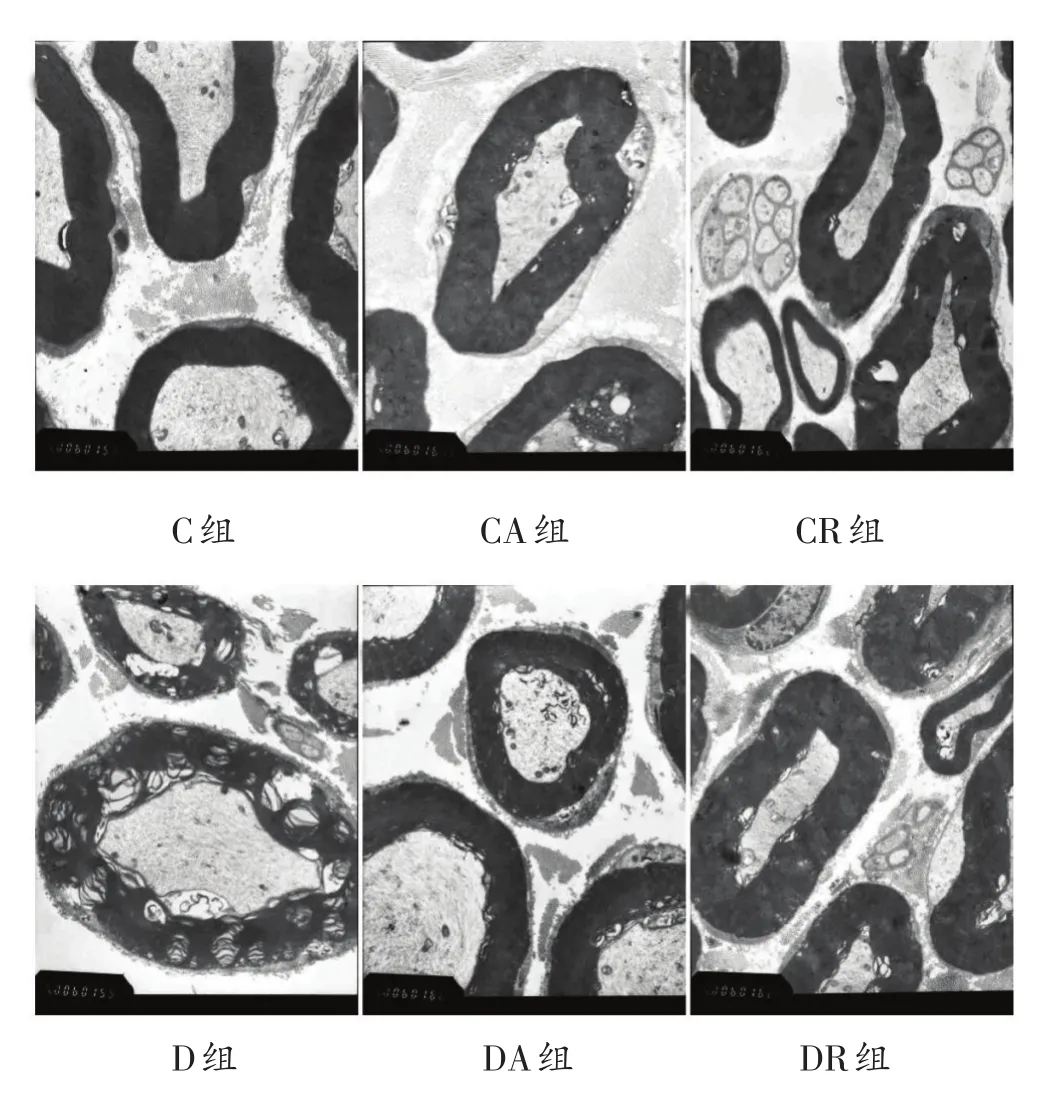
图2 8周运动干预后各组坐骨神经超微结构变化比较(6000倍)
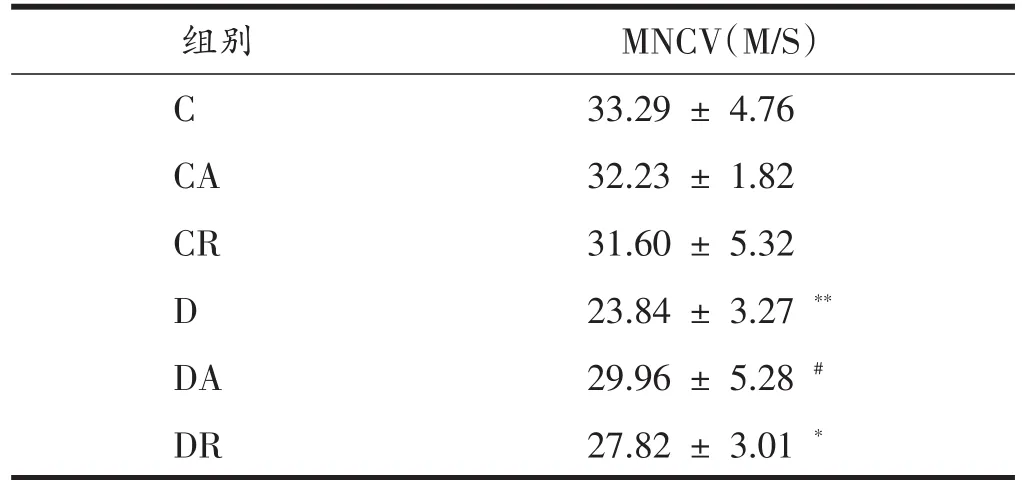
表2 8周运动干预后各组神经传导速度(MNCV)的比较(n=7)
2.6 各组大鼠坐骨神经MPZ、MBP、MAG、Hsp70蛋白表达比较
2.6.1 免疫组化法测各组大鼠坐骨神经MPZ、MBP、MAG阳性表达比较
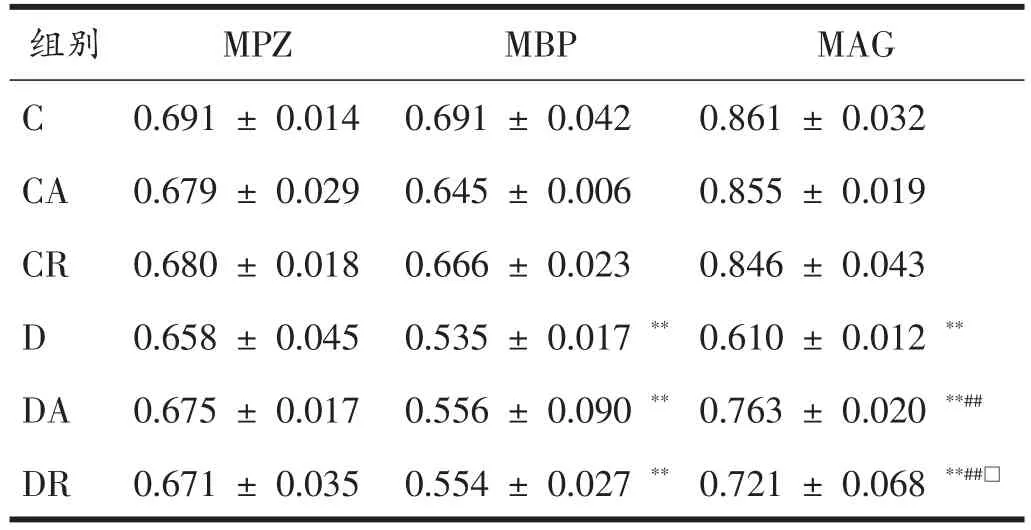
表3 8周运动干预后各组大鼠坐骨神经MPZ、MBP、MAG平均光密度比较(n=7)
免疫组化结果显示(表3、图3-图5)MPZ、MBP、MAG在髓鞘中均呈阳性表达,表达颜色为棕黄色或棕褐色,细胞核呈蓝色。各组MPZ蛋白平均光密度值未见明显差异。与C组比较,D组、DA组和DR组MBP的平均光密度值明显降低(P<0.01);与D组相比,DA、DR组MBP的平均光密度值虽略有增加,但没有统计学意义。与C组比较,D组、DA组和DR组MAG的平均光密度值明显降低(P<0.01);与D组相比,DA和DR组MAG的平均光密度值明显增加(P<0.01),其中DA组的平均光密度高于DR组(P<0.05)。
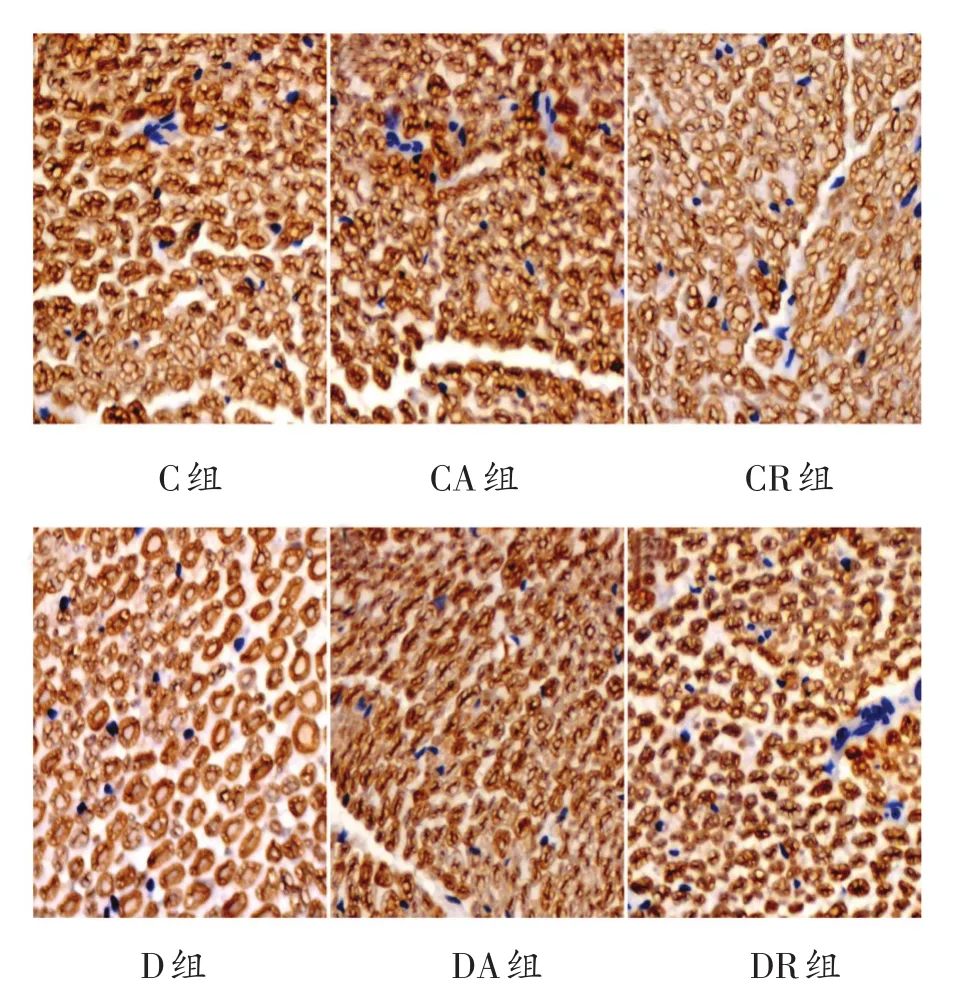
图3 8周运动干预后各组大鼠坐骨神经MPZ阳性表达情况(400倍)
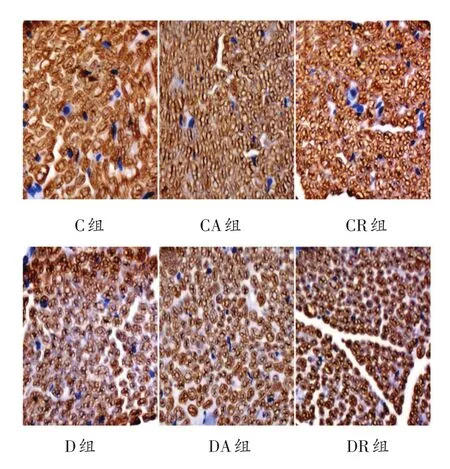
图4 8周运动干预后各组大鼠坐骨神经MBP阳性表达情况(400倍)
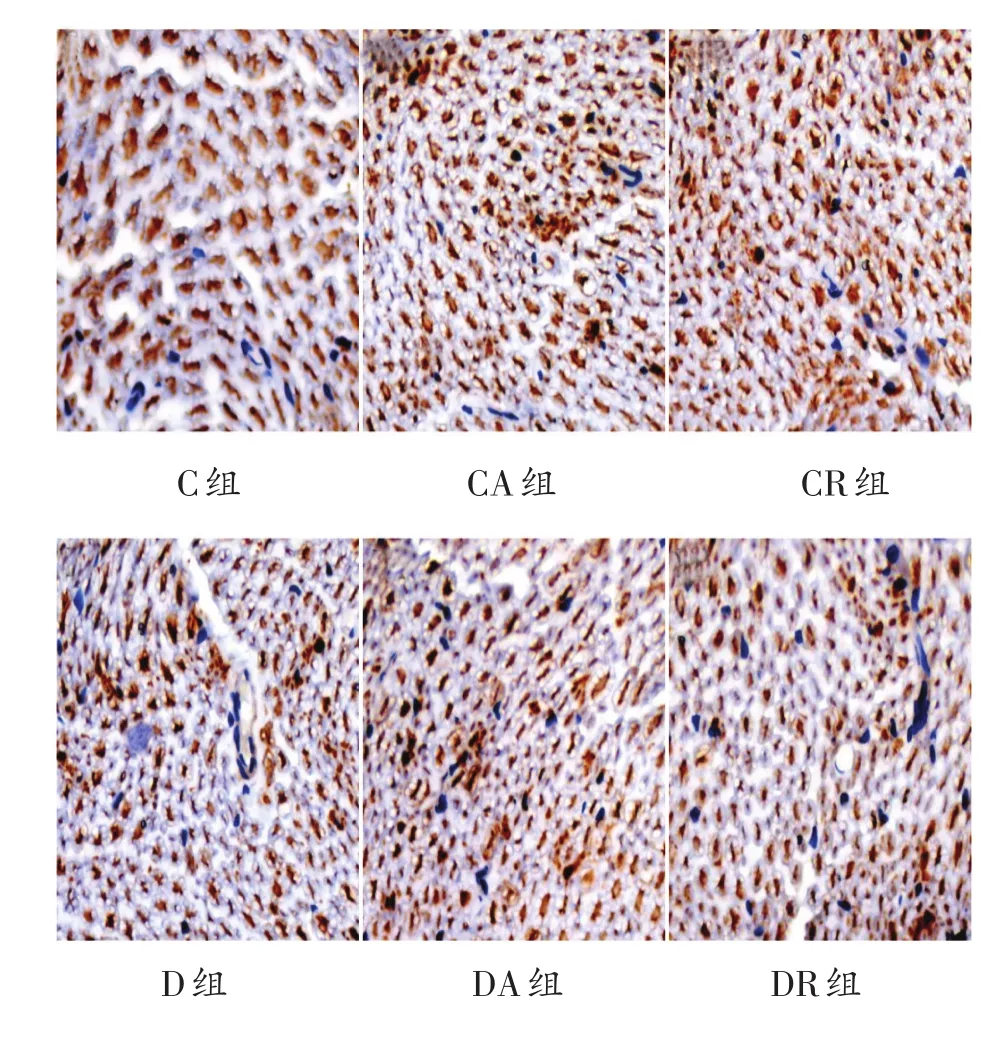
图5 8周运动干预后各组大鼠坐骨神经MAG阳性表达情况(400倍)
2.6.2 Westernblot法测各组大鼠MPZ、MBP和MAG蛋白表达比较
Western blot结果显示(图6),与C组比较,D组MPZ蛋白表达略有下降,但各组蛋白表达比较未见明显差异。与C组比较,D组、DA组和DR组的MBP的蛋白表达明显降低(P<0.01);与D组相比,DA组MBP蛋白表达明显增加(P<0.05),DR组MBP蛋白增加趋势明显,但无统计学意义。与C组比较,D组、DA组和DR组的MAG蛋白表达明显降低(P<0.01);与D组相比,DA和DR运动组MAG的蛋白表达明显增加(P<0.01),两组间比较未见差异。
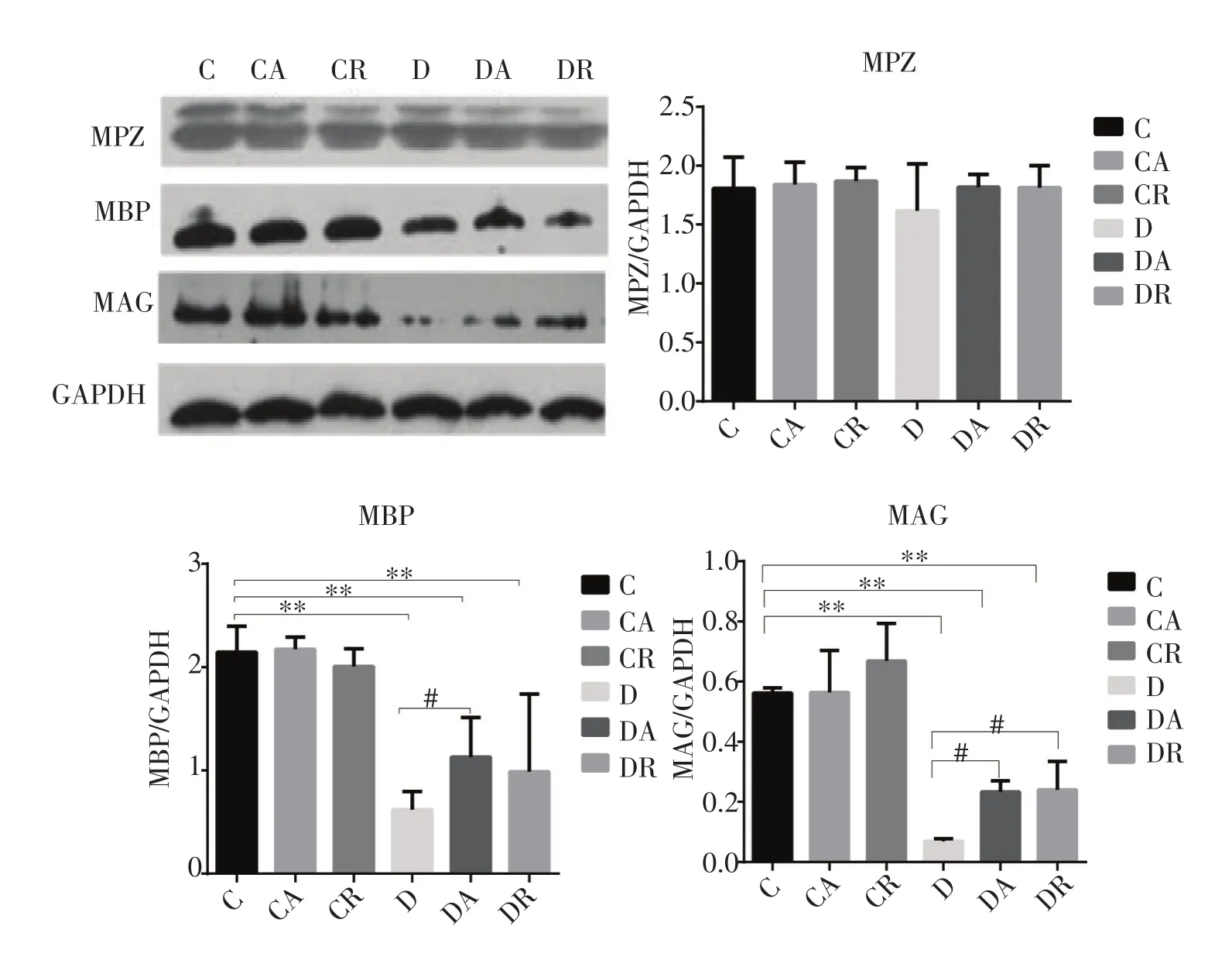
图6 8周运动干预后各组大鼠坐骨神经MPZ、MBP、MAG蛋白表达比较
3 讨论
3.1 不同运动对糖尿病大鼠体重、血糖及胰岛素抵抗的影响
利用高脂高糖喂养并配合小剂量STZ注射是经典的诱导2型糖尿病大鼠模型的方法[2],本研究利用该方法成功诱导2型糖尿病大鼠,表现出高血糖和胰岛素抵抗,糖尿病模型成模率为72.2%。随着糖尿病病程的发展,糖尿病大鼠出现毛色枯黄无光,精神萎靡,多饮,多食,体重下降,痛觉敏感,易惊吓,这和本团队前期研究结果一致[8]。
本研究发现,随着糖尿病病程的发展,糖尿病大鼠体重明显下降,而有氧和抗阻运动均能明显缓解糖尿病大鼠的体重下降,两种干预方式未见明显的差异。高血糖和胰岛素抵抗是2型糖尿病的主要表现,空腹血糖和空腹糖耐量实验(AUC)是判断胰岛素抵抗及2型糖尿病的主要指标[9]。本研究结果显示,至实验末,与C组比较,D组大鼠表现出明显的高血糖和AUC值,是典型的2型糖尿病表现。两种运动均能有效改善糖尿病大鼠的高血糖状态和胰岛素抵抗,且抗阻运动改善血糖和胰岛素抵抗的效果优于有氧运动组。
有氧运动是防治糖尿病的主要方式,其机制已经得到广泛证实。研究发现抗阻运动亦通过改善胰岛素抵抗、加速糖代谢和加速脂代谢等机制在糖尿病的防治中起积极作用。但比较有氧和抗阻运动在改善糖尿病的作用效果的研究较少,且结果尚无定论。如有研究发现利用4周抗阻和耐力运动对2型糖尿病患者进行干预后,抗阻运动对调节血糖和血脂代谢方面的效果优于耐力运动[10]。国内研究认为有氧和抗阻运动均可使糖尿病前期人群空腹和口服葡萄糖耐量试验2小时(OGTT2h)血糖显著下降,并在一定程度上使糖尿病前期人群血糖下降至正常水平,其中抗阻运动可使更多的糖尿病前期个体糖化血清蛋白(GSP)得到改善[11]。本研究结果发现,抗阻运动改善糖尿病大鼠血糖的效果优于有氧运动,其可能机制是抗阻运动能更好地改善胰岛素抵抗。
3.2 不同运动对糖尿病大鼠周围神经结构和功能的影响
本团队前期研究及其他研究均证实,糖尿病状态8周后,HE染色和电镜结果均发现坐骨神经出现结构和功能的异常,引起神经传导速度(MNCV)的下降[8,12],MNCV是检测糖尿病周围神经病变的“金指标”[13]。本次研究显示糖尿病8周后,HE染色可见神经组织出现大小不一,程度不一的髓鞘肿胀、断裂,髓鞘空泡变性;电镜下观察见髓鞘形态明显严重扭曲变形,板层结构松散,排列疏松紊乱,板层出现分离和皱缩,呈典型的脱髓鞘病变;神经结构的改变导致MNCV出现明显下降。
临床研究证实有氧运动可以减轻糖尿病周围神经病变患者的疼痛,改善神经症状,提高生活质量[14]。动物实验证明,有氧运动能有效改善糖尿病周围神经病变大鼠的神经结构、提高神经传导速度,提高热痛阈和机械痛阈[8,15]。近年来,人们开始关注抗阻运动在干预DPN中的作用。Kluding等[16]研究发现,10周的有氧和抗阻联合运动治疗可缓解DPN患者疼痛程度,改善神经系统症状。霍朋[17]等研究发现,有氧运动可改善T2D患者空腹时的自主神经功能,有氧和抗阻运动均可改善葡萄糖负荷时的自主调制反应,且抗阻训练的效果优于有氧运动。本次研究发现,有氧和抗阻运动均能有效改善DPN大鼠的神经结构,提高神经传导速度,其中有氧运动改善的效果优于抗阻运动。
3.3 不同运动对糖尿病大鼠周围神经病变的干预机制
良好的髓鞘结构有利于维持周围神经的传导速度,DPN大鼠出现髓鞘结构的异常及神经传导速度的下降。髓鞘蛋白MPZ、MBP和MAG等对于维持髓鞘结构和功能具有重要作用,是临床检测髓鞘状况的主要指标[18]。MPZ占髓鞘总蛋白量的50%~70%,主要起着黏附作用,是髓鞘形成的“黏附蛋白”[19]。MBP占髓鞘蛋白总量的30%,启动髓鞘形成并压实髓鞘,是“执行蛋白”[20]。MAG占髓鞘蛋白总量的1%,可早期启动髓鞘的形成,是髓鞘形成的“启动蛋白”[21]。糖尿病周围神经病变将导致上述蛋白的降低,通过药物干预可提高髓鞘蛋白的表达,对修复髓鞘结构和提高神经功能具有积极作用[22,23]。近些年来的研究发现,运动能够提高脑瘫模型鼠纹状体和2型糖尿病小鼠腰骶部脊髓中MBP蛋白的表达,对促进髓鞘形成具有积极作用[24,25]。
本次研究显示,在DPN大鼠的坐骨神经中MPZ的平均光密度和蛋白表达略有下降,但无统计学意义。文献报道发现MPZ是髓鞘构成的主要蛋白,糖尿病状态持续16~20周后大鼠坐骨神经中的MPZ才出现明显的表达降低[26,27]。本次实验中8周糖尿病状态对其影响较小,因此不足以导致该蛋白的明显减少,仅表现一定的下降趋势。本实验中,糖尿病大鼠坐骨神经的MBP和MAG的蛋白表达显著下降,导致髓鞘板层结构松散,髓鞘修复和密闭功能降低,出现神经传导速度的下降。而8周有氧和抗阻运动干预后,糖尿病大鼠坐骨神经中MBP和MAG的蛋白表达均显著升高,髓鞘结构得到一定程度修复,神经传导速度提高。提示有氧和抗阻运动改善DPN的可能机制与运动提升MBP和MAG蛋白的表达有关。
4 总结
综上所述,8周糖尿病状态后,糖尿病各组大鼠出现糖代谢异常,坐骨神经结构改变,神经传导速度下降。8周的有氧运动和抗阻运动均能有效调控血糖,改善糖尿病周围神经结构和功能,其中抗阻运动调控血糖的效果优于有氧运动,有氧运动改善神经功能的效果优于抗阻运动,提示两种运动联合干预DPN效果更佳;两种运动改善神经结构和功能的机制可能是两种运动均能促进MBP和MAG蛋白在髓鞘中的表达有关。

