冠状动脉光学相干断层成像观察的重度钙化病变形态特点对支架膨胀不良的影响
汤 白静 薛令合 杨学东 王蔚然 聂绍平 王禹
冠状动脉重度钙化病变介入治疗中,支架膨胀不良和贴壁不良发生率显著增高,是增加支架内血栓形成、支架内再狭窄及不良心血管事件的重要因素[1]。在重度钙化病变中,为了获得良好支架膨胀,充分的预处理十分重要[2-3]。2011年美国心脏协会(AHA)/美国心脏病学会(ACC)经皮冠状动脉介入治疗(PCI)指南推荐冠状动脉旋磨术用于重度钙化病变的预处理( a,C)[4]。为了达到更充分的预处理程度,一些研究在旋磨的基础上,使用切割球囊可以获得更大的管腔面积和良好的支架膨胀效果,通过有效产生钙化环断裂,辅助支架良好膨胀[5-6]。虽然,钙化环断裂可能是影响支架良好膨胀的重要因素,但是,重度钙化病变预处理后,何种形态学特点会影响钙化环断裂,进而影响支架置入效果,尚无充足研究证据。
冠状动脉内光学相干断层成像(OCT)技术对冠状动脉血管内膜有极高的分辨率(10~20 μm)[7]。对钙化病变也有很高的敏感度(95%~96%)和特异度(97%)[8]。可以识别钙化弧度、长度、厚度、钙化小结以及在钙化表面的组织厚度,对钙化环的断裂也能清晰地显示,并可以评价支架置入后膨胀效果,贴壁效果[9-10]。
本研究以经过旋磨术联合切割球囊成形术充分预处理后的重度钙化患者为研究对象,利用OCT作为评价手段,旨在探讨重度钙化病变预处理后,钙化长度、弧度、厚度、钙化表面组织厚度,钙化环断裂以及钙化小结等相关形态学因素对于支架膨胀不良,贴壁不良的影响。
1 对象与方法
1.1 研究对象
本研究为观察性研究,连续选取2016年12月至2017年12月在中国人民解放军总医院心脏介入中心,行冠状动脉旋磨术联合切割球囊成形术治疗的9例冠状动脉重度钙化病变患者,并于预处理后以及支架置入后行OCT检查。入选标准:(1)冠状动脉造影下缺血相关病变血管狭窄>70%;(2)缺血相关病变为重度钙化病变;(3)行冠状动脉旋磨术及切割球囊成形术;(4)置入第二代药物洗脱支架;(5)预处理后及支架置入后行OCT检查,并获得良好可分析的图像。排除标准:(1)30 d内的急性心肌梗死者;(2)支架内再狭窄病变者。行冠状动脉旋磨术及切割球囊成形术,并置入第二代药物洗脱支架,并行OCT检查患者共11例,其中2例预处理后OCT图像不清晰,无法分析而被剔除。共入选9例患者, 9支重度钙化的靶病变。OCT测量后,按2 mm为1节段,共148个病变节段,其中105个钙化节段。
1.2 手术操作
冠状动脉旋磨系统使用波士顿公司的RC 5000 Rotablator旋磨介入治疗系统。初始旋磨头尺寸选择标准为旋磨头尺寸/血管直径比值为0.5~0.6,旋磨转速为140 000~180 000转/min。每一组旋磨的时间均<20 s。旋磨术后,使用切割球囊(美国波士顿公司,Flextome Cutting Balloon)对病变进一步扩张处理。切割球囊直径/血管支架比值为0.7~1.0,按照切割球囊使用推荐。在病变预处理后,均置入第二代药物洗脱支架。支架长度覆盖靶病变远端及近端4 mm。支架置入后,由术者根据经验决定是否后扩张。PCI术后,从两个垂直体位进行造影。手术成功定义为支架顺利置入,残余狭窄<20%,心肌梗死溶栓治疗临床试验前向(TIMI)血流 级。主要不良心血管事件(MACE)包括死亡(全因死亡)、心肌梗死及靶病变再血管化。
1.3 OCT检查
使用FD-OCT系统 (C7-XR Imaging System, 圣犹达公司, 美国)探测深度6~10 mm;分 辨 率 19~39 μm;组 织 扫 描 深 度 1.0~2.0 mm 。Dragon y成像导管2.7 F,最大晶体处直径3.5 F,工作长度135 cm,最大导引钢丝0.014 in(1 in=2.54 cm)。自动回撤装置:回撤速度20~25 mm/s,每秒帧数 100帧/s。分别在常规造影后,预处理后以及支架置入后,对靶病变行OCT检查。将OCT超声探头送至病变远端,自动回撤,连续记录图像。其中8例病变,由于钙化环坚硬并伴有极度狭窄,行预处理前,OCT不能顺利通过病变。但所有病变,均于旋磨联合切割预处理以及支架置入后,完成OCT检查,并获得良好图像。
1.4 OCT影像分析
所有图像刻录在DVD光盘进行分析。根据《光学相干断层成像技术在冠心病介入诊疗领域的应用中国专家建议》[11],钙化定义为边缘清晰的低信号区域。钙化相关参数测量包括:钙化弧度,钙化长度,钙化厚度,钙化小结,钙化斑块表面组织厚度,钙化环断裂。钙化弧度:以管腔中心为圆心,到两侧钙化边缘的弧度。钙化长度:钙化组织斑块在中轴上的长度。钙化厚度:横截面图像中钙化组织的厚度。钙化表面组织厚度:钙化表面至管腔表面之间组织的厚度(图1)。钙化小结:突出于管腔的钙化组织结节。钙化环断裂:可以观察到钙化环出现断口。支架膨胀:支架膨胀率=最小支架面积/平均参考管腔面积×100%,支架膨胀不良为支架膨胀率<90%。支架贴壁不良:以支架小梁表面至管腔表面的纵向距离>260 μm作为显著贴壁不良。组织脱垂:支架置入后组织突出于支架小梁之间的管腔中,脱垂组织面积>10%管腔面积时,定义为显著组织脱垂。
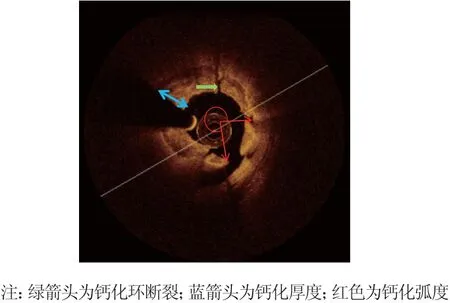
图1 光学相干断层成像钙化相关参数测量
1.5 统计学分析
所有数据采用SPSS19.0软件进行统计学分析。计量资料表示为平均数±标准差。如为正态分布且方差齐,组间比较采用双侧独立t检验;如非正态或方差不齐,组间比较采用矫正t 检验或非参数秩和检验。计数资料以构成比表示,组间比较采用χ2检验。采用单因素Logistic回归分析,对支架膨胀不良、贴壁不良等形态学参数进行相关性分析。将差异有统计学意义的因素,纳入多因素Logistic回归再次分析。采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 患者临床基线资料
9例冠状动脉重度钙化病变患者,其中7例为不稳定型心绞痛,6例合并多支血管病变,4例同时多支血管行PCI(表1)。
2.2 冠状动脉造影资料分析
9例冠状动脉重度钙化病变患者病变管腔平均狭窄率(95±1.3)%。其中分叉病变3例包括球囊保护边支2例、CRUSH双支架处理1例。最大旋磨头使用情况:3例为1.25 mm旋磨头,5例为1.5 mm旋磨头,1例为1.75 mm旋磨头。所有患者旋磨后,均使用了切割球囊处理,5例同时使用了普通球囊预扩张处理。所有患者均置入支架。手术成功率9/9,9个月随访无MACE发生(表2)。

表1 冠状动脉重度钙化病变9例患者临床基本资料
2.3 OCT图像分析结果
9例患者共采集了148个2 mm的病变节段,其中105个病变节段伴随钙化,这105个病变的平均最小管腔面积为(2.40±0.76)mm²,钙化弧度(164.3±86.4)°,钙化长度为(1.72±0.39)mm,钙化厚度为(0.47±0.18)mm,钙化表层组织厚度为(0.15±0.14)mm。旋磨联合切割预处理后,42个(40.0%)节段出现钙化环断裂,44个(41.9%)节段出现夹层,其中6个节段为重度C级夹层(5.7%)。支架置入后,29个(27.6%)节段支架膨胀不良,29个(27.6%)节段支架贴壁不良,24个(22.9%)节段组织脱垂(表3)。

表2 冠状动脉重度钙化病变9例患者冠状动脉造影资料分析
2.4 支架膨胀不良和贴壁不良的相关因素分析
最小管腔面积、钙化弧度、钙化长度、钙化厚度、钙化表面组织厚度、钙化小结、钙化断裂、支架膨胀不良和贴壁不良的单因素线性相关分析见表4~5。多因素Logistic回归分析显示,最小管腔面积是支架膨胀不良的主要危险因素(OR 1.870,95%CI 1.021~3.425),而钙化环断裂是支架膨胀不良的保护因素(OR 0.160,95%CI 0.050~0.516)。钙化弧度是影响支架贴壁不良的主要预测因素 (OR 1.006,95%CI 1.001~1.011)。
2.5 影响钙化环断裂因素
可能影响钙化环断裂的因素,包括最小管腔面积、钙化弧度、钙化长度、钙化厚度、钙化表面组织厚度及钙化小结,其与钙化环断裂相关分析见表6。多因素Logistic多元回归分析显示,钙化表面组织厚度(OR 0.000, 95%CI 0.000~0.001)以及钙化弧度(OR 1.008, 95%CI 1.002~1.015)是钙化环断裂的主要影响因素。

表3 冠状动脉重度钙化病变9例患者OCT图像分析
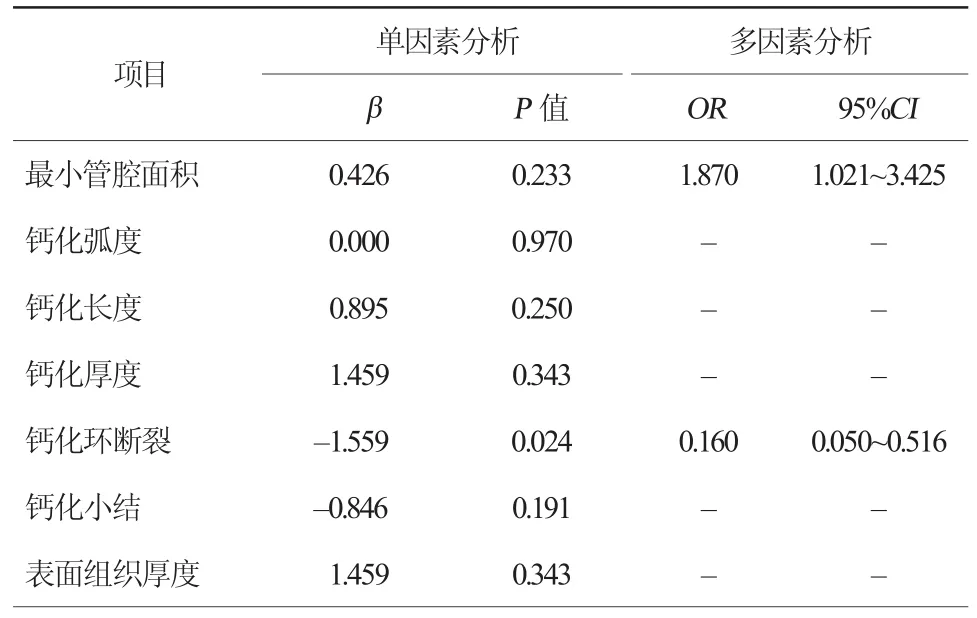
表4 支架膨胀不良相关因素分析
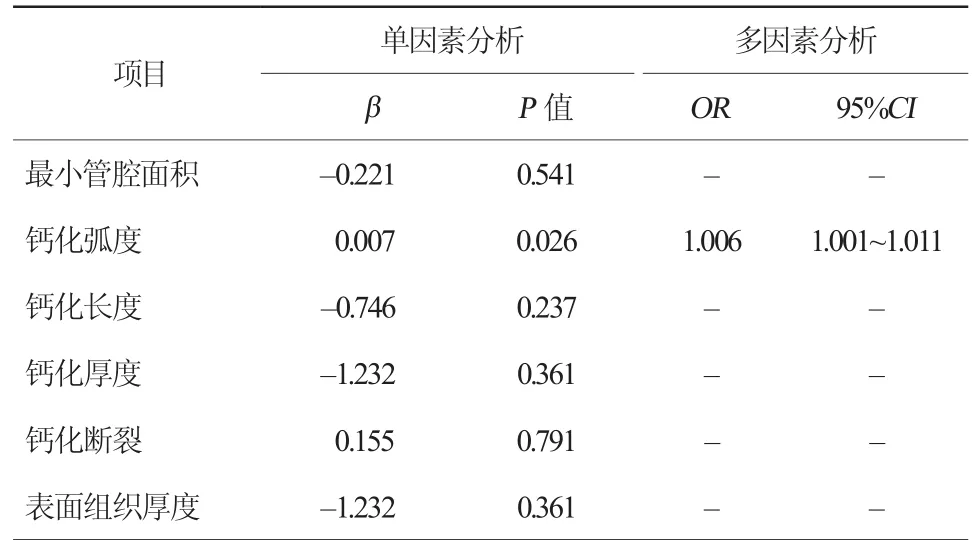
表5 影响支架贴壁不良的因素分析
2.6 浅层钙化与深层钙化分析
在105个钙化节段中,按钙化表面组织厚度分组,厚度≤0.1 mm钙化节段组47个和厚度>0.1 mm钙化节段组58个。两组最小管腔面积、钙化弧度、钙化长度及钙化厚度比较,差异均无统计学意义。而厚度≤0.1 mm钙化节段组中,钙化断裂的比例(76.6%)明显高于厚度>0.1 mm钙化节段组(10.3%),差异有统计学意义(P<0.001)。厚度≤0.1 mm钙化节段组支架膨胀不良的节段比例(19.1%)比厚度>0.1 mm钙化节段组(34.5%)有降低的趋势,但差异无统计学意义(P=0.081)。两组支架贴壁不良和支架置入后组织脱垂比例比较,差异均无统计学意义(表7)。
3 讨论
OCT指导的PCI术研究显示,支架膨胀不良是导致MACE的相关因素[12-14]。在重度钙化病变中,坚硬的钙化环极大限制了支架膨胀,造成近、远期MACE的增加。旋磨术联合切割球囊成形术,充分预处理重度钙化病变,在一定程度上减轻了钙化对支架膨胀的限制[6]。但是,本研究显示,即使经过这种充分的斑块预处理方式, OCT观察下,依然有27.6%的支架节段未能良好膨胀。预处理后,过小的管腔残余面积是支架膨胀不良的预测因素,而预处理后钙化环出现断裂是支架良好膨胀的相关因素。既往血管内超声(IVUS)研究资料也显示,在重度钙化病变中,预处理后的管腔残余狭窄率<40%是支架膨胀不良的主要影响因素[6]。在重度钙化病变中,尽可能增加预处理后的管腔面积,做充分的预处理准备,是获得良好支架膨胀的基础。
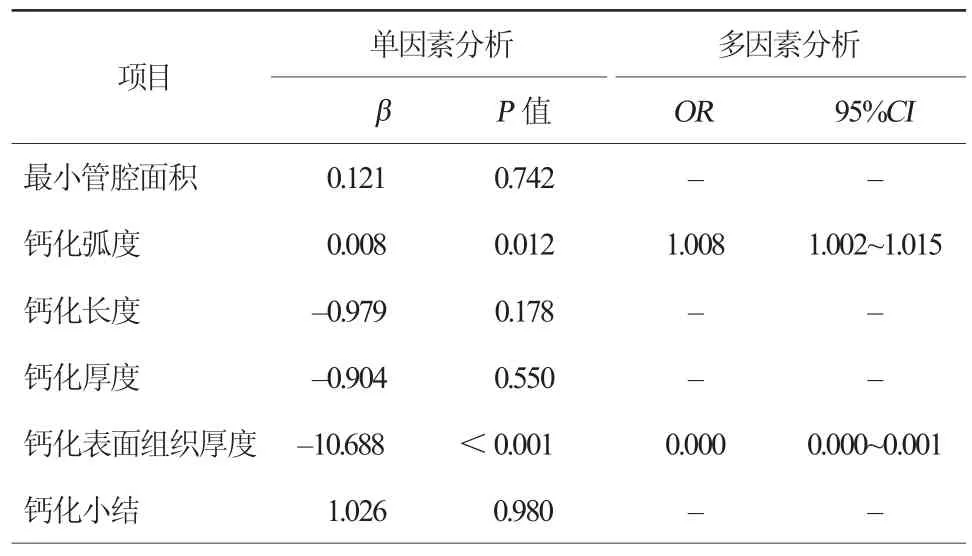
表6 影响钙化环断裂的因素分析
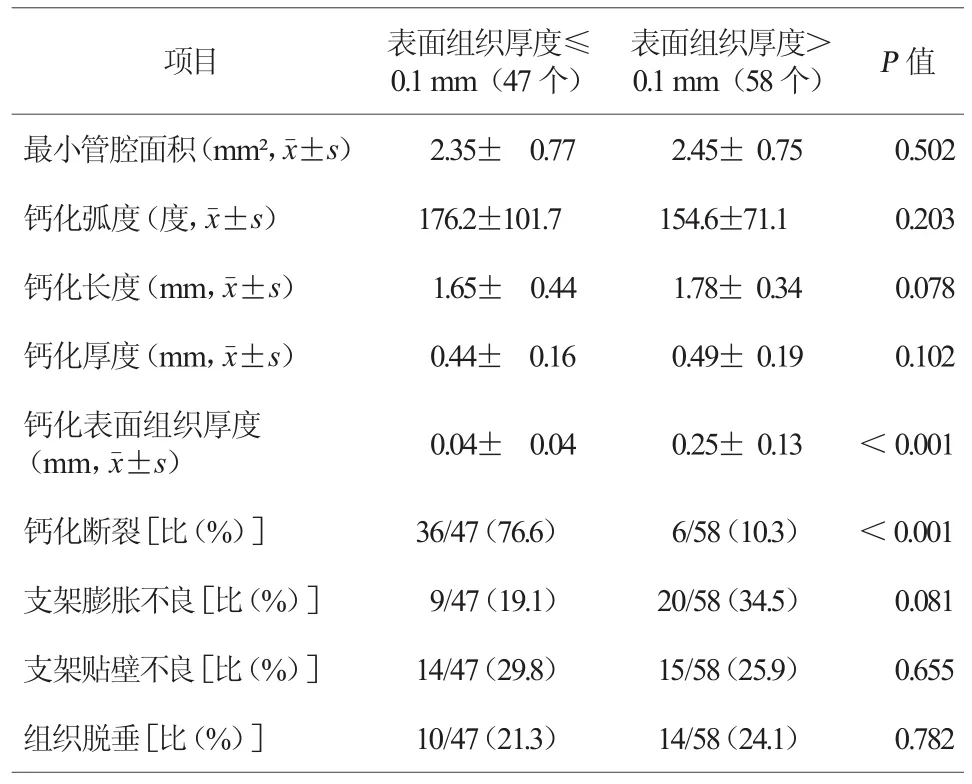
表7 表面组织不同厚度分析
与既往研究相似,本研究显示,预处理后,OCT下观察到的钙化环断裂有利于支架良好膨胀[15-17]。然而,何种形态特点的钙化环可能会发生断裂,尚无充分的研究证据。本研究尽可能全面地记录了钙化环的参数特征,显示钙化弧度和钙化表面组织厚度是影响钙化环是否发生断裂的主要因素,而钙化组织本身的厚度对钙化环是否发生断裂并未显示明显相关性。在钙化弧度较大的病变节段,旋磨后利用切割球囊时,球囊向各个方向的扩张压力会均匀的挤压各个方向上的钙化组织,进而有利于钙化环的断裂。相反,当钙化弧度较小时,球囊扩张的压力,可能因为血管壁的弹性而被分解掉,不利于钙化环的断裂。同一缺血相关病变,远近不同血管段,在远端钙化弧度小的血管段未见钙化环断裂,而近端接近360°钙化环的血管段,可以见到明显的多处钙化环断裂(图2)。这提示,在钙化弧度大的病变中,使用旋磨术联合切割球囊术会产生较好的效果。
既往的IVUS研究,根据钙化在内膜及粥样斑块组织中内1/2,或外1/2分为浅表钙化和深层钙化,并指出旋磨适用于浅表钙化,而对深层钙化可能效果不明显[18]。OCT可以分辨钙化表面组织厚度,对钙化的部位有更精细的区分,本研究详细地收集了钙化表面组织厚度这一参数,并分析了这一参数对预处理后钙化环断裂所造成的影响。当组织厚度为0.1 mm时对钙化环断裂预测的敏感度最高,因此以0.1 mm分组。表面组织厚度>0.1 mm时,即使是IVUS分类中的浅层钙化出现钙化环断裂的比例也明显减少,并伴随支架膨胀不良发生率增高的趋势。当以钙化表层组织厚度分组后,钙化表面组织厚度≤0.1 mm组中76.6%的节段出现了钙化环的断裂,而表面组织厚度>0.1 mm组中,只有10.3%的节段出现钙化环的断裂(图3)。利用OCT所观察的钙化组织特点可能更有利于区别病变对旋磨以及切割等处理后的效果,可以用作病变是否利于旋磨或切割处理的参考指标。
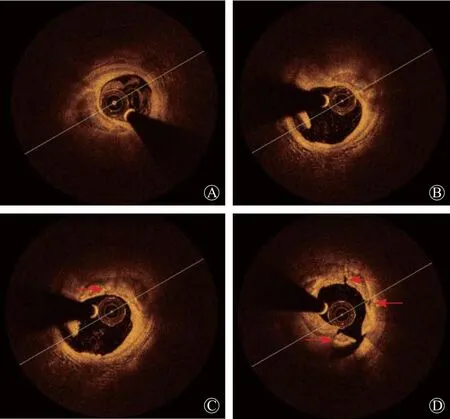
图2 不同钙化弧度与钙化环断裂 A、B.病变远端钙化弧度较小,钙化环未见断裂;C、D.同一缺血相关病变,近端病变节段钙化弧度大,钙化环明显断裂(红箭头所示)
本研究中,有3例病变,分别于旋磨后以及切割球囊扩张后,分别做了OCT检查。其中,在旋磨后仅有21.4%的病变阶段出现钙化环断裂(出现钙化断裂的节段9个/42个钙化节段),而在切割球囊使用后,钙化环断裂的比例显著增加(图4)。旋磨术的作用强调为斑块消蚀(plaque debulking), 而相关旋磨术共识[19-20]指出,在药物支架的时代,旋磨的作用更强调为斑块修饰(plaque modi cation)。斑块修饰是指对浅表钙化组织进行打磨,特别是突出于管腔表面的钙化组织或钙化小结,起到增加管腔面积,并使管腔表面变得光滑的作用,有利于后续器械的输送。但是本研究中显示,旋磨术虽然能使管腔变得光滑,但是对管腔面积的增加和钙化环断裂的作用有限。旋磨后联合切割球囊的使用,增加了管腔面积,并产生了钙化环的断裂。这可能是旋磨联合切割球囊处理重度钙化病变,可以辅助支架良好膨胀的机制。
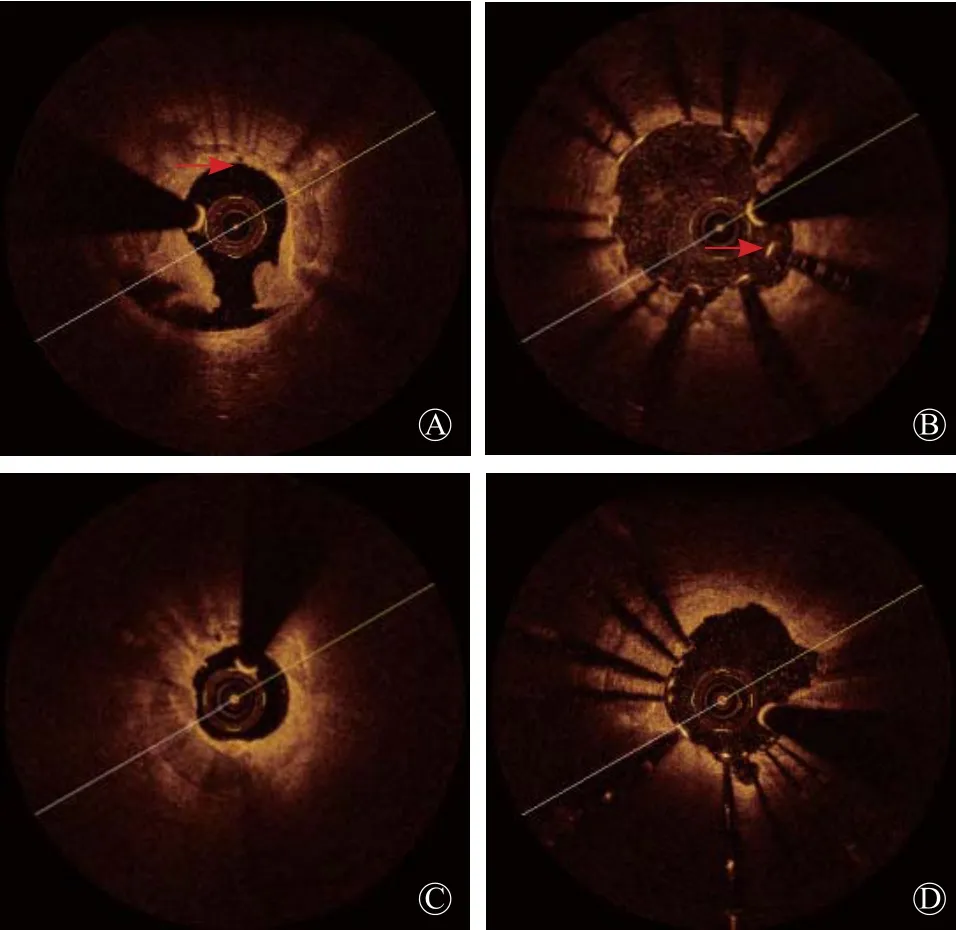
图3 同一横截面水平,光学相干断层成像下支架预处理后,以及支架置入后效果 A.预处理后钙化弧度为259°,钙化表面组织厚度0.8 mm,钙化环断裂(红箭头所示); B.支架置入后,支架膨胀良好,但是贴壁不良,支架梁与内膜距离302 μm(红箭头所示); C.预处理后钙化弧度为102°,钙化表面组织厚度1.2 mm,钙化环无断裂; D.支架置入后,支架膨胀率87%,膨胀不良,贴壁良好,支架梁与内膜距离190 μm
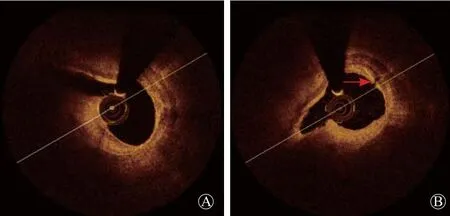
图4 OCT下旋磨以及切割后管腔钙化环变化 A.旋磨后,钙化环未出现断裂;B.同一节段,切割球囊处理后,钙化环出现断裂(红箭头所示)
本研究通过OCT对旋磨联合切割后钙化组织的分析,提示在钙化弧度较大和钙化表面组织厚度较薄的病变中,旋磨联合切割球囊可能会带来更高比例的钙化环断裂,从而降低支架膨胀不良的发生率。但是对于钙化表面组织较厚的病变,旋磨联合切割的获益有待明确。
本研究存在以下几点不足:(1)样本量较小,仅入组9例患者,分析了148个病变节段,不具备普遍性,仅为初步的探索性研究。(2)病变均为重度钙化伴重度狭窄,因此大部分病变未能在处理前行基线的OCT检查。仅能分析预处理后的病变特点。(3)未对患者进行影像随访,远期预后尚待明确。
总之,本研究通过对9例患者,105个经过旋磨联合切割球囊处理的重度钙化病变节段的OCT影像资料分析,表明预处理后,钙化环发生断裂和最小残余管腔面积是影响支架膨胀的主要相关因素,钙化表面组织厚度、钙化弧度是影响钙化环断裂的主要因素,进而影响支架膨胀效果。

