有机锰试剂参与的偶联反应研究型综合实验设计
彭志华, 王一蕾, 吕志凤, 姜翠玉
(中国石油大学(华东) 理学院 化学系, 山东 青岛 266580)
有机化学综合实验是在基础有机化学实验的基础上,集合有机化学基本理论的应用、基本实验技能的综合训练及现代仪器分析技术的综合应用于一体的一门课程[1]。目前,很多高校的化学类专业都开设了综合化学实验课程[2-3]。我校化学专业开设的有机化学综合实验项目主要来源于教师的科研项目,内容涵盖“合成/制备-表征/分析-性能/应用”等。
有机金属试剂及其参与的交叉偶联反应在有机合成中占据着核心地位[4-6]。在有机金属试剂中,有机锰试剂不仅具有主族有机金属试剂的性质,同时还兼有过渡金属的一些化学性质,具有较好的反应活性和选择性[7-9]。因而,有机锰试剂参与的偶联反应可以采用价格低廉的金属催化剂如铁、钴等,在药物、光电材料、农药的合成领域有着广泛的应用[10-11]。有机金属试剂的制备方法和过渡金属催化的交叉偶联反应是有机化学和有机合成理论课中重要的内容。因此,设计了有机锰试剂参与的偶联反应研究型综合实验。
1 实验原理
利用本实验室发展的有机锰试剂的制备方法[12],在MnCl2·2LiCl存在下,卤代烃(主要为溴代物和碘代物)可以和金属镁反应,生成相应的有机锰试剂。其反应过程为卤代烃首先和金属镁发生氧化插入,生成中间体——有机镁试剂;由于MnCl2·2LiCl的存在,有机镁试剂立即经金属交换生成相应的有机锰试剂,其产率可用气相色谱测定。有机锰试剂和2,4-甲氧基-6-氯-1,3,5-三嗪在金属催化和添加剂作用下,发生交叉偶联反应,生成功能性的1,3,5-三嗪化合物,如图1所示。
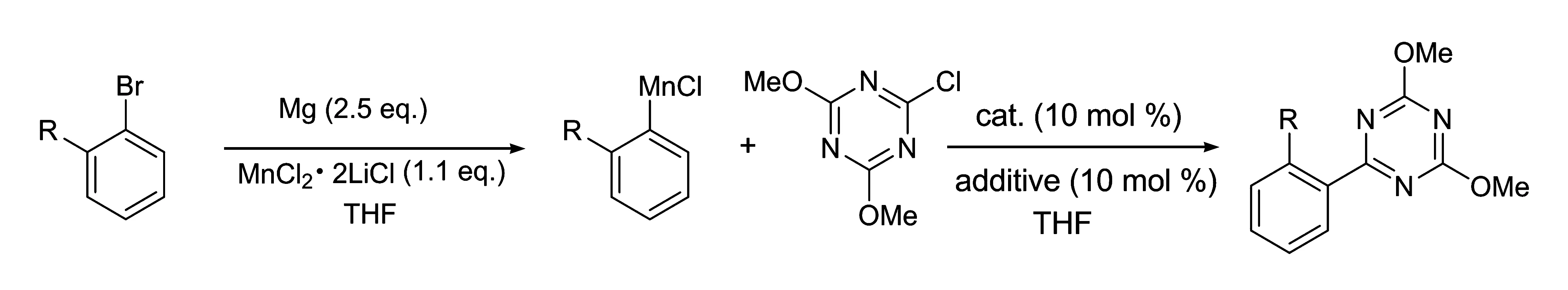
图1 有机锰试剂的制备和参与的偶联反应
在发放综合实验题目时,提供学生有机锰试剂制备方法的文献,让学生进行文献调研,了解交叉偶联反应所需要的催化剂和添加物,并设计可行的实验方案。
2 试剂与仪器
试剂:无水氯化锰;镁;无水三氯化铁;喹啉;异喹啉;二溴化钴;2-氯-4,6-二甲氧基-1,3,5-三嗪;四氢呋喃;氯化锂。
仪器:旋转蒸发仪;电子天平;循环水式真空泵;紫外分析仪;磁力搅拌器;Schlenk反应管;干燥箱;真空泵;A V 400(Bruker 公司)核磁共振波谱仪。
3 实验方法
3.1 有机锰试剂的制备
有机锰试剂的制备按照本实验室研究报道的方法进行。如图2所示,在MnCl2•2LiCl存在下,卤代芳烃和金属镁在四氢呋喃中反应,首先生成有机镁试剂;有机镁试剂随即经金属交换生成相对应的2-甲基苯基氯化锰2a、苯基氯化锰2b和2-甲氧基苯基氯化锰2c。有机锰试剂的浓度用I2/THF溶液进行标定。
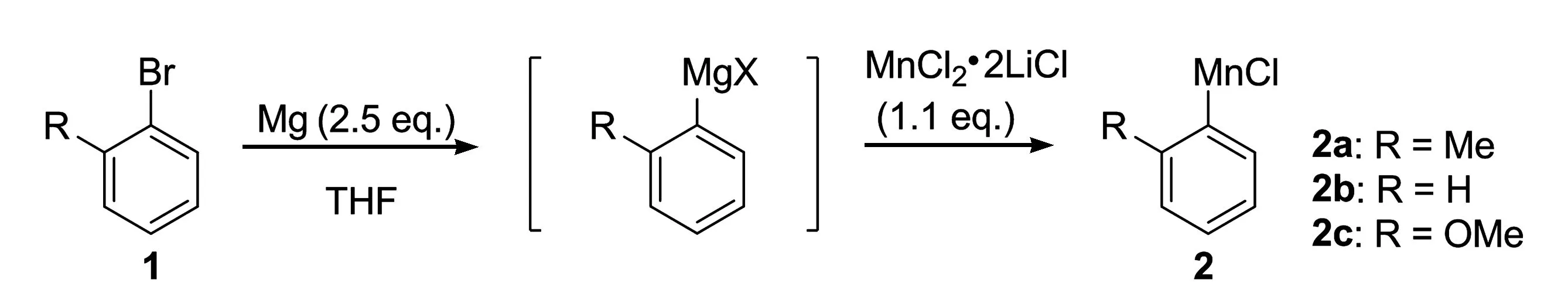
图2 有机锰试剂的制备
3.1.1 MnCl2·2LiCl /THF溶液的制备
在100 mL Schlenk反应瓶中加入搅拌子,橡胶塞封口,用热风枪在真空(100 Pa)下加热(约380 ℃)干燥反应瓶5 min,然后冷却到室温,氮气保护下,依次加入MnCl2(6.30 g, 50 mmol)和LiCl(4.24 g, 100 mmol),在真空(100 Pa)下,于140 ℃油浴中加热搅拌5 h。冷却到室温后, 抽换气3次,氮气保护下,慢慢加入干燥的THF(50 mL),搅拌至澄清溶液,得到1 mol/L的MnCl2·2LiCl /THF溶液。
3.1.2 有机锰试剂的制备
取一支Schlenk管,用热风枪在真空(100 Pa)下加热(约380 ℃)干燥反应管5 min,冷却到室温后;氮气保护下,加入镁屑(360 mg, 15 mmol),然后,再用热风枪在真空100 Pa(1 mbar)下加热(约380 ℃)干燥金属镁5 min;冷却到室温,抽换气3次,N2氛围下,加入12 mL的THF,再用注射器加入上述1 mol/L的MnCl2·2LiCl/THF溶液6.6 mL;在冷水浴中,氮气保护下滴加卤代烃(6 mmol);在冷水浴下搅拌反应 3 h,分别得到2-甲基苯基锰试剂、苯基锰试剂和2-甲氧基苯基锰试剂。有机锰试剂的浓度可用I2/THF标定。2-甲基苯基锰试剂的浓度为0.15 mol/L;苯基锰试剂的浓度为0.13 mol/L;2-甲氧基苯基锰试剂的浓度为0.18 mol/L。
3.2 1,3,5-三嗪衍生物的制备
3.2.1 2,4-二甲氧基-6-(2’-甲基苯基)-1,3,5-三嗪的制备
取一支Schlenk管,用热风枪在真空100 Pa(1 mbar)下加热(约380 ℃)干燥反应管5 min,冷却到室温后;氮气保护下,加入2-氯-4,6-二甲氧基-1,3,5-三嗪(87.8 mg, 0.5 mmol);加入CoBr2(11 mg, 10 mol%)和喹啉(6.5 mg, 10 mol%),在室温下下搅拌反应 2 h;然后,用注射器滴加上述2-甲基苯基锰试剂(4 mL,0.15 mol/L),20 min滴加完毕,室温下反应12 h;反应结束后,20 mL蒸馏水淬灭,乙酸乙酯萃取(20 mL×3),合并有机相,无水硫酸镁干燥,柱层析分离(石油醚和乙酸乙酯体符号比为1∶5),得到相对应产物2,4-二甲氧基-6-(2’-甲基苯基)-1,3,5-三嗪83.6 mg,产率为72%。
1H NMR(400 MHz, CDCl3):δ(ppm)=8.11(d,J=7.3 Hz,1H),7.45~7.21(m,3 H),4.10(s,6 H),2.70(s,3 H)。
13C NMR(100 MHz, CDCl3):δ(ppm)=177.5,172.4,138.9,134.9,131.8,131.1,130.9,125.9,55.2,22.2.
3.2.2 2,4-二甲氧基-6-苯基-1,3,5-三嗪的制备
取一支Schlenk管,用热风枪在真空100 Pa(1 mbar)下加热(约380 ℃)干燥反应管5 min,冷却到室温后;氮气保护下,加入2-氯-4,6-二甲氧基-1,3,5-三嗪(176 mg, 1 mmol);加入CoBr2(22 mg,10 mol%)和喹啉(13 mg,10 mol%),在室温下下搅拌反应 2 h;然后,用注射器滴加苯基锰试剂9 mL,20 min滴加完毕,室温下反应12 h;反应结束后,20 mL蒸馏水淬灭,乙酸乙酯萃取(20 mL× 3),合并有机相,无水硫酸镁干燥,柱层析分离(石油醚和乙酸乙酯体积比为1∶5),得到相对应产物2,4-二甲氧基-6-苯基-1,3,5-三嗪134 mg,产率为61%。
1H NMR(400 MHz, CDCl3):δ(ppm)=8.44~8.38(m,2 H), 7.51~7.44(m, 1 H), 7.42~7.37(m, 2 H), 4.04(s, 6 H).
13C NMR(100 MHz, CDCl3):δ(ppm)=174.9, 172.9, 135.0, 132.8, 128.9, 128.5, 55.2.
3.2.3 2,4-二甲氧基-6-(2’-甲氧基苯基)-1,3,5-三嗪的制备
取一支Schlenk管,用热风枪在真空(100 Pa)下加热(约380 ℃)干燥反应管5 min,冷却到室温后;氮气保护下,加入2-氯-4,6-二甲氧基-1,3,5-三嗪(176 mg,1 mmol)。加入CoBr2(22 mg, 10 mol%)和喹啉(13 mg, 10 mol%),在室温下下搅拌反应 2 h;然后,用注射器滴加上述2-甲氧基苯基锰试剂9 mL,20 min滴加完毕,室温下反应12 h;反应结束后,20 mL蒸馏水淬灭,乙酸乙酯萃取(20 mL× 3),合并有机相,无水硫酸镁干燥,柱层析分离(石油醚∶乙酸乙酯=1∶5~1∶2),得到相对应产物2,4-二甲氧基-6-(2’-甲氧基苯基)-1,3,5-三嗪66 mg,产率为27%。
1H NMR(400 MHz, CDCl3):δ(ppm)=7.95~7.90(m, 1 H), 7.49~7.42(m, 1 H), 7.07~6.99(m, 2 H), 4.08(s, 6 H), 3.89(s, 3 H).
13C NMR(100 MHz, CDCl3):δ(ppm)=175.9, 172.4, 158.7, 132.5, 131.8, 125.5, 120.3, 112.3, 55.9, 54.9.
4 结果与讨论
4.1 三嗪衍生物制备条件的优化
学生虽然已经完成了96学时的有机化学实验,但每个实验都是按照教材上的方案进行,没有接触过如何去筛选和优化反应条件。这部分内容的设计,有利于学生掌握如何优化反应条件、从哪些因素着手优化以及如何根据实验结果调整实验方案等,可为学生以后独立开展研究工作打好基础。
4.1.1 有机锰试剂用量的考察
图3为偶联反应。如表1所示,在不加任何催化剂和添加物的反应条件下,当锰试剂的用量为1.2当量时,以53%的分离产率得到了偶联反应产物2,4-二甲氧基-6-(2’-甲基苯基)-1,3,5-三嗪。把2-甲基苯基氯化锰的用量分别提高到1.5 当量和2当量后,偶联产物的产率分别下降到了32%和36%。

图3 偶联反应

表1 反应温度及有机锰试剂用量和浓度的考察结果
4.1.2 催化剂的影响
在确定了2-氯-4,6-二甲氧基-1,3,5-三嗪和2-甲基苯基氯化锰的用量之后,尝试加入催化剂,结果见表2。在没有催化剂情况下,以53%的产率得到2,4-二甲氧基-6-(2’-甲基苯基)-1,3,5-三嗪;在加入10%的CoBr2作为催化剂后,其偶联反应产率可以提高到61%;说明CoBr2可以有效地促进偶联反应的发生。

表2 催化剂和溶剂的影响
4.1.3 配体的考察
在金属催化的偶联反应中,配体的加入通常能使偶联反应有效地进行,结果见表3。结果发现,在反应中,加入10%的喹啉配体,可使偶联反应产率提高到72%;10%的异喹啉配体抑制了偶联反应;2-苯基吡啶亦可使偶联反应产率提高到71%。因此,选用喹啉配体作为添加剂。

表3 配体的影响
4.1.4 催化剂的考察
考察了其他廉价催化剂例如MnCl2·2LiCl(10%)和FeCl3(10%)的催化能力,结果见表4,配合喹啉配体一起使用,最高产率为65%,其催化效果不如CoBr2。

表4 催化剂的考察
综合以上因素的考察,得到的有机锰试剂与2-氯-4,6-二甲氧基-1,3,5-三嗪偶联反应的优化反应条件为:在CoBr2(10%)和喹啉(10%)催化下,2-氯-4,6-二甲氧基-1,3,5-三嗪(1 equiv)和芳基锰试剂(1.2 equiv)在室温下反应12 h,可以获得较好产率的偶联反应产物。
4.2 底物拓展及结构鉴定
4.2.1 底物的拓展
在得到较优的反应条件之后,为了让学生了解有机合成方法的一般步骤,又设计了其他2个2,4-二甲氧基-6-芳基-1,3,5-三嗪的合成实验,让学生了解在完成反应条件优化后,需对该反应的适用范围展开研究。本部分还涉及让学生熟练掌握利用TLC追踪反应和柱层析分离纯化有机化合物的方法。
如图4所示,在催化剂CoBr2(10%)和配体喹啉(10%)作用下,2-甲基苯基氯化锰和2-氯-4,6-二甲氧基-1,3,5-三嗪在THF溶剂中,室温下搅拌12 h,经分离纯化,以72%产率得到2,4-二甲氧基-6-(2’-甲基苯基)-1,3,5-三嗪4a。相似条件下,Co(Ⅱ)催化的苯基氯化锰和2-氯-4,6-二甲氧基-1,3,5-三嗪的偶联反应也能较好的进行,生成2,4-二甲氧基-6-苯基-1,3,5-三嗪4b,产率为61%。对于含有供电子基团甲氧基的有机锰试剂,其与2-氯-4,6-二甲氧基-1,3,5-三嗪的偶联反应产率有所下降,偶联产物2,4-二甲氧基-6-(2’-甲氧基苯基)-1,3,5-三嗪4c的产率为27%。产率较低的可能原因:在CoBr2催化下,2-甲氧基苯基氯化锰容易发生自身偶联反应,从而降低了与2-氯-4,6-二甲氧基-1,3,5-三嗪的偶联反应产率。
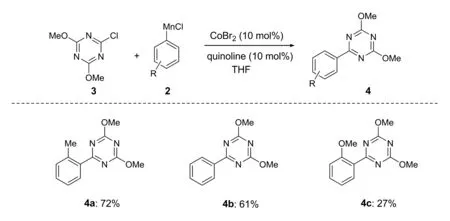
图4 Co(Ⅱ)催化的有机锰试剂与2-氯-4,6-二甲氧基-1,3,5-三嗪的偶联反应
4.2.2 产物的结构鉴定
在分离得到2,4-二甲氧基-6-芳基-1,3,5-三嗪之后,利用NMR鉴定产物的结构。该部分实验的目的是让学生学习和掌握解析NMR谱图的方法。
以化合物2,4-二甲氧基-6-(2’-甲基苯基)-1,3,5-三嗪(记为4a)为例,图5为化合物4a的1H NMR谱图。化学位移δ(ppm)=8.11(d,J=7.3 Hz, 1 H)和7.45~7.21(m, 3 H)为苯环上的4个氢;化学位移δ(ppm)=4.10(s, 6 H),是单峰,为2个甲氧基中的6个氢;化学位移 δ(ppm) =2.70(s, 3 H),单峰,是苯环上甲基的3个氢。
图6为化合物4a的13C NMR谱图。化学位移δ(ppm)=177.5是三嗪环中与甲氧基相连的碳, 172.4为三嗪环中与芳基相连的碳, 138.9、134.9、131.8、131.1、130.9、125.9是苯环上的6个碳, 55.2为甲氧基的碳, 22.2为甲基的碳。
4.3 实验内容的进一步拓展
该综合实验的实验内容可进一步进行拓展,上升为大学生创新项目。可拓展内容如下:
(1) 1,3,5-三嗪衍生物和有机锰试剂的底物应用范围研究:制备多个含有不同官能团如卤素、酯基等的1,3,5-三嗪衍生物以及有机锰试剂,考察其在Co催化的有机锰试剂的偶联反应的官能团兼容性。
(2) 把所研究的方法学应用到药物中间体或者目标分子的合成当中,考察该方法学的应用前景。
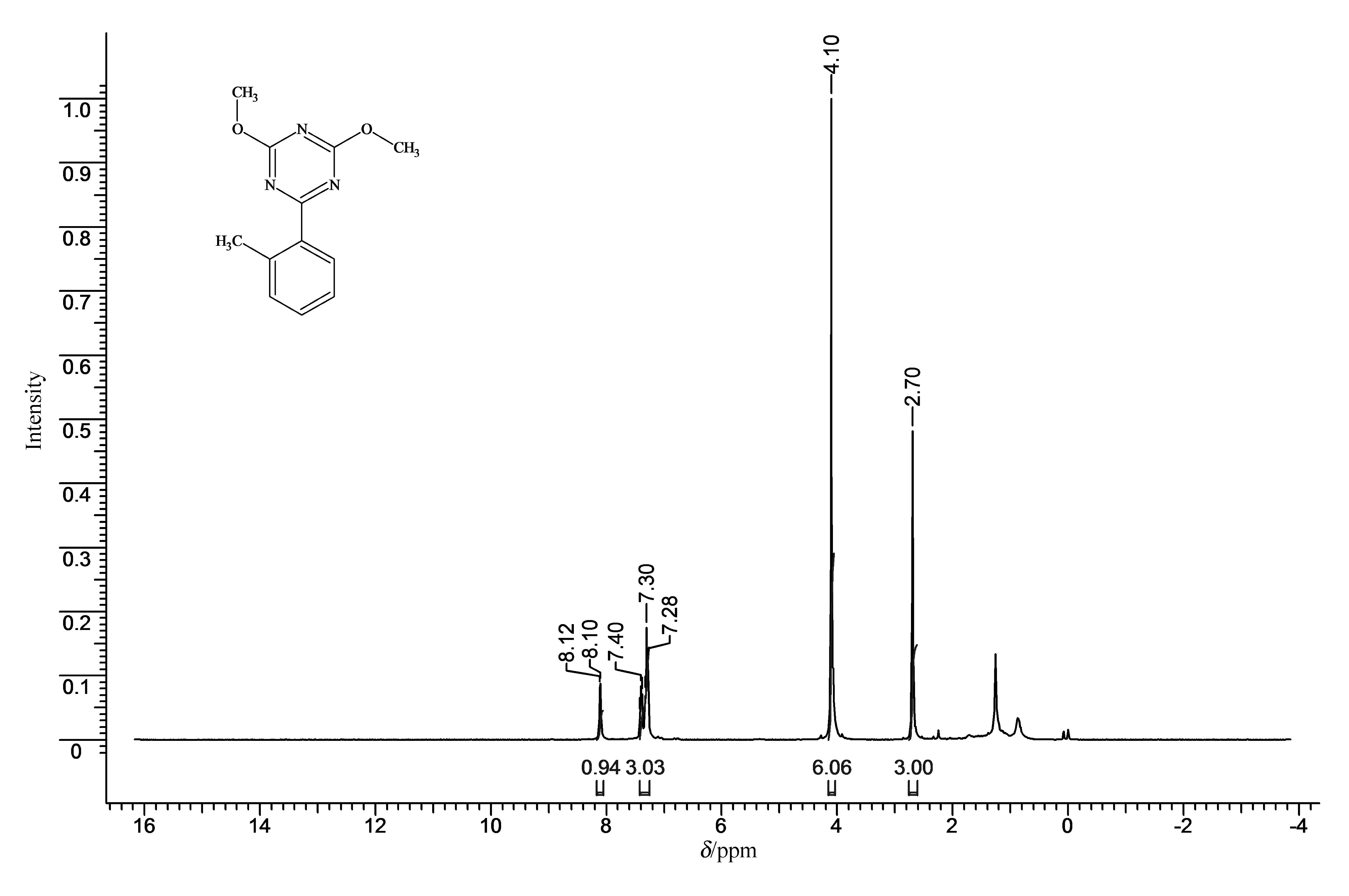
图5 2,4-二甲氧基-6-(2’-甲基苯基)-1,3,5-三嗪的1H NMR谱图
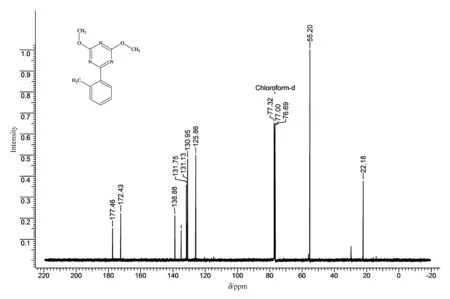
图6 2,4-二甲氧基-6-(2’-甲基苯基)-1,3,5-三嗪的13C NMR谱图
5 结语
研究性综合实验激发了学生的学习主动性和创造性,有利于全面提升大学生的综合素质。本综合实验项目在化学15级学生中实施(1组,3人),选题学生反映此课题让他们充分地掌握了无水无氧基本操作、有机化学反应的条件优化方法、有机化合物的分离提纯以及结构鉴定等知识,加深了有机化学前沿知识的认识。并通过查阅文献、实验的设计及操作、结果分析与讨论等系统训练,提高了分析问题、解决问题的能力,养成了良好的科学素养,为后续科研工作的开展打下坚实的基础。

