耐盐、低温适生芽孢杆菌TS1、TS3的拮抗及降解纤维素活性分析
吴晓晖, 谢永丽, 陈 兰, 柴树芳, 赵继丽
(1.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海西宁 810016;2.青海大学农牧学院高原草地资源与生态省部共建重点实验室,青海西宁 810016)
芽孢杆菌是一类重要的植物生长促生菌,因其能产生抑制病原菌生长的化合物而成为生防菌研究的热点,芽孢杆菌拮抗活性常被作为筛选生防芽孢杆菌的重要指标,生防菌分泌的胞外代谢产物可直接抑制病原物的生长、杀死病原物或形成不利于病原物的环境条件,间接抑制病原物的生长,从而促进植物生长[1-2]。同时,芽孢杆菌可通过抑制病原菌的滋生,提高饲料的卫生品质。因此,芽孢杆菌在生态农业及生态畜牧业发展中具有很好的研究意义和应用潜力。产生抗生素是芽孢杆菌具有拮抗作用的重要原因之一,芽孢杆菌产生的抗生素包括由核糖体合成的小分子细菌素[3]、非核糖体合成的肽类物质及其他一些抗菌活性物质。非核糖体合成的抗生素中,伊枯草菌素(Iturin)[4]、表面活性素(Surfactin)[5]及泛革素(Fengycin)[6]为主要的脂肽类化合物,其中Iturin主要抑制真菌生长,Surfactin能够抑制细菌、病毒和支原体生长,Fengycin可抑制丝状真菌生长并降低作物病害的发生。部分芽孢杆菌还可产生内切葡聚糖酶(endo-1,4-β-D-glucanohydrolase)、外切葡聚糖酶(exoglucanase)、木聚糖酶(xylan)、甘露聚糖酶(β-mannanase)等纤维素活性酶,可有效降解纤维素,将纤维转化为糖类或其他营养产物[7]。
青海省秸秆纤维素资源丰富,利用却十分有限,若应用芽孢杆菌分泌的纤维素酶加速对草料、秸秆木质纤维素的降解,可使养分有效释放,不仅能缓解家畜饲草料短缺,还能通过秸秆还田改善土壤的结构、提高土壤肥力、降低环境污染[8]。本研究在青海省托素湖畔骆驼蓬(PeganumharmalaL.)根围土壤中分离筛选出2株耐盐及低温适生芽孢杆菌菌株,通过16S rDNA及gyrB基因序列分析鉴定菌株,测定菌株拮抗病原细菌、病原真菌活性及菌株降解纤维素活性,利用基质辅助激光解吸附-离子化飞行时间质谱(MALDI-TOF-MS)分析菌株产生脂肽类化合物的种类以期为适用高原生态环境的生物菌肥研发提供耐逆性生防芽孢杆菌菌源,为生态农业和生态畜牧业研究提供优质的研发菌源。
1 材料与方法
1.1 试验材料及供试菌株
试验于2016年在青海大学高原草地资源与生态省部共建重点实验室进行。菌株分离自青海省海西州托素湖边骆驼蓬根围土壤。由青海大学高原草地资源与生态省部共建重点实验室保存。细菌NA固体培养基、LB固体培养基参考Wu等方法[9]配制;真菌PDA培养基参考薛鹏琦等方法[10]配制;低温1C培养基参考刘芳等方法[11]配制;CMC培养基参考张楠等方法[12]配制。扩增引物由南京金斯瑞生物技术有限公司合成;PCR扩增反应试剂购自宝生物工程(大连)有限公司;PCR产物纯化试剂盒购自爱思进生物技术(杭州)有限公司。
1.2 菌株分子鉴定
1.2.1 16S rDNA序列分析鉴定 16S rDNA序列扩增引物为正向引物27F:5′-AGAGTTTGATCMTGGCTCAG-3′,反向引物1492R:5′-GGYTACCTTGTTACGACTT-3′。PCR扩增条件为95 ℃ 4 min;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 2 min,34个循环;72 ℃ 10 min[13]。将16S rDNA扩增产物回收纯化后测序,测序所得序列通过NCBI数据库进行Blast比对,并采用MEGA 3.1软件[14]对分离芽孢杆菌及模式菌进行系统发育分析。
1.2.2gyrB基因序列分析鉴定gyrB基因扩增引物序列为正向引物UP1:5′-GAAGTCATCATGACCGTTCTGCAYGCNG GNGGNAARTTYGA-3′,反向引物UP2r:5′-AGCAGGGTAC GGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′。PCR扩增条件为95 ℃ 4 min;98 ℃ 10 s,62 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃ 8 min[15]。将gyrB基因扩增产物纯化测序,所测序列通过NCBI数据库进行Blast比对,并采用MEGA 3.1软件[14]对分离芽孢杆菌及模式菌进行系统发育分析。
1.3 菌株耐逆性测定
1.3.1 耐盐性测定 将供试菌株分别接种到含NaCl浓度梯度分别为3%、5%、7%、9%、11%、13%、15%的LB培养基中过夜培养12 h,吸取50 μL菌液涂板于相应的固体LB培养基上,置于37 ℃下培养,每个处理3次重复,培养5 d后,每天观察菌落生长情况并记录菌株的耐盐特性[15]。
1.3.2 耐低温测定 用灭菌牙签挑取供试菌株长势优良的单菌落接种到低温1C液体培养基中过夜培养12 h,吸取 10 μL 菌液接种于1C固体培养基平板上,设置18、14、10、4 ℃ 等4个温度梯度进行培养,每个处理3次重复。每天观察菌落生长情况,测定菌株的耐低温特性[15]。
1.4 菌株拮抗活性测定
1.4.1 拮抗病原真菌活性 分别在油菜菌核菌(Sclerotiniasclerotiorum)、小麦赤霉菌(FusaHumgraminearumSehw)、瓜类枯萎病菌(Fusariumoxysporum)的PDA平板边缘打取直径为0.7 cm的菌碟,接种在新的PDA平板中央。在距离菌块 2.5 cm 处,呈“十”字形分布的4个接种点上放置直径为 4 mm 的滤纸小圆片,将供试芽孢杆菌在37 ℃、200 r/min条件下培养14 h后,吸取5 μL菌液接种于滤纸片上,每个处理重复3次,放入26 ℃恒温培养箱中培养2~3 d后取出,观察并记录供试芽孢杆菌抑制病原真菌生长的结果[16]。
1.4.2 拮抗病原细菌活性 将大白菜软腐病菌(Pectobacteriumcarotovorum)菌悬液与冷却到50 ℃左右的NA培养基按体积比1 ∶30混匀,制成含菌平板,在距离平板中心2.5 cm处,呈“十”字形分布的4个接种点上分别放置直径为4 mm的滤纸小圆片。将供试菌株接种于LB液体培养基中,37 ℃、200 r/min过夜振荡培养14 h后,吸取5 μL菌液接种于滤纸片上,每个处理重复3次。置于28 ℃培养箱中培养 2~3 d,观察并记录供试芽孢杆菌抑制病原细菌生长的结果[16]。
1.5 脂肽类化合物的测定及分析
1.5.1 脂肽类化合物粗提 将供试菌株TS1、TS3单菌落接种于LB液体培养基中过夜振荡活化,将菌液以3%的接菌量转接于Landy培养基中,30 ℃发酵38 h,发酵条件参见王帅等方法[17]。发酵培养结束后,将培养物在200 r/min的条件下离心2 min取上清,在上清液中加入6 mol/L HCl调pH值至2.0,轻微搅动,置于 4 ℃ 冰箱中过夜培养。离心收集沉淀,加入甲醇,用1 mol/L NaOH调节pH值至7.0,再次用甲醇抽提并混合抽提液,获得脂肽类化合物粗提物[17]。
1.5.2 脂肽类化合物活性测定 在血(羊血)平板距中央2.5 cm处,呈“十”字形分布的4个接种点上,放上直径为 4 mm 的滤纸小圆片,取待测脂肽类化合物粗提物5 μL点在滤纸片中央,试验以甲醇点在滤纸片中央为对照,每个处理重复3次。将血平板放入26 ℃恒温培养箱中过夜培养,观察透明圈大小并记录透明圈直径[14]。
1.5.3 MALDI-TOF-MS质谱分析 利用基质辅助激光解吸附-离子化飞行时间质谱(MALDI-TOF-MS)分析菌株Landy发酵产生的脂肽类化合物种类,基质为α-氰-4-羟肉桂酸。
1.6 解纤维素活性分析
在CMC-Na筛选培养基平板呈“十”字形分布的4个接种点上,放置直径为4 mm的滤纸小圆片。将供试菌株置于LB液体培养基中,37 ℃、200 r/min过夜培养12 h后,取待测菌液5 μL点在滤纸片中央,每个处理重复3次,将平板倒置于37 ℃恒温培养箱中培养2 d后,将革兰氏碘液注入并淹没平板表面,静置4 min倒去染液,观测并记录试验结果。若菌株将培养基中的纤维素大分子降解为小分子糖类,即可在滤纸片周围观察到圆形的透明圈。测定并记录透明圈直径、菌落直径,并计算两者比值A[15]。
1.7 木聚糖酶活性测定
将芽孢杆菌菌液以2%的接菌量转接至CMC诱导产酶培养基中,37 ℃ 200 r/min培养48 h;将培养液在 4 000 r/min、4 ℃下离心10 min,上清液即为粗酶液[17]。取灭菌的2 mL离心管,加入200 μL 1%木聚糖(均溶于pH值7.0 PBS)作为反应底物(测定各菌株的木聚糖酶活性),将各反应底物在37 ℃金属浴上保温。吸取200 μL上述稀释至合适浓度的粗酶液与底物涡旋混合,37 ℃金属浴 30 min;加入 500 μL 3,5-二硝基水杨酸(DNS)试剂终止反应,并于沸水中煮沸 5 min,冷却后,加入1 mL ddH2O;吸取反应液至分光光度计中测定吸光度D540 nm;按照绘制的木糖标准曲线,计算反应液中对应还原糖的含量,扣除粗酶液和底物中所含的还原糖含量,计算得出各菌株木聚酶活性[18]。1 min 催化生成1 μmol还原糖为1个酶活性单位,记作1 U。每个样品测定3次,取平均值[19]。
2 结果与分析
2.1 菌株分子鉴定
以菌株TS1、TS3基因组DNA为模板扩增16S rDNA片段,扩增到大小约1 500 bp的特征性条带。将测序结果在NCBI中与Gen Bank中的己知序列进行Blast比对,比对结果见表1。菌株TS1与萎缩芽孢杆菌(B.atrophaeus)BKS1-45的16S rDNA序列相同(或一致)性为99%;菌株TS3与解淀粉芽孢杆菌(B.amyloliquefaciens)JS的16S rDNA序列相同(或一致)性为100%。
以菌株TS1、TS3基因组DNA为模板扩增gyrB基因片段,扩增到大小约1 300 bp的PCR特征性条带。将PCR产物纯化后测序,将测序结果在NCBI中用Blast软件与Gen Bank中己知序列进行比较,比对结果表明,菌株TS1与萎缩芽孢杆菌LSSC3的gyrB基因序列相同(或一致)性为99%;菌株TS3与解淀粉芽孢杆菌FZB42的gyrB基因序列相同(或一致)性为100%。
通过16S rDNA及gyrB基因测序分析,最终将菌株TS1鉴定为萎缩芽孢杆菌,菌株TS3鉴定为解淀粉芽孢杆菌。

表1 菌株的16S rDNA及gyrB序列比对结果
2.2 菌株的抗逆性
2.2.1 菌株抗盐性 菌株TS1、TS3耐盐性测定结果见表2,菌株TS1、TS3均可在添加3%、5%、7%、9% NaCl的LB培养基上生长良好,在含NaCl浓度为13%的培养基上,菌株TS1可缓慢生长,菌株TS3无法生长;在含NaCl浓度为15%的培养基上,菌株TS1、TS3均不能生长,2株菌株显示出良好的耐盐性,菌株TS1耐盐性略高于菌株TS3。
2.2.2 菌株低温适生性 分别测定菌株TS1、TS3在18、14、10、4 ℃低温条件下的生长情况。结果(表2)显示,在18、14 ℃ 条件下,菌株TS1、TS3生长良好,在培养1 d后均长出菌苔;在10 ℃条件下,菌株TS1生长良好、菌株TS3缓慢生长,菌株TS1表现出更强的扩展性,培养1 d后即可出现明显的菌苔,菌株TS3培养2 d后长出菌苔;在4 ℃低温条件下,菌株TS1可缓慢生长,在培养3~4 d后出现菌苔,菌株TS3无法生长。2株菌株均表现出良好的低温适生性,菌株TS1表现出更好的低温适生性。
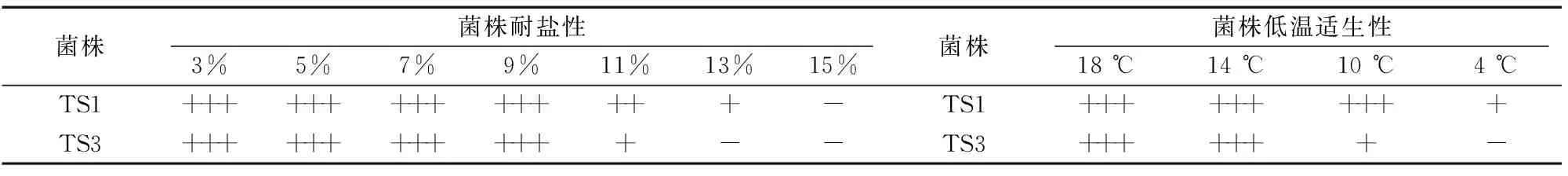
表2 菌株的耐盐性及低温适生性
注:+++表示生长良好;++表示正常生长;+表示缓慢生长;-表示不能生长。
2.3 菌株的拮抗活性
2.3.1 抑病原真菌活性 以油菜菌核菌、瓜类枯萎病菌及小麦赤霉菌为指示菌来检测菌株拮抗病原真菌活性。结果(图1、表3)表明,菌株TS1、TS3对油菜菌核病菌抑菌圈直径≥13 mm,对瓜类枯萎病菌抑菌圈直径 ≥10 mm,对小麦赤霉菌抑菌圈直径≥15 mm,表现出良好的拮抗活。
2.3.2 抑病原细菌活性 以大白菜软腐病菌为指示菌检测菌株拮抗病原细菌的活性。检测结果(图1、表3)表明,菌株TS3对病原细菌的拮抗活性较为明显,其拮抗大白菜软腐病菌的抑菌圈直径为13 mm;而菌株TS1拮抗大白菜软腐病病原细菌的抑菌圈直径为8 mm,菌株TS3表现出更高的拮抗活性。
2.4 脂肽类化合物的鉴定
脂肽类化合物是芽孢杆菌产生的最主要的抗菌物质[20-21],芽孢杆菌产生的脂肽类化合物分子量在900~2 000 bp 中范围内[22]。选择菌株TS1、TS3通过Landy发酵获得脂肽类化合物,对脂肽类化合物粗提物进行MALDI-TOF-MS分析。MALDI-TOF-MS图谱显示,菌株TS1在质荷比(m/z)为1 030.92、1 044.83、1 058.92处有离子峰出现,这3个离子峰均对应于Surfactin的分子质量;在m/z为1 435.17、1 513.67 处有离子峰出现,这2个离子峰均对应于Fengycin的分子质量。菌株TS3在m/z为1 030.75、1 044.75、1 058.83 处有离子峰出现,这3个离子峰均对应于Surfactin的分子质量;在m/z为1 133.42处有离子峰出现,这个离子峰对应于IturinA的分子质量。MALDI-TOF-MS质谱分析结果表明,菌株TS1能产生脂肽类化合物Surfactin、Fengycin,菌株TS3能产生脂肽类化合物Surfactin、IturinA。推断拮抗菌株抑制病原真菌及病原细菌生长可能与其产生抗菌作用的脂肽类化合物有关。
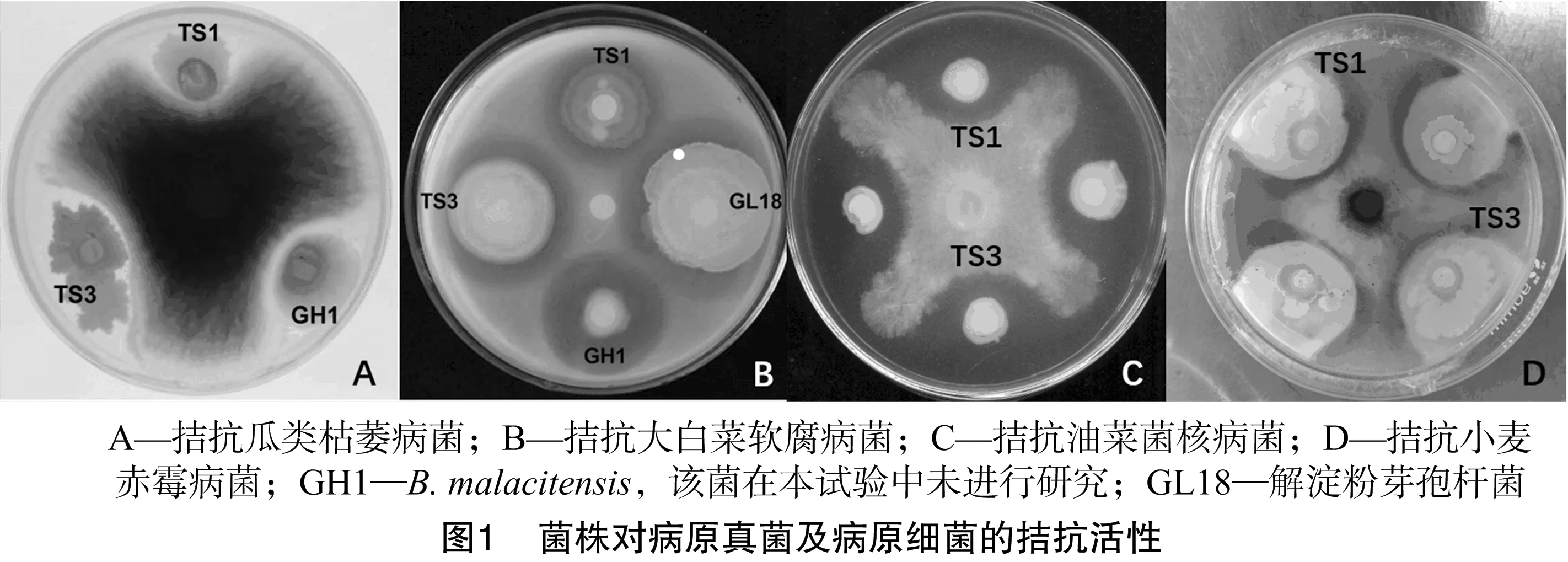
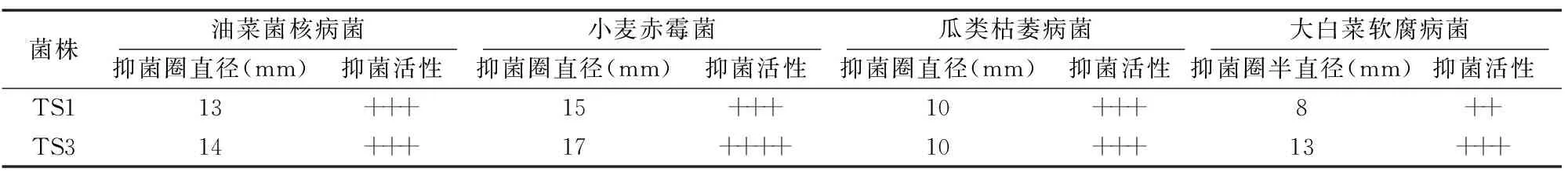
表3 芽孢杆菌抑菌活性特征
注:+表示抑菌圈直径大于等于0 mm小于等于5 mm;++表示抑菌圈直径大于5 mm小于等于10 mm;+++表示抑菌圈直径大于10 mm小于等于15 mm;++++表示抑菌圈直径大于15 mm。表4同。
2.5 脂肽类化合物抗生素活性分析
2.5.1 血平板试验 通过血平板检测菌株TS1、TS3产生的脂肽类化合物的抗生素活性。结果(图2-A、表4)显示,2株菌株提取的脂肽类化合物粗提物可在血平板上形成透明圈,其中菌株TS1形成的透明圈直径为11.5 mm,菌株TS3形成的透明圈直径为 14.0 mm,表明菌株TS1、TS3产生的脂肽类化合物具有抗生素活性,可通过与红细胞膜上的磷脂双分子层相互作用形成离子通道,破坏膜结构,使细胞内容物释放,引起血细胞死亡。
2.5.2 抑病原细菌活性 测定菌株TS1、TS3产生的脂肽类化合物对病原细菌大白菜软腐病的拮抗活性。结果(图2-B、表4)显示,脂肽类化合物在含菌平板上产生抑菌圈,其中菌株TS3产生的脂肽类化合物粗提物对病原细菌的抑菌效果非常明显,抑菌圈直径为16 mm,表明脂肽类化合物具有明显的抑制病原细菌的活性,推测菌株的拮抗活性与其产生的脂肽类化合物有关。
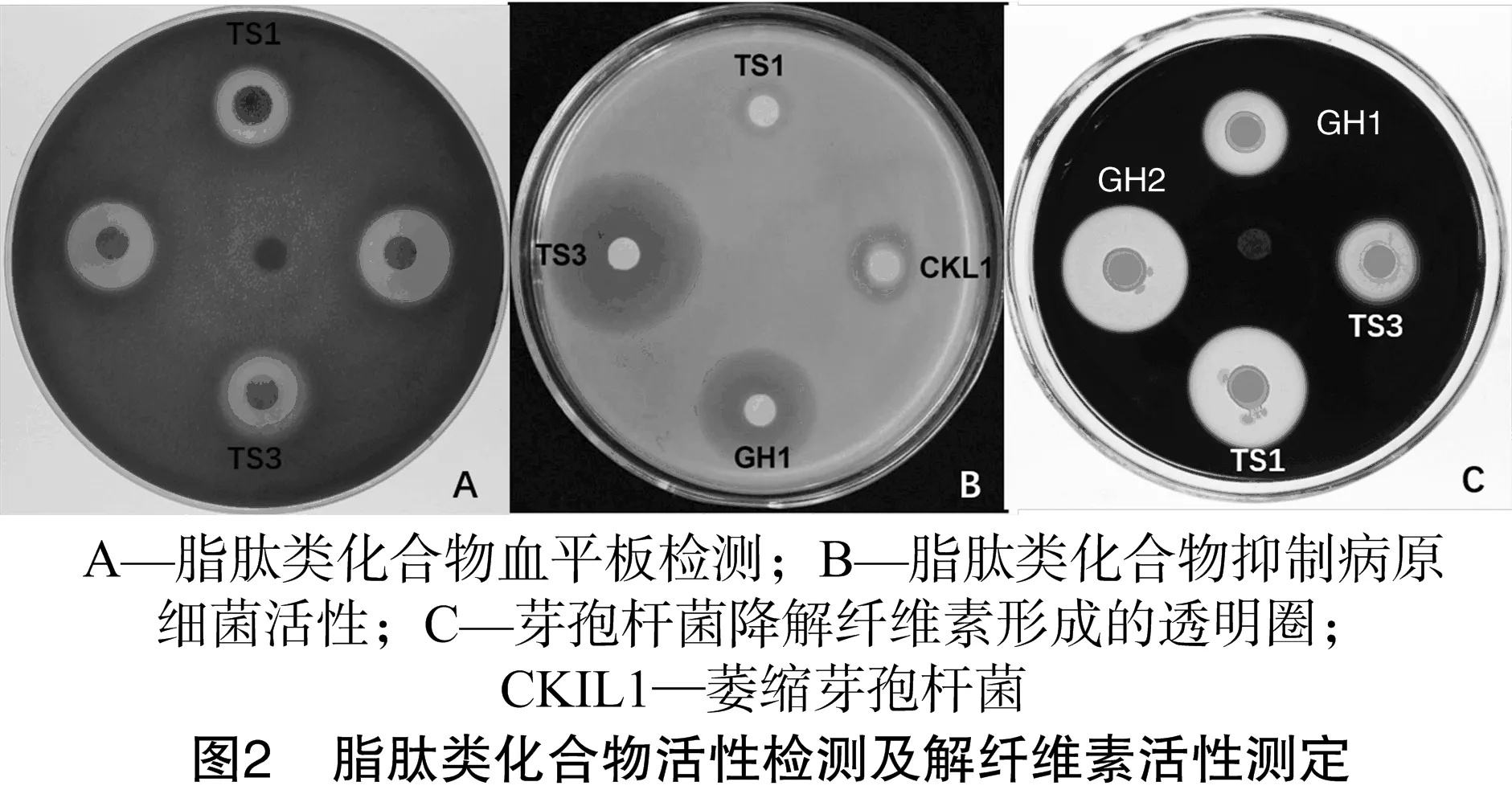

表4 生防菌株产生的脂肽类化合物活性检测
2.6 降解纤维素活性
2.6.1 降解纤维素活性 检测菌株TS1、TS3降解纤维素活性。结果(图2-C、表5)显示,在CMC-Na固体培养基上,菌株TS1、TS3均可产生透明圈,表明菌株可利用培养基中的唯一碳源CMC-Na,并将其降解形成降解透明圈,更确切的说是菌株可产生纤维素活性酶,将CMC培养基中的CMC-Na进行酶促降解,使其革兰氏碘液染色后无法附着染料而形成透明圈,通过透明圈直径的大小可以初步反映降解纤维素活性的大小。菌株TS1、TS3产生的降解纤维素透明圈直径分别为23、17 mm,A值分别为3.15、2.33,表现为明显的降解纤维素活性。
2.6.2 菌株产木聚糖酶活性的测定 酶活性计算公式为酶活性(U/mg)=(葡萄糖含量×稀释倍数×5.56)/反应液中酶加入量×时间)。酶活性测定结果(表5)表明,菌株TS1酶活性值为116.76 U/mL,菌株TS3的酶活性值为 150.12 U/mL。
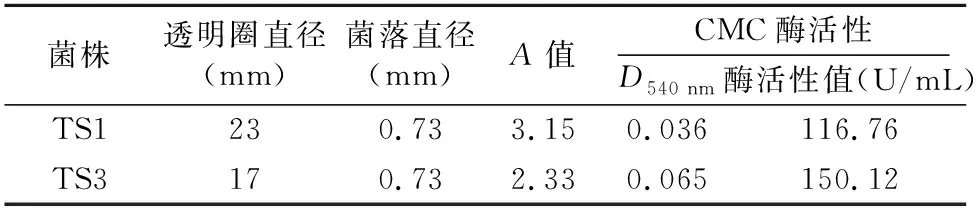
表5 菌株解纤维素活性测定及酶活测定
3 结论与讨论
青藏高原极地环境微生物资源具有十分广阔的研究和开发前景。芽孢杆菌是一类重要的植物根围促生菌及生防菌,与植物之间存在有益的互作关系。芽孢杆菌通过多途径机制与植物相互作用,刺激植物产生诱导系统抗病性,抑制植物病害发生、促进植物生长,是生物农药和生物肥料研发和应用的理想菌源[23]。芽孢杆菌可通过非核糖体肽途径合成具有抑真菌、细菌、病毒、菌原体等生物活性的脂肽类化合物和聚酮化合物,在农牧业生产中具有良好的应用潜力[24]。与营养细胞相比,芽孢杆菌的抗逆芽孢壁中有皮质层,对高温、紫外线及抗菌素等具有很强的抗性,可以耐受饲料加工、饲料储藏和牲畜胃的酸性环境,饲用后在肠道酸性环境中具有高度的稳定性,在畜牧业及饲料产业中同样具有重要的应用价值[25-28]。
本研究从青海省托素湖畔骆驼蓬根围土壤中分离筛选到耐盐耐低温芽孢杆菌TS1、TS3,具有明显的拮抗植物病原细菌和病原真菌活性,Landy发酵法提取到菌株TS1、TS3的脂肽类化合物;MALDI-TOF-MS分析结果表明,菌株TS1可产生脂肽类化合物Surfactin、Fengycin,菌株TS3可产生脂肽类化合物Surfactin、IturinA,推测芽孢杆菌的拮抗活性与其产生的脂肽类化合物有关。CMC法测定结果表明,菌株TS1、TS3具有降解纤维素活性,2株菌株可在以CMC-Na为唯一碳源的培养基上形成降解透明圈,具有解纤维素活性,其酶活性分别达到116.76、150.12 U/mL。菌株TS1可在4 ℃低温条件下生长,菌株TS3在10 ℃温度条件下和含NaCl浓度为11%的LB平板上生长,表明2株菌株具有明显的耐盐、耐低温适生特性。目前,耐盐菌是具有重要研究开发价值的微生物资源,耐盐菌的耐盐基因分离及耐盐机制研究,在农业生产、环境修复等方面均有应用潜力;同时,也可研发耐盐生物菌肥,改良盐碱地土壤。本研究分离筛选的菌株TS1、TS3具有拮抗病原真菌和病原细菌活性及纤维素降解活性,具有一定的耐盐及低温适生特性,适应高原生态环境,可作为适应高原气候条件的耐盐耐低温生物菌肥和生物农药的研发菌源,此外,在饲料加工生产及作物秸秆还田领域具有一定的研究潜力。

