16S rRNA甲基化酶RmtB耐药重组菌的构建及其稳定性研究
陈 琳, 管远红, 黄东璋, 齐富刚, 魏冬霞, 陈瀛川, 张 欢, 王亚南, 苏哲君,张洪涛, 区卓麟, 陈冬冬, 吴怀秀, 于淼淼, 杨雨秋
(江苏农牧科技职业学院,江苏泰州 22530)
抗耐药菌感染已成为世界性难题,研究细菌耐药机制,针对耐药机制寻求新的抗感染药物,寻找一些增强或保护现有抗菌药物抗菌活性的物质,已成为抗感染治疗尤其是抗耐药菌感染治疗的一个重要研究方向。
16S rRNA甲基转移酶是近年来出现的一种介导临床菌对氨基糖苷类抗生素尤其是对4,5-及4,6-二脱氧链霉胺类氨基糖苷抗生素高度耐药的核糖体RNA甲基转移酶[1]。编码16S rRNA甲基转移酶的基因大多位于质粒、转座子、整合子、插入序列共同区等可动遗传因子上,具有易于传播和扩散的特点[2-5]。目前,几乎世界各地均有16S rRNA甲基转移酶耐药临床菌出现的报道,且有不断增多的趋势[6-8],这给临床抗革兰氏阴性菌感染治疗带来巨大的挑战。因此,通过系统研究16S rRNA甲基转移酶耐药机制,建立有效的药物筛选模型,寻找有效的药物来抑制16S rRNA甲基转移酶的活性或进一步恢复耐药菌对氨基糖苷类抗菌药物的敏感性或降低细菌对氨基糖苷类的耐药性具有重要的理论及临床意义。基于此,本研究进行了16S rRNA甲基化酶RmtB耐药重组菌的构建及其稳定性研究,以期为抗耐药菌药物筛选奠定基础。
1 材料与方法
1.1 试验菌株
16S rRNA甲基化酶阳性菌Escherichiacoli(编号P-25),自临床腹泻猪分离,经PCR检测鉴定携带16S rRNA甲基化酶RmtB。工程菌E.coliJM109,购自TaKaRa生物试剂公司。质控菌E.coliATCC 25922,购自杭州滨和微生物试剂有限公司。
1.2 培养基
水解酪蛋白肉汤(MH Broth)、LB肉汤及LB琼脂等,均购自杭州滨和微生物试剂有限公司。
1.3 主要试剂
EmeraldAmp Max PCR Master Mix、限制性内切酶EcoR Ⅰ(8~20 U/μL)及SalⅠ(8~20 U/μL),DNA分子量标准DL 2 000 (50 ng/μL)、250 bp DNA ladder、克隆载体pMD18-T Vector、TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0,TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0,TaKaRa MiniBEST Plasmid Purification Kit Ver.4.0等,均购自宝生物工程(大连)有限公司。
1.4 供试药物
共10种药物,阿米卡星(效价630 μg/mg)、硫酸庆大霉素(效价592 μg/mg)、新霉素(效价652 U/mg)、大观霉素(效价650 U/mg),均购自某质检标准物质中心。氯霉素(99.3%)、氨苄西林(95%)、头孢唑林(99.3%),均购自杭州某微生物试剂有限公司。氟苯尼考(98.63%),购自浙江某药业有限公司。恩诺沙星(98.7%),购自上虞某药业有限公司。多西环素(84.56%),购自河北某制药有限公司。
1.5 方法
1.5.1 16S rRNA甲基化酶RmtB全基因的PCR扩增 应用TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0提取DNA。设计RmtB全序列引物RmtB-F:5′-CTGT-CAGACCAAGTTTACTC-3′;RmtB-R:5′-GGCGCTGT-AAGTATAATGGC-3′,均由上海英俊生物技术有限公司合成。确定PCR反应体系[9],利用梯度PCR确定最佳循环条件为:95 ℃预变性5 min;95 ℃变性30 s,54 ℃退火30 s,72 ℃ 延伸45 s,30 个循环;72 ℃再延伸5 min。取适量PCR扩增产物,以DL 2 000的DNA分子量标准做参考,以6 V/cm的电压,用1.5%~2.0%琼脂糖凝胶进行电泳,结束后拍照分析电泳结果。
1.5.2 RmtB的克隆、转化及鉴定 按照TaKaRa Agarose Gel DNA Purification Kit Ver.2.0 DNA片段纯化回收试剂盒使用说明操作,回收带全长基因的PCR产物。将回收的目的DNA片断与pMD18-T载体连接,在16 ℃条件下反应1 h,同时按分子克隆试验指南操作[10]制备感受态细胞并确定RmtB重组质粒转化体系,然后进行连接转化,挑取白色菌落,使用菌落或菌液PCR法确认载体中插入片段的长度大小。用TaKaRa MiniBEST Plasmid Purification Kit Ver.4.0提取重组质粒,进行电泳和含量测定。依照RmtB重组质粒双酶切鉴定体系(表1),用限制性内切酶EcoR Ⅰ和SalⅠ双酶切重组质粒DNA,37 ℃恒温水浴4 h后,取5~10 μL酶切产物,1.2%琼脂糖凝胶电泳观察重组菌提取结果。同时将菌落PCR及双酶切鉴定阳性菌落送至华大基因进行序列测定,测序结果采用DNA Star 6.0与GenBank上下载的序列进行MegAlign。
1.5.3 RmtB重组菌的药物敏感性检测 选取受试药物,按照CLSI的指导原则选取溶剂进行配制和稀释,在MH琼脂平板上挑取单个菌落接种于2 mL Muller-Hinton(MH)肉汤管中,37 ℃振荡培养4~8 h,用调节过Ca、Mg离子的MH肉汤稀释菌液,使稀释菌液达到0.5麦氏比浊管浊度,再按 1 ∶100 稀释菌液至含菌量约为1×106CFU/mL。然后进行MICs测定,记录药敏试验结果,以MIC值位于美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,简称CLSI)规定的敏感(susceptible,S)、中介(intermediate,I)、耐药(resistance,R)折点值范围判断药敏试验结果。CLSI规定的10种药物敏感、中介、耐药折点值判断标准见表2。

表1 RmtB重组质粒双酶切鉴定体系

表2 药敏试验判断标准
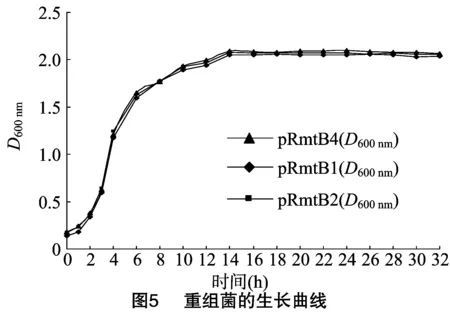
1.5.4 RmtB重组菌的稳定性研究 取RmtB重组大肠杆菌接种于不含阿米卡星、庆大霉素及氨苄西林的LB固体培养基上,37 ℃过夜培养。2 d再挑取平板上的菌落接种于LB固体培养基,重复以上操作,连续传3代。将上述连续传了3代的重组菌接种于LB液体培养基,于37 ℃、200 r/min振荡培养至菌液D600 nm值约为0.6。再按照1 ∶100比例接种于LB肉汤的试管中,37 ℃、200 r/min振荡培养,分别于0、2、4、6、8、10、12、14、16、18、20、22、26、28、30、32 h后测定菌液的D600 nm。以时间为横坐标,菌液D600 nm值为纵坐标,绘出重组菌的生长曲线,测定重组质粒传代以后的最低抑菌浓度(MICs)。
2 结果
2.1 16S rRNA甲基化酶RmtB编码基因的PCR扩增结果
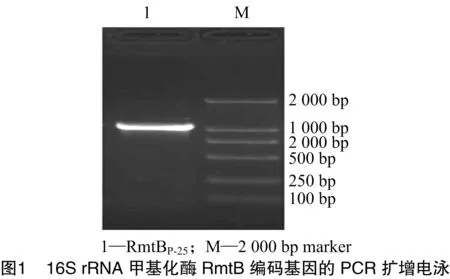
以16S rRNA甲基化酶阳性菌E.coli(编号P-25)提取的DNA为模板,用含RmtB全基因的引物进行PCR扩增,得到目的片段RmtBP-25(图1)。
2.2 16S rRNA甲基化酶RmtB编码基因的克隆转化及结果
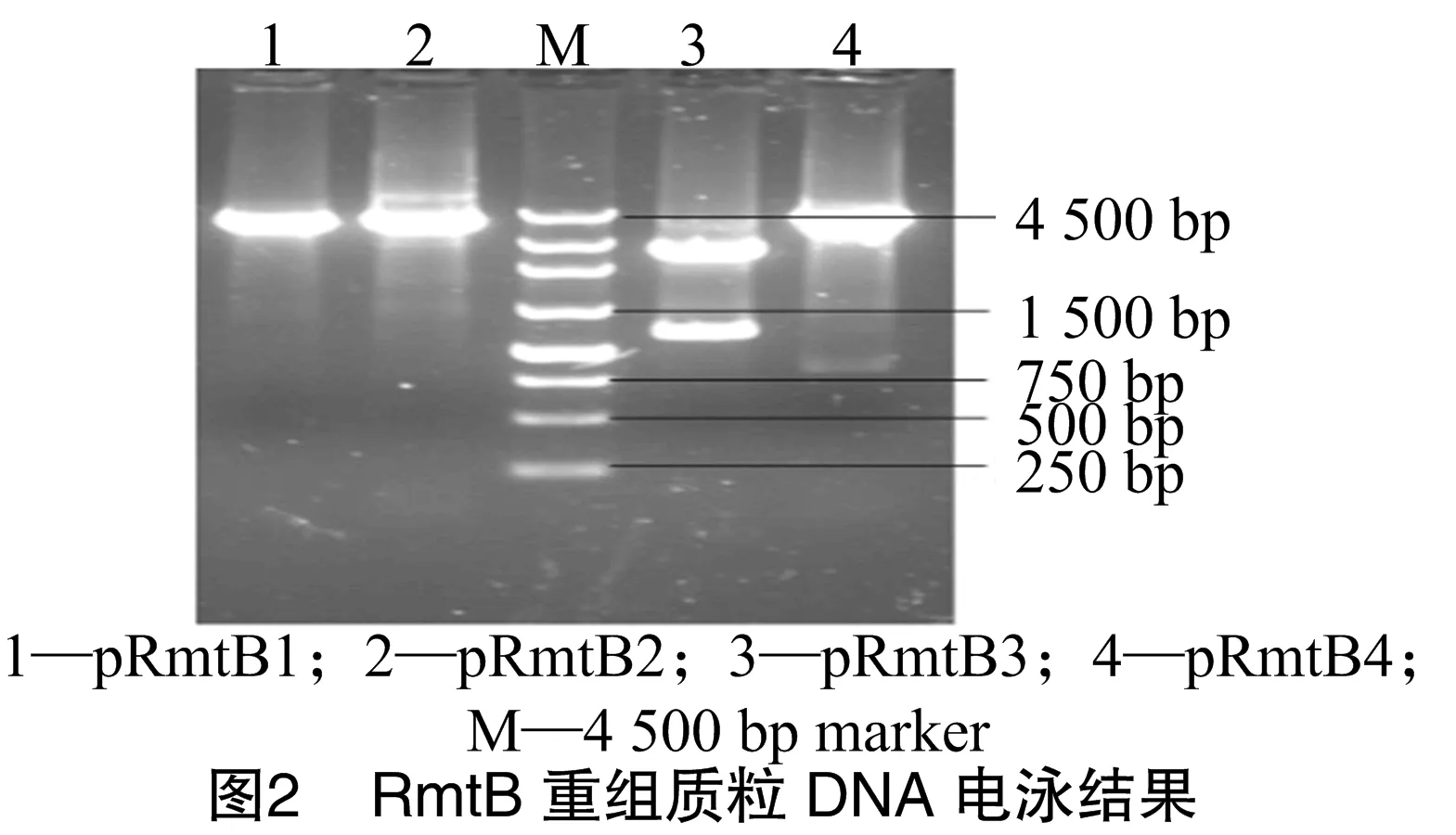
回收16S rRNA甲基化酶RmtB全基因PCR扩增产物,将回收片段与pMD18-T载体连接,并按照分子克隆实验指南转化入大肠杆菌JM109,挑取4个白色菌落,分别命名为pRmtB1、pRmtB2、pRmtB3、pRmtB4。提取4个重组质粒DNA进行电泳,结果见图2。
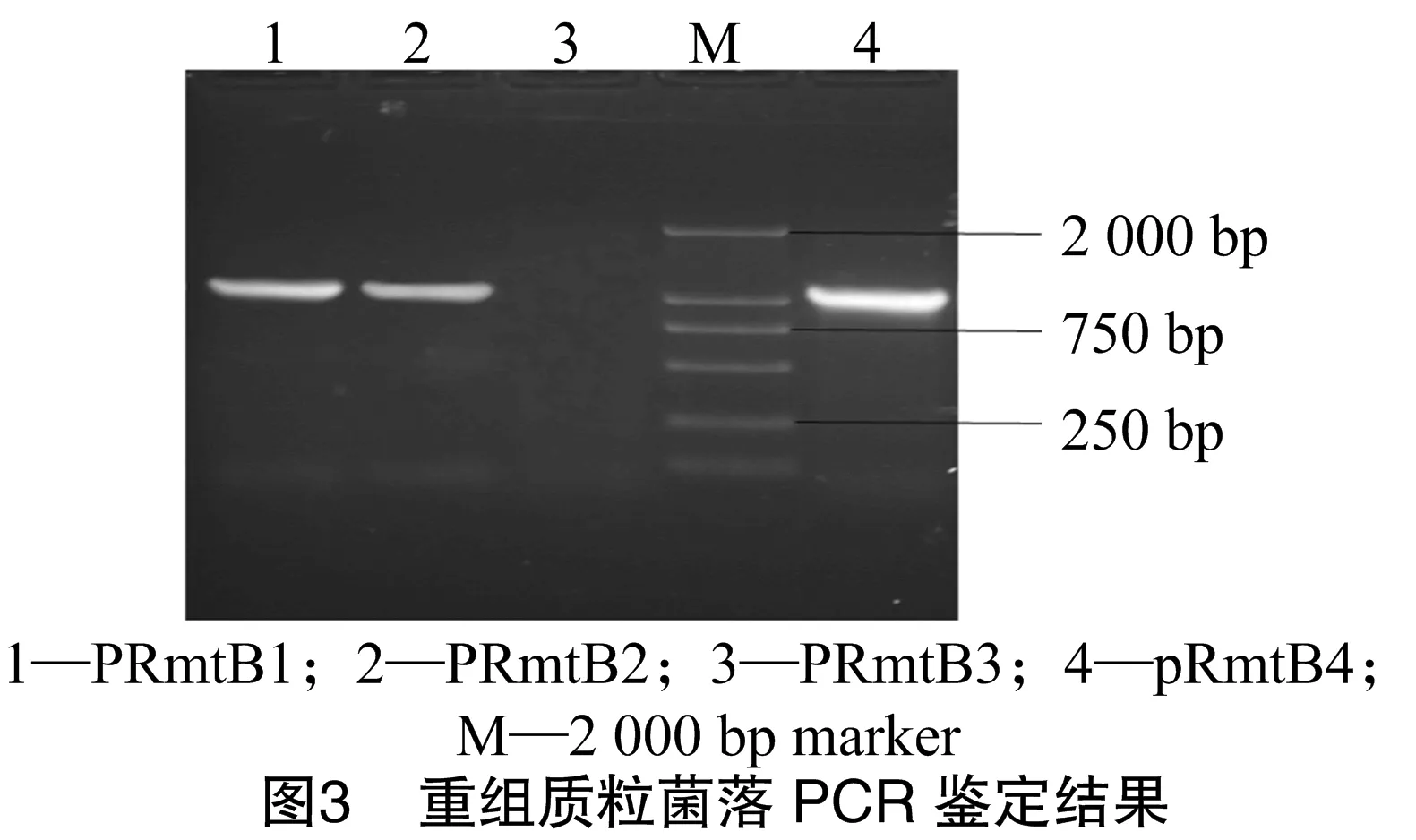
2.3 RmtB重组菌的菌落PCR鉴定结果
由图3可知,4个重组质粒中,只有3个pRmtB1、pRmtB2及pRmtB4中含有rmtB全基因。
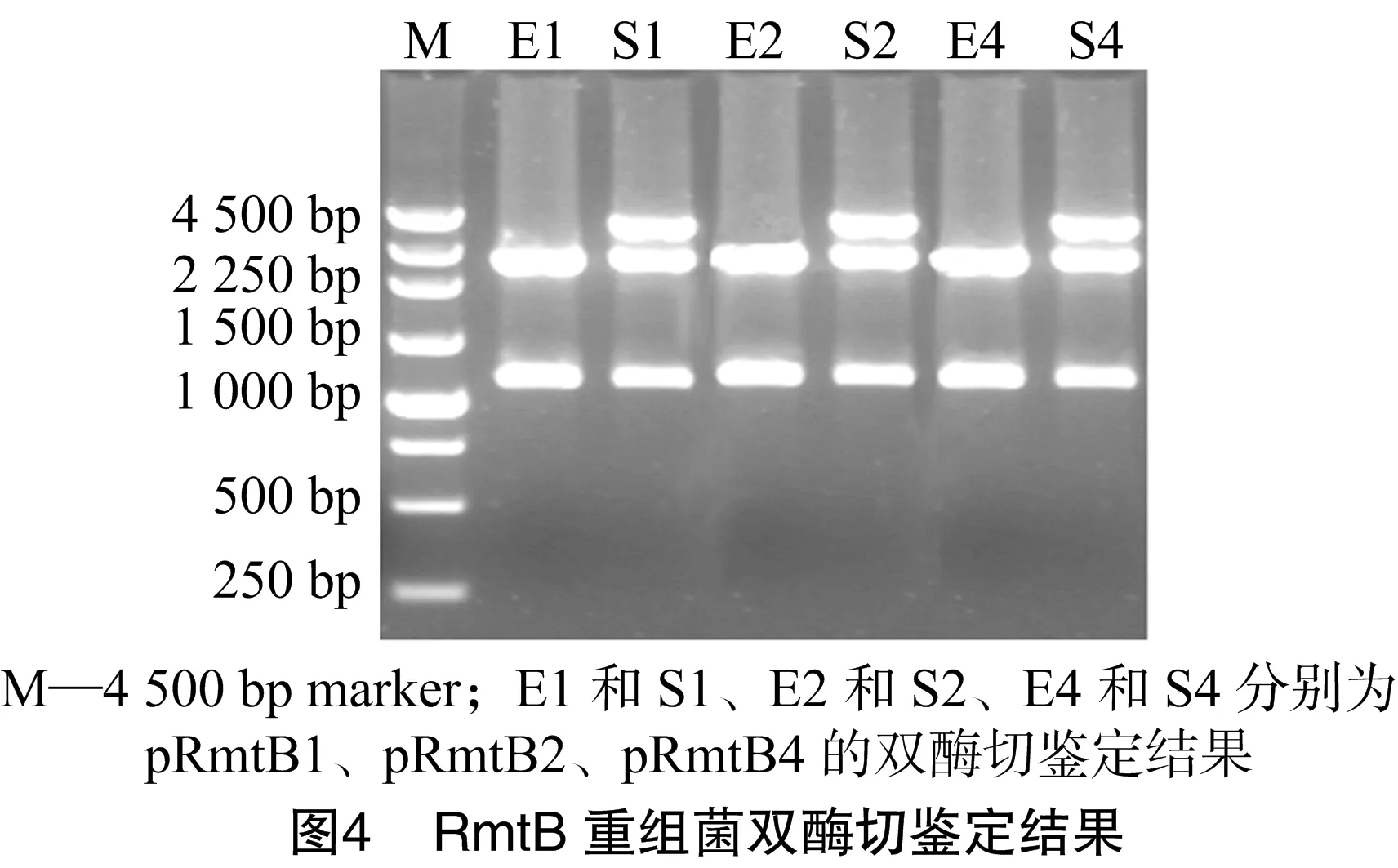
2.4 RmtB重组菌的双酶切鉴定结果
经菌落PCT鉴定阳性的重组质粒双酶切鉴定及结果见图4。
2.5 RmtB重组菌的序列分析鉴定结果
上述3个经菌落PCR及双酶切鉴定呈阳性的重组菌,送上海英俊生物技术有限公司进行序列测定。测序结果用DNAStar 6.0与GenBank上下载的序列进行MegAlign。结果证实,16S rRNA甲基化酶RmtB成功转入大肠杆菌JM109中。
2.6 RmtB重组菌的药物敏感性检测结果
RmtB重组菌对10种药物的MICs,由表2可知,3株重组菌均对阿米卡星、庆大霉素及氨苄西林耐药。
2.7 16S rRNA甲基化酶RmtB重组菌稳定性研究结果
16S rRNA甲基化酶RmtB重组菌pRmtB1、pRmtB2及pRmtB4在无抗生素筛选压力下,连续传3代后的生长曲线及药敏试验结果,由图5及表3可知,重组菌pRmtB1对阿米卡星及庆大霉素仍然高度耐药,其MIC分别为>1 024 μg/mL及512 μg/mL。而pRmtB2及pRmtB4对阿米卡星及庆大霉素的MIC均为4 μg/mL。

表2 重组菌对10种药物的MICs μg/mL
3 分析和讨论
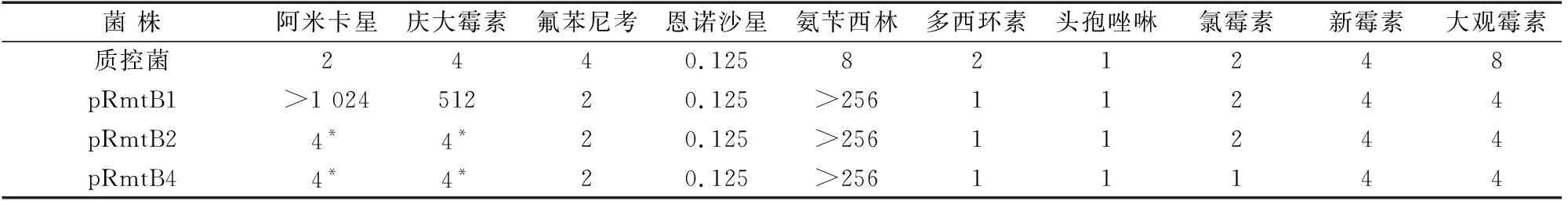
表3 RmtB重组菌连续传3代以后对10种药物的MICs μg/mL
注:“*”表示重组菌pRmtB2和pRmtB4经过传代3次以后对丁胺卡那霉素和庆大霉素的耐药性消失。
本研究应用分子克隆技术构建了16S rRNA甲基化酶RmtB重组菌,并对重组菌进行了稳定性研究。结果表明,16S rRNA甲基化酶RmtB重组菌pRmtB1比较稳定,连传3代以后对丁胺卡那霉素及庆大霉素仍然高度耐药,其MIC分别为>1 024 μg/mL、512 μg/mL。而pRmtB2、pRmtB4传代的过程中,对丁胺卡那霉素及庆大霉素的敏感性恢复,其MIC均为 4 μg/mL。研究结果表明,16S rRNA甲基化酶RmtB重组菌pRmtB1稳定性较强,可作为16S rRNA甲基化酶耐药抑制剂筛选模型。
4 结论
本研究应用分子克隆技术构建了16S rRNA甲基化酶RmtB重组菌,稳定性试验结果表明,16S rRNA甲基化酶RmtB重组菌pRmtB1稳定性较强,可作为16S rRNA甲基化酶耐药抑制剂筛选模型。

