灰树花生理成熟期到出菇期生理生化初探
叶建强, 宋 冰, 李 玉, 付永平, 李 丹, 李长田, 王 菲, 徐安然, 孟灵思
(吉林农业大学/食药用菌教育部工程研究中心,吉林长春 130118)
灰树花[Grifolafrondosa(Dicks.) Gray]商品名别称栗子蘑(中国河北省迁西县)、舞茸(日本)[1],具有很高的食药价值[2-5],素有“食用菌王子”之美称[6]。目前,灰树花在日本的销量已仅次于香菇和金针菇,稳居第3位[7],在我国也是主要栽培珍稀食药用菌之一[8],在河北省迁西县、山东省泰安市及浙江省庆元县等地已形成区域特色产业[9]。
食用菌栽培过程分为培养过程及出菇过程。培养过程分为定植期、发热期和生理成熟期[10]。生理成熟期能显著影响食用菌的产量和效益。近些年,关于食用菌生理成熟期的研究不断增多。以往的研究表明,不同食用菌拥有不同的较适应的生理成熟期培养天数,如香菇(20~40 d)、白灵菇(30~60 d)、茶薪菇(20~25 d)、蟹味菇(30~35 d)、灰树花(20~30 d)、杏鲍菇(7 d)、金针菇(2~5 d)、真姬菇(25~40 d)等[11],但未有针对关于该阶段的深入研究。灰树花属于中高温型菌[12],出菇温度和发菌温度基本一致,可以减少其他因素的影响。虽然已有关于灰树花栽培过程中胞外酶等方面的报道[13-14],但都没有进入该阶段的深入研究。本试验以主要栽培料硬杂木木屑、麦麸、轻质碳酸钙等为栽培培养基[15],研究灰树花生理成熟期到出菇阶段的培养基质量、含水量等生理生化变化,以期为灰树花栽培提供参考。
1 材料与方法
1.1 试验材料
1.1.1 灰树花菌种 菌株号为H34,由吉林农业大学食药用菌教育部工程研究中心提供,来源于山东省泰安市。栽培料主料(硬杂木木屑)和辅料(麦麸、轻质碳酸钙),均购自吉林省长春市农博园菌菜基地。
1.1.2 培养基 配方:75%硬杂木木屑(主料),23%麦麸(辅料),2%轻质碳酸钙(辅料),培养料含水量在62.5%左右,pH值自然。
1.2 试验方法
1.2.1 栽培试验 各料运用烘干箱在105 ℃烘干30 min,测定含水量。按配方配比及含水量称取各材料,加水拌至含水量为62.5%左右,采用33.00 cm×17.50 cm×0.05 cm聚丙烯袋装湿料800.0 g(干料300.0 g),袋口套直径为2.5 cm的套环,插入直径为2.5 cm、深12 cm的柱型塑料插棒,在 121 ℃ 灭菌85 min,冷却至室温,接种菌棒(拔出塑料插棒),每袋接种10 mL液体菌种,盖上透气盖,在23~26 ℃培养大部分显现原基,转入出菇室。出菇室管理如下:去掉透气盖及原基,搔菌出菇;温度维持在19~21 ℃,湿度为93%~97%,二氧化碳浓度为400~700 μL/L,光照为200 lx/12 h,直到采收。
1.2.2 粗酶液的制备过程 在生理成熟阶段到出菇阶段,每5 d取样1次,3次重复。取样过程:菌袋开口,在栽培料下 2~3 cm处均匀取样品,每份20.0 g左右,每天09:00随机测量及取样,样品用液氮冷冻后,保存在-80 ℃冰箱中备用[16]。粗酶液提取:称1.0 g样品,其中1份加入2.0 mL蒸馏水,在28 ℃温度下浸提4 h,过滤残渣,3 000 r/min离心 10 min,取上清液,上清液即是粗酶液,保藏在4 ℃,每个样品2次重复,分别备用。
1.2.3 生理测定方法 pH值采用手持式Testo 206酸度计测定[17];菌袋失质量等于上一次取样阶段质量减去当前取样阶段菌袋的质量[18];培养基干质量测定方法参照王玉万等的方法[19];含水量测定采用105 ℃烘干法[20];温度差采用水银温度计测定菌料温度,等于菌料中心温度减去环境温度;菌料单位面积压力采用GY-4果实硬度计测量。
1.2.4 生化测定方法 羧甲基纤维素酶和滤纸纤维素酶活性测定参照Mandels等的方法[21],淀粉酶活性测定参照李合生的方法[22],羧甲基纤维素酶、滤纸纤维素酶、淀粉酶酶活力单位定义为1 U=1 μmol葡萄糖/(60 min·g)干培养物;半纤维素酶活性测定参照Shamala等的方法[23],酶活力单位定义为1 U=1 μmol木糖/(60 min·g)干培养物;漆酶、多酚氧化酶、愈创木酚氧化酶活性测定参照宋爱荣等的方法[24-25],酶活力单位定义为1 U=ΔD/(30 min·g)干培养物。胞外可溶性蛋白含量测定采用lowry法[26],应用酪蛋白作标准曲线;胞外可溶性糖含量测定采用二硝基水杨酸法[27],使用葡萄糖作标准曲线。
2 结果与分析
2.1 灰树花栽培特性
由表1可知,在灰树花栽培过程中,菌袋在26 d左右满袋,40 d左右部分菌袋套环口处显现原基,40 d去掉套环及原基(生理后熟期显现),搔菌出菇,54 d开始采收,到62 d采收结束,根据曾宪森等的报道[12],该种属于中高温型菌种(17~26 ℃)。
本试验从生理成熟期到出菇期,共取8个时间点,分别是0、5、10、15、20、25、30、35 d,其中,0、5、10、15 d属于生理成熟期,20、25、30、35 d属于出菇期。菌袋移入出菇室时,为了控制整齐度及方便研究灰树花出菇各阶段,去掉套环及原基(生理后熟期显现),搔菌出菇,各时期的状态见表2。

表1 灰树花生育理过程特性

表2 各取样时间灰树花的状态
2.2 灰树花生理特性变化
对灰树花生理成熟期(0~15 d)和出菇期(15~35 d)的生理变化进行分析,由图1可知,菌料中含水量在0~5 d基本保持上升状态,但5~10 d 明显下降,可能由于原基形成,呼吸加快导致水分散失,进入出菇期,15~30 d含水量不断下降,且25~30 d下降明显,可能与原基分化(此阶段原基吐出大量白色水珠)有关,30~35 d含水量有略微升高。菌料的pH值在0~5 d缓慢降低,在5~15 d不断升高,其中10~15 d 升高明显,15 d达最高值,进入出菇期,菌料的pH值基本保持下降,但20~25 d有小幅升高,表明原基形成过程中培养菌料的pH值会升高。
菌料中有纵横交错的菌丝,形成一个庞大的整体,能承受一定压力,与菌丝量有一定相关性。由图2可知,菌料单位面积承受的压力在0~15 d不断升高,其中在0~5 d明显升高,其后变化不大,进入出菇期,15~25 d不断升高,20~25 d升高明显,25 d达最高值,25~35 d不断下降,其中25~30 d下降明显。这与Montoya等报道菌丝量在该过程不断升高到一定值[14,28]基本一致,但菌丝的韧性还与菌丝的内含物及年龄有关,本研究表明在25~35 d单位面积压力下降,可能是菌丝体把内含物输送到子实体中相关。菌料失质量在0~5 d不断降低,5~10 d明显升高,可能与原基形成前代谢加强有关,10~15 d不断下降,进入出菇期,15~30 d 不断升高,在30 d达到最大值,可能与割口出菇方式有关,30~35 d明显减少,可能与灰树花叶片生长可以接受到环境中高湿度水汽有关。菌袋的内外温度差变化反应了菌料的代谢情况。温度差在0~5 d缓慢下降,5~10 d明显升高,可能与菌袋袋口出现原基有关,10~15 d温度差维持在较高水平,进入出菇期,15~20 d仍然维持在高水平,20~30 d明显降低,30~35 d基本维持不变。
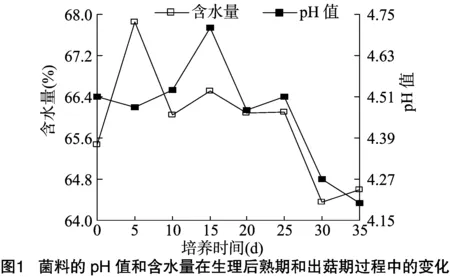

2.3 灰树花胞外酶变化
从生理成熟期(0~15 d)到出菇期(15~35 d),随着培养时间的增加,灰树花各个酶类活性有着不同的变化。
由图3可知,纤维素降解酶类主要包括羧甲基纤维素酶和滤纸纤维素酶。其中,羧甲基纤维素酶活性在0~15 d基本呈下降趋势,但5~10 d有细微上升,可能跟菌袋袋口出现原基有关,进入出菇期,20~25 d有较高值。这表明原基形成时,羧甲基纤维素酶活性升高,也与Montoya等报道灰树花羧甲基纤维素酶[14]基本一致。此外,滤纸纤维素酶活性进入出菇期开始不断上升,25 d有较高值,之后明显下降。这表明滤纸纤维素酶活性在生理成熟期较弱,在出菇期大量分泌,且在原基分化时有最大值,这与倪新江等报道滤纸纤维素酶活性比纤维素酶及半纤维素酶活性微弱[13]相一致,且在出菇期变化与本试验一致。半纤维素酶活性在0~5 d略微下降,5~15 d明显上升,进入出菇期,基本维持在较高水平,但20~25 d明显下降,这可能与原基分化有关。淀粉酶活性在0~15 d基本不断升高,但5~10 d有细微下降,可能与菌袋袋口出现原基有关,进入出菇期,15~20 d 快速上升,20 d时达最大值,可能与菌丝恢复相关,但20~30 d明显下降,30~35 d又上升。淀粉酶活性在生理成熟期与倪新江等的报道[13-14]不一致,可能是与本试验选的高温菌种有关,但在出菇期基本一致,表明灰树花出菇时,淀粉酶活性不断降低。

木质素降解酶类主要是漆酶,与漆酶相关酶包括漆酶、愈创木酚氧化酶和多酚氧化酶[29-30]。由图4可知,3种酶的活性在 0~35 d基本是不断降低的,在10、25、35 d均有高峰值。这表明木质素降解酶类酶活性在生理成熟期和出菇期低,无太大相关性,与倪新江等研究报道漆酶类变化[13-14]基本一致。但木质素降解酶类酶活性在原基形成时,酶活性会有一定提高,表明原基形成与木质素降解酶类有一定正相关性,这与姜性坚等报道在白色茶树菇栽培过程中原基形成及分化时漆酶显著升高[31]相一致。
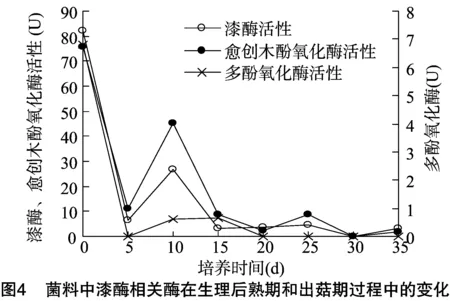
2.4 灰树花胞外可溶性蛋白含量和胞外可溶性糖含量变化
由图5可知,胞外水溶性蛋白含量在0~5 d不断升高,5~35 d 变化轻微,其中15~20 d有明显下降,这可能是由于菌丝恢复生长需要蛋白,导致胞外蛋白进入细胞内,构建细胞生长。胞外可溶性糖含量变化,在0~15 d基本是不断下降的,但在 5~10 d有细微上升,可能跟原基形成有关,进入出菇期,在20 d有较大值,20~35 d不断下降,可能与菌丝恢复期菌丝量变多有关。这与Montoya等研究报道菌料还原糖变化趋势[14,28]基本一致,但本试验中出菇期开始时胞外可溶性糖含量突然升高,可能与本试验搔菌出菇时菌丝恢复生长相关。
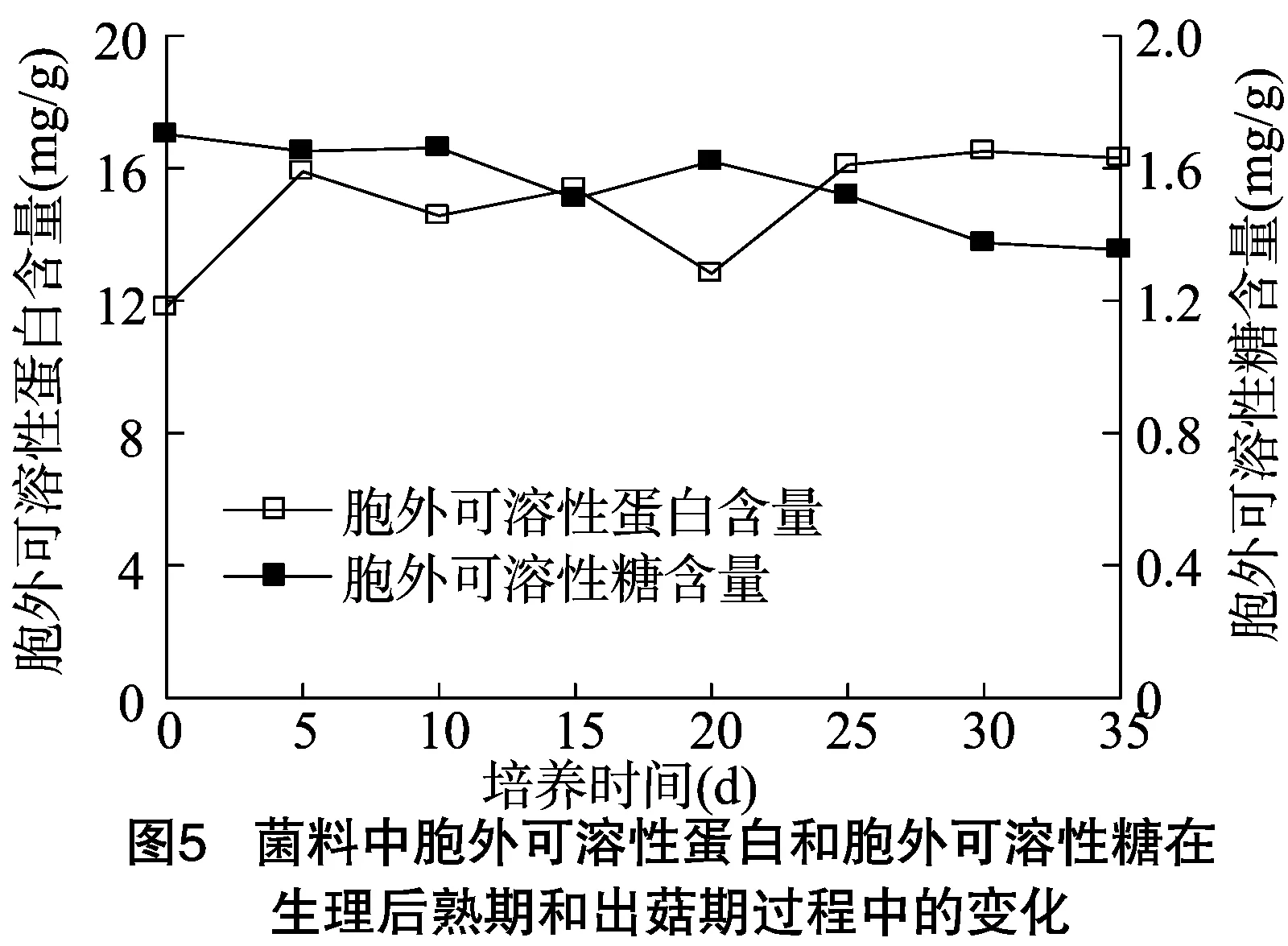
3 结论与讨论
本试验研究了中高温型灰树花在栽培过程中从生理成熟期到出菇期的生理生化变化,pH值、漆酶相关酶活性不断下降,但都在出现原基时明显升高,这与在白色茶树菇原基形成时,漆酶活性升高[31]相似;含水量在生理成熟期基本呈不断升高的趋势,在出菇期不断下降,原基分化时下降,这与在黑木耳[32]和真姬菇[18]栽培中生理成熟期菌料含水量不断升高相似;菌料单位面积压力在生理成熟期不断升高到一定水平,在出菇期的原基形成时明显升高,达到最大值,后不断降低;菌料失质量在生理成熟期较低,在出菇期明显升高,到原基形成及分化后明显降低;温度差在生理成熟期先降低,后升高到一定值(原基显现),维持到出菇期菌丝恢复,之后明显降低;滤纸纤维素酶活性在生理成熟期酶活性较低,在出菇期明显升高,在原基分化时达到最大值;羧甲基纤维素酶活性在生理成熟期降低到稳定值,在出菇期明显升高,原基形成后不断降低,这与倪新江等报道灰树花中[13]类似;淀粉酶活性在生理成熟期不断升高,在出菇期维持在较高水平,但在原基形成时降低;半纤维素酶活性在生理成熟期不断升高,到出菇期菌丝恢复时达到最大值,后不断下降,采收时又升高;胞外可溶性糖含量在生理成熟期维持较高水平,在出菇期不断降低,与Montoya等研究报道菌料还原糖在生理成熟期维持较高,出菇期下降的变化[14,28]相同;胞外可溶性蛋白含量在生理成熟期不断升高到一定水平,在出菇期菌丝恢复时降低,后又升高到稳定水平。
因此,本试验结果表明不同指标变化趋势不完全相同,同一指标不同时期变化也不完全相同。菌料的单位面积压力、羧甲基纤维素酶活性、胞外可溶性蛋白含量在生理成熟期间(原基形成前)能到达一定水平,是否可以应用于生理成熟期判断还须进一步研究;pH值和漆酶相关酶与原基形成有一定正相关,这对灰树花原基形成研究具有积极意义,同时为灰树花栽培过程中的生理成熟期及出菇管理提供理论依据。

