抗传染性支气管炎病毒N蛋白单克隆抗体的制备及鉴定
周景明, 耿 玥, 马文利, 刘红亮, 祁艳华, 张改平, 王爱萍
(郑州大学 生命科学学院 河南 郑州 450001)
0 引言
传染性支气管炎(infectious bronchitis,IB)是传染性支气管炎病毒(infectious bronchitis virus,IBV)引起的鸡的一种急性、高度接触性传染病,是严重危害养鸡业的重大传染病之一[1].IBV 是一种变异性很强的冠状病毒,血清型众多,不同血清型之间缺乏交叉保护[2].IBV的蔓延对全球家禽业造成了严重的经济损失[3].IBV的N基因进化最为保守,且N蛋白是诱导机体免疫应答的重要免疫原蛋白.制备针对N蛋白的单克隆抗体,对于建立IBV快速诊断方法具有重要意义.
1 材料和方法
1.1 材料
H120毒株(AV1511)购自中国兽医药品监察所;SPF种蛋购于北京梅里亚维通实验动物技术有限公司;3只6~8周龄的雌性BALB/c小鼠购自郑州大学实验动物中心;SP2/0细胞由本实验室保存;表达载体pGEX-6p-1、E.coliTransetta(DE3)均由实验室保存;IPTG、氯霉素和氨苄青霉素购自Solarbio 公司;限制性核酸内切酶、T4 DNA 连接酶购自Promega 公司;HRP 标记羊抗鸡、羊抗鼠IgG 购自Abbkine 公司;ECL 发光液购自Beyotime公司.
1.2 IBV的扩繁
将IBV种毒 H120冻干粉用1 mL灭菌的PBS缓冲液溶解.种蛋孵化至10日龄,用照蛋器观察鸡胚发育情况并标出气室,避开大血管,在接近气室处标记接种部位,用1 mL注射器吸取病毒稀释液接种鸡胚(200 μL/枚),石蜡封口,在孵化箱中孵育.在接毒48 h后收毒,收获鸡胚尿囊液.于4 ℃ 10 000 rpm离心15 min,收获上清液并用0.22 μm滤膜除菌,-80 ℃保存.
1.3 N蛋白的原核表达
1.3.1构建pGEX-6p-1-N表达载体 登陆NCBI,根据Genebank中已发表的IBV H120(accessionnumber:FJ888351)的N基因序列,使用Primer5.0设计引物,在上、下游引物5’端分别引入EcoRⅠ和XhoⅠ酶切位点,上游引物HP1序列为:CCGGAATTCATGGCGAGCGGTAAGAC,下游引物HP2序列为:CCGCTCGAGTTACAACTCATTCTCTCCAAG,引物由上海生工生物工程有限公司合成.提取尿囊液中的总RNA,以提取的总RNA为模板,Random Hexamer Primer 为引物,反转录成cDNA.以cDNA为模板,扩增N基因.提取pGEX-6p-1质粒,将表达载体与上述纯化回收的PCR产物,使用EcoRⅠ和XhoⅠ进行双酶切.将双酶切后的PCR产物和pGEX-6p-1纯化回收,然后连接.
1.3.2N蛋白的表达及纯化 将连接后的重组质粒pGEX-6p-1-N转化入100 μLE.coliTransetta(DE3)感受态细胞.挑取单克隆,接种于含有氨苄青霉素(50 μg/mL)与氯霉素(34 μg/ml)的5 mL LB液体培养基内,于37 ℃条件下220 rpm摇床上培养约14 h.将上述菌液以1∶100(V∶V)的比例加入含有氨苄青霉素(50 μg/mL)与氯霉素(34 μg/mL)的液体LB培养基,37 ℃ 220 rpm,活化至OD600 nm为0.6~0.8.加入IPTG,使其终浓度为1 mM,于20 ℃ 220 rpm摇床上继续诱导6 h.
采用GST柱对重组N蛋白进行纯化,取纯化后的重组N蛋白加入3.2 μg PreScission Protease(160 μg/mL纯化介质),4 ℃反应过夜,即获得纯化的N蛋白.采用SDS-PAGE凝胶电泳分析.
1.4 IBV N蛋白单克隆抗体的制备
取纯化后N蛋白,再向其中加入一定量的弗氏佐剂(初次免疫用弗氏完全佐剂,再次免疫用弗氏不完全佐剂),将其乳化后皮下多点注射3只6~8周龄的雌性BALB/c小鼠.可在第3次免疫1周后测定小鼠血清中的抗体效价,选取效价高的1只小鼠进行增强免疫,于3 d后细胞融合.
将超强免疫小鼠的脾细胞和SP2/0细胞以1∶5~1∶10(V∶V)的比例混合,离心,弃去上清,轻轻把细胞团打散.用1 mL移液管取37 ℃预热的PEG1500,1 min内缓慢滴加完,保持在37 ℃水浴中缓慢晃动离心管90 s.向其中添加15 mL 37 ℃预热的GNK,放置在37 ℃水浴中温育5 min.补加预热的GNK到40 mL,离心,倒掉上清,将细胞团打散.加入20 mL预热的HAT选择培养基混匀,加到提前一天制备好的饲养细胞内,100 μL/孔,置于37 ℃ 5% CO2培养箱培养.
待杂交瘤细胞状态生长良好时,半量换液后3~4 d进行阳性孔筛选.分别用N蛋白和IBV病毒液作为包被原,SP2/0细胞上清液为阴性对照,采用间接ELISA方法筛选出分泌抗体能力强的阳性孔.选择效价高的阳性杂交瘤细胞按有限稀释法进行亚克隆.重复亚克隆3~4轮.
1.5 IBV N蛋白单克隆抗体的鉴定
用体内诱生腹水法对IBV N蛋白mAb进行大量制备.采用辛酸/饱和硫酸铵法对单抗腹水纯化.鉴定其亚型、特异性、与不同IBV毒株的反应、亲和力.
2 结果与分析
2.1 构建pGEX-6p-1-N表达载体
用RNAiso Plus从感染IBV H120毒株的尿囊液里提取总RNA,再反转录成cDNA,以cDNA为模板,PCR扩增目的基因.PCR产物通过1%琼脂糖凝胶电泳鉴定,2号泳道明显可见大小约1 230 bp的条带,和预期片段大小相同(图1).
2.2 N蛋白的原核表达及纯化
如图2所示,重组表达菌pGEX-6p-1-N-Transetta(DE3)经过IPTG诱导后,在79 kD附近有明显条带,和预期结果一致.经过可溶性分析,超声后的上清中有大量目的蛋白,而沉淀中基本没有,表明20 ℃条件下诱导的重组N蛋白绝大部分是可溶形式表达的.重组N蛋白通过GST柱纯化后,无明显杂带,表明重组N蛋白的纯化效果较好.
用PreScission Protease酶切融合蛋白并去除GST标签,纯化得到无标签的重组N蛋白,SDS-PAGE鉴定结果显示,去除标签后的重组N蛋白分子量约为52 kD,与预期大小相符(图3).Western-blot结果显示,重组蛋白可以与IBV阳性血清反应,说明其具有较好的免疫反应性,具有较好的抗原性(图4).
2.3 N蛋白单克隆抗体的制备
经过3轮亚克隆,获得了13株抗N蛋白单抗(1A3D4、1G1G9、3A8C4、1A3G4、3A5E7、2E4H4、1A12C5、2B3B2、2B3A3、2E2A9、3A5H12、2C4E6、2B5D12),其中8株能与IBV结合(图5).

1:Marker;2:PCR产物图1 PCR扩增IBV N基因Fig.1 PCR product of IBV N gene

1:Marker;2:诱导前;3:诱导后;4:上清;5:沉淀;6:纯化后;7:NC图2 重组N蛋白的SDS-PAGE鉴定Fig.2 SDS-PAGE analysis of recombinant N protein
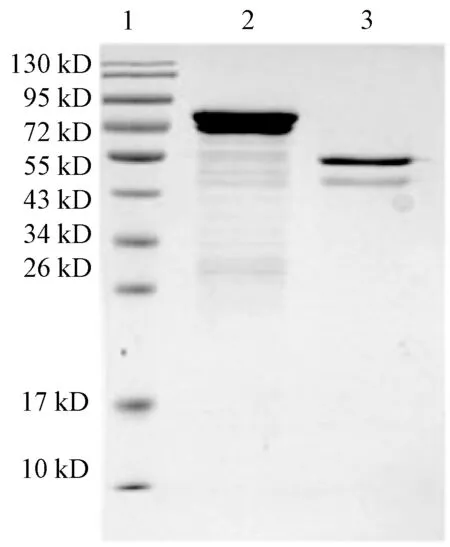
1:Marker;2:重组N蛋白;3:N蛋白图3 N蛋白的SDS-PAGE鉴定Fig.3 SDS-PAGE analysis of the N protein
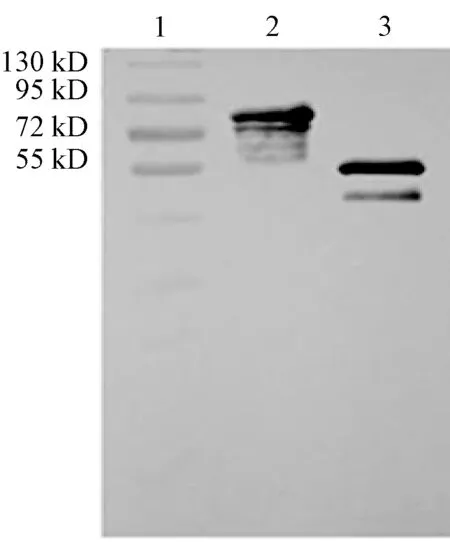
1:Marker;2:重组N蛋白;3:N蛋白图4 N蛋白的Western-bolt鉴定Fig.4 Western blotting analysis of the N protein
选择效价高且能与IBV结合的1A12C5杂交瘤细胞株对其进行大量制备.将纯化前后的1A12C5腹水通过12% SDS-PAGE鉴定分析,纯化后的1A12C5单抗分别在55 kD与25 kD处有明显条带,这两个条带分别为抗体分子的重链与轻链,而且与腹水纯化前相比,纯化后的抗体具有较高的纯度(图6).
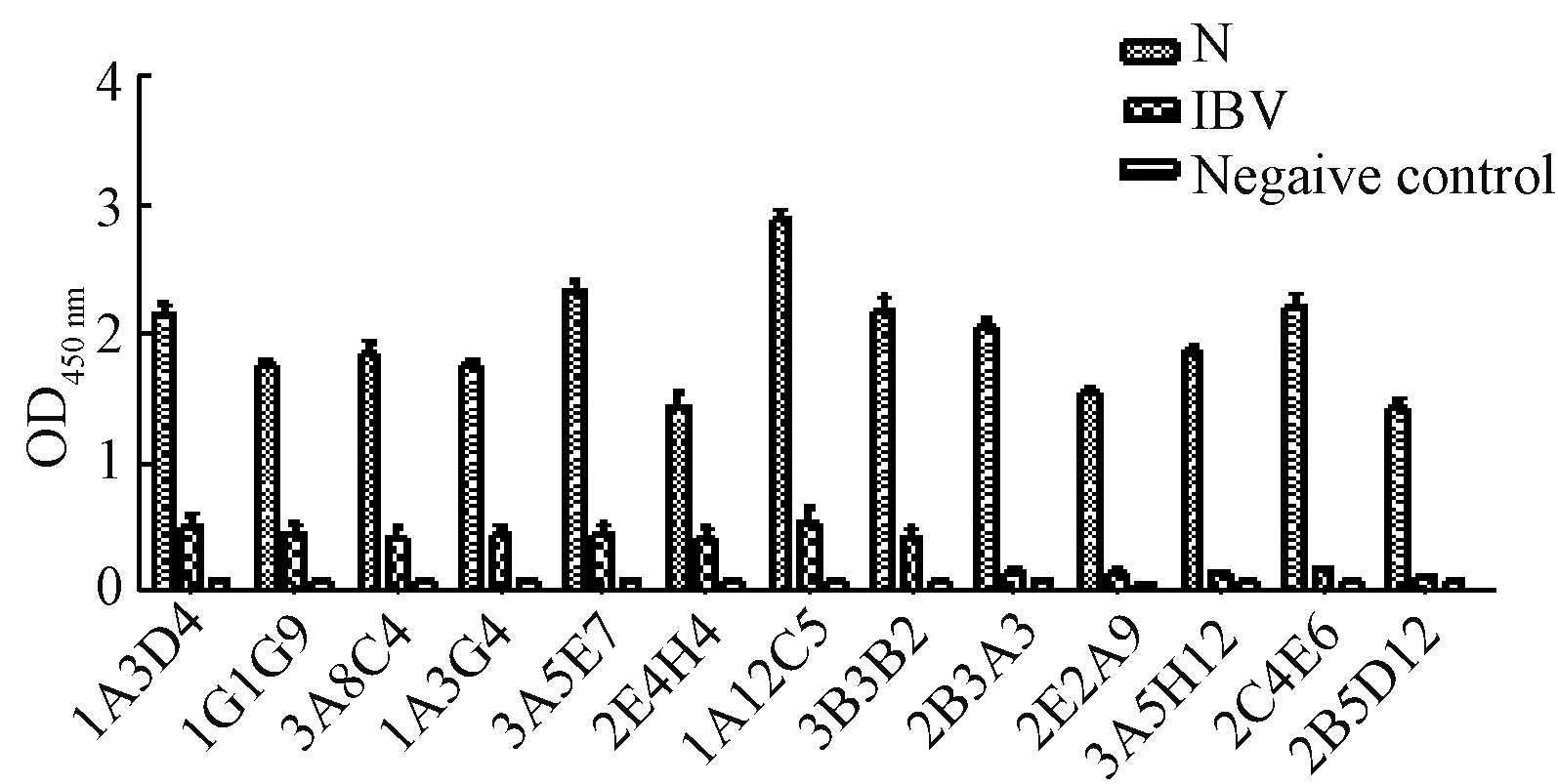
图5 抗N蛋白单抗的间接ELISA测定Fig.5 Indirect ELISA assay of mAb
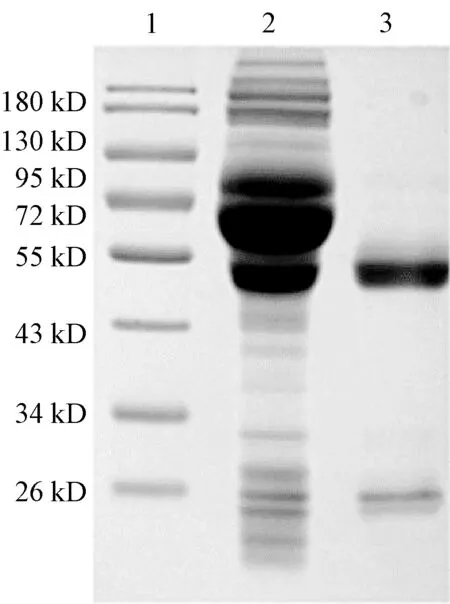
1:Marker;2:1A12C5单抗纯化前;3:1A12C5单抗纯化后图6 1A12C5单抗纯化的SDS-PAGE分析Fig.6 SDS-PAGE analysis of 1A12C5 mAb purification
2.4 N蛋白单克隆抗体的鉴定
采用Mouse Monoclonal Antibody Isotyping Reagents测定纯化后的1A12C5单抗的亚型.亚型鉴定结果中可以看出,在重链的鉴定孔中IgG2b 孔的OD450 nm值最高,而在轻链的鉴定孔中kappa 孔的OD450 nm值最高(图7),由此可以看出1A12C5 单抗属于IgG2b 重链、κ 轻链型.
用IBV、NDV、IBDV病毒液和阴性尿囊液包被96孔酶标板,间接ELISA鉴定所得1A12C5单抗特异性获得的单抗只对IBV具有特异性,和NDV、IBDV和阴性尿囊液无交叉反应(图8).

图7 1A12C5单抗亚型鉴定Fig.7 Identification of 1A12C5 mAb subtype
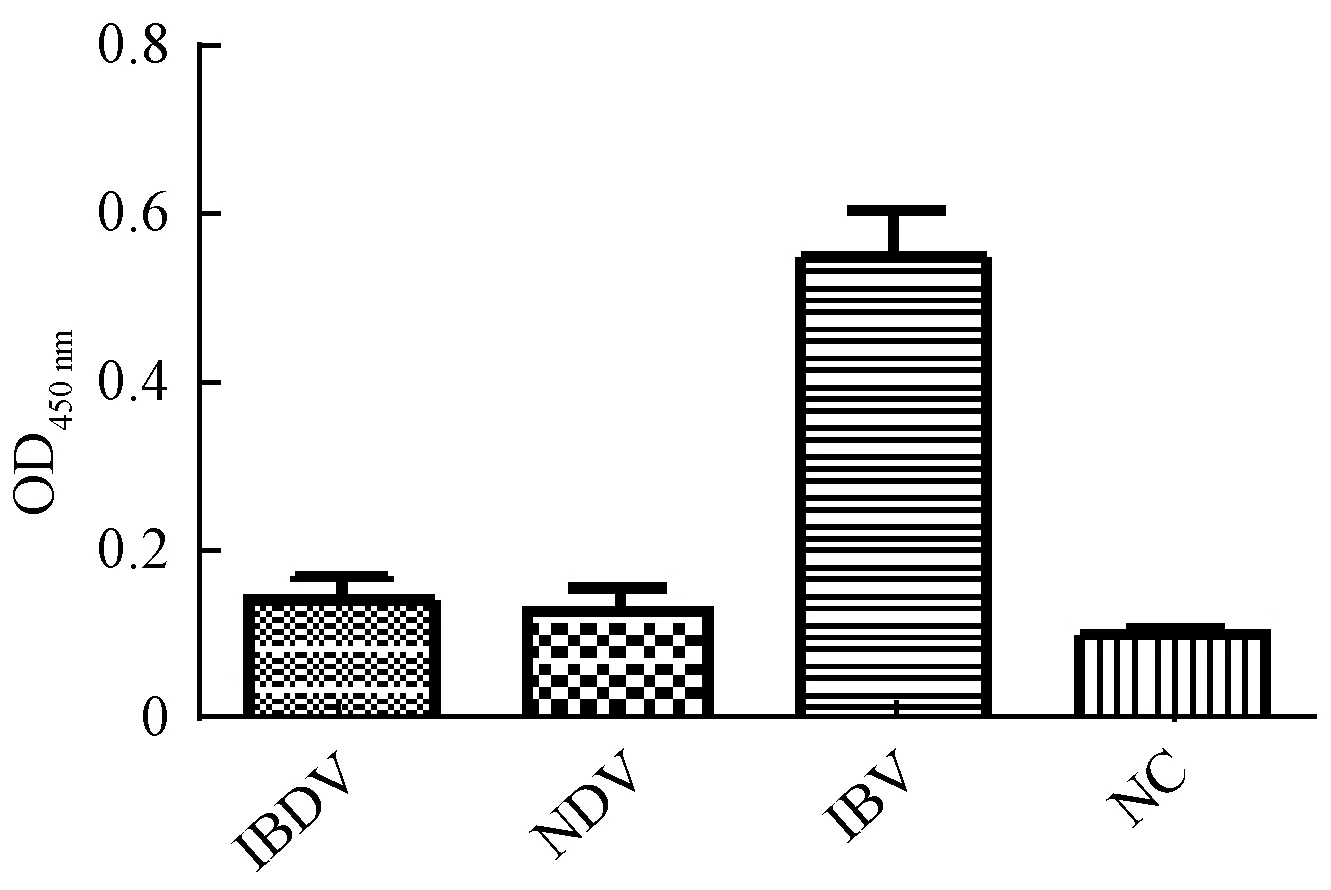
图8 1A12C5单抗特异性鉴定Fig.8 Specific identification of 1A12C5 mAb
分别用H120、M41、LDT3-A接种的尿囊液进行Western-blot分析.1A12C5单抗能与不同清型的IBV结合(图9).
根据亲和常数计算公式可以得出1A12C5单抗的亲和常数Ka为1.87×107L/mol.通常,亲和常数在107~1012L/mol范围之间表明抗体亲和力较高,1A12C5单克隆抗体具备较高亲和力.
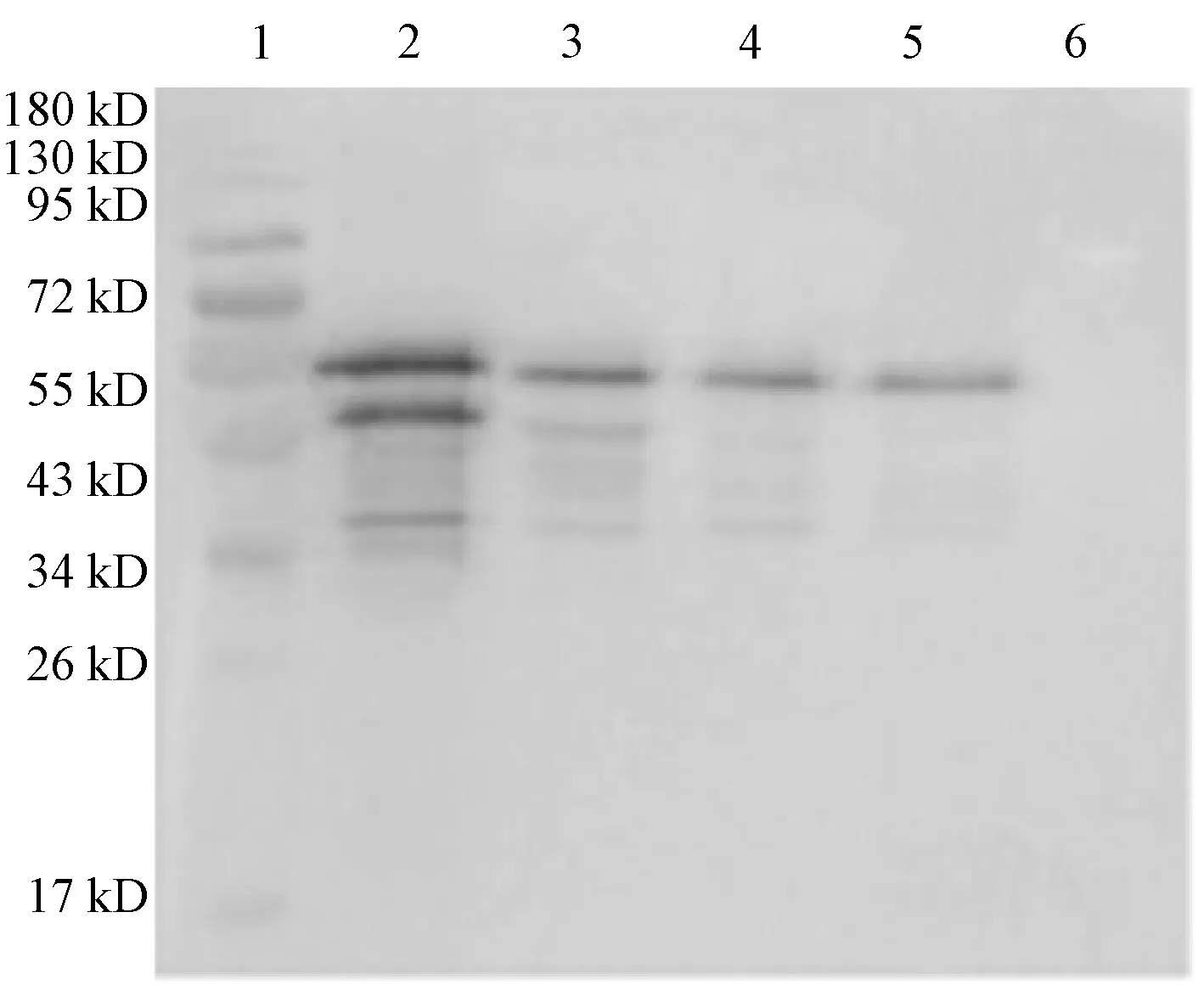
1:Marker;2:N蛋白;3:H120;4:M41;5:LDT3-A;6:NC图9 1A12C5单抗与不同IBV毒株的反应的Western-blot分析Fig.9 Western-blot analysis of the reaction between 1A12C5 mAb and different IBV strains
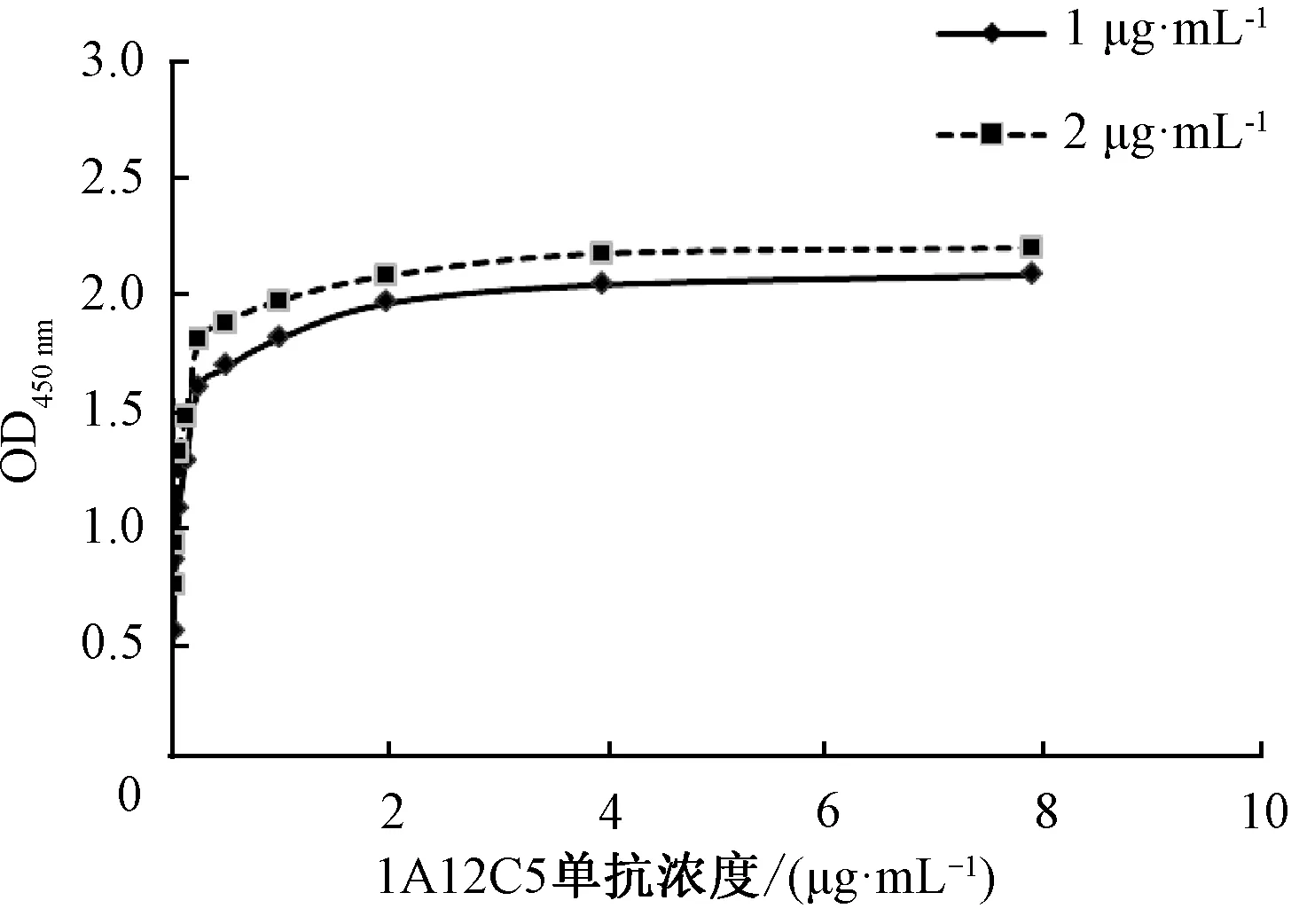
图10 1A12C5单抗亲和常数分析Fig.10 Affinity analysis of 1A12C5 mAb
3 讨论
根据IBV H120毒株的氨基酸序列可知,N蛋白约为52 kD,pGEX-6p-1本身的融合蛋白GST大小约27 kD,因此重组蛋白分子量为79 kD.在进行SDS-PAGE鉴定时,结果显示表达产物有两种:一种蛋白表达量较高,片段较大,为主要产物;另一种表达量较低,片段较短,是附带产物.在文献[4-6]的报道中出现类似现象,可能是目的蛋白在受电荷影响最大的地方发生断裂所致,可能是融合蛋白的基因编码出错的产物.在IBV、火鸡冠状病毒、小鼠肝炎病毒及副粘病毒中已报道这一类似的现象[7-9].Western-blot分析结果表明两种主要表达蛋白均具有抗原性.
可靠的筛选方法在制备单抗过程中起着关键作用.在细胞融合之前必须建立好合适的筛选方法,避免因为竞争性抑制导致丢失所需的杂交瘤细胞株.本实验利用间接ELISA法,含IBV的尿囊液和纯化后的N蛋白分别作为包被原进行双筛选.在整个实验中,为保证实验条件的一致性,检测使用的抗原包被量和阳性、阴性血清的稀释度均保持一致,同时选择SP2/0细胞上清作为阴性对照,获得了13株能稳定分泌抗IBV N蛋白抗体的杂交瘤细胞株,其中8株能与IBV结合.
N蛋白是IBV的主要结构蛋白之一,在遗传进化中最为保守,不同毒株间同源性最高,病毒感染过程中表达量最大,它与病毒的组装和机体细胞免疫等方面有重要相关性[10].N蛋白可作为抗原进行血清学检测,可以检测各种血清型的抗体,不存在病原检测中范围狭窄的问题.N蛋白可在宿主体内产生高水平的抗体[11],其诱导机体分泌特异性抗体的时间以及免疫原性都优于IBV的其他蛋白.
Koch研究报道针对IBV N蛋白的单抗具备病毒中和活性.病毒液及组织中有未加工成熟的N蛋白,也可通过特殊处理使病毒内部完全暴露,增强检测效果.研制针对IBV N蛋白的单抗可以与IBV通过抗原抗体发生特异性结合,对于IBV的预防、诊断以及控制有重要的意义.

