一种快速检测岷江百合总RNA样本中基因组DNA残留的方法
杜文凯 袁素霞 胡凤荣
(1. 南京林业大学风景园林学院,南京 210037;2. 中国农业科学院蔬菜花卉研究所,北京 100081)
百合(Liliumspp.)为我国栽培历史悠久的药、食、赏多用途植物,世界五大鲜切花之一。随着现代分子生物学的不断发展,百合花色[1]、花香[2]、发育[3]及抗性[4]等相关基因的研究都取得了较大进展,为今后百合分子育种奠定了良好基础[5]。
前人对百合基因功能研究中,基因表达分析占据了重要地位[6]。实时荧光定量PCR(Real-time quantitative PCR,qRT-PCR)是一种快速检测基因表达量的方法,因其具有高通量、高灵敏和实时检测等特点,目前被广泛应用于植物基因表达水平研究中[7-8]。尽管qRT-PCR操作简单,但qRT-PCR的准确性却受多方面因素影响,如引物特异性、反应体系和RNA质量等[9-12]。RNA样本中基因组DNA残留对后期基因表达分析的准确性具有很大影响,残留的基因组DNA一方面会影响RNA浓度的精确定量;另一方面,残留的DNA也会影响qRT-PCR扩增效率[13]。目前,常采用设计跨内含子引物的方法来避免基因组DNA残留对供试基因表达结果的影响[14-16]。但是很多物种的基因组测序尚未开展,很难将所有待研究基因的引物都设计为跨内含子引物[17]。因此,为了保证qRT-PCR结果的准确性,获得高质量且无基因组DNA残留的总RNA样本是非常必要的。
目前,市面上RNA提取试剂盒和第一链cDNA合成试剂盒种类繁多。虽然大部分RNA提取试剂盒中都包含有DNA去除步骤,但DNA是否去除干净无法得知。此外,为了避免总RNA样本中有残留的基因组DNA污染,部分第一链cDNA合成试剂盒中也加入了基因组DNA去除步骤,但cDNA质量无法预知。因此,为了检测总RNA和cDNA样本中基因组DNA残留是否去除干净,本研究从前期得到的转录组数据(尚未发表)中筛选了1个高度保守的持家基因TIP41-like,拟针对其内含子序列设计引物,以期可简便快捷的检测百合总RNA以及cDNA样本中有无基因组DNA残留,为后续相关基因表达分析的准确性奠定基础。
1 材料和方法
1.1 材料
1.1.1 供试材料 供试材料为岷江百合(Lilium regale)组织培养植株,保存于中国农业科学院蔬菜花卉研究所组培室。随机选取6株生长发育一致的组培苗,分别取其叶片,经液氮速冻后,于-80℃冰箱保存备用。
1.1.2 试剂 选择3种不同公司生产的RNA提取试剂盒(分别标记为A、B、C,均含有基因组DNA去除步骤)用于提取岷江百合叶片RNA。采用2种不同公司品牌的第一链cDNA合成试剂盒(分别标记为Ⅰ、Ⅱ;Ⅰ不含有基因组DNA去除步骤,Ⅱ含有基因组DNA去除步骤)用于合成cDNA。
1.2 方法
1.2.1 含内含子的DNA序列扩增 从岷江百合转录组数据(尚未公布)中获得了持家基因TIP41-like的一段mRNA序列,利用DNAMAN 5.0软件将其序列与NCBI数据库中所有物种的TIP41-like基因组序列进行比对,推测该岷江百合TIP41-like部分序列对应的基因组DNA序列中含有2个内含子,并使用Primer Premier 5.0软件根据此段序列设计DNA扩增产物中含2个内含子的引物 :F:5′-CCGAAAATCAGGGTAGGGTG-3′及 R :5′-CGAAGCCAGAAACGGAGAAGA-3′。引物由上海生工生物公司合成。
以岷江百合叶片DNA为模板进行PCR扩增,PCR 反应体系20 μL :模版DNA 2 μL,PCR Forward Primer 0.5 μL,PCR Reverse Primer 0.5 μL,2×Taq PCR Magic Mix 10 μL,ddH2O 7 μL。
PCR反应程序为:94℃预变性3 min;94℃变性30秒,58℃退火30 s,72℃延伸1 min,循环35次;72℃延伸5 min。反应结束后,取6 μL产物用2%琼脂糖凝胶电泳并观察拍照。
1.2.2 基因组DNA残留检测引物设计 将含内含子序列的DNA扩增产物送至上海生工生物公司测序,利用DNAMAN 5.0软件对所得到的序列进行核酸拼接;将拼接好的序列与TIP41-like转录组mRNA序列进行比对,寻找出内含子序列。根据所获得的TIP41-like内含子序列,利用Primer Premier 5.0软件设计基因组DNA残留检测引物,引物设计时应保证引物其中任意一端序列全部落在内含子序列上,引物设计完成后由上海生工生物公司合成。以岷江百合叶片DNA为模板进行PCR扩增,反应体系参照1.2.1。反应结束后,取6 μL产物用2%琼脂糖凝胶电泳并观察拍照。
1.2.3 RNA样本中基因组DNA残留检测 通过1.2%琼脂糖凝胶电泳对三种不同RNA提取试剂盒提取的岷江百合叶片的总RNA样本进行检测,利用Quawell Q3000超微量紫外分光光度计检测总RNA的质量和浓度。
以3种不同RNA试剂盒提取的岷江百合叶片总RNA为模板,使用基因组DNA残留检测引物进行PCR扩增,PCR反应体系20 μL:模版RNA 2 μL,PCR Forward Primer 0.5 μL,PCR Reverse Primer 0.5μL,2×Taq PCR Magic Mix 10 μL,ddH2O 7 μL。
PCR反应程序为:94℃预变性3 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,循环35次;72℃延伸5 min。反应结束后,取6 μL产物用2%琼脂糖凝胶电泳,并观察拍照。
1.2.4 cDNA中基因组DNA残留检测 以两种不同公司品牌的第一链cDNA合成试剂盒对3种RNA提取试剂盒提取的18个RNA样本分别进行第一链cDNA合成。以获得的cDNA为模板,分别使用基因组DNA残留检测引物进行PCR扩增,反应体系参照1.3.3。反应结束后,取6 μL产物用2%琼脂糖凝胶电泳并观察拍照。
2 结果
2.1 含内含子的DNA序列扩增及序列比对
以DNA为模板,使用扩增产物中含内含子的引物(F/R)进行PCR扩增,获得了条带单一的目的片段(图1)。将此DNA扩增产物送上海生工生物公司测序,得到了片段大小为367 bp的碱基序列。利用DNAMAN 5.0软件将测序获得的DNA产物片段与转录组mRNA序列进行比对发现,此DNA扩增产物共有2段内含子序列(图2)。
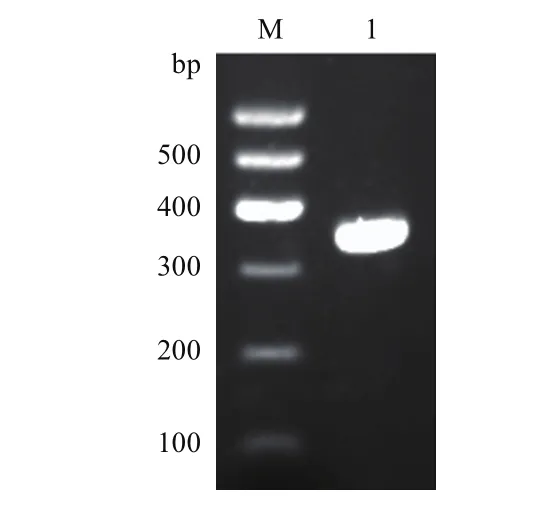
图1 岷江百合TIP41-like含内含子DNA片段扩增结果

图2 TIP41-like含内含子DNA片段和对应的mRNA片段序列比对结果
2.2 基因组DNA残留检测引物设计
根据2.1比对结果,设计了一对基因组DNA残留检测引物 :LDRG-F:5′-CTCTTTTATGACGAGGTTGGTA-3′及 LDRG-R :5′-CAGGGAAATCGGTCAGTGTT-3′。其中LDRG-R引物全部落在内含子序列上(图 2)。
岷江百合叶片DNA为模板,对设计的基因组DNA残留检测引物(LDRG-F/LDRG-R)进行PCR扩增验证,获得了条带单一与预期产物长度(182 bp)结果相一致的扩增片段(图3)。
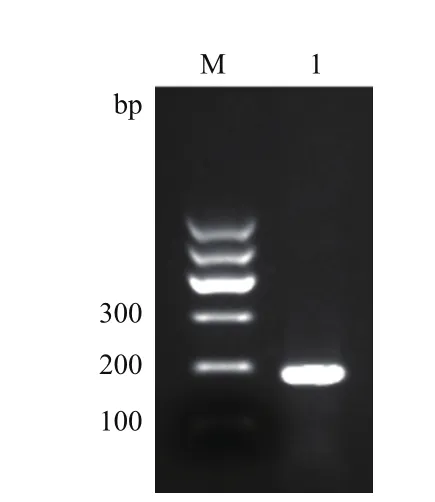
图3 岷江百合基因组DNA残留检测片段扩增结果
2.3 RNA样本检测
三种RNA提取试剂盒提取的总RNA经1.2%琼脂糖凝胶电泳检测,结果(图4)显示,28S和18S rRNA条带清晰,无杂带和弥散现象。经Quawell Q3000检测,OD260/280在1.8-2.1范围内,表明提取的RNA完整性好,无蛋白质污染。
使用基因组DNA残留检测引物(LDRGF/LDRG-R)对提取的总RNA进行检测,结果(图5)显示,使用试剂盒A和B提取的12个总RNA样本中均能扩增出条带,且条带清晰,表明总RNA样本中含有较高浓度的DNA残留。使用试剂盒C提取的总RNA样本中未能扩增出条带,表明此总RNA样本中无基因组DNA残留。
2.4 cDNA样本中基因组DNA残留检测
利用第一链cDNA合成试剂盒Ⅰ、Ⅱ对三种RNA提取试剂盒提取的总RNA样本分别进行反转录,使用基因组DNA残留检测引物(LDRGF/LDRG-R)对获得的cDNA样本进行检测,结果(图6)表明:两种cDNA合成试剂盒合成的cDNA 样本中A1-A6和B1-B6均能扩增出目的片段,C1-C6无法扩增出目的条带,表明两种cDNA合成试剂盒均无法去除RNA样本中残留的基因组DNA。
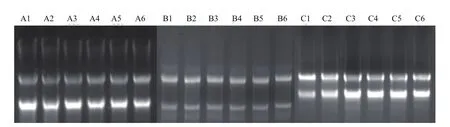
图4 三种不同RNA提取试剂盒提取的岷江百合叶片总RNA电泳检测结果
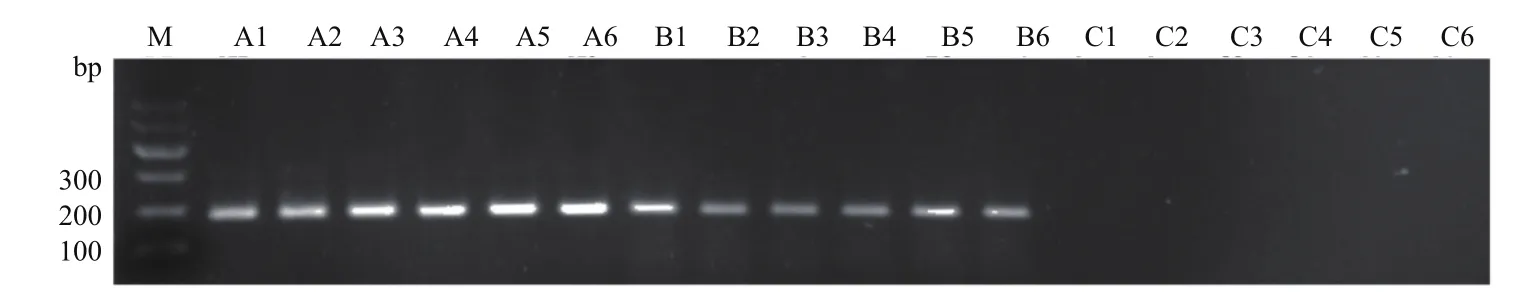
图5 总RNA样本中基因组DNA残留检测片段扩增结果
3 讨论
RNA质量是影响qRT-PCR准确性的关键因素之一[18-21],本课题组在前期qRT-PCR实验中发现,待测基因的相对表达量不稳定,推测总RNA样本可能存在基因组DNA残留,因此,建立一种快速高效地检测总RNA样本中基因组DNA残留的方法具有重要的实践意义。本实验在前期得到的转录组数据中挖掘了一个持家基因TIP41-like,根据其部分内含子序列设计了一对基因组DNA残留检测引物,用于检测总RNA和cDNA样本中的基因组DNA残留。
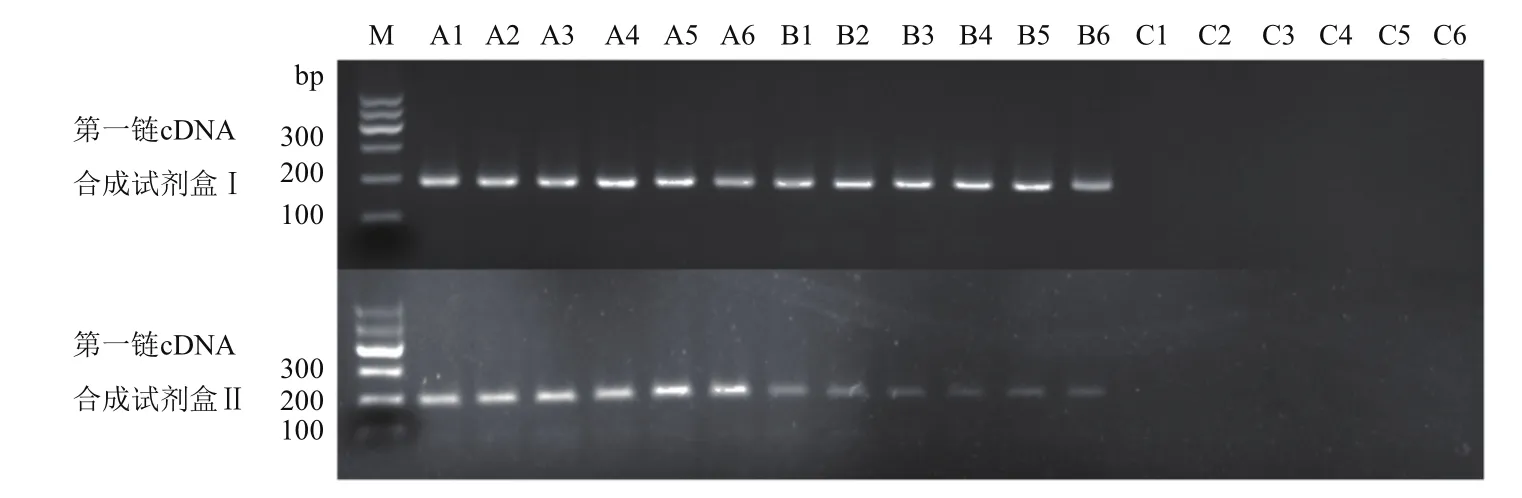
图6 cDNA样本中基因组DNA残留检测片段扩增结果
基因组DNA残留是抑制后续实验中反转录和实时荧光定量PCR反应的重要因素[22-23]。目前RNA提取过程中去除基因组DNA最常用的方法就是加入DNase Ⅰ消化[24]。本研究采用了3种不同公司生产的RNA提取试剂盒对岷江百合组培苗叶片进行了总RNA提取,通过RNA凝胶电泳和纯度检测无法得知总RNA样本中基因组DNA是否去除干净(图4)。但使用基因组DNA残留检测引物(LDRG-F/LDRG-R)对总RNA样本进行扩增后发现,尽管3种试剂盒提取过程中均含有DNA去除步骤,但是RNA质量差异较大,总RNA提取试剂盒A、B提取的RNA样本均存在严重的基因组DNA污染,而试剂盒C提取的总RNA样本无基因组DNA残留(图5)。
此外,部分试剂公司为了避免总RNA样本中残留基因组DNA,第一链cDNA合成试剂盒中增加了基因组DNA去除步骤。在本试验中,尽管第一链cDNA合成试剂盒Ⅰ中含有基因组DNA去除步骤,但还是无法去除总RNA样本残留的基因组DNA(图 6)。
目前,很多研究都是将获得的总RNA和cDNA样本直接用于后续试验[25-26],尽管市面上大多数RNA提取试剂盒和部分第一链cDNA合成试剂盒中都加入了基因组DNA去除步骤,但获得的总RNA和cDNA样本质量无法预知,因此,为了保证qRTPCR实验的准确性,必须对提取的总RNA及cDNA样本进行基因组DNA残留检测,这一点应该引起从事类似科学研究者的重视。本研究依据持家基因TIP41-like部分内含子序列设计的基因组DNA残留检测引物,可快速检测岷江百合总RNA以及cDNA样本中有无基因组DNA残留,以确保后续待测基因表达分析的准确性,并为其他百合材料以及其他物种相关研究提供参考。
4 结论
依据转录组中持家基因TIP41-like的部分内含子序列设计了1对基因组DNA残留检测引物:LDRG-F :5′-CTCTTTTATGACGAGGTTGGTA-3′及LDRG-R :5′-CAGGGAAATCGGTCAGTGTT-3′,能够快速检测总RNA样本中的基因组DNA残留。

