盐胁迫对4种园林植物荧光特性的影响
佘汉基, 张潮, 薛立,*, 邝雷, 郑欣颖, 谢腾芳
盐胁迫对4种园林植物荧光特性的影响
佘汉基1, 张潮2, 薛立1,*, 邝雷2, 郑欣颖1, 谢腾芳2
1. 华南农业大学林学与风景园林学院, 广州 510642 2. 广州普邦园林股份有限公司, 广州 510600
利用NaCl模拟不同强度的盐胁迫条件, 对大红花、龙船花、朱蕉和花叶假连翘幼苗进行30天胁迫处理, 测定其荧光动力学参数, 并用主成分方法评定了其抗盐能力, 以探讨4种幼苗对盐胁迫的生理响应特点, 为耐盐园林植物的选育提供依据。研究表明, 随着盐胁迫的时间的延长, 0.3 %盐浓度胁迫的大红花、龙船花、花叶假连翘幼苗叶片的v/m不断下降, 而朱蕉幼苗叶片的v/m先降后升, 0.6 %盐浓度胁迫的4种幼苗叶片的v/m均不断下降; 在0.3%和0.6 %盐浓度胁迫下, 4种幼苗叶片的()、和随着胁迫时间的延长均不断下降。主成分分析表明, 0.3%和0.6 %盐浓度胁迫的4种幼苗荧光指标得分均为朱蕉>龙船花>花叶假连翘>大红花。
园林植株; 盐胁迫; 荧光指标; 主成分分析
1 前言
土壤盐渍化危害植物生长、造成土壤荒漠化和恶化生态环境, 是人类面临的世界性难题。世界有10%以上的陆地面积受盐渍化的影响[1]。我国耕地中盐碱地约占15%[2], 其中滨海地带和岛屿沿岸沿海长达1.8×104km, 分布着各种滨海盐土[3], 植物种类少, 覆盖率低, 景观效果不佳。随着人们生活水平的提高, 滨海旅游区的发展方兴未艾。因此筛选和种植适宜滨海盐土生长的园林植物, 可以丰富滨海景观, 改善生态环境。
盐胁迫破坏胞内离子平衡[4–5], 抑制光合作用, 而叶绿素荧光参数的变化能反映与环境的关系[6]和环境胁迫对光系统域的损伤程度[7], 可以用于评价环境胁迫的影响[8]。目前植物抗盐荧光生理的研究集中于棉花(L.)[9]、高粱(Pers.)[10]、水稻()[11]、亚麻()[12]、金银花(Thunb.)[13]等农作物, 麻栎()[3]、台湾桤木()[14]、朴树()和白榆(L.)[15]、鸡爪槭()[16]、杨树(L.)[17], 枳椇()和皂荚()[18]等乔木树种, 以及山葡萄(Rupr.)[19]和葡萄(L.)[20]等木质藤本方面, 罕见盐胁迫影响园林植物荧光生理的研究。大红花()、龙船花()、朱蕉()和花叶假连翘()是热带、亚热带地区的重要的园林绿化灌木植物, 常种植于海滨沙地, 当土壤含盐量较高时会影响植物的水势、矿物质吸收和光合作用等主要过程,最终抑制植物器官的生长[21]。目前尽管对这些植物的抗盐生理[22]、叶片和土壤的养分特性[23]有过一定的研究, 尚未见到有关其荧光特性研究。本研究人工模拟干盐胁迫环境, 测定其荧光特性变化, 通过研究其抗盐特性, 为海滨绿化的选择提供参考。
2 材料与方法
2.1 试验材料
本试验地选择广州市天河区华南农业大学林学与风景园林学院进行, 试验所用的大红花、龙船花、朱蕉、花叶假连翘4 种苗木均来自广州市普邦园林公司的1 年生实生苗。2015年5 月底, 将新进幼苗移栽进规格为直径20 cm、高30 cm的盆内, 每盆定植一株。土壤为黄心土、荷兰土, 以3:1的比例混合。实验开始时4 种幼苗的基本概况如表1。
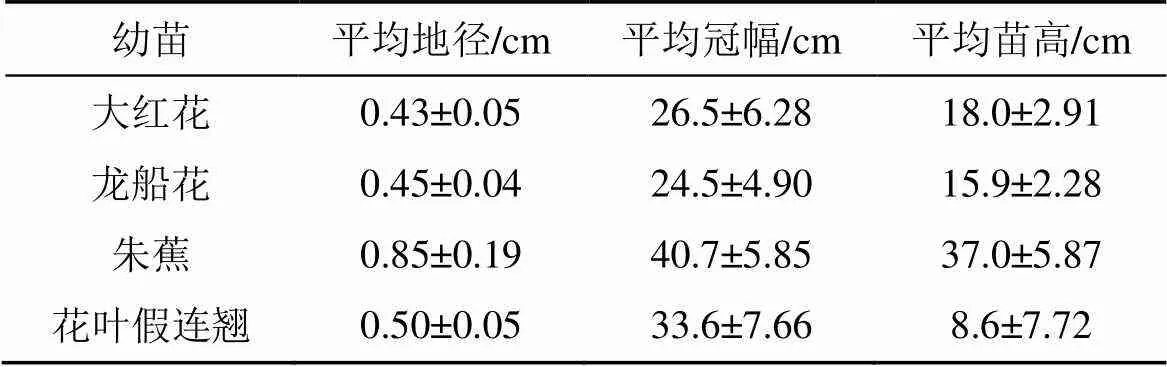
表1 4种幼苗的基本情况(平均值±标准差)
2.2 试验方法
盐分浓度参考冯蕾等[18]的NaCl溶液加入法, 梯度法设置3 个盐浓度: 对照(CK)、0.3%和0.6%(NaCl浓度为盐分和土壤干质量之比, 即NaCl浓度=NaCl质量(g)/盆土干质量(g)×100%), 每个处理50 个重复。为保证处理盆中盐分不流失, 盆下各放置一个塑料托盘。试验开始时, 经称重控水, 使各盆中土壤含水量约为田间最大持水量的70%, 以利于实验盐分在土壤中充分扩散。待植株恢复正常生长后, 将不同浓度NaCl溶解于等体积水后施入各盆中以达到预定土壤含盐量, 对照浇等体积的水。每天各盆浇等量水1 次, 以平衡蒸发量, 将盘内渗出水分及时返还处理盆中, 以确保盆中的盐总量。
每种幼苗选取5 株苗, 在从上到下的第3 位至第8 位完全展开的成熟叶中选3 枚叶片挂牌标记。试验开始0 d、15 d、30 d测定叶片的荧光参数。采用脉冲调制荧光仪OS-1P调制荧光仪测定室温下荧光动力学参数, 将挂牌标记叶片暗适应20 min后, 选择非化学淬灭()模式, 设定每次测量时间为3 min, 重复3 次, 测定叶片暗适应下的光系统Ⅱ初始荧光(o)等指标, 计算出最大光化学效率(v/m)、非光化学淬灭()、实际光量子效率()、表观光合电子传递速率()等指标。
2.3 数据分析
数据统计分析和作图由Microsoft Excel、SAS 8.1软件系统完成, 试验结果采用主成分分析方法进行综合评定, 主成分累计贡献率达85%以上来确定主成分个数[24]。
进行主成分分析分析前, 用极差法对各荧光指标数值进行标准化, 标准化公式如下[25-26]:
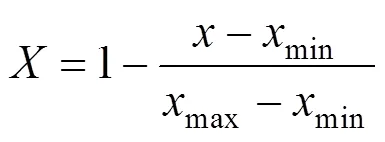
公式中,为标准化后所得数据,为某项指标的原始数据,min为某项指标原始数据的最小值,max为某项指标原始数据的最大值。
3 结果与分析
3.1 初始荧光
初始荧光Fo是光系统Ⅱ(PS Ⅱ)反应中心处于完全开放时的荧光产量, 它与叶片叶绿素浓度有关。0.3%和0.6%盐浓度胁迫下, 随着胁迫时间的延长, 大红花、龙船花、朱蕉和花叶假连翘幼苗叶片的o持续上升, 30 d时0.3%盐浓度胁迫的分别比0 d上升了73%、106%、88%和115%(图1), 0.6%盐浓度胁迫的分别比0 d上升了71%、55%、90%和115 %(图2)。
3.2 PSII最大光化学效率
PSII最大光化学效率(v/m)反映PSⅡ原初最大光能利用效率。0.3%盐浓度胁迫下, 随着胁迫时间的延长, 大红花、龙船花、花叶假连翘幼苗叶片的v/m不断下降, 而朱蕉幼苗叶片的v/m先降后升, 30 d时分别比0 d下降了31%、38%、28%和30%(图3); 在0.6%盐浓度胁迫下, 4 种幼苗叶片的v/m均不断下降, 30 d时, 大红花、龙船花、朱蕉、花叶假连翘幼苗的v/m分别比0 d下降了39%、46%、39%和39%(图4)。v/m的下降表明盐胁迫下植物的PSⅡ的潜在活性和原初光能转换效率减弱, 发生了光合作用的光抑制。
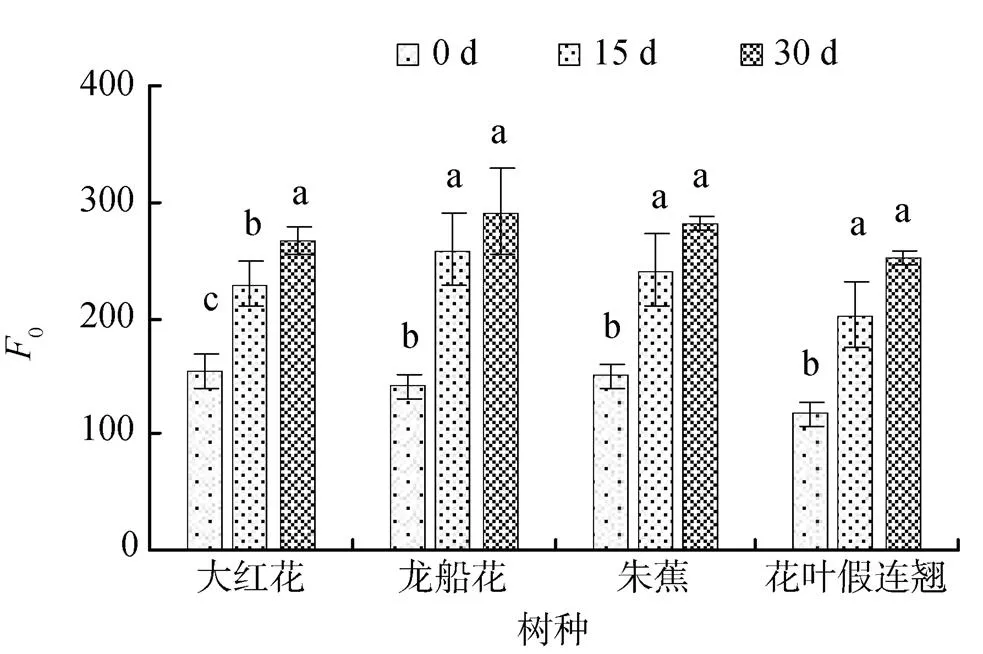
图1 0.3%盐胁迫对四种园林植物初始荧光的影响

图2 0.6%盐胁迫对四种园林植物初始荧光的影响
3.3 PSII实际光量子产量
()表示植物光合作用下PSII实际光化学量子产额, 反映植物PSII反映中心在部分关闭情况下的实际原始光能捕获效率。盐浓度胁迫下, 4 种幼苗叶片的()随着胁迫时间的延长不断下降(图5和6)。30 d时, 0.3%盐浓度胁迫的大红花、龙船花、朱蕉和花叶假连翘幼苗叶片的()分别比0 d下降了36%、27%、18%和41%, 0.6%盐浓度胁迫的分别比0 d下降了54%、55%、25%和51%。()的下降表明植物的光合受阻, 环境因子的胁迫导致氧释放能力降低。
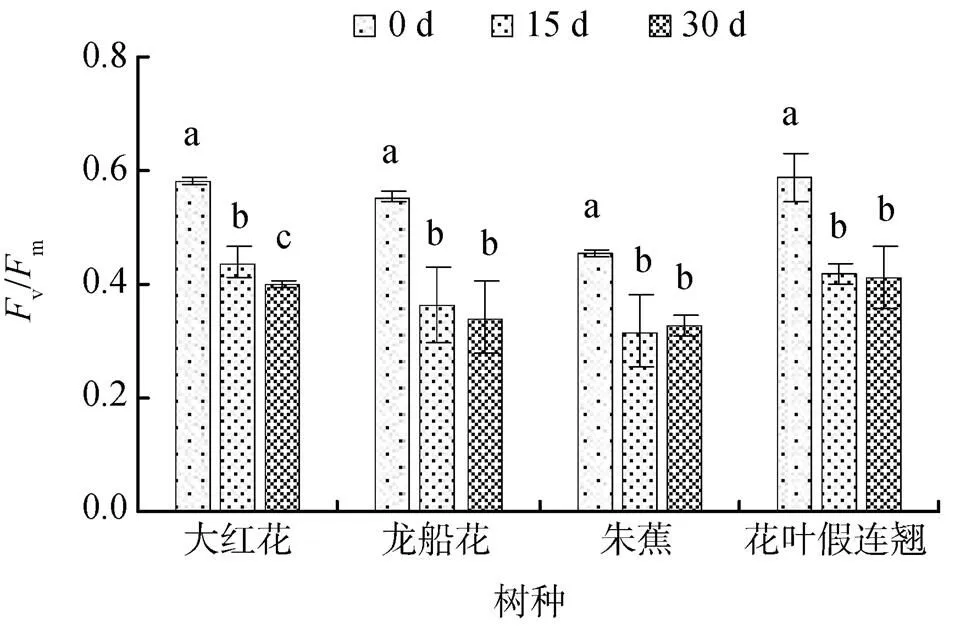
图3 0.3%盐胁迫对四种园林植物PSII最大光化学效率的影响
Fig. 3 Effect of 0.3% salt stress onv/mof garden plant of four species
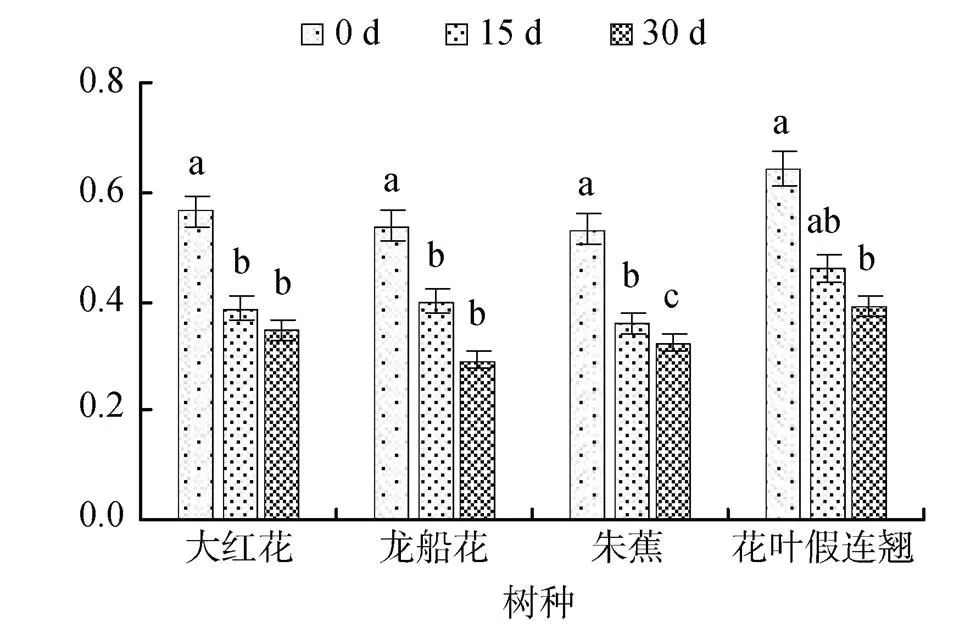
图4 0.6%盐胁迫对四种园林植物PSII最大光化学效率的影响

图5 0.3%盐胁迫对四种园林植物PSII实际量子的影响
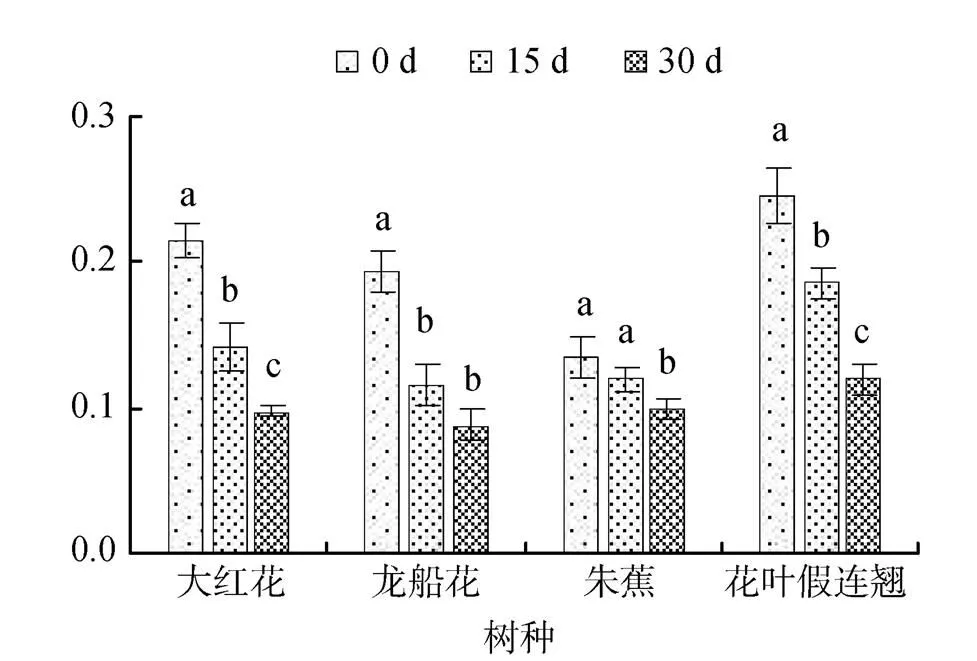
图6 0.6%盐胁迫对四种园林植物PSII实际光化学量子的影响
3.4 光合电子传递速率
光合电子传递速率()表示实际光强条件下的表观电子传递效率, 反映植物光合能力的有效参数。随着胁迫时间的延长, 0.3%和0.6%盐浓度胁迫下, 4 种幼苗叶片的不断下降(图7与8)。30 d时, 0.3%盐浓度胁迫的大红花、龙船花、朱蕉和花叶假连翘幼苗叶片的分别比0 d下降了36%、27%、10%和41%, 0.6%盐浓度胁迫的分别比0 d下降了55%、55%、14%和37%。的下降表明植物PSII反应中心的电子捕获能力易降低, 阻碍PSII的光化学活性, 抑制植物的PSII原初光能转化率和PSII实际光能转化率。
3.5 非光化学淬灭
非光化学淬灭()反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分, 是表示的热耗散多少的指标。盐胁迫的4 种幼苗叶片的随着胁迫时间的延长而不断下降(图9和10)。30 d时, 0.3%盐浓度胁迫的大红花、龙船花、朱蕉和花叶假连翘幼苗叶片的分别比0 d下降了48%、45%、41%和56%, 0.6%盐浓度胁迫的分别比0 d下降了17%、21%、5%和62%。

图7 0.3%盐胁迫对园林植物光合电子传递速率的影响
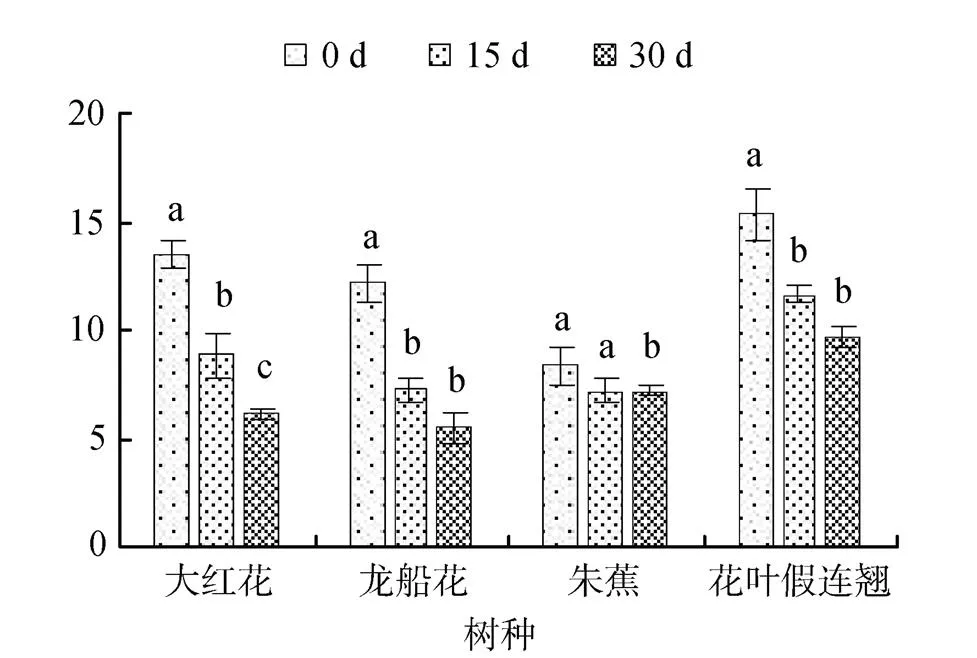
图8 0.6%盐胁迫对园林植物光合电子传递速率的影响
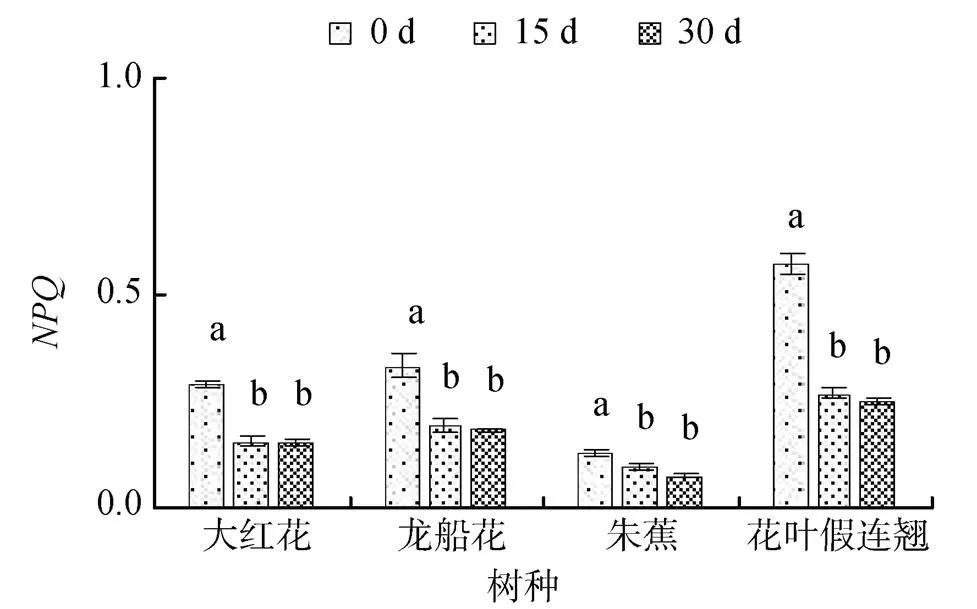
图9 0.3%盐胁迫对4中园林植物非光化学淬灭的影响
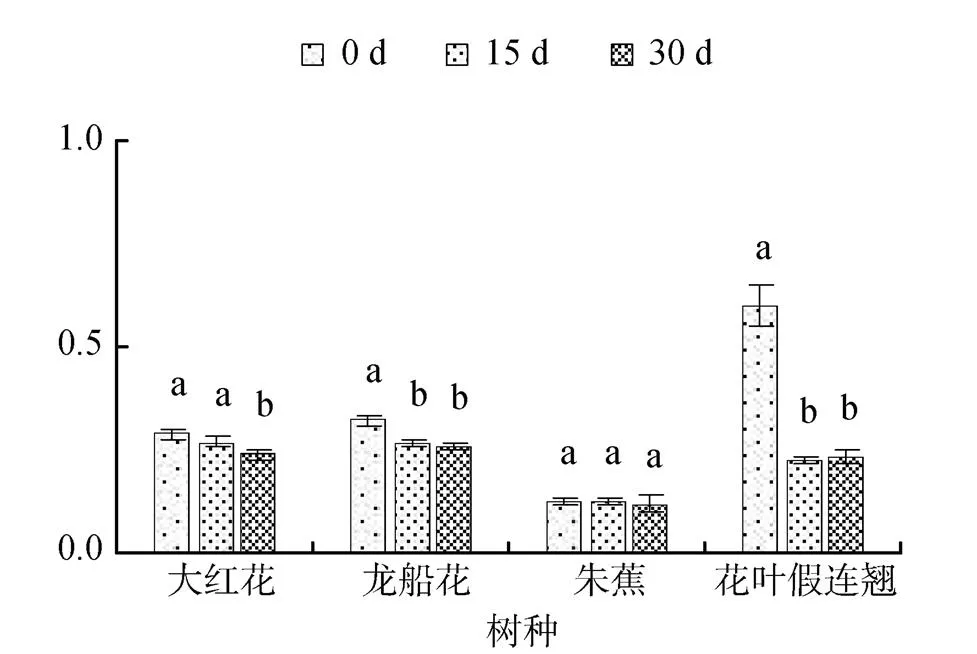
图10 0.6%盐胁迫对四种园林植物非光化学淬灭的影响

表2 0.3 %盐浓度的胁迫下植物抗盐性的综合评定结果
3.6 植物抗盐性综合评价
根据6 项荧光指标m、、、、o、v/m进行主成分分析, 结果表明, 在0.3%盐浓度胁迫下, 4 种植株幼苗的荧光指标抗盐性强弱顺序为朱蕉>龙船花>花叶假连翘>大红花(表2)。
由表3可知, 在0.6%盐浓度胁迫下, 4 种植株幼苗的荧光指标抗盐性强弱顺序为朱蕉>龙船花>花叶假连翘>大红花。
4 结论与讨论
叶绿素荧光参数可以反映植物的光合作用效率、光合作用反应中心开放程度和植物的热耗散情况。o可以用来衡量PSⅡ的稳定性,o降低表明PSⅡ天线色素的热耗散增加, 而o的增加表明PSⅡ反应中心的破坏或可逆失活[27]。盐碱胁迫导致4 个树种苗木的o不断增加, 说明盐胁迫可能破坏了其PSⅡ反应中心或可逆失活。
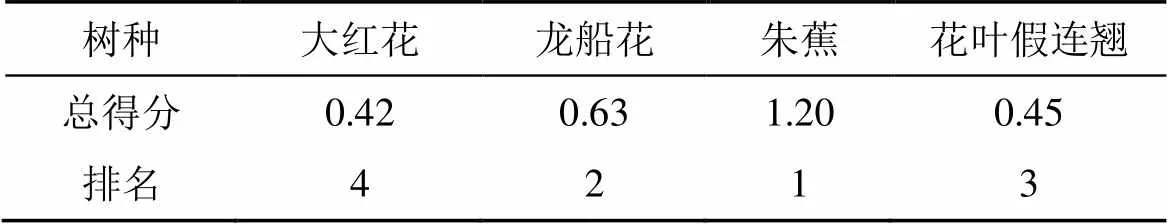
表3 0.6 %盐浓度的胁迫下植物抗盐性的综合评定结果
PSII的最大光化学效率(v/m)是暗适应下PSII的最大量子产量, 能反映植物对光能的利用效率[20]。本研究表明, 0.3%和0.6%盐胁迫下各植物的v/m随着盐胁迫时间的延长均持续下降, 说明盐胁迫使PSII受到了伤害, PSII的潜在活性和原初光能转换效率减弱, 植物发生了光抑制。
实际光化学量子效率常用来表示植物光合作用下PSII总的光化学量子产额, 它反映PS域反应中心在部分关闭情况下的实际原初光能捕获效率[28]。本研究中, 0.3%和0.6%盐胁迫的4 种植物的下降, 表明实际光化学转化效率的下降, 阻止了植物同化力( NADPH、ATP) 的形成, 影响了植物对碳的固定和同化。
是反映实际光强下的表观电子传递速率, 同时也是表示植物光合能力大小的有效参数, 反映了PSII反应中心的电子捕获效率[29,30]。本研究中, 盐胁迫的4 种幼苗均呈下降趋势, 表明捕光蛋白复合体被抑制, 使得电子传递受阻, 光能转化效率降低[31]。原因可能是盐胁迫导致类囊体膜的流动性减小, 从而导致类囊体膜上的反应中心、捕光天线、电子传递体等蛋白的结构或构象发生变化, 最终对PSII的功能造抑制[28]。
非光化学淬灭()反映的是植物PSII吸收的光能中不能用于光合电子传递而以热的形式耗散掉的光能部分[26]。逆境环境下用于光化学反应的光能部分显著减少, 从而形成过剩光能。当大量过剩光能不能及时用于光化学反应时, 就能形成光抑制现象。植物可以通过热耗散消耗过剩光能而避免损伤光和器官[32], 是植物的一种自我保护机制, 对光合机构起一定的保护作用[33]。本研究中, 盐胁迫下4 种幼苗的呈现下降趋势, 可能是由于盐胁迫抑制叶黄素循环的关键酶活性, 影响了叶黄素循环[34], 结果削弱了PSII天线热耗散的保护能力, 不利于其热耗散[28]。
本研究中, 盐胁迫导致反映PSII电子传递能力有关的荧光参数均显著下降, 这表明低温引起捕光天线和反应中心结构的变化, PSII的电子传递严重受阻并受到光抑制[35]。4 种幼苗的下降, 表明实际光化学转化效率的下降, 阻止了植物同化力( NADPH、ATP) 的形成, 影响了植物对碳的固定和同化[36]。由于的下降又不能有效启动非辐射热能量耗散机制, 最终造成植物对光能的利用效率的显著下降(v/m降低)。4 种幼苗中, 朱蕉的v/m、、和的降幅较另外3 种幼苗少, 表明其在盐胁迫保持较快的光合电子传递速率, 反应中心实际进行光化学反应的效率比另外3 种幼苗高, 避免光合速率过度下降。4 种幼苗的NPQ均有所下降, 表明PSII天线热耗散的保护能力被显著削弱[35]。主成分分析得出在0.3%和0.6%盐浓度胁迫下, 4 种植株幼苗的荧光指标抗盐能力均为朱蕉>龙船花>花叶假连翘>大红花, 与4 种幼苗荧光参数的表现一致, 说明主成分分析是一种综合评价植物生理特性的有效方法。
[1] 吴敏, 薛立, 李燕. 植物盐胁迫适应机制研究进展[J]. 林业科学, 2007, 43(8): 111–117.
[2] 李彬, 王志春, 孙志高, 等. 中国盐碱地资源与可持续利用研究[J]. 干旱地区农业研究, 2005, 23(2): 152–158.
[3] 王标, 虞木奎, 海菁, 等. 盐胁迫对不同种源麻栎叶片光合特征的影响[J]. 应用生态学报, 2009, 20(8): 1817–1824.
[4] ZHANG Jinlin, Flowers T J, WANG Suomin. Mechanisms of sodium uptake by roots of higher plants[J]. Plant and Soil,2010, 326: 45–60.
[5] ZHANG Jinlin, SHI Huazhong. Physiological and molecular mechanisms of plant salt tolerance[J]. Photosynthesis Research, 2013, 115(1): 1–22.
[6] 张培, 郭俊杰, 谌红辉, 等. 西南桦24个无性系的幼苗叶绿素荧光特性[J]. 西北林学院学报, 2016, 31(2) : 126–129.
[7] 种培芳, 杨江山. 4种金色叶树木叶绿素荧光动力学参数对SO2胁迫的响应[J]. 西北林学院学报, 2013, 28(6): 14–19.
[8] 赵竑绯, 赵阳, 张驰, 等. 模拟淹水对杞柳生长和光合特性的影响[J]. 生态学报, 2013, 33(3): 898–906.
[9] 杨淑萍, 危常州, 梁永超. 盐胁迫对不同基因型海岛棉光合作用及荧光特性的影响[J]. 中国农业科学, 2010, 43(8): 1585–1593.
[10] 孙璐, 周宇飞, 李丰先, 等. 盐胁迫对高粱幼苗光合作用和荧光特性的影响[J]. 中国农业科学, 2012, 45(16): 3265–3272.
[11] 刘晓龙, 徐晨, 徐克章, 等. 盐胁迫对水稻叶片光合作用和叶绿素荧光特性的影响[J]. 作物杂志, 2014, (2): 88–92.
[12] 郭瑞, 李峰, 周际, 等. 亚麻响应盐、碱胁迫的生理特征[J]. 植物生态学报, 2016, 40(1): 69–79.
[13] 颜坤, 赵世杰, 徐化凌, 等. 盐胁迫对不同倍性金银花光合特性的影响[J]. 中国农业科学, 2015, 48(16): 3275–3286
[14] 张璐颖, 文笑, 林勇明, 等. 盐胁迫对台湾桤木幼苗光合作用和荧光特性的影响[J]. 福建林学院学报2013, 33(3): 193–199.
[15] 周丹丹, 刘德玺, 李存华, 等.盐胁迫对朴树和速生白榆幼苗光合特性及叶绿素荧光参数的影响[J]. 西北植物学报, 2016, 36(5): 1004–1011.
[16] 唐玲, 李倩中, 荣立苹, 等.盐胁迫对鸡爪槭幼苗生长及其叶绿素荧光参数的影响[J]. 西北植物学报, 2015, 35(10): 2050–2055.
[17] 武传兰, 隆小华, 金善钊, 等. 盐胁迫对不同品系杨树幼苗生长和叶绿素荧光的效应[J]. 生态学杂志, 2012, 31(6): 1347–1352.
[18] 冯蕾, 白志英, 路丙社, 等. 氯化钠胁迫对枳椇和皂荚生长、叶绿素荧光及活性氧代谢的影响[J]. 应用生态学报, 2008, 19(11): 2503–2508.
[19] 秦红艳, 艾军, 许培磊, 等. 盐胁迫对山葡萄叶绿素荧光参数及超微结构的影响[J]. 西北植物学报, 2013, 33(6): 1159–1164.
[20] 李学孚, 倪智敏, 吴月燕, 等.盐胁迫对‘鄞红’葡萄光合特性及叶片细胞结构的影响[J]. 生态学报, 2015, 35(13): 4436–4444.
[21] YADAV S, IRFAN M, AHMAD A, et al. Causes of salinity and plant manifestations to salt stress: a review[J]. Journal of Environmental Biology, 2011, 32(5):667–685.
[22] 王卓敏, 刘小川, 薛立, 等. 广东横琴岛园林植物叶片和土壤的养分特性研究[J]. 中南林业科技大学学报, 2017, 36(10): 36–44.
[23] 郑欣颖, 李鹏飞, 薛立, 等. 3种园林植物的抗盐生理研究[J]. 中南林业科技大学学报, 2017, 36(9): 62–67.
[24] 冯慧芳, 薛立, 任向荣, 等. 4 种阔叶幼苗对PEG模拟干旱的生理响应[J]. 生态学报, 2011, 31(2): 371–382.
[25] 邵怡若, 许建新, 薛立, 等. 低温胁迫时间对4种幼苗生理生化及光合特性的影响[J]. 生态学报, 2013, 33(14): 4237–4247.
[26] 卢广超, 许建新, 薛立, 等. 低温胁迫对4种幼苗的叶绿素荧光特性的影响[J]. 中南林业科技大学学报, 2014, 33(2) : 44–49
[27] 刘强, 王庆成, 王占武. 叶绿素荧光动力学参数作为植物抗盐性评价指标的有效性[J]. 广东农业科学, 2014, 41(21) : 37–40, 74.
[28] 卢广超, 许建新, 薛立, 等. 干旱胁迫下4种常用植物幼苗的光合和荧光特性综合评价[J].生态学报, 2013, 33 (24) : 7872–7881.
[29] 许长成, 李德全, 邹琦, 等. 干旱条件下冬小麦不同叶龄叶绿素荧光及叶黄素循环组分的变化[J]. 植物生理学报, 1999, 25(1): 29–37.
[30] 鲍思伟, 谈锋. 高温对曼地亚红豆杉叶绿素荧光参数的影响[J]. 福建林业科技, 2009, 36(3): 64–68.
[31] 李威, 赵雨森, 周志强, 等. 干旱和复水对东北红豆杉叶片叶绿素荧光特性和抗氧化酶活性的影响[J]. 中国沙漠, 2012, 32 (1): 112–116.
[32] 李春霞, 曹慧. 干旱对苹果属植物叶绿素荧光参数的影响. 安徽农业科学, 2008, 36(31): 13536–13538.
[33] 马博英, 金松恒, 徐礼根, 等. 低温对三种暖季型草坪草和绿素荧光特性的影响[J]. 中国草地学报, 2006, 28(1): 58–62.
[34] 陈梅, 唐运来. 低温胁迫对玉米幼苗叶片叶绿素荧光参数的影响[J]. 内蒙古农业大学学报, 2012, 33(3): 20–24.
[35] 许培磊, 焦竹青, 王振兴, 等. 五味子休眠前叶片的叶绿素荧光参数变化研究[J]. 华北农学报, 2012, 27 (增刊) : 209–212.
[36] 刘爱荣, 陈双臣, 王淼博, 等. 高温胁迫对番茄幼苗光合作用和叶绿素荧光参数的影响[J]. 西北农业学报, 2010, 19(5): 145–148.
Effects of salt stress on chlorophyll fluorescence parameters of seedlings of four garden plantspecies
SHE Hanji1, ZHANG Chao2, XUE Li1,*, KUANG Lei2, ZHENG Xinying1, XIE Tengfang2
1. College of Forestry and Landscape Architecture, South China Agricultural University, Guangzhou 510642, China 2. Pubang Landscape Architecture Co Lt, Guangzhou 510600, China
Effects of salt (NaCl) stress on fluorescent indices of,,andseedlings were studied to provide a foundation for garden plants selection under salt stress. The seedlings of the four species were placed in simulating salt environment and then their fluorescent indices were measured. The principal component analysis was used to evaluate salt resistance of these seedlings. The results showed thatv/mof,andcontinuously decreased with increasing salt stress time, whiledecreased followed by an increase at 0.3 % salt concentration, whereas that continuously decreasedfor seedlings of the four species at0.6 % salt concentration.,andof seedlings of the four species continuously decreased at 0.3% and 0.6 % salt concentrationsThe principal component analysis indicated that fluorescence index score of seedlings of the four species decreased in the order of>>>.
garden plant; salt stress; fluorescence index; principal component analysis
10.14108/j.cnki.1008-8873.2018.05.012
S68
A
1008-8873(2018)05-087-07
2017-01-07;
2018-01-02
广州市科技项目“广州市生态园林技术研究企业重点实验室”(2014SY000010); 中央财政林业科技推广示范项目“广东省生态公益林培育技术 推广” (2015-GDTK-07)
佘汉基(1993—), 男, 硕士生, 主要从事林学和植物生理研究, E-mail: 670363198@qq.com
通信作者:薛立(1958—), 男, 博士, 教授, 博士生导师, 主要从事树木生理、森林培育和生态学研究, E-mail: forxue@scau.edu.cn
佘汉基, 张潮, 薛立, 等. 盐胁迫对4种园林植物荧光特性的影响[J]. 生态科学, 2018, 37(5): 87-93.
SHE Hanji, ZHANG Chao, XUE Li, et al. Effects of salt stress on chlorophyll fluorescence parameters of seedlings of four garden plant species[J]. Ecological Science, 2018, 37(5): 87-93.

