急性低温胁迫对四指马鲅幼鱼肝脏、肌肉以及鳃组织结构的影响
区又君, 刘奇奇,2, 温久福, 李加儿, 李活
急性低温胁迫对四指马鲅幼鱼肝脏、肌肉以及鳃组织结构的影响
区又君1, 刘奇奇1,2, 温久福1, 李加儿1, 李活3
1. 中国水产科学研究院南海水产研究所, 农业部南海渔业资源开发利用重点实验室, 广州 510300 2. 上海海洋大学水产与生命学院, 上海 201306 3. 茂名市金阳热带海珍养殖有限公司, 广东 茂名 525444
为探究急性低温胁迫对四指马鲅幼鱼肝脏、肌肉以及鳃组织结构的影响。该研究设置了常温(27±0.5 ℃)组、20 ℃组以及15 ℃组共三个温度梯度进行试验, 以常温组作为对照,在试验进行的2 h、6 h以及12 h分别采集肝脏、肌肉以及鳃样品进行观察和测定。结果显示: 随着低温处理时间的延长, 20℃组的肝脏细胞空泡结构呈增多, 细胞核偏离, 染色变浅趋势; 肌纤维出现弯曲现象, 肌纤维之间与内部均出现较大间隙; 线粒体丰富细胞数目增多, 鳃小片末端轻微的膨大到鳃小片整体水肿且严重弯曲, 血管以及血窦内出现大量的红细胞, 部分鳃小片因红细胞过多而涨破; 同时, 15 ℃组肝脏细胞排列混乱, 肝板结构不清晰, 细胞核溶解, 肝脏整体失去固有形态。肌纤维间隙增大, 部分断裂直至肌纤维之间与内部均严重开裂, 部分肌纤维溶解并暴露出细胞核。鳃小片表皮出现轻微的脱落, 少部分鳃小片胀大到其吸水涨破, 鳃小片基本形态不可见。该研究结果为优化四指马鲅养殖生产温控管理措施, 提高越冬成活率提供参考资料。
四指马鲅; 低温胁迫; 组织结构
1 前言
四指马鲅()俗称午鱼、马友等, 隶属于鲻形目Mugiliformes、马鲅科Polynemidae、四指马鲅属[1]。主要分布于印度洋和太平洋西部, 我国沿海地区均有出现, 以南方居多, 属于热带及温带的海产鱼类。由于其抗病性强、肉质鲜美、生长迅速等优点受到广大养殖户和消费者的欢迎并迅速成为近年来新兴的水产养殖新品种。目前, 关于四指马鲅养殖生物学研究如盐度耐受性[2]、消化道结构和功能细胞的发育[3]以及胚胎发育[4]等方面的研究已经有报道, 但其规模化养殖依然面临诸多问题如其极易受到温度、盐度以及人为因素的干扰而造成病害甚至死亡等。如何改善养殖生产温控管理措施, 成为该鱼推广养殖的重要问题之一。
自然界存在季节更替、气候变化等环境温度的改变, 鱼类生活的环境温度也经常出现节律性或突发性的变动[5]。由于鱼类为变温动物, 身体温度很大程度会受到水环境的影响, 研究表明: 长时间的低温胁迫会影响大黄鱼()[6]的血液生化指标。鱼类通常会对自身代谢进行调整, 以适应环境温度的变化[7], 然而短时间急剧的温度变化则会对其造成伤害。因此, 研究短时间急剧的温度变化对鱼类的影响具有重要意义。龙华[8]的研究表明: 在一定范围内, 较高的温度可以促进鱼类生长, 较低的温度则会抑制其生长。通常, 低温胁迫包括两个方面, 冷驯化和温度骤变[9]。冷驯化指水温的缓慢降低, 而温度骤降指剧烈的降温, 对鲤()[10,11]的研究表明: 冷驯化一般可使鱼体内部出现相应的补偿机制以保持内环境的稳态; 而水温的骤降则会打破这种稳定态势, 继而使鱼体出现胁迫反应, 而付世建[12]等研究表明, 急性低温胁迫会影响南方鲇()幼鱼的耗氧率和呼吸频率, 也同样证明了这一点。宾石玉等[13]的研究也表明, 低温可以造成埃及尼罗罗非鱼()肝脏、脾脏和鳃组织结构的损伤, 而且温度越低损伤越严重。鱼类适宜生活的水温范围, 一般是12—30 ℃, 超过这个温度范围, 其生存就会受到影响, 但少数鱼类如大西洋鳕鱼()[14]因为细胞能合成抗冻蛋白而可以在较低温度下生存。目前, 国内外学者在鲫()[15]、褐牙鲆()[16]以及金头鲷()[17]等鱼的低温胁迫方面进行了深入的研究, 但在四指马鲅的低温胁迫方面研究较少。该研究以四指马鲅幼鱼为材料, 分析了四指马鲅幼鱼肝脏、肌肉以及鳃组织对不同程度低温的应答规律, 旨在探究其幼鱼对低温胁迫的反应, 为其人工养殖中的温度调控和越冬管理提供参考依据。
2 材料和方法
2.1 实验材料
实验所用的四指马鲅于2016年6月到9月在南海水产研究所珠海试验基地培育所得, 体长5.0±0.5 cm, 体质量1.5±0.4 g。实验开始前先暂养在室温(27 ℃)条件下使其适应环境, 暂养期间每天换水1次, 每次换水量1/2左右, 24 h连续充气。暂养一周后, 随机挑选体色正常, 健康的幼鱼270尾进行实验。
2.2 实验设计
实验在pH=8.0±0.2、溶解氧为6.0±0.5 mg.L-1下进行, 将四指马鲅幼鱼分为 3个实验组即对照组(27 ℃)、20 ℃组和15 ℃组, 每组放90尾幼鱼, 平均分成3等份。试验用9个圆柱形水桶, 直径为0.9 m、高为1.0 m, 加水量约占总体积的80%, 三个常温, 三个放入20 ℃的水浴中保温, 另外三个放入15 ℃的水浴中保温, 使每组之间以及等份之间互不影响。取样前先用MS-222 麻醉对照组四指马鲅2—3 min, 解剖鱼体, 取其的肝脏、肌肉和鳃样品固定于4%的多聚甲醛中。
2.3 样品测定
肝脏、肌肉以及鳃组织切片的制作: 取多聚甲醛固定的肌肉和鰓, 经过流水冲洗、70%—100%的乙醇脱水和二甲苯透明, 石蜡包埋处理后用Leica切片机进行连续切片, 切片厚度5—6 μm, 采用HE染色和中性树脂封片于Zeiss显微镜下观察并拍照。
3 结果
3.1 急性低温胁迫对四指马鲅幼鱼肝脏组织结构的影响
如图1-A、D、G所示: 对照组的肝细胞体积较大, 呈多面体, 细胞核呈圆球形且位于中央, 部分肝细胞具有2—3个核; 肝板结构清晰; 肝血窦形态正常分布于肝细胞之间。与对照组相比, 2h 20℃组的肝细胞纹路比较清晰, 其他未见明显变化。2h 15℃组的肝细胞部分区域出现空泡, 细胞核位于细胞一侧; 肝板结构不清晰, 肝血窦间隙收缩; 中央静脉形状不规则, 其周围细胞出现弥散现象, 肝细胞整体染色加深。6h 20℃组肝细胞出现大量的空泡, 细胞核位于肝细胞一侧; 肝板结构不清晰, 肝血窦增宽, 且其中红细胞数量增多; 肝细胞整体染色较浅。6h 15℃组肝细胞空泡化严重, 细胞核增大, 部分细胞核甚至溶解; 肝血窦与肝板结构均消失不见; 血管收缩且其中充满红细胞。12h 20℃组肝细胞空泡化严重, 细胞核位于细胞一侧, 血管收缩且其中充满红细胞, 细胞核呈不规则形状, 肝板结构消失, 整体染色较浅。12h 15℃组肝细胞整体失去固有形态, 细胞核溶解, 肝脏基本结构均不清晰。
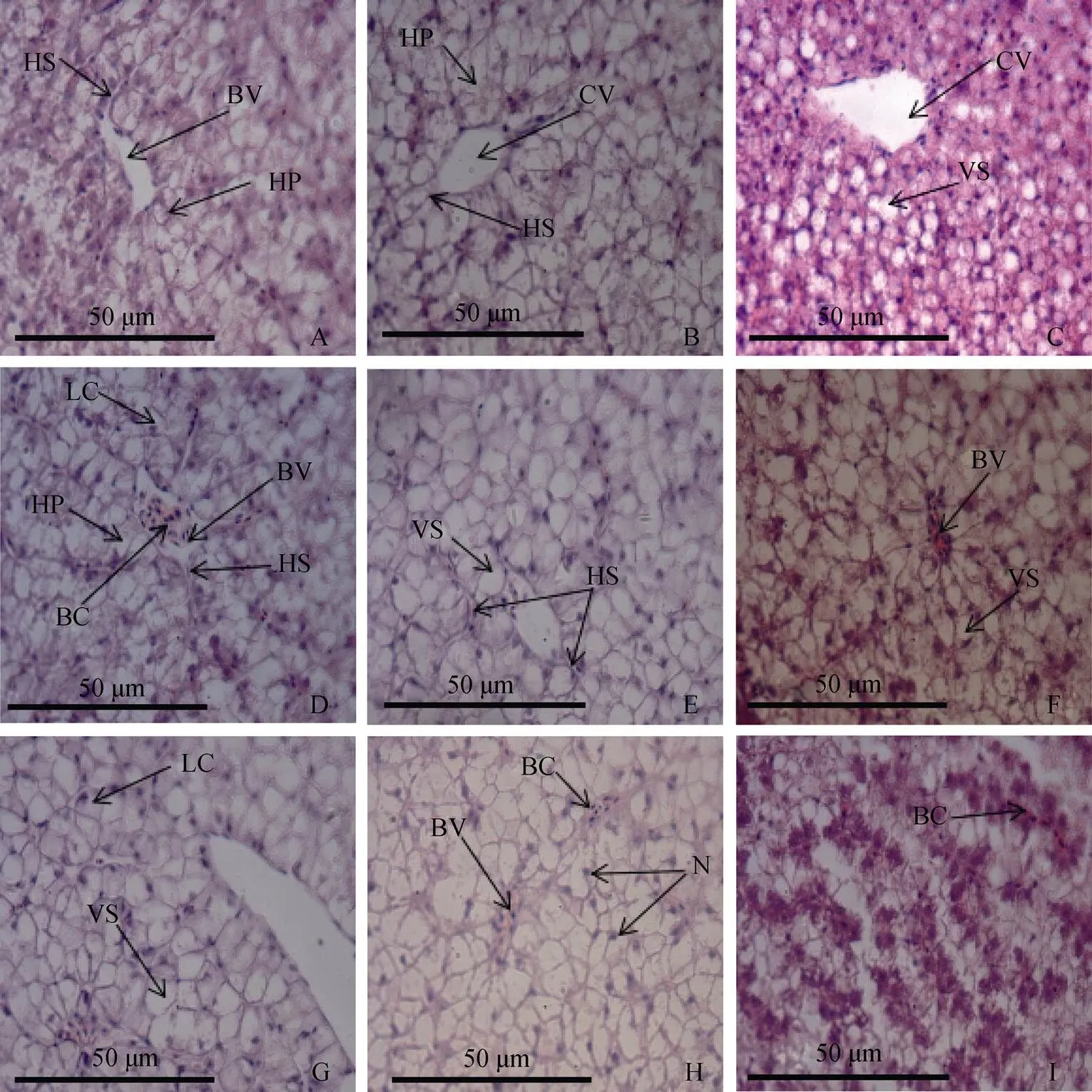
注: A: 肝脏, 2h对照组; B: 肝脏, 2h 20℃组; C: 肝脏, 2h 15℃组; D: 肝脏, 6h 对照组; E: 肝脏, 6h 20℃组; F: 肝脏, 6h 15℃组; G: 肝脏, 12h对照组; H: 肝脏, 12h 20℃组; I: 肝脏, 12h 15℃组; HS. 肝血窦; BV. 血管; HP. 肝板; CV.中央静脉;VS. 空泡; BC. 红细胞; LC. 肝细胞; N.细胞核
3.2 急性低温胁迫对四指马鲅幼鱼肌肉组织结构的影响
如图2-A、D、G所示, 对照组的肌纤维呈长柱型, 细胞核一个或多个; 肌原纤维由两种性质不同的物质组成, 其折射率不同, 在显微镜下呈现明显的明带和暗带交替现象, 由于相邻的各条肌原纤维的明暗横纹都相应的排列在同一平面上, 因此肌纤维出现规则的明暗交替的横纹。与对照组相比, 2h 20℃组的肌纤维基本结构未见明显变化, 但肌纤维间隙增大, 少量肌原纤维脱离纤维束。2h 15℃组的肌纤维间隙增大, 部分出现断裂现象。6h 20℃组肌纤维出现轻微的弯曲现象, 其间隙增宽。6h 15℃组大部分肌纤维断裂, 并出现纵向开裂, 肌原纤维散乱现象。12h 20℃组大部分肌纤维弯曲, 肌纤维之间与内部均出现间隙, 且其间隙较大。12h 15℃组肌纤维之间与内部均严重开裂, 部分肌纤维溶解并暴露出细胞核。
3.3 急性低温胁迫对四指马鲅幼鱼鳃组织结构的影响
如图3-A、D、G所示: 对照组的鳃丝中间有一条延鳃丝方向分布的血管, 鳃丝两侧对称分布着鳃小片, 其是鱼类进行气体交换的场所, 鳃小片中间分布着微血管即为鳃血窦; 鳃小片基部分布着一定数目的线粒体丰富细胞, 是鱼类调节渗透压的主要场所。与对照组相比, 2h 20℃组线粒体丰富细胞数目增多, 血窦间隙增大鳃小片末端出现轻微的膨大现象。2h 15℃组线粒体丰富细胞增多, 血窦间隙增大, 鳃小片表皮出现轻微的脱落, 少部分鳃血窦因充血而使鳃小片胀大。6h 20℃组鳃丝血管收缩, 鳃小片末端出现弯曲现象, 线粒体丰富细胞数目减少, 部分表皮脱落。6h 15℃组线粒体丰富细胞减少, 血管收缩, 鳃小片整体水肿且弯曲严重, 导致两侧不对称。12h 20℃组鳃小片整体水肿且严重弯曲, 鳃小片中间血窦开裂, 血管以及血窦内出现大量的红细胞, 部分鳃小片因红细胞过多而涨破, 且表皮脱落。12h 15℃组鳃小片部分吸水涨破, 大量的红细胞流出, 鳃小片基本形态难以辨别。
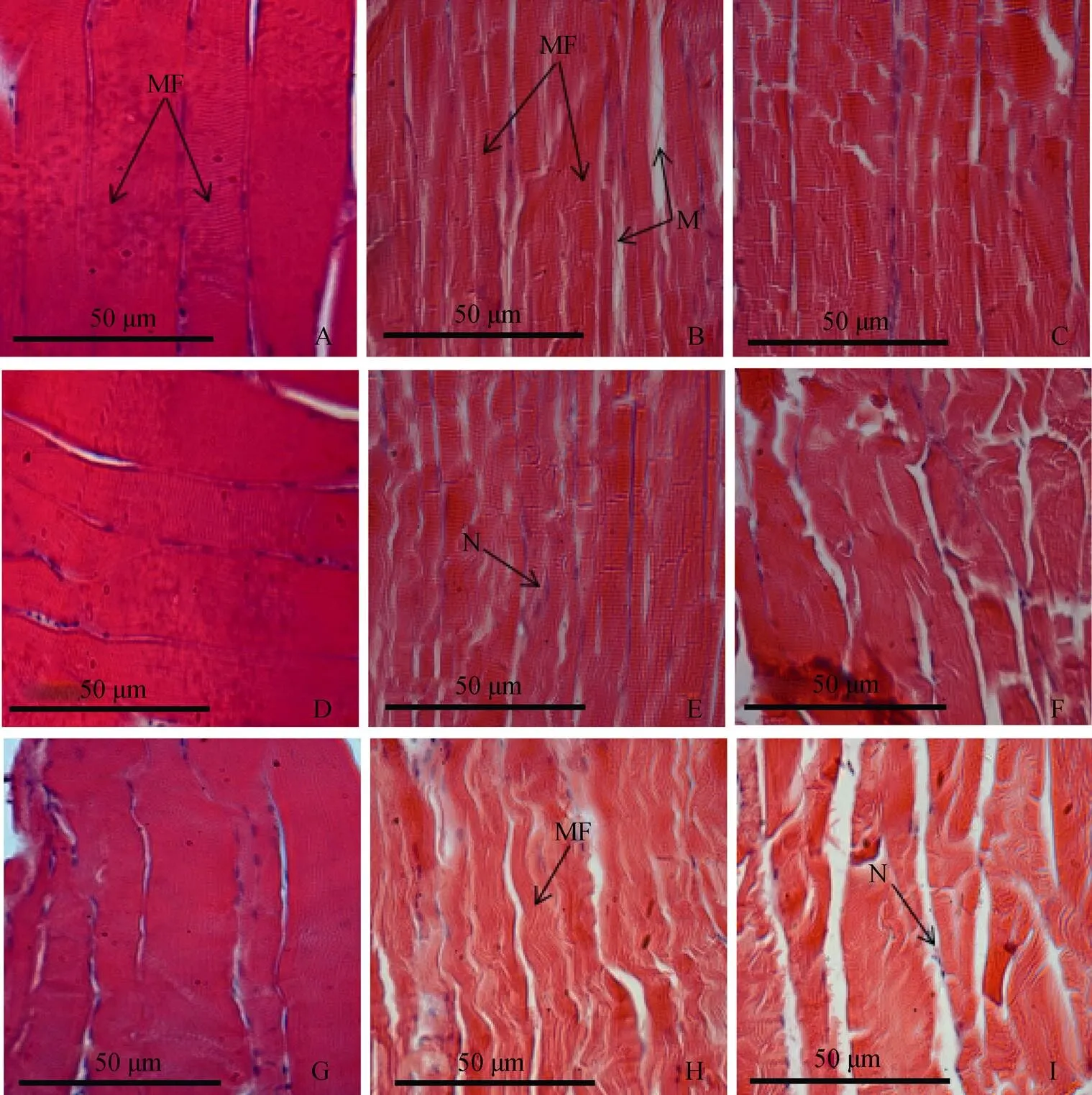
注: A: 肌肉, 2h对照组; B: 肌肉, 2h 20℃组; C: 肌肉, 2h 15℃组; D: 肌肉, 6h 对照组; E: 肌肉, 6h 20℃组; F: 肌肉, 6h 15℃组; G: 肌肉, 12h对照组; H: 肌肉, 12h 20℃组; I: 肌肉, 12h 15℃组; MF.肌纤维; M.肌原纤维; N.细胞核。
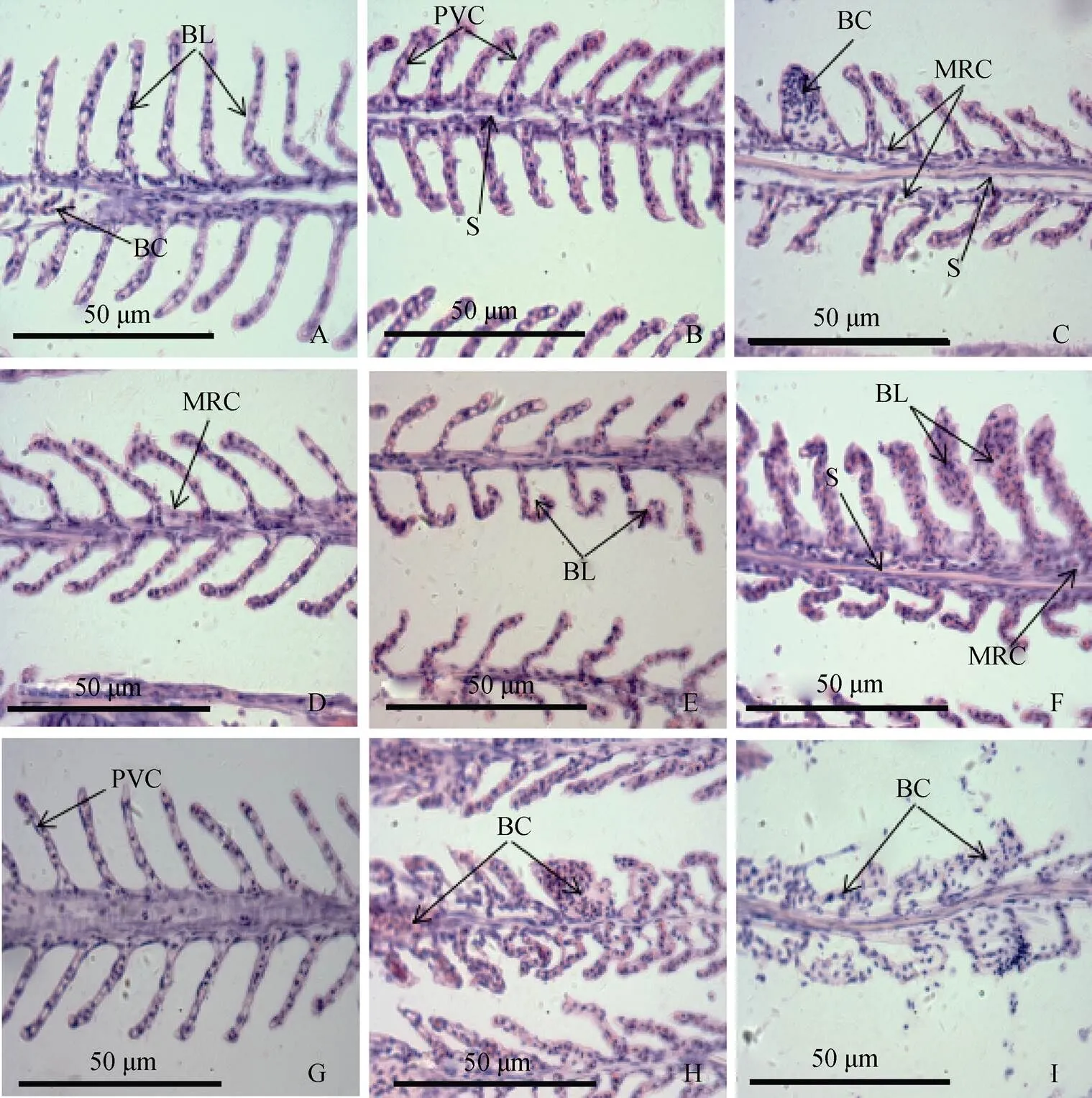
注: A: 鳃, 2h对照组; B: 鳃, 2h 20℃组; C: 鳃, 2h 15℃组; D: 鳃, 6h 对照组; E: 鳃, 6h 20℃组; F: 鳃, 6h 15℃组; G: 鳃, 12h对照组; H: 鳃, 12h 20℃组; I: 鳃, 12h 15℃组; BL:鳃小片; BC:血细胞; PVC:扁平上皮细胞; S:血窦; MRC:线粒体丰富细胞。
4 讨论
鱼类生活在水中极易受到水体环境因子如盐度、温度、pH等影响, 其中温度作为重要的环境因素之一时刻影响着鱼类的生命活动。研究表明[8]: 水温会影响鱼类的呼吸与循环系统。而洪磊等[18]的研究表明: 水温与鱼类生理指标之间具有较好的相关性, 故被广泛用于评估鱼类新陈代谢能力和生理健康程度。
4.1 急性低温胁迫对四指马鲅幼鱼肝脏组织结构的影响
肝脏是鱼类最大的消化腺, 可分泌胆汁促进脂肪的分解与吸收, 又参与多种物质的合成、贮存、代谢、转化和分解。肝脏细胞内有很多内含物, 其中主要包括: 糖原、脂滴以及色素等, 其含量与机体的生理状态有密切关系。贾明亮[19]对奥尼罗非鱼()的研究也表明, 在低温胁迫初期, 胆固醇、甘油三酯和葡萄糖作为能源物质而被大量消耗, 后期由于蛋白质和脂肪等的代谢利用, 使这三种物质含量回升。本研究中, 2h 20℃组肝细胞未见明显变化, 说明20℃条件下短暂的暴露, 机体主要靠分解葡萄糖等小分子物质功能, 不会对肝脏组织形成明显的影响。彭士明等[20]对银鲳()幼鱼的研究表明: 在应激胁迫下, 银鲳机体的能量供给主要来自肝脏糖原的分解, 2h 15℃组肝细胞出现空泡可能是因为突然的低温使四指马鲅幼鱼耗氧量增加[21], 导致肝糖原或脂肪被分解, 造成肝细胞出现空泡化; 因为鱼类为变温动物, 身体温度很大程度上取决于环境温度, 故过低的环境温度导致鱼体温度降低, 导致肝脏以及血窦收缩, 肝脏的收缩导致中央静脉受到压迫而形态改变; 另外肝细胞染色加深可能原因是, 四指马鲅幼鱼为了抵御突然的低温, 需要合成抗氧化酶等物质, 以减轻低温对肝脏的损伤。长时间暴露于20℃温度下, 导致肝细胞中糖原与脂滴逐渐被氧化分解, 故随着低温时间的延长其空泡化逐渐严重; 20℃虽然是低温, 但对于四指马鲅而言尚处于可适应范围内, 为了满足耗氧量的增加, 血液流量也随之增加, 故表现为血窦加宽, 且其中充满红细胞。长时间暴露于15℃低温下, 肝脏的自我调节能力逐渐失去作用, 故肝细胞严重损伤变性, 部分肝细胞中细胞核萎缩或消失, 此结果与高糖饲料对草鱼()[22]肝脏的损伤结果相似; 表明低温胁迫使的肝脏受到损伤, 并随着低温胁迫时间的延长而加深[19]。
4.2 急性低温胁迫对四指马鲅幼鱼肌肉组织结构的影响
肌肉是鱼类运动的主要参与者, 而突然的低温胁迫使四指马鲅幼鱼迅速运动, 不可避免的会对肌肉组织造成一定损伤。研究表明[23], 应激可能导致鲫肌肉退化以及细胞代谢的恶化, 最终导致细胞死亡。在20℃低温条件下随着处理时间的延长, 肌纤维间隙逐渐增大, 直到后来肌纤维出现弯曲现象, 都表明低温对肌肉有着显著影响, 而且随着低温暴露时间的延长损伤程度加深。在由常温突然降到15℃条件下,四指马鲅幼鱼迅速游动, 导致部分肌纤维断裂; 张琦等[24]对深黄被孢霉()的研究表明, 低温条件下细胞膜流动性明显降低, 加上其剧烈的运动导致细胞膜的破坏, 故本研究中肌纤维断裂甚至露出细胞核; Mourente G等[25]对金头鲷的研究也表明细胞膜脂质过氧化损伤, 将导致生物膜结构的破坏, 同时本研究结果也说明了低温胁迫使肌肉脂质过氧化程度加深。
4.3 急性低温胁迫对四指马鲅幼鱼鳃组织结构的影响
鳃是鱼类的主要的呼吸器官, 同时也具有排泄氨氮等代谢废物, 以及调节渗透压的功能。对赤鲷()[26]的研究表明, 在众多的环境因素中, 除了盐度以外, 环境温度也可以影响鱼类的渗透压平衡及细胞膜的通透性。20℃条件下, 随着低温时间的延长, 四指马鲅幼鱼渗透压平衡逐渐被打破, 为重新建立新的平衡, 其需要消耗大量的能量以维持渗透压平衡, 故线粒体丰富细胞数目逐渐增多; 渗透压的维持以及剧烈的运动都导致了其细胞呼吸量加大, 继而耗氧量的增加, 需要更多的红细胞以输送氧气, 故鳃小片内含有较多的红细胞, 但因为水温较低导致鳃丝中血管收缩, 这导致了红细胞的分布不均匀现象, 血细胞局部大量堆积, 这与陈彩芳等[27]对泥蚶()的研究结果相似。Robertson等[28]的研究发现低温显著影响膜的水渗透性, 如低温驯化使虹鳟()和尼罗罗非鱼的鳃弓吸水量增加1.5—3倍, 本研究发现随着低温处理时间的延长, 鳃小片水肿程度加深, 同样说明了这点。鳃小片在较低温度下有收缩趋势, 而其同时又有肿胀趋势, 鳃小片呈弯曲状, 可能是在两种趋势的共同作用下导致。徐奇友等[29]研究表明, ATP酶活性的下降将引起细胞膜结构的破坏, 低温可能导致鳃中ATP活性下降, 进而使鳃表皮出现细胞坏死脱落现象。15℃条件下, 由于渗透压平衡被打破以及细胞呼吸加强, 导致线粒体丰富细胞数目增加, 但随着时间的延长其数量又逐渐减少, 可能原因是较低的温度导致鳃的渗透压调节功能以及呼吸功能紊乱。贾明亮[19]的研究表明, 在低温胁迫条件下鱼体的代谢下降, 红细胞减少, 血液输送氧的能力降低, 故本研究中低温处理6h鳃血管出现收缩现象。与20℃相比, 15℃温度下鳃小片收缩与水肿的趋势更加强烈, 故其弯曲的更加严重, 宾石玉等[13]对埃及尼罗罗非鱼的研究也表明, 鳃细胞的损伤程度均随水温降低而增强。较低的温度导致渗透压平衡被打破, 且超出了机体的自我调节能力, 故本研究中鳃小片逐渐吸水膨胀, 并出现严重的充血现象, 直到大部分鳃小片都涨破流出红细胞, 这与重金属离子对泥蚶[27]鳃的影响结果相同。
[1] 孙典荣, 陈铮.南海鱼类检索[M]. 北京; 海洋出版社, 2013: 380–382.
[2] 谢木娇, 区又君, 温久福, 等. 四指马鲅)受精卵和仔鱼对不同盐度的耐受性[J]. 生态学杂志, 2016, 35(5): 1263–1267.
[3] 谢木娇, 区又君, 李加儿, 等. 四指马鲅稚鱼、幼鱼和成鱼消化道黏液细胞组织化学研究[J]. 中国细胞生物学学报, 2015, 37(9): 1226–1234.
[4] 谢木娇, 区又君, 李加儿, 等. 不同发育阶段的四指马鲅消化道组织学比较研究[J]. 南方水产科学, 2016, 12(2): 51–58.
[5] 李洁, 黄国强, 张秀梅, 等.高温-最佳温度循环对褐牙鲆生长、能量分配和身体成分的影响[J].水产学报, 2010, 34(8): 91–98.
[6] 冀德伟, 李明云, 王天柱, 等. 不同低温胁迫时间对大黄鱼血清生化指标的影响[J]. 水产科学, 2009, 28(1): 1–4.
[7] COUTO A, ENES P, PERES H, et al. Effect of water temperature and dietary starch on growth and metabolic utilization of diets in gilthead sea bream () juveniles [J]. Comparative Biochemistry and Physiology A, 2008, 151(1): 45–90.
[8] 龙华. 温度对鱼类生存的影响[J].渔业现代化, 2005(2): 254–257.
[9] 陈超, 施兆鸿, 薛宝贵, 等. 低温胁迫对七带石斑鱼幼鱼血清生化指标的影响[J].水产学报, 2012, 36(8): 1249–1256.
[10] GOOS H J, CONSTEN D. Stress adaptation, cortisol and pubertal development in the male common carp,[J]. Molecular and Cellular Endocrinology, 2002, 197(1–2): 106–116.
[11] ENGELSMA M Y, HOUGEE S, NAP D, et al. Multiple acute temperature stress affects leucocyte population and antibody responses in common carp,[J]. Fish & Shellfish Immunology, 2003, 15 (5): 397–410.
[12] 付世建, 曹振东, 彭姜岚. 急性低温胁迫对南方鲇幼鱼耗氧率和呼吸频率的影响[J]. 水生态学杂志, 2008, 28(3): 46–48.
[13] 宾石玉, 林勇, 曾兰, 等. 低温胁迫对埃及尼罗罗非鱼肝、脾和鳃细胞形态的影响[J]. 广西师范大学学报自然科学版, 2015, 33(3): 123–128.
[14] HEW C L, SLAUGHTER D, FLETCHER G L, et al. Antifreeze glycoproteins in the plasma of Newfoundland Atlantic cod ()[J]. Canadian Journal of Zoology, 1981, 59(11): 2186–2192.
[15] PANG X, CAO Z D, FU S J. The effects of temperature on metabolic interaction between digestion and locomotion in juveniles of three cyprinid fish (and) [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2011, 159(3): 253–260.
[16] 黄国强, 李洁, 唐夏, 等. 温度胁迫及恢复过程中褐牙鲆幼鱼 GH, IGF-I, RNA/DNA 比值和糖原的变化[J]. 南方水产科学, 2012, 8(6): 16–21.
[17] KYPRIANOU T D, PÖRTNER H O, ANESTIS A, et al. Metabolic and molecular stress responses of gilthead seam breamduring exposure to low ambient temperature: an analysis of mechanisms underlying the winter syndrome [J]. Journal of Comparative Physiology, 2010, 180(7): 100– 1018.
[18] 洪磊, 张秀梅.环境胁迫对鱼类生理机能的影响[J].海洋科学进展, 2004, 22(1): 114–121.
[19] 贾明亮. 低温胁迫对奥尼罗非鱼的生长、肌肉组成和血液生理生化指标的影响[D]. 湛江: 广东海洋大学, 2010.
[20] 彭士明, 施兆鸿, 李杰, 等. 运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响[J]. 水产学报, 2011, 35(6): 831–837.
[21] HOCHACHKA P W. Biochemical adaptation [M]: Princeton University Press; 1984: 383–413.
[22] 郭小泽, 梁旭方, 方刘, 等. 饲料中非蛋白能量源对草鱼血清生化指标和肝脏组织的影响[J]. 水生生物学报, 2014(3): 582–587.
[23] ZHANG J, SHEN H, WANG X, et al. Effects of chronic exposure of 2, 4-dichlorophenol on the antioxidant system in liver of freshwater fish[J]. Chemosphere, 2004, 55(2): 167–174.
[24] 张琦, 杨昭杰, 赵汝丽, 等. 多不饱和脂肪酸与深黄被孢霉低温适应性的关系(英文)[J]. 昆明理工大学学报自然科学版, 2015(1): 67–73.
[25] MOURENTE G, DÍAZ-SALVAGO E, BELL J G. Increased activities of hepatic antioxidant defence enzymes in juvenile gilthead sea bream (L.) fed dietary oxidised oil: attenuation by dietary vitamin E[J]. Aquaculture, 2002, 214(1–4): 343–361.
[26] OSTROWSKI A D, WATANABE W O, MONTGOMERY F P, et al. Effects of salinity and temperature on the growth, survival, whole body osmolality, and expression of Na+/K+-ATPase mRNA in red porgy () larvae[J]. Aquaculture, 2011, 314(1/4): 193–201.
[27] 陈彩芳, 沈伟良, 霍礼辉, 等. 重金属离子Cd2+对泥蚶鳃及肝脏细胞显微和超微结构的影响[J]. 水产学报. 2012, 36(4): 522–528.
[28] ROBERTSON J C, HAZEL J R. Influence of Temperature and Membrane Lipid Composition on the Osmotic Water Permeability of Teleost Gills [J]. Physiological and Biochemical Zoology,1999, 72(5): 623–632.
[29] 徐奇友, 李婵, 杨萍, 等. 用大豆分离蛋白和肉骨粉代替鱼粉对虹鳟生产性能和非特异性免疫指标的影响[J]. 大连海洋大学学报, 2008, 23(1): 8–12.
The effects ofacute low temperature stress on liver, muscle and gill tissues of juvenile
OU Youjun1, LIU Qiqi1,2, WEN Jiufu1, LI Jiaer1, LI Huo3
1. Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Science, Guangzhou 510300, China 2. College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China 3. Maoming Jinyang Tropical Fish Breeding Co. Ltd,aoming, 525444, China
In order to explore the effects of acute low temperature stress on liver, muscle and gill tissues of juvenile, three test groups, control group (27±0.5℃), 20℃ group and 15℃ group, were set up in this study. The liver tissue, muscle tissue, and gill tissue were sampled at 2h, 6h and 12h when low temperature stress occurred to make slices. Results showed that with the time prolonging, the liver cells in 20℃ group performance as vesicles structure was increased; nucleus was deviated and the staining became shallow. The muscle fibers were bending, and there was a large gap between the muscle fibers and the interior. The number of mitochondria rich cells was increased, and slight swelling symptom occurred at the end of the gill lamellae, until to final, the gill lamellae became overall edema and severely bending. A large number of red blood cells were appeared in sinus and blood vessels, besides, part of gill lamellae was burst because of too many red cells. Meanwhile, the liver cells in 15℃ group performance as the liver cells chaotic arrangement, the liver plate structure was not clear, the cell nucleus dissolved, and the whole liver lost its inherent form. The gap between muscle fibers increased, and some of them ruptured until the muscle fibers were severely cracked. Some muscle fibers dissolved and the nucleus was exposed. The epidermis of the lamellae of the gill appeared slight shedding. A few of lamellae was swollen, finally, it was burstbecause of water absorption, and the basic form of lamellae was not visible. Results of this study provide reference for overwintering management of juvenileand improving survival rate in winter.
; low temperature stress; organization structure
10.14108/j.cnki.1008-8873.2018.05.008
S917.3
A
1008-8873(2018)05-053-07
2017-05-03;
2017-11-09
广东省“扬帆计划”引进创新创业团队项目(2016YT03H038); 广东省省级科技计划项目(2017B020204002); 广东省渔业生态环境重点实验室开放课题(LFE-2016-8)
区又君(1964—), 女, 研究员, 从事鱼类繁育、养殖与遗传育种研究, E-mail: ouyoujun@126.com
区又君, 刘奇奇, 温久福, 等. 急性低温胁迫对四指马鲅幼鱼肝脏、肌肉以及鳃组织结构的影响[J]. 生态科学, 2018, 37(5): 53-59.
OU Youjun, LIU Qiqi, WEN Jiufu, et al. The effectsof acute low temperature stress on liver, muscle and gill tissues of juvenile[J]. Ecological Science, 2018, 37(5): 53-59.

