慢病毒介导神经生长因子过表达诱导脐带间充质干细胞向神经元样分化
陈浩浩,郑群,王文倩,江文娇,王飞凤,傅晓艳,张宁*
(1金华职业技术学院医学院分子生物学实验室;2金华市人民医院生殖医学中心;3 金华市思丹姆干细胞生物科技有限公司,金华321000)
间充质干细胞(mesenchymal stem cells,MSC)是多能的干细胞,可以分化形成骨细胞、脂肪细胞、软骨细胞以及神经细胞[1-3]。 MSC可以从骨髓、脂肪、脐带血、脐带和羊膜等多种组织分离。人脐带来源的间充质干细胞(umbilical cord mesenchymal stem cells,UCMSc)具有便于取材、来源广泛、细胞增殖快、分化能力强的特点,适合进行体外扩充增殖,且无伦理学限制,是一个有潜力的MSC来源。间充质干细胞已被用于动物模型和临床实验以治疗许多疾病,如心肌梗塞,移植物抗宿主病,中风和脊髓损伤[4]。
神经生长因子(nerve growth factor,NGF)是神经营养因子家族中第一个被发现的成员,对中枢神经和周围神经生长、发育及分化至关重要[5]。NGF通常在成体海马和皮质表达,并提供神经营养支持胆碱能神经元[6]。重组β-NGF蛋白进入受损神经中可促进神经修复和增强神经损伤后功能恢复,但在体内NGF半衰期较短,不会穿过血脑屏障并难以输送到中枢神经系统[7]。通过对UMSCs进行基因修饰,让其过表达NGF,进入体内后能修复中枢神经系统的损伤,促进神经元的存活或再生,因此本研究对慢病毒介导NGF过表达对体外UMSCs分化的影响进行了探讨。
材料和方法
1 材料
本研究所用脐带组织为健康产妇自愿捐赠,由金华市思丹姆干细胞生物科技有限公司提供;DMEM、胎牛血清(FBS)、胰酶、青链霉素等均购自美国Gibco公司;CD34、CD45、CD19、CD14、CD105、CD90、CD73荧光素偶联抗体购自BD公司;NGF、GAPDH抗体及二抗购自Abcam;β-NGF ELISA检测试剂盒购自杭州联科生物公司;BIORAD逆转录试剂盒及荧光定量PCR试剂盒购自杭州宝诚生物;引物由上海生工合成。
2 NGF过表达慢病毒载体的构建
通过Pubmed检索Human ngf mRNA序列为XM_006710663.3,长度为 943bp,https∶//www.ncbi.nlm.nih.gov/nuccore/XM_006710663.3,采用pLVX.CMV. eGFP. PGK. PuroR载体,元件顺序为3FLAGNGF-GFP,委托杭州赫贝生物技术公司构建合成,最终得到滴度为1×108TU/ml的病毒颗粒。
3 UCMSc分离培养及鉴定
取脐带组织,用PBS液清洗组织3遍,用眼科剪刀将组织标本剪碎;将脐带转移至细胞分离管中,加入2ml基础培养基(DMEN-F12+10%胎牛血清+1%青链霉素)后,组织分离器搅拌3次(每次45s)。然后将组织转移至50 ml离心管中加入适量PBS,300g离心15min,弃上清,再加入PBS重复洗涤3次,加培养液,置于37ºС、5%CO2培养箱培养。待细胞汇合度达到80%以上,收集细胞并传代,传至第3代时,收集细胞用于流式细胞仪检测,观察细胞表面分子CD34、CD45、CD19、CD14、CD105、CD90、CD73的表达。
4 慢病毒转染
对鉴定后的细胞传代扩增,收集细胞,配成5×105cells/ml细胞悬液,接种于6孔板中,4h后换液,弃去部分培养基,加MOI值10的病毒液及8ng/ml Polybrene,其中转染组为携带NGF,对照组只携带GFP,培养6h后,换液,继续培养72h,收集细胞用于后续实验。
5 免疫荧光
将细胞接种于放有小圆盖玻片的24孔培养板中,待细胞快长满玻片时,吸出上清,4%多聚甲醛固定,抗体封闭液37 ℃1h,加兔抗NGF抗体(1∶200)4℃过夜,PBS洗3次,TRITC标记山羊抗兔二抗(1∶50)37 ℃温育1h,PBS洗3次,加DAPI染色液(10 ng/ml),抗荧光淬灭封片液封片,荧光显微镜观察。
6 ELISA法检测细胞上清液NGF含量
收集细胞相应培养液上清,BCA法检测各样本总蛋白浓度。采用Human β-NGF ELISA 检测试剂盒,参照试剂盒内步骤进行,酶标仪450nm波长读取OD值。绘制标准曲线,计算各样本NGF含量(pg/ml),最终结果以NGF含量和总蛋白浓度的比值表示,即每mg蛋白中NGF的含量(pg/mg)。
7 Western blot
收集细胞加入蛋白裂解液100μl,裂解10min,4℃、12000g离心5min,取上清,BCA法测定蛋白质浓度。取等量蛋白,加5×SDS loading buffer沸水浴变性5min,进行SDS-PAGE电泳,80V,30min,直至所有样品压成一线,120V 100min;冰盒转膜,200mA,60min;5%脱脂奶粉室温封闭60min;兔抗 NGF(1∶1000)、小鼠抗 GAPDH(1∶1000)4℃孵育过夜;TBST洗3次,每次10min;HRP标记山羊抗兔(1∶5000)、HRP标记山羊抗小鼠(1∶5000)37℃孵育1h;TBST洗3次,每次10min;ECL A液+B液5min,显影液3min,定影液3min;拍照。应用Quantity One软件对蛋白条带光密度进行测定,以NGF与GAPDH条带光密度比值表示NGF相对表达水平。
8 qRT-PCR
收集细胞,Trizol法提取总RNA,取2μl RNA酶标仪测定RNA溶液浓度,采用逆转录试剂盒,管中加入4μl 5×iScript Reaction Mix、1μl iScript Reverse Transcriptase、1μg RNA 以 及 RNase free ddH2O 至20μl。在PCR仪上进行逆转录反应:25℃ 5min,46℃ 20min,95℃ 1min。取反转录得到的cDNA各2μl作为模板,分别 10µmol/L 引物 1μl(引物序列见表1),2×iTaqTMuniversal SYBR@Green supermix 10μl,ddH2O 7μl,95℃ 5s, 60℃ 30s,40 个循环,PCR仪上进行扩增。每个样品的Ct值从内参基因的值中减去得到ΔCt,然后比较2-ΔΔCt值。
9 统计学分析
数据采用SPSS16.0统计软件分析。所有数据均采用平均值±标准差(¯x±s) 表示,对数据首先进行正态分布和方差齐性检验,符合正态分布和方差齐性的两组间数据分析采用独立样本t检验分析,多组间数据分析采用重复测量设计的方差分析,以P<0.05为具有统计学显著的差异。

表1 qRT-PCR引物序列Tab. 1 Sequences of primers for qRT-PCR
结 果
1 流式细胞术鉴定脐带间充质干细胞
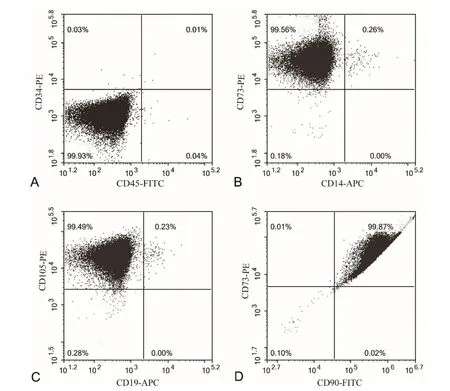
图1 流式细胞术鉴定间充质干细胞。A,CD34(PE)和CD45(FITC)都阴性;B,CD14(APC)阴性而CD73(PE)阳性;C,CD19(APC)阴性而CD105(PE)阳性;D,CD90(FITC)阳性Fig. 1 Identification of mesenchymal stem cells by flow cytometry. A, CD34 (PE) and CD45 (FITC) were negative; B, CD14 (APC) was negative and CD73 (PE) was positive; C, CD19 (APC) was negative and CD105 (PE) was positive; D, CD90 (FITC) was positive
流式细胞术分析显示,分离的细胞其表面标记CD34(PE)和CD45(FITC)都为阴性(图1A),CD14(APC)为阴性而CD73(PE)为阳性(图1B),CD19(APC)为阴性而CD105(PE)为阳性(图1C),CD90(FITC)为阳性(图1D),据此认定为脐带间充质干细胞。
2 NGF基因修饰的脐带间充质干细胞高表达和分泌NGF
免疫荧光染色检测显示,过表达NGF的慢病毒转染72h后,脐带间充质干细胞表达GFP(绿色)的同时有NGF表达(TRITC标记,红色)(图2)。
Western blot和qRT-PCR检测显示,过表达NGF的慢病毒转染的脐带间充质干细胞中NGF的蛋白和mRNA表达水平均显著高于对照组和空白组(图3A和图3B)。ELISA检测发现,过表达NGF的慢病毒转染的脐带间充质干细胞β-NGF含量为(747.61±208.74)pg/mg,显著高于对照组的(1.48±0.57)pg/mg和空白组的(2.04±0.29)pg/mg(图3C)。
由此表明,过表达NGF的慢病毒转染成功,NGF基因修饰的脐带间充质干细胞高水平表达和分泌 β-NGF。

图2 慢病毒转染的脐带间充质干细胞中NGF的免疫荧光检测。A,表达GFP(绿色)的细胞;B,与A同一视野中的免疫荧光染色显示的表达NGF的细胞(TRITC标记,红色);C,同视野内DAPI染色的细胞核(蓝色);D,A、B和C的叠加图像;比例尺,20μmFig. 2 Immunofluorescence assay for NGF expression in umbilical cord mesenchymal stem cells transfected with NGF-lentivirus. A, cells expressing GFP (green); B, cells expressing NGF stained by immunofluorescence (TRITC conjugated, red) in the same field as A; C, the nuclei stained by DAPI(blue) in the same field as A; D, the merged image of A, B and C; scale bar, 20μm
3 NGF基因修饰的脐带间充质干细胞高表达nestin、GFAP、MAP2、tubulin mRNA
对神经谱系的特异性标志物mRNA进行qRTPCR检测发现,结果显示,相对于对照组和空白组,转染组细胞的nestin、GFAP、MAP2、tubulin mRNA表达水平显著上调(图4)。
讨 论
NGF对于神经元(特别是感觉神经元)的生长和发育是非常重要的,其分子量大约为13.2kDa,所以不能有效通过血脑屏障,即使进入脑内也很快降解,需要持续给药维持效果。另外由于人体内广泛存在NGF受体(神经营养因子p75和酪氨酸激酶A),易出现明显副作用,因而限制了NGF的临床应用[8,9]。国内外学者采用MSCs (mesenchymal stem cells)治疗一些神经系统疾病,证实了其具有一定的疗效[10,11]。有研究发现采用VEGF和GDNF等基因修饰的MSCs移植治疗某些疾病的效果要优于单纯应用MSCs治疗[12],而间充质干细胞在诱导因子(如NGF)的作用下可分化成神经元样细胞[13,14]。这些结果给予了我们启发,在本研究中,我们利用重组慢病毒载体转染UCMSc,通过神经谱系的特定基因的检测证实UCMSc能分化为神经元样细胞。

图3 慢病毒转染的脐带间充质干细胞NGF表达与分泌检测。A,NGF表达的Western blot检测:A1,代表性Western blot结果;A2,NGF表达水平的统计学分析;B,NGF mRNA表达水平qRT-PCR检测的统计学分析;C,细胞上清液β-NGF含量ELISA法检测的统计分析;**P<0.01(n=3)Fig. 3 Detection for expression and secretion of NGF in umbilical cord mesenchymal stem cells transfected with NGF-lentivirus. A, Western blot detection for NGF expression∶ A1, representative Western blot results; A2, statistical analysis for NGF expression level; B, statistical analysis of NGF mRNA expression detected by qRT-PCR; C, statistical analysis of β-NGF content in cell supernatants detected by ELISA; **P<0.01 (n=3)
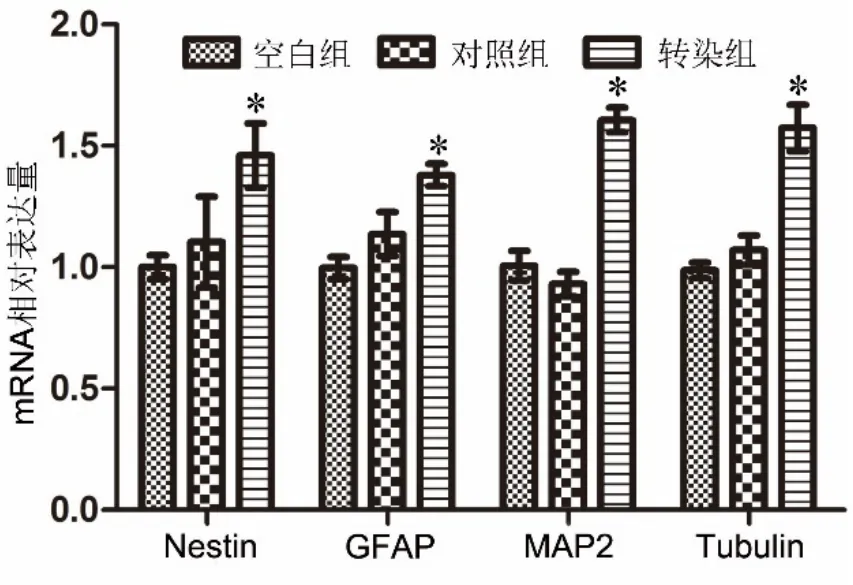
图4 qRT-PCR检测nestin、GFAP、MAP2及tubulin mRNA表达水平的统计学分析;与对照组比较:*0.01<P<0.05(n=3)Fig. 4 Statistical analysis of mRNA expression levels of nestin, GFAP,MAP2 and tubulin detected by qRT-PCR; compared with control group∶*0.01<P<0.05 (n=3)
NGF主要由α、β和γ三种亚单位,而β亚单位是具有NGF的生物活性单位,在我们的研究中,对转染后细胞培养液中的β-NGF测定显示,转染组培养液中β-NGF的含量明显升高,表明转染后的UCMSc开始大量分泌NGF。收集细胞利用Western blot和qRT-PCR检测则证明了NGF内源性表达增多。Nestin、GFAP、MAP2及tubulin等神经特异性蛋白在神经干细胞分化和增殖中起决定性作用[15],因而我们对细胞的神经谱系的特异性标志物进行了基因水平表达的检测,结果显示这些标志物在基因层面表达都有显著性增加,这说明慢病毒介导的NGF过表达能促进UCMSc向神经元样细胞进行分化。而目前对于MSC向神经元样细胞分化这一现象是由内源性表达引起,还是培养液中高浓度NGF引起,还不明确。有学者研究发现慢病毒转导骨髓间充质干细胞表达NGF后4d,细胞内源性NGF水平反而出现降低[16],这与我们的结果不太一致,可能原因首先为MSC来源不同,本研究采用P3代UCMSc,其次慢病毒转染后会影响MSc的增殖传代,从而可能会影响NGF的表达。国内学者证实鼠神经生长因子能够体外诱导UCMSc分化为类神经元,并发现细胞GFAP阳性率高于NSE阳性率,表明UCMSc更多转换为了神经胶质细胞[17]。因此,UCMSc向神经元样细胞分化的相关机理仍需要科研人员进一步深入的研究。
本研究得到的转染NGF脐带间充质干细胞能以自分泌的形式获得稳定持久的NGF表达,不仅自身能向神经元样分化,若应用于一些神经系统疾病(如脊髓损伤、老年痴呆、多发性硬化症等)的治疗,也能促进神经干细胞的生长和分化,从而保护受损的神经元免于死亡,并诱导神经纤维再生。我们认为将干细胞和NGF的神经营养能力联合应用可能是比较一种有前景的治疗途径。

