肺炎克雷伯菌碳青霉烯酶的检测及基因型分析
董大光,王 健,潘亚萍,沈继录,徐元宏
肺炎克雷伯菌是临床分离及医院感染的重要致病菌之一,随着β-内酰胺类及氨基糖苷类等广谱抗菌素的广泛使用,细菌易产生超广谱β-内酰胺酶和头孢菌素酶以及氨基糖苷类修饰酶,尤为严重的是对碳青霉烯类抗生素耐药的肺炎克雷伯菌(carbapenem-resistantKlebsiellapneumoniae,CRKP)的持续增加[1-2],给临床抗感染治疗带来了极大的挑战。该文收集了25株CRKP,对耐药性、耐药基因进行检测以及流行状况进行了初步分析,以探究CRKP的耐药机制及其流行情况。
1 材料与方法
1.1材料
1.1.1研究对象 收集2016年1月~12月安徽医科大学第一附属医院分离的25株对碳青霉烯类具有很强耐药性的肺炎克雷伯菌,将之作为本次研究的对象,并且做到同一个患者没有重复分离株。采用质控标准菌株大肠埃希菌ATCC25922。
1.1.2仪器 全自动的Vitek 2 Compact微生物系统和基质辅助激光解吸电离飞行时间质谱均购自法国生物梅里埃公司;GeneAmp970基因扩增仪购自美国PE公司。
1.1.3试剂 血平板、麦康凯平板、MH平板等培养基购自合肥天达诊断试剂有限公司;药敏纸片购自英国OXOID公司;亚胺培南粉末购自国药集团国瑞药业有限公司;细菌蛋白抽提液购自美国Thermo Fisher Scientific公司。
1.1.4引物 标志物DL2000、Ex Taq DNA聚合酶试剂盒购自宝生物工程(大连)有限公司;琼脂糖、引物购自生工生物工程(上海)股份有限公司;引物序列:F:5′-TCTGGACCGCTGGGAGCTGG-3′;R:5′-TGCCCGTTGACGCCCAATCC-3′。片段大小为510 bp。
1.2方法
1.2.1细菌鉴定和药敏实验 细菌鉴定和药敏试验采用VITEK-2 Compact全自动微生物分析系统,部分药物补充K-B法,具体标准参照CLIS 2016推荐的方法。
1.2.2产碳青霉烯酶肺炎克雷伯菌表型筛选
1.2.2.1改良Hodge试验(modified Hodge test,MHT) 把0.5麦氏浊度的大肠杆菌ATCC 25922的悬浮液1 ∶10稀释后均匀涂布于药敏试验平板上。于平板正中央贴10 μg/片美罗培南药敏纸片,将待测菌挑取出来,自纸片外缘向平板边缘划线接种待检菌,经35 ℃培养过夜后判定效果。
1.2.2.2Carba NP(Carbapenemase Nordmann-Poirel)试验 制备A液(含0.1 mmol/L硫酸锌的酚红溶液)和B液(A液中加入6 mg/ml 亚胺培南)。分别标记1.5 ml离心管为a、b,每管中加入100 μl 细菌蛋白抽提液,从37 ℃培养24 h血平板上挑取受试菌株,振荡混匀5 s,a管中加入100 μl A液,b管中加入100 μl B液,涡旋振荡混匀,置于37 ℃孵箱,每0.5 h观察记录颜色变化至孵育2 h结束。
1.2.2.3改良碳青霉烯灭活试验(modified Carbapenem inactivation method,mCIM) 取1 μl接种环的过夜培养纯菌落于2 ml TSB肉汤中,震荡混匀,每管菌悬液放入一张含10 μg美罗培南的无菌纸片,(35±2) ℃孵育4 h后,用0.5麦氏浊度的大肠埃希ATCC 25922菌悬液(直接菌悬法)涂布平板,干燥3~10 min,将美罗培南纸片从TSB肉汤中取出贴于已涂布有大肠埃希菌ATCC25922的MH平板上。倒置平板,孵育18~24 h后量取抑菌圈直径。
1.3金属酶表型EDTA协同试验准备MH药敏琼脂平皿和待测菌,将过夜待测菌用无菌生理盐水调至0.5麦氏浊度的菌悬液,将菌液均匀涂布于MH平皿上,静置10 min待干燥,将10 μg/片亚胺培南贴在MH平皿上,距其1 cm处贴一张EDTA(吸附有0.5 mol/L EDTA 10 μl)纸片。35 ℃培养18 ~24 h后观察结果。
1.4产肺炎克雷伯菌型碳青霉烯酶基因检测采用煮沸裂解法提取总DNA为模板。blaKPC基因扩增,扩增条件为:95 ℃预变性5 min;94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸1 min,如此循环33次;最后在72 ℃下延伸5 min。对PCR产物进行电泳分析。上海生工公司对扩增产物进行测序,对测序结果进行比对。
1.5耐药菌株同源性分析煮沸法制备细菌DNA,ERIC-PCR的引物序列ERIC1:ATGTAAGCTCCTGGGGATTCAC;ERIC2:AAGTAAGTGACTGGGGTGAGCG。扩增条件是:95 ℃预变性3 min,94 ℃变性1 min,35 ℃退火1 min,72 ℃延伸1 min,如此循环20次,接着94 ℃变性1 min, 42 ℃退火1 min,72 ℃延伸1 min,如此循环35次,最后在72 ℃延伸5 min。取出扩增产物10 μl,加入到1.5%琼脂糖凝胶里,开始电泳分析。判定标准为主要的条带位置和数量相同为同一基因型。
1.6统计学处理使用WHONET 5.6软件对K-B法的药敏结果和仪器法最小抑制浓度(MIC)药敏结果进行数据处理及分析。
2 结果
2.1药物敏感实验结果所分离的25株肺炎克雷伯菌中,复方新诺明和米诺环素的耐药率较低,分别为28%和4%。其他抗生素(头孢菌素、喹诺酮类、青霉素类、青霉素/青霉素酶抑制剂、氨曲南等)均高度耐药。见表1。

表1 25株耐碳氢酶类菌对18种抗菌药物的耐药率
2.2MHT试验、CarbaNP试验和mCIM试验结果对25株肺炎克雷伯菌碳青霉烯酶表型检测,3种试验结果相同,24株CRKP阳性,阳性率为96%,阴性株为同一标本。见图1~3。
2.3EDTA协同试验亚胺培南-EDTA协同试验检测25株耐药菌株的金属酶表型,没有发现阳性菌株。见图4。

图1 改良Hodge试验碳青霉烯酶检测结果
1:阳性质控菌ATCC BAA1705;2:阴性质控菌株ATCC BAA1796;3、4:受试菌株,阳性结果
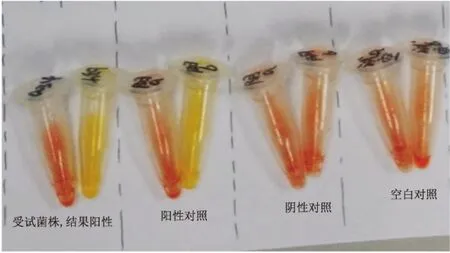
图2 Carba NP试验碳青霉烯酶检测结果

图3 改良碳青霉烯灭活试验碳青霉烯酶检测结果
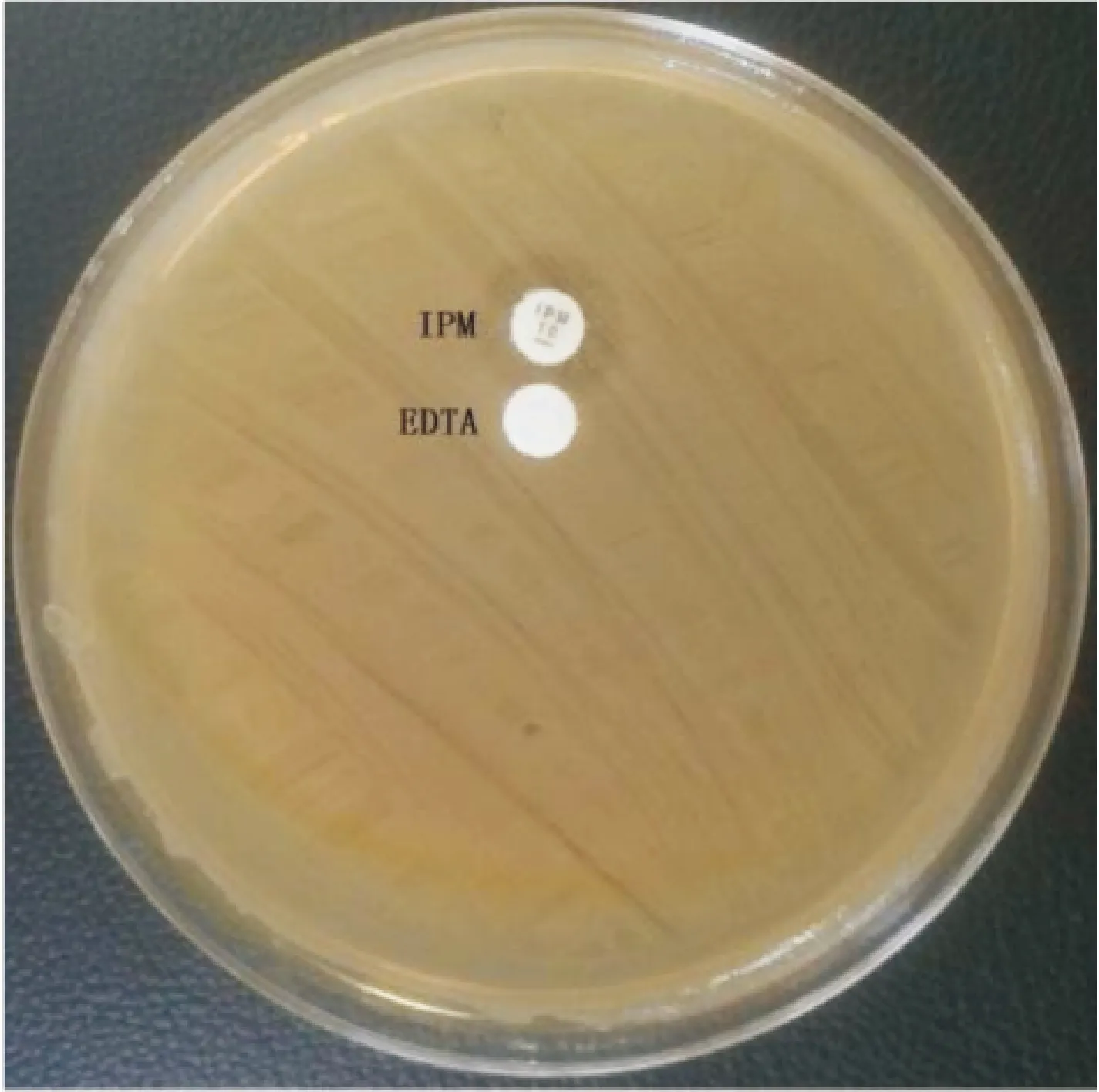
图4 EDTA协同试验检测结果
2.4KPC酶基因检测结果24株碳青霉烯酶表型试验阳性的CRKP进行PCR扩增,DNA产物进行测序对比,结果显示均为KPC-2型基因,1株碳青霉烯酶表型检测的阴性株KPC酶基因检测结果为阴性。见图5。
2.5ERIC-PCR基因分型25株CRKP主要分为8型,其中Ⅰ型3株,Ⅱ型最多共14株,Ⅲ型和Ⅶ型各2株,Ⅳ、Ⅴ、Ⅵ、Ⅷ型各1株。见图6。

图5 部分临床菌株KPC基因电泳图
M:Marker;8号株的KPC基因阴性,其他菌株均为阳性

图6 部分临床菌株ERIC-PCR基因分型图谱
M:Marker;1、2、9为Ⅰ型;3、4、5、8、12、13、15、17为Ⅱ型;6、7为Ⅲ型;10为Ⅳ型;11为Ⅴ型;14为Ⅵ型;16为Ⅶ型
3 讨论
肺炎克雷伯菌在临床和医院感染中是重要的致病菌,对外界有强烈的抵抗力。我院25株CRKP药敏结果显示,复方新诺明的敏感率为72%,对米诺环素的敏感率为92%,其他抗菌药物均高度耐药。提示CRKP常常伴随对其他抗生素也耐药,形成多重耐药,给临床抗感染治疗带来极大困难,而临床治疗CRKP感染可以选用四环素类抗生素和复方新诺明。
CLSI在2009年推荐了MHT试验,该实验用于检测肠杆菌科细菌碳青霉烯酶的表型,是一种常规的方法。2015年时,CLSI引进了Carba NP试验,该实验除可用于检测肠杆菌科,还可以检测铜绿假单胞菌和不动杆菌属碳青霉烯酶的表型[3]。mCIM是由Van et al[4]发现的快速检测碳青霉烯酶的实验,并于2017年CLSI新指南推荐采用mCIM检测碳青霉烯酶。它们共同优点在于使用简便,并且成本很低,检测具有很高的准确率,因此,适合临床微生物室开展,被广泛用于检测产碳青霉烯酶肠杆菌科细菌。唐海玲 等[5]通过与PCR法比较,用Carba NP试验方法,筛查多重耐药革兰阴性杆菌产碳青霉烯酶,具有97.06%的敏感性和100%特异性,效果很好。同时文献[6]也表明Carba NP试验在检测KPC、NDM、VIM、IMP、SPM和SME型碳青霉烯酶方面具有较好的敏感性(>90%)和特异性(>90%)。Tijet et al[7]用mCIM与Carba NP两种方法检测182株肠杆菌科细菌,两者均可有效地检测出碳青霉烯酶。余佳佳 等[8]用mCIM,以154株临床分离的肠杆菌科细菌为对象,筛查出了产碳青霉烯酶的细菌,将其与MHT结果进行比较发现,mCIM具有符合率和特异性高、结果易于观察等优势。该实验25株CRKP分别进行Hodge、Carba NP和 mCIM试验,结果发现三组试验结果相同,有24株阳性,占总数的96%,非常接近储雯雯 等[9]报道的阳性率93.2%。碳青霉烯酶筛选试验阳性的24株CRKP进行PCR扩增和电泳分析,共出现23个目标带,PCR扩增产物测序结果都是KPC-2型耐药基因,1株PCR阴性的菌株耐药机制有待于进一步深入研究。
MHT试验不足之处是其特异度表现上不够,尤其在弱阳性菌株检测时,很难分析Hodge试验的结果。Carba NP试验可以快速检测碳青霉烯酶的表型,但需要特殊的试剂以及无法检测某些碳青霉烯酶(如染色体编码的OXA型碳青霉烯酶),在检测OXA-232型碳青霉烯酶存在一定的假阴性。且目前CLSI只有肠杆菌科细菌标准的mCIM。同种细菌在金属酶的特异性作用下可能会出现不同的金属酶基因,检测相应的基因就需要设计不同的引物,且只能检测已知耐药基因,因此耗时长。因此我们主要采用EDTA作为酶抑制剂,结果发现金属酶检测试验结果均为阴性,可能产其他型酶,有待检测。
25株CRKP主要来自ICU和血液内科,且标本类型主要为血液标本。通过ERIC-PCR分型,25株肺炎克雷伯菌可分为8个亚型:Ⅰ型3株,Ⅱ型14株,Ⅲ型和Ⅶ型各2株,Ⅳ、Ⅴ、Ⅵ、Ⅷ型各1株。该8个型别分布于多个科室,未呈现出集中于某个科室。
综上所述,MHT试验、Carba NP试验和mCIM试验,对于碳青霉烯酶的筛查均快捷、简单、易行。此外,我院产碳青霉烯酶肺炎克雷伯菌的基因型主要为KPC-2,其耐药形式严重,而四环素类药物对其有良好的体外抗菌活性。因此临床要加强防范,合理应用抗生素治疗该菌的感染及监控耐药株的传播。

