扫帚状氧化铈制备及其对Pt基阳极催化剂催化性能的影响
莫逸杰 郭瑞华*,, 安胜利 郭乐乐 张捷宇 周国治
(1内蒙古科技大学材料与冶金学院,包头 014010)
(2内蒙古自治区先进陶瓷材料与器件重点实验室,包头 014010)
(3上海大学材料科学与工程学院,上海 200072)
燃料电池是一种将燃料及氧化剂的化学能转变为电能的新型发电设备[1],具有高效、绿色环保、噪声低等优点[2]。直接乙醇燃料电池(DEFC)是以乙醇作为能量来源,通过化学反应转变为电能的设备[3]。而乙醇由于其来源广泛,无毒,渗透率低,能量密度高,可再生等优点而备受关注[4-5]。DEFC因其具有环保、便携、操作便利等优势,它的开发研究可作为未来交通运输和便携式电子设备的电源[6-7]。目前对DEFC的研究鲜有突破性进展,原因主要是催化剂活性较低而成本较高[8-9]。因此,开发高效乙醇氧化电催化剂是直接乙醇燃料电池技术进步的关键[10-11]。
目前低温燃料电池常用的阳极催化剂是Pt/C。然而,Pt易被低温乙醇电氧化过程中产生的类CO中间体毒害[12]。 通过添加 Rh[13]、Sn[14]和 Ni[15]等铂类助催化剂,可以减轻CO中毒的发生。二元Pt-Rh合金是DEFC中用于乙醇氧化的最先进的催化剂[16],但是Rh同样属于贵金属,因此限制了PtRh基催化剂在DEFC中的应用。有报道显示在Pt/C催化剂中直接添加金属氧化物(TiO2[17],ZrO2[18],MoO2[19],CeO2[20])能够有效地提高催化剂的抗CO中毒能力。其中,CeO2因其有2种有效作用机理而备受关注,一种是利用Ce的+3/+4变价,将CeO2看成储氧放氧的容器,O2浓度较低时放氧,较高时储氧,从而减弱CO的吸附反应;另一种是“双功能机理”,通常情况下是利用CeO2表面吸附的含氧活性物质将Pt表面吸附的CO氧化,生成CO2后逸出。具体是在低电位时吸附大量的含氧物种如-OHads。高电位时由CeO2吸附的含氧物种-OHads与Pt表面的CO进行氧化反应生成CO2。根据上述2种原因,稀土氧化物CeO2利于CO的氧化脱除[21-23]。此外,氧化钵的低价格有助于降低DEFC的成本。因此,氧化钵是用于Pt基催化剂的有前景的助剂。近年来,微波辅助乙二醇还原法由于其具有所制备催化剂粒径小且分散度高,反应速度快,反应温度控制便利等优点,被广泛应用于碳载金属催化剂的制备[24-25]。因此,为了解决催化剂易被CO毒化,电催化性能较低等问题,以含有丰富官能团的石墨烯为载体,通过添加扫帚状CeO2作为辅助催化剂,采用微波辅助乙二醇还原氯铂酸法制备Pt-CeO2/RGO催化剂(RGO代表还原态氧化石墨烯),探究扫帚状CeO2的添加对Pt基催化剂电催化性能的影响,这对于开发新型的高效、廉价Pt基催化剂用于燃料电池具有重要意义。
1 实验部分
1.1 样品的制备
1.1.1 CeO2的制备
将5.88 L的柠檬酸钠溶于80 mL去离子水中,随后加入2.4 L尿素,在磁力搅拌下形成混合溶液。同时,称取1.63 L六水硝酸钵溶于20 mL去离子水中搅拌均匀后,将六水硝酸钵溶液缓慢滴入上述混合溶液中,搅拌30 min,直到溶液变为淡黄色。将溶液置入反应釜并放入烘箱中,120℃下加热39 h,然后降至室温。抽滤后得到氧化钵前驱体在300℃焙烧4 h,即可获得CeO2样品粉末。
1.1.2 催化剂的制备
取50 mL乙二醇及自制的氧化石墨烯加入烧杯中, 向杯内加制备好的 CeO2(mRGO∶mCeO2=1∶0,1∶0.5,1∶1,1∶2,1∶3,RGO 与 CeO2的总质量为 30 mL),再滴入浓度为0.05 mol·L-1的H2PtCl6溶液。超声处理30 min。随后将上述溶液微波加热70 s,取出冷至不沸腾,此过程循环3次。然后磁力搅拌12 h,抽滤,干燥20 h,即可得到5组催化剂,如表1所示。其中1#为不加CeO2的空白对照组。
1.1.3 工作电极的制备
将玻碳电极依次用1.0和3.0μm的Al2O3粉在麂皮抛光布上磨至镜面,抛光后均用水和乙醇在超声波环境下清洗。配制含乙醇、水和5%(w/w)Nafion溶液的混合溶液,体积分数分别为20%、73.75%和6.25%。将4 mL催化剂与上述溶液混合,配成浆液,超声波处理30 min,使其充分分散。用微取样器移取5μL悬浮液滴涂到电极表面上,40℃干燥3 h,即制得工作电极。
1.2 性能表征
用日本D/max-rB X射线衍射仪对催化剂组成和结晶情况进行了分析,工作电压为40 kV,工作电流为15 mA,Cu Kα射线源为光源,波长为0.154 06nm,扫描范围为20°~80°;用中科鑫欣国际贸易有限公司的Apollo 300热场发射扫描电镜对所制备样品表面状态进行分析,加速电压为20 kV,工作距离为0.5 mm;用金埃谱比表面积及孔径分析仪测试材料的N2的吸附-脱附,计算BET比表面和孔径分布;用英国Thermo Scientific生产的ESCALAB 250ⅪX射线光电子能谱仪分析催化剂中各组成元素含量及存在状态;用荷兰生产的IVIUM电化学工作站对所制备催化剂进行电化学测试,测试使用三电极体系,铂丝对电极,饱和甘汞电极为参比电极,电位均相对于饱和甘汞电极,在测试之前向所用溶液中通入N2,时间约为30 min,以此来去除O2的影响。

表1 五种催化剂的RGO与CeO2质量比Table 1 Mass ratios of RGO to CeO2 for five kinds of catalysts
2 结果与讨论
2.1 CeO2性能表征
根据前期预实验,选择在水热温度为120℃,水热时间为39 h,焙烧温度为300℃的条件下制备CeO2。图1为所制备CeO2的XRD图,由图可知,样品 材 料 的(111)、(200)、(220)和(311)衍 射 峰 与 标 准PDF卡片上CeO2的典型特征峰相对应,为立方萤石结构。样品材料的尖锐衍射峰表明制备的CeO2纳米晶体具有较高的结晶度,并且没有出现杂质峰。
图2为不同放大倍数的CeO2SEM图,由图可知,CeO2呈现出扫帚状形态,纳米棒一端连接,另一端发散,且大小均匀分散性好。形成机理是:首先,反应物溶液于反应釜中结晶,形成了许多CeO2纳米晶体,随着反应过程的进行,这些纳米晶体在柠檬酸钠的协助下自主形成纳米棒。随着奥斯瓦尔德熟化过程的进行,许多纳米晶体在纳米棒表面形成并自组装。外部纳米粒子变大,内部纳米颗粒变小,最终由于纳米棒的外部和内部之间的晶体浓度差而消失,得到了具有多孔结构的纳米棒。同时,纳米棒之间的间隙逐渐收缩,变得彼此靠近,形成了多孔扫帚状结构[26]。扫帚状CeO2特殊之处在于三维开放式结构,因此,有利于反应物与产物之间的扩散,且其具有多孔、大比表面积特性,有利于提高催化剂粒子的分散性,适合用作催化剂助剂。

图2 不同放大倍数的CeO2SEM图FiL.2 SEM imaLes of CeO2 with different maLnifications

图3 CeO2的氮气吸附-脱附曲线(插图)及BJH孔径分布FiL.3 NitroLen adsorption-desorption isotherm(inset)and BJH pore size distribution of CeO2
图3 插图为CeO2粉体样品的N2吸附-脱附曲线。由图3可以看出,此等温线属于IUPAC分类中的Ⅳ型,H3滞后环。当相对压力p/p0较低时是单分子层吸附,相对压力不断升高,毛细管凝聚产生,在吸附脱附曲线上产生一个转折 (一般情况下p/p0≥0.4)。经BET(Brunauer-Emmett-Teller)模型分析计算得到氧化钵的比表面积为175 m2·L-1。图3为CeO2粉体样品的孔径分布曲线,由BJH(Barrett-Joyner-Halenda)模型得出氧化钵的孔径均在2~4 nm,处于介孔区域,因此本文所制备的CeO2具备较好的综合性能。

图1 CeO2的XRD图FiL.1 XRD pattern of CeO2
2.2 催化剂物理表征
2.2.1 催化剂的扫描电镜(SEM)表征
图4为4#催化剂的SEM照片及面扫、点扫分析,由图4(a)可知,CeO2保持原有扫帚状形貌,对图4(a)进行了面扫描分析(图4(b)~(d)),可知催化剂中C、Ce和Pt分布均匀。为了进一步证明Pt的分布,对图 4(a)中的点(1)、(2)做了点扫分析(图 4(e),(f)),从图中可以看出Pt在CeO2表面分布较少,约占6%,在石墨烯载体表面约占28%,表明Pt纳米粒子均匀地分布在石墨烯的表面,CeO2担载在石墨烯上。
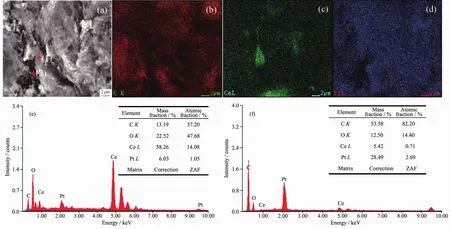
图4 4#催化剂的SEM图 (a)、面扫分析结果 (b~d)和图 (a)中点(1)、(2)的EDS分析结果 (e,f)FiL.4 SEM imaLe(a),plane scan analysis(b~d)and EDSanalysis of dot(1),(2)from(a)for 4#catalyst(e,f)
2.2.2 催化剂的X射线衍射(XRD)表征
图5为5种催化剂的XRD图,由图可知,所有催化剂在2θ=26.5°附近有1个(002)的衍射峰,这是石墨结构的有力证明,表明氧化石墨烯已经被还原。 此外, 3#、4#、5# 催化剂在 2θ=33.1°附近出现了CeO2的(200)衍射峰,而2#不明显,这是因为CeO2的含量较低(mRGO∶mCeO2=1∶0.5),在 XRD 中不能表现出来,但是 2#、3#、4#、5# 催化剂都在 2θ=28.5°、47.5°和56.3°出现了另外3个特征衍射峰,分别对应面心立方结构 CeO2的(111)、(220)和(311)晶面。各组催化剂在 2θ=39.8°、46.2°和 67.5°都出现了 3 个特征衍射峰,分别对应 Pt的(111)、(200)和(220)晶面。并且由图可知,与1#相比,2#~5#催化剂中Pt各晶面的衍射峰峰位并未偏移,说明CeO2的加入并未改变Pt的晶格参数。同时,2#~5#催化剂中Pt的衍射峰有明显宽化,说明加入扫帚状CeO2能够减小Pt纳米颗粒的晶粒尺寸,也能提高其分散度。
2.2.3 催化剂的X射线光电子能谱(XPS)表征
图6中是5种催化剂中Ce3d和Pt4f的XPS图谱。由于 2#~5#催化剂Ce3d XPS图谱Ce3+与Ce4+的结合能相差不大,因此选4#样品Ce3d XPS图谱为例。从图中可以看出,Ce3d中Ce4+的结合能主要位于 882、885、900、904 和 917eV 附近, 且在 917 eV附近存在Ce4+的指纹峰[27],说明催化剂中主要以Ce4+存在。Pt4f7/2金属态的结合能理论值为71.2 eV[28],5种催化剂结合能分别是 70.58、70.78、71.33、70.98和70.73 eV,接近理论值。同时由图可知,加入CeO2的2#~5#催化剂Pt4f7/2峰位较1#催化剂正移,表明Pt和CeO2之间有强的相互作用,使Pt/CeO2间产生双功能机理,且能使Pt粒子分散得更为均匀,提高催化剂的催化性能[29-31]。图中Pt金属态Pt4f7/2峰和Pt4f5/2峰的结合能为 70.58和 73.72 eV、70.78和74.53 eV、71.33 和 75.09 eV、70.98 和 74.83 eV、70.73和74.04 eV, 而Pt2+的Pt4f7/2峰和Pt4f5/2峰的结合能为 71.32和 74.53 eV、71.52和 75.36 eV、71.92和 74.64 eV、71.46和 74.35 eV、71.35和 74.47 eV,通过积分面积/XPS灵敏度因子计算结果如表2所示,由表可以看出,5种催化剂中Pt主要以金属态形式存在, 当 mRGO∶mCeO2=1∶2 时,Pt金属态含量最高。

图5 五种催化剂的XRD衍射图FiL.5 XRD patterns of five kinds of catalysts
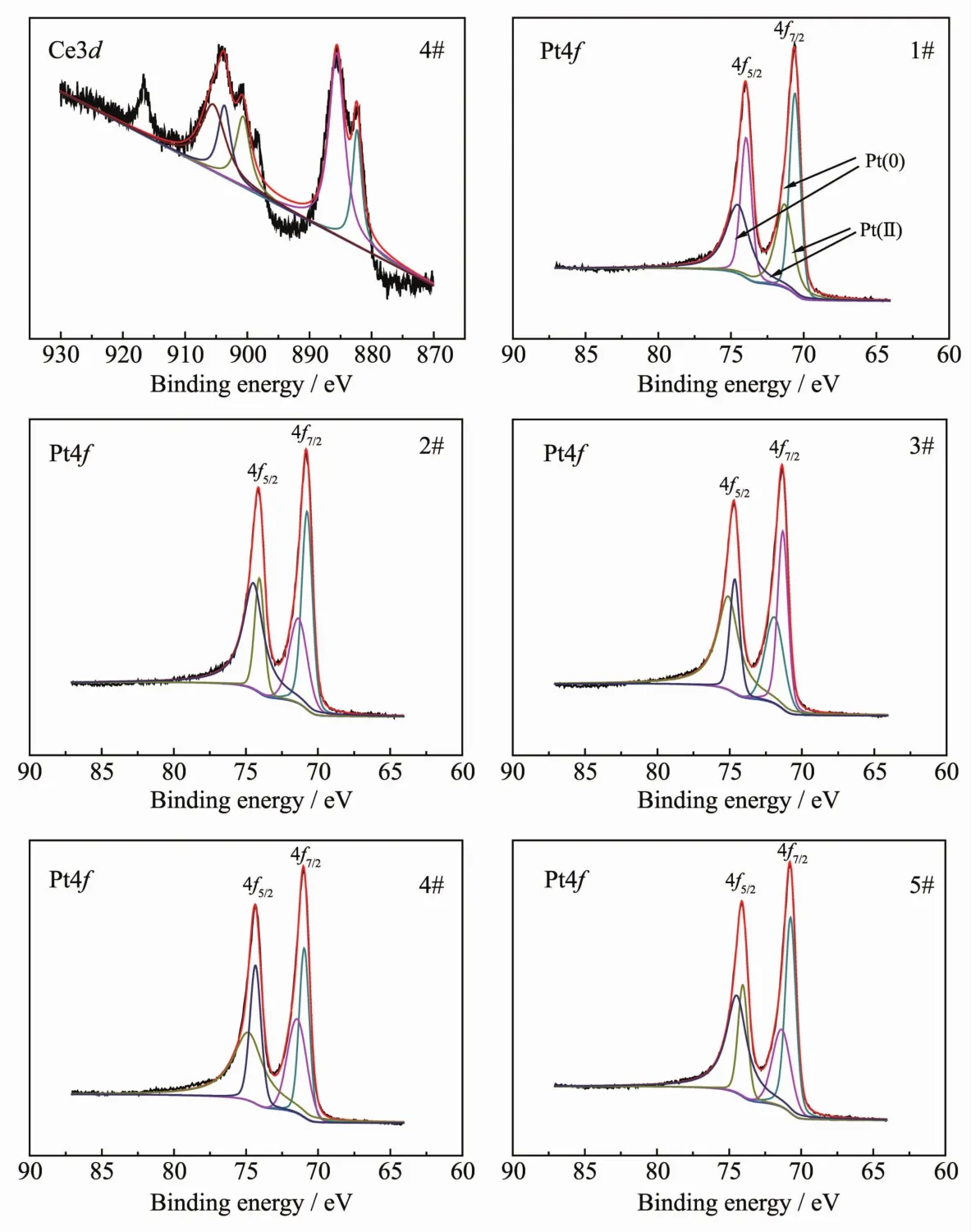
图6 五种催化剂中Ce3d和Pt4f的XPS图谱FiL.6 XPSspectra of Ce3d and Pt4f for five catalysts

表2 五种催化剂的XPS图谱分析数据Table 2 XPSdata and the possible chemical states of five catalysts
2.3 催化性能分析
2.3.1 催化剂的电化学活性表面积
图7表示的是5种催化剂在饱和N2的0.5 mol·L-1H2SO4溶液中的循环伏安曲线,扫描速度是50 mV·s-1,电位范围为-0.3~0.6 V。 由图可以看出 5种催化剂都在-0.3~-0.2 V附近出现H的脱附峰。催化剂的电化学活性表面积(ESA)根据下式计算[32]:

式中,QH(C)代表H脱附时的电量,mPt(L)代表电极上担载的Pt的质量,S(mA·V)代表H脱附峰的面积,v(mV·s-1)代表扫描速度,0.21 mC·cm-2是 H 在Pt单位表面积吸附所需的电量。5种催化剂的电化学活性表面积如表3所示。由表可以看出5种电催化剂的电化学活性表面积大小排序为 4#>3#>5#>2#>1#。由此可知,添加了扫帚状CeO2的2#~5#催化剂的电化学活性表面积均大于1#催化剂,这是由于扫帚状CeO2具有多孔、大比表面积特性,可有效提高Pt纳米粒子的分散度,减小其粒径,从而提高催化剂的电化学活性表面积[33]。同时可知,4#催化剂(mRGO∶mCeO2=1∶2)的电化学活性表面积最大,约为 1#催化剂的2倍。在相同的Pt负载量下,催化剂的不同ESA是由于不同的CeO2含量对Pt粒子分散度及载体电导率的影响导致的。当mRGO∶mCeO2增加至1∶2时,Pt颗粒分散度最优,尺寸最合适,因此ESA增加了。但当mRGO∶mCeO2超过1∶2时,载体的电导率受到很大影响,因此ESA降低。因此,添加适量的扫帚状CeO2能够提高催化剂的电化学活性表面积。

图7 五种催化剂在饱和N2的0.5 mol·L-1 H2SO4溶液中的循环伏安曲线FiL.7 Cyclic voltammetric curves of five catalysts in 0.5 mol·L-1 H2SO4 solution saturated with N2
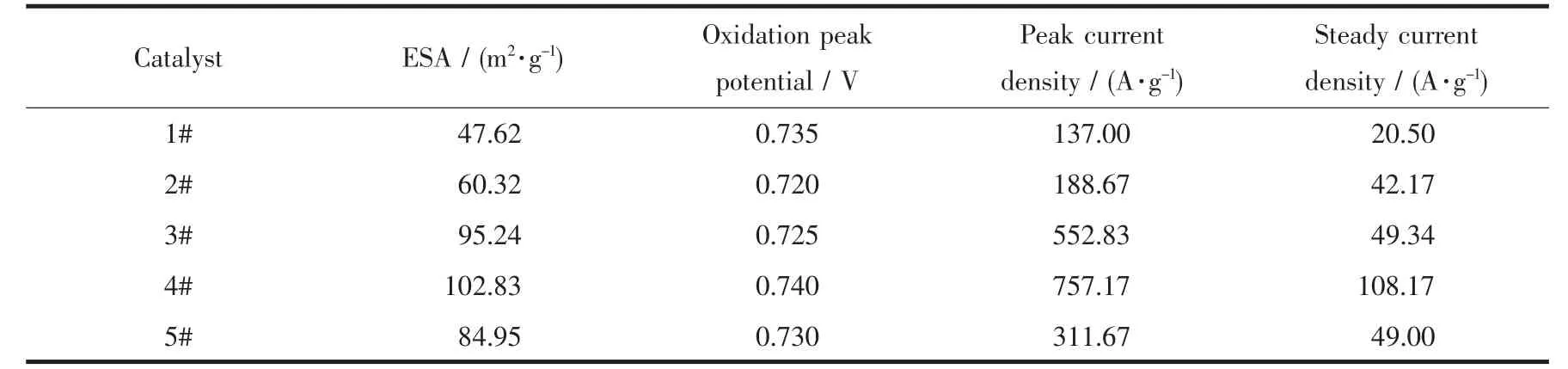
表3 五种催化剂的电化学活性表面积、氧化峰电位及电流密度Table 3 Electrochemical activity of five catalysts:active surface area,oxidation peak potential and current density
2.3.2 催化剂的乙醇循环伏安表征
图8为5种催化剂在1 mol·L-1CH3CH2OH+0.5 mol·L-1H2SO4溶液中对乙醇电化学氧化的循环伏安曲线,扫描速度为50 mV·s-1,电位范围为0.0~1.2 V。从图中可以看出,5种催化剂在正扫时产生2个氧化峰,负扫时产生1个氧化峰,并且其对应的氧化峰峰值电位相近。正扫时在0.0~0.4 V范围内,电流密度上升幅度较小;0.4~0.8 V区域出现了电流密度峰值,主要对应乙醇完全氧化生成CO2,但在0.7~0.9 V区域,电流密度出现了下降;电位升高到1.0~1.1 V区域,出现乙醇氧化电流密度峰值,对应乙醇部分氧化生成乙醛和乙酸;在电位负扫区域,正扫时产生的氧化物(Pt-O)被还原,释放了表面活性位,对乙醇的催化氧化能力恢复。由于正扫第一个峰对应于乙醇完全氧化生成CO2的过程,且氧化峰电流密度一般作为评估乙醇电化学氧化的指标[20],所以本文选择使用正扫第一个峰的电流密度来评估催化剂的催化性能。5种催化剂对乙醇氧化的峰电流密度如表3所示,由表可以看出峰电流密度大小排序为 4#>3#>5#>2#>1#。 可知, 添加了扫帚状 CeO2的2#~5#催化剂的氧化峰电流密度均高于1#催化剂,这是由于扫帚状CeO2具有三维开放式结构,利于反应物与产物之间的扩散,且CeO2的储-放氧作用以及Pt/CeO2间的双功能机理提高了催化剂的抗CO中毒能力,从而有效提高了催化剂的催化效率。同时可知,4# 催化剂(mRGO∶mCeO2=1∶2)的峰电流密度最大,说明添加适量的扫帚状CeO2有利于提高催化剂对乙醇氧化的峰值电流密度。因此,4#催化剂(mRGO∶mCeO2=1∶2)具有较好的对乙醇催化氧化的能力。

图 8 五种催化剂在 1 mol·L-1 CH3CH2OH+0.5 mol·L-1 H2SO4溶液中的循环伏安曲线FiL.8 Cyclic voltammetric curves of five catalysts in 1 mol·L-1 CH3CH2OH+0.5 mol·L-1 H2SO4 solution
2.3.3 催化剂的I-t曲线表征
图 9为 5种催化剂在饱和 N2的 1 mol·L-1CH3CH2OH+0.5 mol·L-1H2SO4溶液中的 I-t曲线,测试电位为0.6 V,测试时间为1 100 s。由图可知,5种曲线均有下降趋势,这是由于催化剂被乙醇氧化反应所产生的中间物种如CHOads和COads等毒化,使电流密度急剧降低。随着反应的进行,Pt表面吸附的中间物种氧化脱附与吸附过程趋于平衡,电流密度趋于稳定。当反应时间为1 000 s时,5种催化剂的稳态电流密度如表3所示。由表可看出稳态电流密度大小顺序为 4#>3#>5#>2#>1#。 综合分析图 9,4# 催化剂的稳定性及抗CO中毒能力最好,对乙醇的催化氧化性能最佳,与图8循环伏安分析相吻合。

图9 五种催化剂在饱和N2的1 mol·L-1 CH3CH2OH+0.5 mol·L-1 H2SO4溶液中的 I-t曲线FiL.9 I-t curve of five catalysts in 1 mol·L-1 CH3CH2OH+0.5 mol·L-1 H2SO4 solution
2.3.4 催化剂的电化学阻抗谱表征
图10为5种催化剂在0.4 V电位下及1 mol·L-1CH3CH2OH+0.5 mol·L-1H2SO4溶液中的交流阻抗Nyquist图,频率范围为 1×105~0.1 Hz;交流信号正弦波振幅为10 mV。在醇类催化的交流阻抗Nyquist图中,右半圆的直径主要表示醇类催化反应中所产生的电荷转移电阻,其与醇类催化反应进行的难易程度相关[34]。因此,由图可知,添加了扫帚状CeO2的2#~5#催化剂的电荷转移电阻均小于1#催化剂,这说明扫帚状CeO2的加入提高了Pt颗粒的分散度,同时其三维开放式结构增强了催化剂的质子传导性,有利于电荷转移电阻的降低,乙醇的催化反应更容易进行。同时可看出,当mRGO∶mCeO2增加至1∶2时,Pt颗粒的分散度最好,催化剂的质子传导性最佳,因此电荷转移电阻最小,但当mRGO∶mCeO为 1∶3时,电荷转移电阻又出现了增加,可以解释如下:当CeO2添加过量时,其作为非导电性物质会对催化剂载体的导电性产生不良影响,因此催化剂的电荷转移电阻会随之增大,乙醇的催化反应较难进行。综合分析图10,4#催化剂的电荷转移电阻最小,乙醇的催化反应最容易进行,与上述循环伏安及计时电流曲线分析相吻合。
2.3.5 催化剂的变温循环伏安曲线-阿伦尼乌斯方程

图10 五种催化剂在0.4V电位下及1 mol·L-1 CH3CH2OH+0.5 mol·L-1 H2SO4溶液中的交流阻抗Nyquist图FiL.10 Nyquist plots of impedance spectroscopy for five catalysts in 1 mol·L-1 CH3CH2OH+0.5 mol·L-1 H2SO4 solution at 0.4 V
在25~60℃范围内对1#~5#催化剂进行循环伏安测试,电解液为 1 mol·L-1CH3CH2OH+0.5 mol·L-1H2SO4溶液,扫描速度为50 mV·s-1,电位范围为0.0~1.2V,得到了5种催化剂的变温循环伏安曲线(图11)。其阿伦尼乌斯方程为:

其中ip是峰电流密度,R是理想气体常数,K是常数,Ea是阿伦尼乌斯活化能,T是温度。将(2)式变换可得:

由图11可知,随温度的升高,5种催化剂正扫第一个峰的峰值电流密度逐渐增大。这是由于随着温度在一定范围内升高,催化剂对乙醇催化氧化反应速率提高,反应产物如CO或CO2均以气体形式逸出,反应朝正向进行,提高了峰值电流密度。

以ln ip对1/T作图,拟合之后可以得到斜率k,由k=-Ea/R计算得到乙醇催化氧化的活化能Ea,如图11(f)所示。拟合之后得到各样品的斜率分别是-6.44、-5.82、-3.61、-2.50 和-4.62, 相应的活化能分别是 53.54、48.39、30.01、20.79 和 38.41 kJ·mol-1,其中3#和4#催化剂的活化能低于文献报道的Pt/C催化剂的 33 kJ·mol-1[35]。同时可知,与 1# 相比,加入扫帚状CeO2的2#~5#催化剂的活化能明显降低,反应更容易发生,且 4#(mRGO∶mCeO2=1∶2)的活化能最低,这与上述电化学测试的结论一致。

图11 五种催化剂的变温循环伏安曲线(a~e)及阿伦尼乌斯方程拟合曲线(f)FiL.11 Cyclic voltammetry at various temperatures(a~e)and fittinLcurves of Arrhenius equation(f)for five catalysts
3 结 论
采用水热法,以柠檬酸钠为形貌控制剂,根据奥斯瓦尔德熟化与晶体生长机制,合成了比表面积为 175 m2·L-1,孔径在 2~4 nm范围内的扫帚状CeO2。再采用微波辅助乙二醇还原氯铂酸法成功合成了Pt-CeO2/RGO催化剂。通过XPS测试证实了Pt纳米颗粒与CeO2间存在强的相互作用。电化学性能测试结果表明,添加扫帚状CeO2催化剂的催化性能均优于未添加的催化剂。同时,催化剂的电催化性能取决于扫帚状CeO2的添加量,当mRGO∶mCeO2=1∶2时,催化剂对乙醇的催化氧化活性、稳定性最佳,乙醇在该催化剂上催化反应的电荷转移电阻最小,活化能最低。因此,Pt-CeO2/RGO催化剂可以作为直接乙醇燃料电池的廉价、高效的阳极催化剂。

