茶树CsCCD1和CsCCD4基因的克隆和表达分析
王 赞,岳 川,曹红利,郭雅玲
(福建农林大学 园艺学院, 茶学福建省高校重点实验室, 福州 350002)
类胡萝卜素是一类异戊二烯四萜类化合物,总数超过700种,大部分来源于具有40个碳骨架的四环戊二烯(C40)[1]。类胡萝卜素为植物花、叶、茎和果实提供丰富的颜色,参与了光能捕获、传递和光保护过程[2],并在酶的作用下形成重要的植物激素前体化合物和具花果香的挥发性物质[3]。
Tan等[4]第一次从玉米胚胎中鉴定出与ABA合成代谢相关的类胡萝卜素裂解氧化酶VP14,根据同源性分析在拟南芥中确定9条类胡萝卜素裂解氧化双加氧酶基因[5],分为类胡萝卜素裂解双加氧酶基因(carotenoid cleavage dioxygenases,CCD)和9-顺式-环氧类胡萝卜素裂解双加氧酶基因(nine-cis-epoxycarotenoid dioxygenases,NCED)[6]。其中,NCED是ABA合成的关键基因[7],CCD7和CCD8是独脚金内酯合成的关键基因[8-9]。CCD1和CCD4则氧化裂解多种类胡萝卜素和脱辅基类胡萝卜素,生成具有花果香气的香气物质[10-11],如β-紫罗酮、α-紫罗酮、香叶基丙酮和二氢海葵内酯等[12],是园艺植物中的关键风味物质。Rubio等[13]发现无论在藏红花(Crocussativus)或者大肠杆菌中,藏红花CsCCD1和CsCCD4都可以通过β-胡萝卜素生成β-紫罗酮。
香气是乌龙茶重要的品质因子之一,也是评判乌龙茶做青质量的重要因素,在做青过程中主要产生各种挥发性物质,才能形成乌龙茶天然花果香的独特风格[14-16]。乌龙茶香气主要包括萜类、类胡萝卜素类、脂类及糖苷衍生物,乌龙茶香气形成机制之一是类胡萝卜素氧化裂解[17],从而产生β-紫罗酮、香叶基丙酮、茶香螺酮等香气组分[18]。通过PCA分析显示β-紫罗酮是乌龙茶特征性香气成分[19],这些香气成分具有低阈值的特点,比如β-紫罗酮阈值为0.2 μg/L,因此在形成乌龙茶天然花果香中发挥关键作用[20-21]。Wang等[22]研究表明茶叶中富含胡萝卜素和叶黄素,这也为类胡萝卜素氧化裂解酶提供了充足底物。已有研究显示,乌龙茶做青调控茶树脂氧合酶[23]和单萜合成酶[24]表达,与乌龙茶香气形成密切相关。
虽然类胡萝卜素裂解是乌龙茶香气形成途径之一,但其机制还不明确,CsCCD1和CsCCD4在乌龙茶加工过程中的表达模式研究还罕有报道。本试验以铁观音嫩梢为材料,克隆得到CsCCD1和CsCCD4全长cDNA序列,并对其进行生物信息学分析。利用qRT-PCR技术检测了CsCCD1和CsCCD4在茶树不同组织部位和乌龙茶做青的表达模式,为明确CsCCD1和CsCCD4在乌龙茶加工过程香气形成的作用提供理论参考。
1 材料和方法
1.1 试验材料
铁观音茶树种植于福建农林大学园艺学院教学茶山,2017年10月中旬采制以下试验材料:
(1)采摘铁观音茶树嫩梢第二叶,提取总RNA和cDNA用于后续的RT-PCR实验。
(2)采集铁观音茶树根、茎、第二叶、花和成熟果,用于检测CsCCD1和CsCCD4组织特异性表达。
(3)采集铁观音茶树中开面一芽三叶嫩梢进行乌龙茶加工,对鲜叶、晒青、一摇、二摇、三摇和杀青前各工序在制品二叶取样,用于检测在乌龙茶做青过程中的表达模式。
所有试验均设置3次生物学重复,取样后立即用液氮冷冻随即转入-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1总RNA提取和cDNA的合成按照天根多糖多酚植物总RNA提取试剂盒提取茶树总RNA,1%琼脂糖凝胶电泳检测完整性,使用NanoDrop2000超微量分光光度计测定浓度和纯度。采用TaKaRa的PrimeScriptTM1st strand cDNA Synthesis Kit试剂盒合成cDNA。
1.2.2CsCCD1和CsCCD4基因克隆CsCCD1和CsCCD4基因序列从转录组数据[25]得到,在ORF两端设计引物(表1)进行RT-PCR,参照TransTaq®DNA Polymerase High Fidelty (HiFi)试剂盒进行。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃反应2 min,72 ℃延伸10 min,35个循环。采用1%琼脂糖凝胶电泳验证,PCR产物按照天根通用型DNA纯化回收试剂盒回收。新鲜胶回收产物立即连接到pEASY-Blunt Zera Cloning载体,转入Trans1-T1感受态细胞在氨苄青霉素固体LB培养基37℃培养过夜,挑选3个阳性克隆菌液送至北京华大基因科技有限公司测序。

表1 引物序列
1.2.3CsCCD1和CsCCD4生物信息学分析利用DNAStar软件进行ORF查找,使用DNAMAN软件进行氨基酸预测。使用ProtParam、TargetP、SingalP 4.1 Server、ChloroP软件对编码氨基酸序列进行生物信息学分析。利用MEME Suit 4.12.0和TMHMM server 2.0软件进行Motif和跨膜结构分析。使用GOR4、SWISS-MODEL在线分析工具构建蛋白质二、三级结构并用Pymol软件编辑输出。使用DNAMAN软件进行多序列比对。利用MEGA7.0软件构建系统发育进化树。
1.2.4CsCCD1和CsCCD4实时荧光定量PCR表达分析在NCBI Ptimer-Blast上设计荧光定量PCR引物(表1),采用TransStart®Tip Green qRT-PCR superMix试剂盒10 μL体系,分别以茶树ACTIN1和EF1为内参基因,检测CsCCD1和CsCCD4在铁观音茶树组织部位、乌龙茶做青过程中的表达量。实验结果利用Excel 2016按照2-ΔΔCt方法进行计算,SPSS 21.0软件进行ANOVA分析,利用GraphPad Prism 6绘图。
2 结果与分析
2.1 CsCCD1和CsCCD4基因克隆
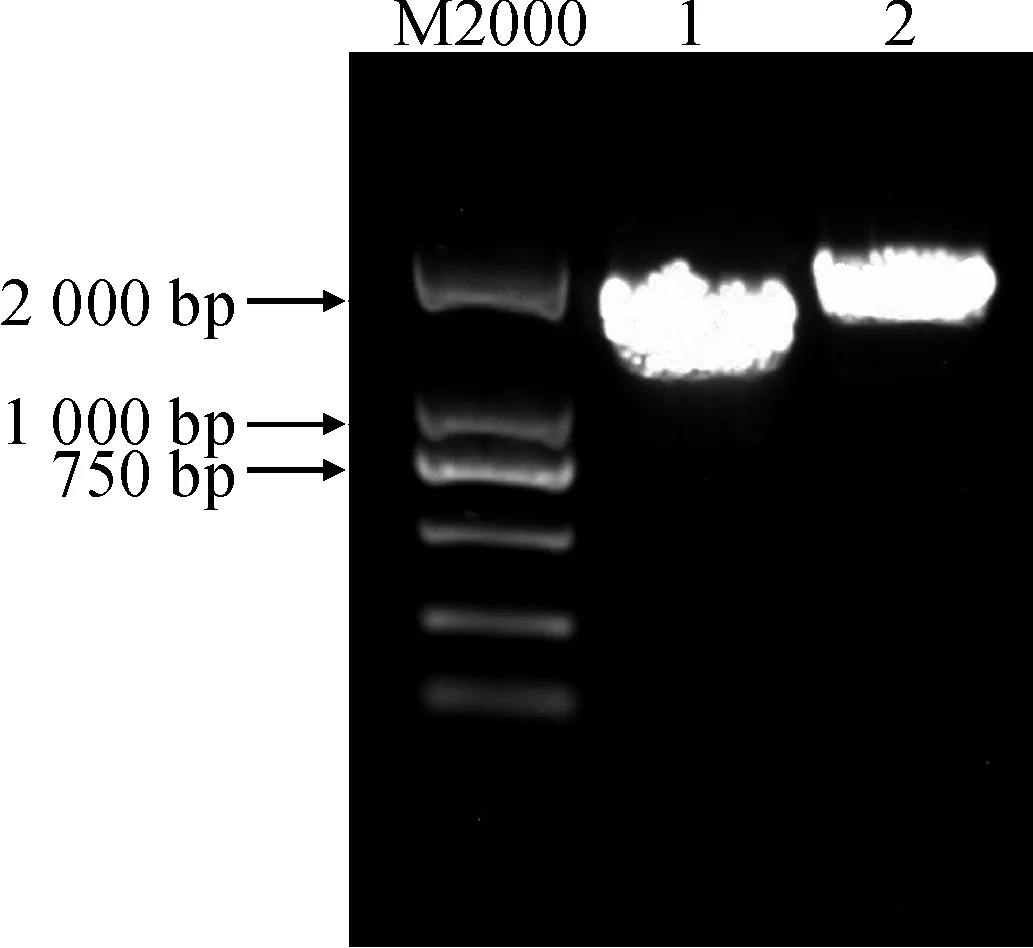
1.CsCCD1;2.CsCCD4 图1 CsCCD1和CsCCD4基因全长扩增Fig.1 The full length amplification of CsCCD1 and CsCCD4
通过RT-PCR技术得到基因全长cDNA(图1),序列拼接结果通过NCBI比对发现具有完整ORF,与其他物种CCD1和CCD4具有高度相似性,命名为CsCCD1和CsCCD4 (NCBI登录号分别为MH119136和MH119137)。CsCCD1序列全长1 766 bp,包含1 641 bp ORF,编码545个氨基酸。CsCCD4序列全长1 942 bp,包含1 842 bp ORF,编码612个氨基酸。
2.2 CsCCD1和CsCCD4蛋白质的理化性质预测和结构分析
理化性质预测结果显示,CsCCD1相对分子量为61.62 kD,理论等电点为5.74, 不稳定系数30.03,平均亲水系数-0.250,推测为稳定的亲水蛋白。CsCCD4相对分子量为66.75 kD,理论等电点为5.99,不稳定系数41.70,平均亲水系数-0.186,推测为不稳定的亲水蛋白。
TMHMM server 2.0、TargetP、SingalP4.1 Server、ChloroP在线分析软件显示,CsCCD1和CsCCD4不具有跨膜结构和信号肽序列,属于非分泌蛋白。CsCCD1位于细胞质中,CsCCD4定位于叶绿体上。叶绿体转运肽预测结果显示CsCCD1不存在N端叶绿体转运肽序列,而CsCCD4在N端存在42个氨基酸残基的叶绿体转运肽序列,与前人研究结果一致[28-29]。
GOR4预测编码蛋白质二级结构结果显示,CsCCD1的α-螺旋占27.47%,延伸链占22.89%,无规则卷曲占49.63%。CsCCD4的α-螺旋占21.37%,延伸链占17.29%,无规则卷曲占61.34%。用PyMOL软件编辑输出蛋白质三维结构(图2),CsCCD1和CsCCD4均与玉米VP14蛋白(3npe.1.A)相似性最高,分别达到39.92%和39.88%,GMQE分值为0.71和0.64。
2.3 CsCCD1和CsCCD4蛋白质同源比对和进化树分析
同源性和保守结构域分析显示,CsCCD1和CsCCD4序列具有CCD家族保守结构域RPE65。CsCCD1与杜鹃RjCCD1(BAT32878.1)相似度为88%。CsCCD4与杜鹃RjCCD4(BAT32880.1)相似度达到76%。
利用DNAMAN软件与其他植物中的CCD蛋白进行多序列比对,结果显示(图3,A、C),茶树CsCCD1和CsCCD4同其他物种具有较高的保守性,已有研究结果表明通过4个严格保守的组氨酸Fe2+活性位点发挥作用[30]。其中CsCCD4还包括了特有的谷氨酸和天冬氨酸位点,用来固定结合Fe2+[31-32]。MEME保守结构预测显示(图3,B、D),CsCCD1和CsCCD4中含有5个主要的motif,贯穿整个RPE65。利用茶树CsCCD1和CsCCD4蛋白序列同其他物种构建系统进化树,分析表明(图4),CsCCD1和CsCCD4均与杜鹃聚在一起,说明茶树与杜鹃亲缘关系最近。
2.4 CsCCD1和CsCCD4基因的表达分析
茶树CsCCD1和CsCCD4在根、茎、叶、花、果实中均有表达(图5,A),但差异巨大,并且表达模式是相似的。在茎、叶和花中表达量较高,其中在叶中表达量最高。整体来看,CsCCD1不同组织部位中的表达水平为叶>花>茎>果>根,CsCCD4为叶>茎>花>果>根。
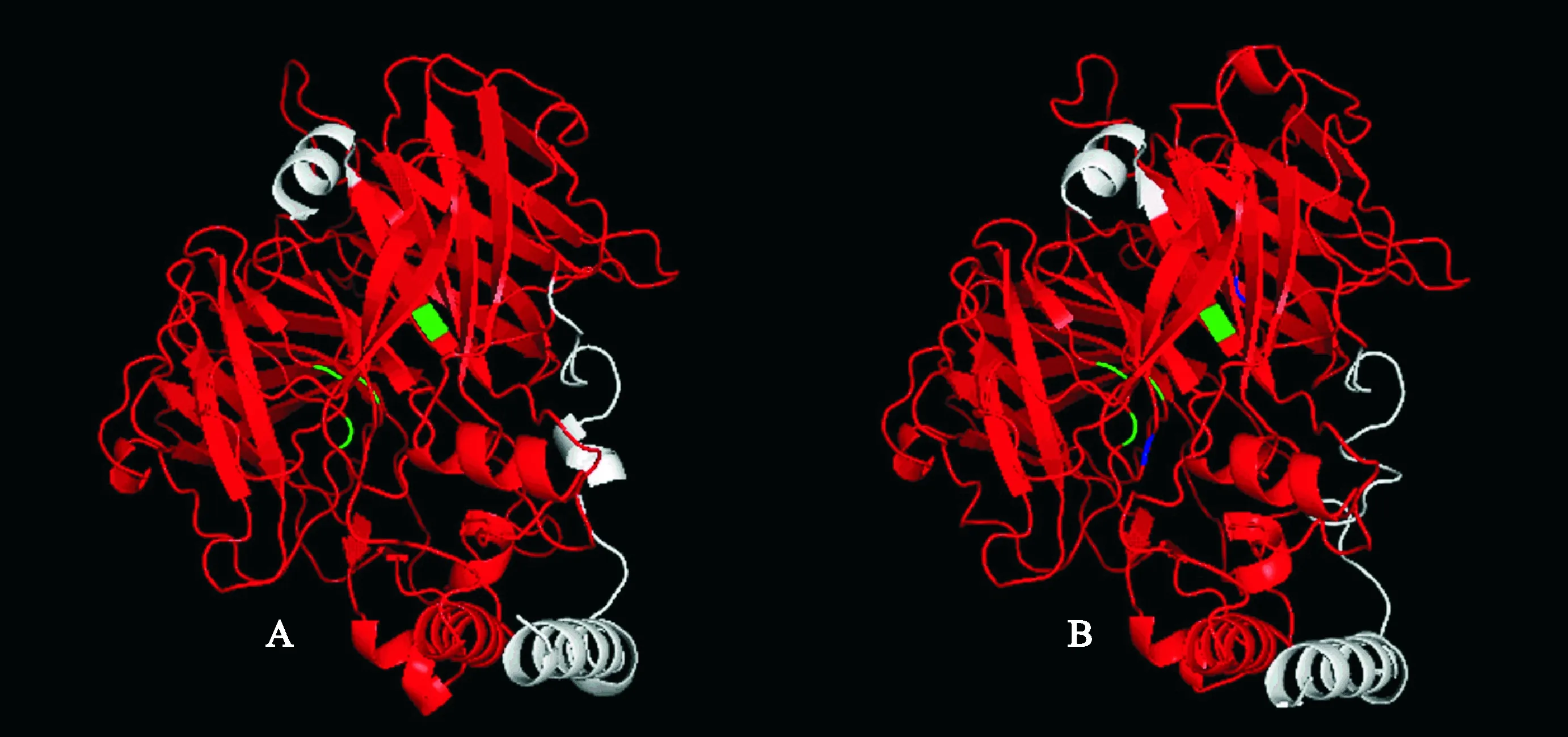
4个严格保守的Fe2+活性位点用绿色表示,谷氨酸和天冬氨酸固定位点用蓝色表示,红色为CCD蛋白特征保守结构域序列图2 CsCCD1(A)和CsCCD4(B)蛋白三维结构Four strictly conserved iron-coordinating residues in green. Glutamates or aspartates fixing in blue. The conserved domain of CCD protein in red. Fig.2 Three-dimensional structure analysis of CsCCD1 (A) and CsCCD4 (B) proteins
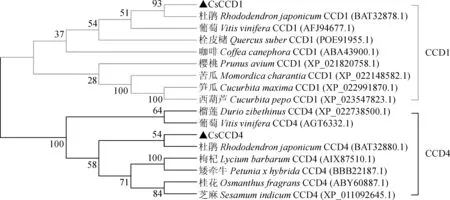
图4 CsCCD1和CsCCD4系统发育树Fig.4 Phylogenetic tree of CsCCD1 and CsCCD4

CsCCD1、CsCCD4.茶树;RjCCD1、RjCCD4. 杜鹃(BAT32878.1、BAT32880.1);CmCCD1.笋瓜(XP_022991870.1);VvCCD1.葡萄(AFJ94677.1);PhCCD4.矮牵牛(BBB22187.1);LbCCD4.枸杞(AIX87510.1); 方框中为叶绿体转运肽,下划线表示CCD家族保守结构域,*表示4个保守的Fe2+活性位点,△表示谷氨酸和天冬氨酸固定位点图3 多序列比对(A、C)和MEME保守域预测(B、D)CsCCD1, CsCCD4.Camellia sinensis; RjCCD1, RjCCD4.Rhododendron japonicum;CmCCD1.Cucurbita maxima; VvCCD1.Vitis vinifera; PhCCD4. Petunia hybrida;LbCCD4. Lycium barbarum; A putative chloroplast-targeting transit peptide is framed, the conserved domain of CCD protein is underlined, * expression four strictly conserved iron-coordinating residues, △expression Glutamates or aspartates fixingFig.3 Multiple alignment(A,C) and motif prediction(B,D) analysis using MEME database
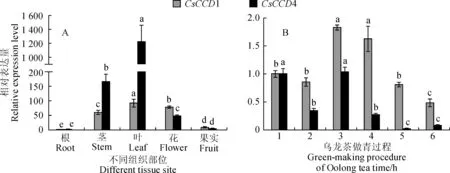
不同小写字母表示在0.05水平上差异显著;1.鲜叶;2.晒青;3.一摇;4.二摇;5.三摇;6.杀青前图5 CsCCD1和CsCCD4的表达分析Different normal letters indicate significant difference at 0.05 level. 1. Leaves;2. Solar withering;3. First tumbling;4. Second tumbling;5. Third tumbling;6. Before fixationFig.5 Expression analysis of CsCCD1 and CsCCD4
乌龙茶加工包括了6个阶段,首先将鲜叶放置水筛在室外晒青30 min,茶树CsCCD1和CsCCD4表达模式一致(图5,B),从鲜叶到晒青下调表达,CsCCD4表达量下降显著。一摇至三摇阶段,分别利用水筛每隔2 h手工摇青3、8、10 min,并在每次摇青后凉青2h取样。在此阶段中,CsCCD1和CsCCD4在一摇后迅速显著上调达到峰值,CsCCD1表达量增加明显。虽然从一摇后均有下降,但CsCCD1在一摇至三摇一直保持在较高水平。三摇结束后摊放5 h至杀青前,CsCCD1表达量才显著低于鲜叶,而CsCCD4表达量在一摇后迅速下调至较低水平,显著低于鲜叶。
3 讨 论
本试验通过同源克隆得到茶树类胡萝卜素裂解双加氧酶基因CsCCD1和CsCCD4,其中CsCCD1的cDNA全长1 766 bp,编码545个氨基酸。CsCCD4的cDNA全长1 942 bp,编码612个氨基酸,系统发育树分别与杜鹃RjCCD1和RjCCD4聚为一类。NCBI比对发现具有CCD家族RPE65特征保守结构域,还有4个高度保守的Fe2+结合位点的组氨酸残基。CCD作为典型的非血红素铁氧酶,这种四重铁离子结构产生更高的极性中心,促进了底物与双氧位点结合[33]。CsCCD1定位于细胞质而CsCCD4则位于质体,CsCCD4的N端叶绿体转运肽,表明CsCCD1和CsCCD4作为类胡萝卜素双加氧酶在不同位点氧化裂解广泛的类胡萝卜素底物[13, 34]。
Wei等[35]研究表明番茄SlCCD1和SlCCD4在叶、茎和花中的表达量显著高于其他部位,特别是SlCCD4的差异更加明显,而菊花CmCCD4a在花器官和根中几乎不表达[36]。Tian等[37]发现枸杞LcCCD4不但在叶和花中强烈表达,结合主要类胡萝卜素组分分析提出LcCCD4表达水平与枸杞所含的β-胡萝卜素浓度高度一致。本试验中发现茶树CsCCD1和CsCCD4的组织特异性表达差异显著,在茶树叶、茎和花的表达强烈。茶树在叶片和嫩茎部位大量积累类胡萝卜素[38],说明基因表达与类胡萝卜素空间分布和基因亚细胞定位关系密切,同时也有研究表明CCD1和CCD4在分子水平上调控花器官的颜色、香气及生殖生长[36, 39-40]。
乌龙茶做青是形成天然花果香气的关键,类胡萝卜素的酶促氧化就发生在做青导致的半发酵过程中[17]。目前已经报道了多种茶树萜烯类香气合成酶受乌龙茶做青调控,Zhou等[41]和Mei等[42]的结果说明做青的机械振动显著提高了茶树橙花叔醇合成酶CsNES基因和芳樟醇合成酶CsLIS表达,导致橙花叔醇芳樟醇大量积累,其含量变化与基因表达模式一致,形成了乌龙茶典型香气。本研究显示茶树CsCCD1和CsCCD4在加工过程中表达相似,总体上看CsCCD1受做青调控更加明显,表达水平整体高于CsCCD4。一摇的CsCCD1表达量显著高于鲜叶和晒青叶,从三摇开始迅速降低,而CsCCD4则是在二摇后就快速降低。在酵母中表达覆盆子RiCCD1基因,可以积累β-紫罗酮和香叶基丙酮[43]。葡萄的VvCCD4基因可以裂解ζ-胡萝卜素和番茄红素,产生α-紫罗酮和香叶基丙酮等多种香气成分[44],并且基因表达与类胡萝卜素前体物质、香气含量之间高度相关[45]。Wang等[46]利用SPME-GC-MS检测发现,随着乌龙茶做青程度的加重,高沸点、具有天然花果香的香气含量大幅度提高,其中包含了多种里胡萝卜素裂解产物。在乌龙茶半发酵4~8 h内,α-紫罗酮、β-紫罗酮、香叶基丙酮和β-柠檬酸醛这些类胡萝卜素裂解产物含量显著增加,其中丰度最高的是β-紫罗酮[47]。综上所述,乌龙茶做青调控了CsCCD1和CsCCD4表达,推测参与了乌龙茶天然花果香味的形成,较CsCCD4而言,CsCCD1对香气形成更为重要。
目前,已经大量研究显示CCD1和CCD4通过降解类胡萝卜素调控植物颜色及风味,但在茶树中还未有深入研究。通过类胡萝卜素介导的香气形成途径对茶叶香气品质有重要作用,但其酶促降解机制还不清晰。因此,后续可以基于靶向代谢组学技术,将CsCCD1和CsCCD4基因表达与类胡萝卜素组分及香气组分进行综合分析。本研究同源克隆得到茶树CsCCD1和CsCCD4基因,分析讨论了在茶树不同组织部位和乌龙茶加工过程中的表达模式,推测其在乌龙茶香气形成中有重要作用,为茶树CsCCD1和CsCCD4基因功能验证提供理论依据。

