文心兰乙烯不敏感基因EIN2的克隆及表达分析
时 欢,李 蓉,高玉莹,林玉玲,杜宜殷,赖钟雄,黄鹏林,,3*
(1 福建农林大学 园艺植物生物工程研究所,福州 350002;2 台湾大学 园艺暨景观学系,台北 10617;3 中国文化大学 生物科技研究所,台北 11114)
乙烯作为五大类激素中的唯一气态物质,其在植物的生长发育中扮演着重要角色,广泛参与植物生长发育和衰老的整个生长周期,如种子的萌发,苗的生长,花的开放和衰老以及果实的成熟等[1]。乙烯主要通过一系列的信号转导实现其对植物的调控过程。乙烯的受体基因是最早感受到乙烯信号的,然后它会抑制下游的CTR1,从而激活EIN2,再将信号传递给细胞核内的EIN3/EILs,促进转录因子ERF的表达,最终诱导一系列与乙烯反应相关基因的转录翻译[2]。而在乙烯信号转导途径中EIN2是其关键因子。EIN2正调控乙烯反应,是一种跨膜蛋白,其N端负责接收上游信号,C端负责激活下游乙烯信号;其C端在乙烯的诱导下发生剪切,分离下来的C端就像一个转运分子,将信号从内质网运输到细胞核内,完成其信号转导的过程[3-5]。
乙烯不敏感基因最早是Alonso从拟南芥中采用图位克隆法克隆出来的[6]。随后从烟草[7]、苹果[8]、桃[9]、桑树[10]、番茄[11]、甜瓜[12]、矮牵牛[13]、石竹[14]等植物中也克隆得到了EIN2同源基因。研究发现AtEIN2在拟南芥的抗逆、抗病及其种子的生长发育过程起重要作用[9]。Pp-EIN2在调控桃果实成熟软化过程中起关键作用[9]。在矮牵牛的发育过程中EIN2 mRNA的表达受空间和时间上的调节,且获得花的衰老明显延迟的转基因植物[13, 15]。
文心兰(Oncidesa)是世界上重要的盆切花经济栽培品种,具有较高的经济价值[16]。其离开母体,花瓣容易枯凋,所以在文心兰切花的采收和运输过程中极易受到损伤,内源或外源乙烯通过信号转导引起切花的衰老反应,而EIN2又是乙烯信号转导途径中的关键因子[17]。本研究克隆了文心兰OnEIN2基因的cDNA全长,使用qRT-PCR对文心兰不同组织器官和不同花期中OnEIN2表达进行定量分析,以研究其生理功能、基因表达,及其在文心兰花的衰老、乙烯信号转导途径中的作用。
1 材料和方法
1.1 材 料
本研究材料为文心兰‘南茜’,由福建农林大学园艺植物生物工程研究所提供。2018年3月分别取‘南茜’的不同组织部位,包括根、假鳞茎和叶片,以及处于花苞期、绽口期、半开放期、盛开期、衰老期的花为材料进行定量表达分析。所有的材料均在液氮中冻存后存于-80 ℃冰箱中保存备用。
1.2 方 法
1.2.1文心兰总RNA提取及其cDNA第一链合成参考Trizol试剂盒(Invitrogen公司)的方法提取文心兰花器官的总RNA,以及各个部位和不同花期的RNA。采用植物基因组DNA试剂盒(北京百泰克生物技术有限公司)提取文心兰‘南茜’基因组DNA。采用Thermo超微量核酸检测仪测定RNA浓度并通过1% 琼脂糖凝胶电泳检测RNA的纯度和浓度,随后采用SMARTTMRACE cDNA Amplification Kit 试剂盒(TaKaRa)逆转录cDNA用于基因克隆。用PrimescriptTMRT Reagene kit试剂盒(TaKaRa)逆转录成cDNA用于定量PCR分析。
1.2.2文心兰OnEIN2基因的筛选与克隆从拟南芥基因组数据库网站(http://www.arabidopsis.org/)中下载基因AtEIN2的核酸序列作为参考序列,与‘南茜’转录组数据库进行比对分析,获得一条相似度较高的cDNA序列。根据此cDNA序列设计引物(表1)OnEIN2-ORF1-F、OnEIN2-ORF1-R、OnEIN2-ORF2-F、OnEIN2-ORF2-R、OnEIN2-ORF3-F、OnEIN2-ORF3-R,以文心兰‘南茜’的cDNA为模板进行PCR反应,扩增该基因的ORF序列。然后根据已知的ORF序列,分别设计2条3′-RACE的特异性引物和5′-RACE的特异性引物,结合GeneRacerTM3′ 和3′ 巢式引物以及5′ 和5′ 巢式引物,以‘南茜’文心兰的cDNA为模板进行巢式PCR反应,分别扩增3′ 和5′ 序列,用DNA-MAN对所获得的片段进行全长拼接。以上引物均由福州尚亚生物技术有限公司合成。
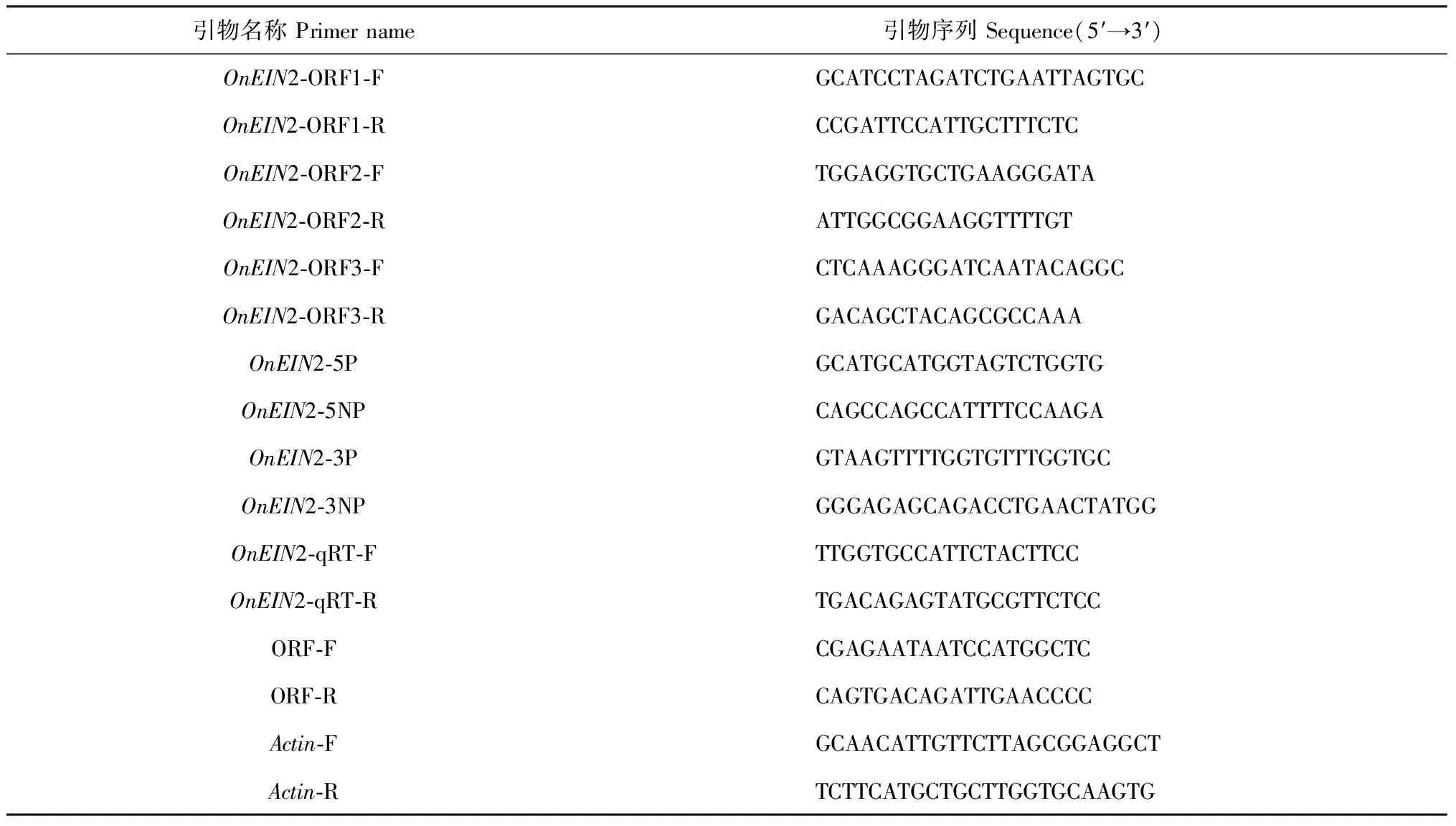
表1 实验所用引物序列
PCR反应体系为25 μL,其中Dream Taq酶12.5 μL,ddH2O 9.5 μL,模版cDNA 1 μL,上下游引物各1 μL。PCR扩增程序为94 ℃预变性3 min,94 ℃变性30 s,55~59 ℃ 退火30 s,72 ℃延伸2 min 30 s,35个循环,最后72 ℃延伸10 min。获得的目的片段采用Gel/PCR Extraction Kit 回收,经pMD 18-T载体连接后转化T1感受态中进行TA克隆并挑选阳性克隆子进行菌液PCR,将有目的条带的菌液送至铂尚生物技术(上海)有限公司测序。
1.2.3生物信息学分析采用DNAMAN软件分析核苷酸序列,通过NCBI(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行保守结构域预测;使用Signal P 4.0 Server预测蛋白质信号肽;使用ExPASy Protparam预测编码蛋白的理化性质;使用SOPMA预测其二级结构;使用TMpred预测其跨膜结构;使用PSORT预测其定位;使用DNAMAN 6.0软件进行引物的设计、序列拼接及序列比对,使用MEGA 6.1软件中的Neighbor-Joining (NJ法) 进行进化树构建。
1.2.4qRT-PCR分析本研究以Actin作为内参基因,引物序列见表1。根据获得的基因序列设计1对特异引物OnEIN2-qRT-F和OnEIN2-qRT-R,采用罗氏LightCycler 480仪器,通过qRT-PCR检测OnEIN2基因在文心兰不同组织部位以及不同花期的表达情况。将cDNA样本混合物进行2倍梯度稀释,分别对目标基因和内参基因进行扩增,获得标准曲线、溶解曲线和扩增曲线以确定引物特异性和扩增效率。以不同组织部位及不同开放时期花器官的cDNA原液为模板进行扩增。采用SYBR premix Ex TaqTMⅡkit(TaKaRa)进行qRT-PCR反应,反应体系为20 μL,包含10 μL SYBRⅡ,1 μL cDNA模版,上下游引物各0.8 μL,7.4 μL sdH2O。程序为:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸15 s,40次循环。用 2-ΔΔCT法获得OnEIN2的相对表达量。
2 结果与分析
2.1 文心兰OnEIN2基因的克隆
根据筛选获得的cDNA序列,设计OnEIN2-ORF1-F、OnEIN2-ORF1-R、OnEIN2-ORF2-F、OnEIN2-ORF2-R、OnEIN2-ORF3-F、OnEIN2-ORF3-R等6条引物, PCR扩增OnEIN2基因保守区 (图1),测序结果显示其中ORF1长1 469 bp,ORF2长1 494 bp,ORF3长1 105 bp,拼接后得到一条3 745 bp片段。初步推测该产物可能为目标ORF序列。在拼接得到的序列的5′和3′分别设计特异性引物,3′ 设计OnEIN2-3P和OnEIN2-3NP为特异引物,经3′-RACE巢式PCR扩增,电泳检测获得1条约650 bp条带 (图1);以OnEIN2-5P和OnEIN2-5NP为特异引物,经5′-RACE扩增,电泳检测显示获得1条约200 bp条带 (图1)。测序结果表明,这2个片段分别为667 bp和222 bp。将获得的5′-RACE末端、3′-RACE末端和ORF片段进行序列比对拼接,初步推断拼接的cDNA全长为文心兰EIN2基因序列。设计ORF全长验证引物进行PCR扩增,比对结果显示和拼接得到的序列一致,故此为文心兰OnEIN2基因序列。此cDNA全长为4 177 bp,包含3 879 bp开放阅读框,编码1 292个氨基酸,其5′-UTR长90 bp,3′-UTR长208 bp。
2.2 文心兰OnEIN2基因的生物信息学分析
利用Protparam分析OnEIN2基因编码蛋白的理化性质,结果显示,该蛋白分子式C6406H9988N1670O1897S47,分子量为142.22 kD,等电点为5.80,亲水性系数(GRAVY)为0.047,推测其疏水性大于亲水性,不稳定指数为45.16,属于不稳定蛋白。Signal P 4.1 Server信号肽预测结果表明OnEIN2不含信号肽结构,属于非分泌蛋白。PSORT预测OnEIN2定位在质膜中的可能性为80.0%,定位在叶绿体类囊体膜的可能性为60.9%,定位在高尔基体中的可能性为 40.0%,定位在内质网膜上的可能性为30.0%。SOPMA分析结果预测,OnEIN2蛋白二级结构主要由α螺旋(36.38%)、随机卷曲(48.07%)、延伸链(12.77%)和少量的β转角(2.79%)组成。α螺旋和随机卷曲为二级结构的主要元件,分散于整个蛋白质中。对文心兰OnEIN2蛋白保守结构域进行预测,结果如图2,该蛋白含有Nramp超家族特有的二价金属阳离子转运蛋白,是一种与拟南芥乙烯不敏感蛋白相似的天然抗性相关巨噬细胞家族蛋白,它是乙烯调节的信号传导通路的中心因素。
OnEIN2的N末端位于内质网膜上,当接收上游元件传递的乙烯信号后,其CNED区被切割下来,在NLS的作用下进入细胞核,并将信号传递给下游接受信号的元件[18-19]。经过Smart在线软件分析,编码序列中第5 ~ 451位氨基酸含有11个跨膜结构,其中第33 ~ 368个氨基酸区域为类Nramp蛋白结构域(图3)。经过序列比对分析,预测第631和632个氨基酸之间为信号切割点,第631个氨基酸以后的序列为CNED区;L1261 ~ L1268的序列被预测为核定位信号(NLS)[10]。
2.3 OnEIN2进化树分析与氨基酸序列比对
分析文心兰OnEIN2基因与铁皮石斛、拟南芥、水稻等植物的EIN2基因编码氨基酸序列,发现文心兰与铁皮石斛、小兰屿蝴蝶兰、小果野芭蕉、海枣等物种进化距离较近,且这些进化关系近的植物的氨基酸序列比对结果显示其一致性为72.25%,其保守性较高。以文心兰与其他物种的EIN2基因编码氨基酸序列比对为基础,构建NJ进化树,以分析它们的进化关系。参照进化树的构型,可将整个进化树划为2个亚群(图4)。其中I类除了香石竹外均是单子叶植物;Ⅱ类除了玉米、水稻外均是双子叶植物。说明双子叶植物和单子叶植物的乙烯信号转导在进化上可能存在一定差异[10]。
2.4 OnEIN2在文心兰不同组织器官中的表达分析
以Actin为内参基因,分析了OnEIN2在文心兰不同器官定量表达模式。qRT-PCR结果(图5)表明,OnEIN2在文心兰的根、假鳞茎、叶和花中均有表达,其中假鳞茎中的表达量最低;花中的表达量最高,花中的表达量约为假鳞茎中的28倍;OnEIN2在叶中的表达量高于根中的,但都低于花;而其在根中的表达量也仅略高于假鳞茎中的表达量。由此可以推断出,文心兰花的生长发育过程或与OnEIN2有关。

图2 文心兰OnEIN2保守结构域的预测结果Fig.2 Prediction of OnEIN2 conserved domains
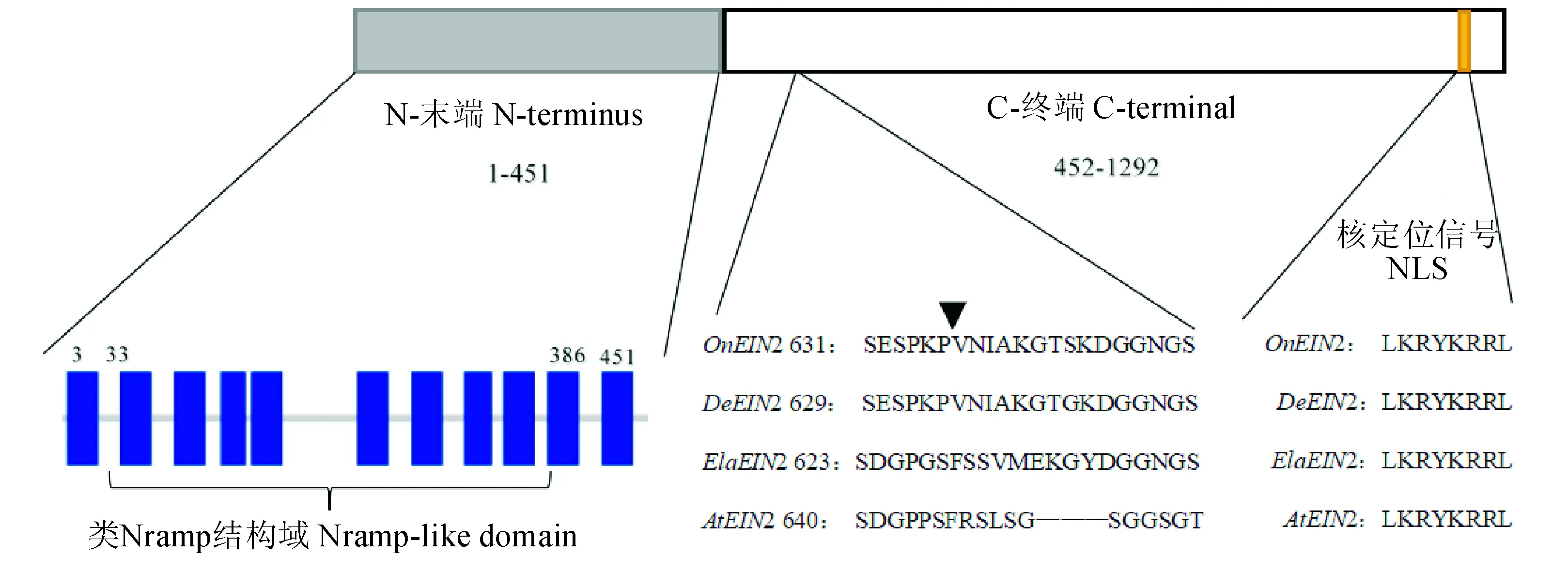
OnEIN2:文心兰;DeEIN2:铁皮石斛;ElaEIN2:油棕;AtEIN2:拟南芥图3 文心兰OnEIN2编码蛋白分析OnEIN2:Oncidesa;DeEIN2:Dendrobium catenatum;ElaEIN2:Elaeis guineensis;AtEIN2:Arabidopsis thalianaFig.3 Analysis of OnEIN2 predicted protein
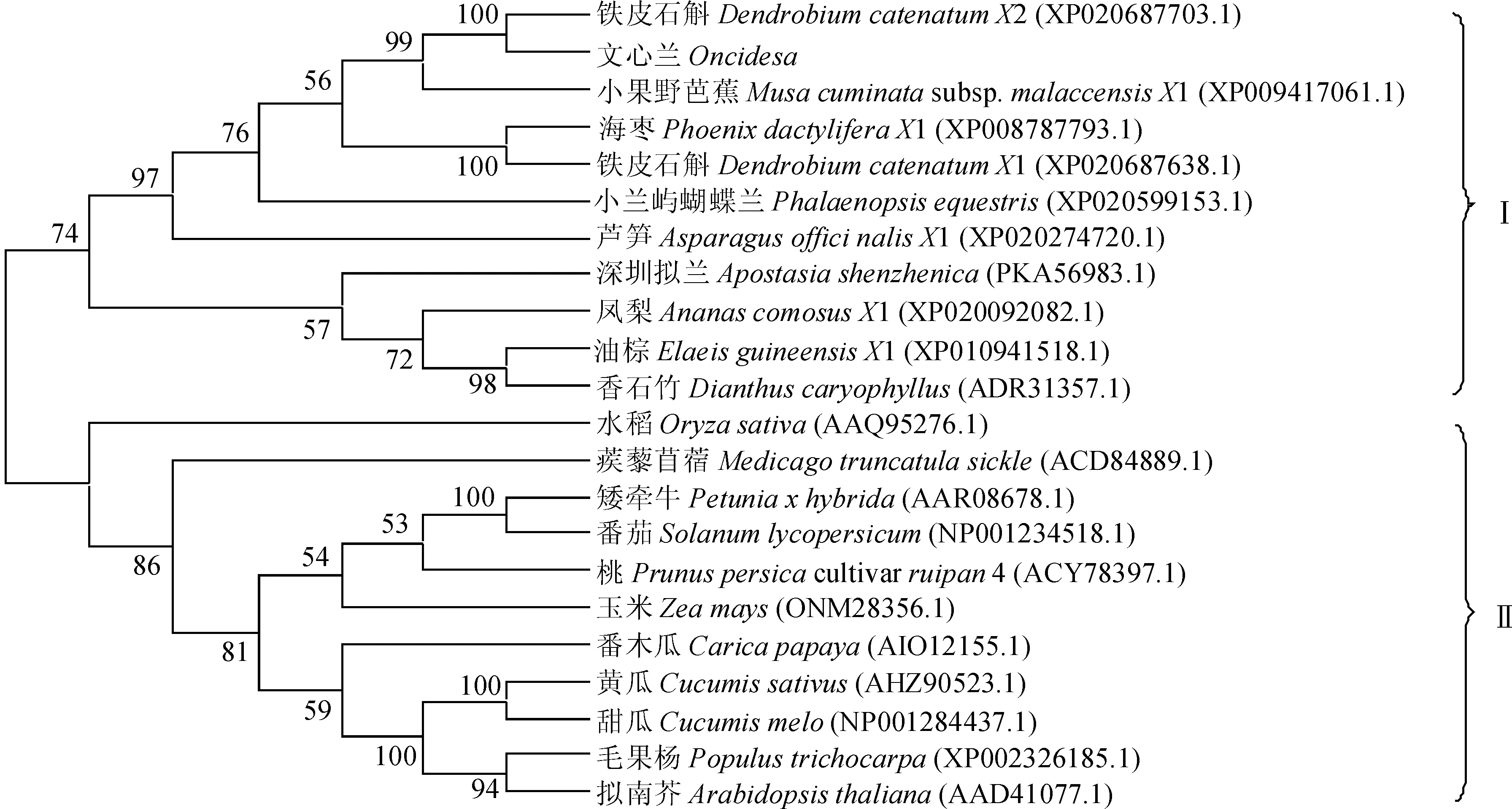
节点上的数值表示bootstrap重复1 000次的置信度,括号内为蛋白登录号图4 文心兰与不同植物中EIN2系统进化树Fig.4 Phylogenetic tree comparing the EIN2 nucleotide sequences of different plants

图5 文心兰不同组织部位的OnEIN2基因表达Fig.5 Expression analysis of OnEIN2 in different tissues of Oncidesa
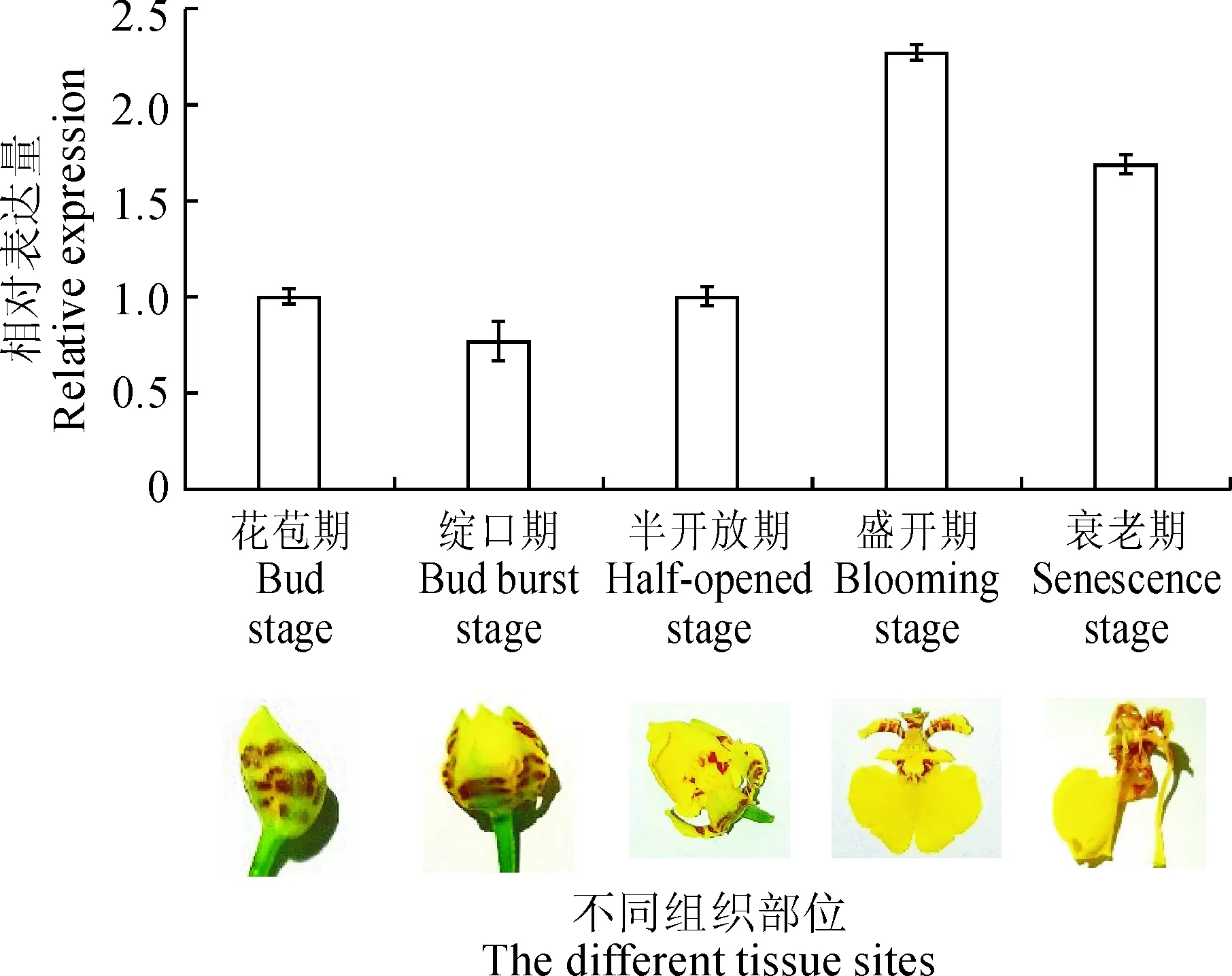
图6 文心兰不同花期的OnEIN2基因表达Fig.6 Expression analysis of OnEIN2 in different flowering stages of Oncidesa
2. 5 OnEIN2在文心兰不同花期中的表达分析
文心兰不同花期的定量结果表明,OnEIN2基因随着花的开放呈现上升的趋势,呈现一定的规律性(图6)。从花苞期到半开放期,OnEIN2基因的表达量变化不明显,而从半开放期到盛开期,相对表达量持续增加,并在盛开期到达最高表达量,接着从盛开期到衰老期的表达量呈下降趋势。盛开期的表达量约为花苞期的2.27倍。从定量图中可以看出,该基因的表达具有明显的时间特异性。
3 讨 论
3.1 文心兰OnEIN2蛋白特性分析
采用RT-PCR结合RACE法,从文心兰‘南茜’中克隆获得长为4 177 bp的OnEIN2基因,其中ORF长为3 879 bp,预测可编码1 292个氨基酸。对其分析发现该蛋白N端是个Nramp家族,C端含有C-NED和一个核定位信号。EIN2是乙烯信号传递途径中的一个重要组分,它介导了蛋白激酶CTRI和转录因子EIN3/EIL之间的信号传递,是乙烯和胁迫反应共有的一个双功能蛋白质。而且EIN2连接了不同的激素信号途径,植物可能拥有一个组合机制通过启用一套共有的信号传递分子来调节不同的胁迫[15]。EIN2 基因的表达对于植物营养生长、成熟衰老和胁迫响应也有重要意义[6, 13]。此外,当EIN2功能缺失时,植物体对乙烯不敏感[6]。
3.2 OnEIN2可能在文心兰花的盛开和衰老过程中发挥着重要作用
本研究的qPCR结果表明OnEIN2在不同的组织部位中的相对表达量差异显著,依次为花>叶>根>假鳞茎,其中在花中的表达量远远大于其他3个组织部位,说明该基因在花的整个发育过程中起重要作用;而在不同花期中的定量结果显示其在盛花期相对表达量最高,而后是衰老期,而花苞期、绽口期和半开放期的表达量相似。OnEIN2基因的时空表达特异性表达说明它与花衰老有很大关系。因为有乙烯存在时会激活受体基因,进而激活EIN2,所以当EIN2的表达量高时,说明此时乙烯含量比较高,这也是引起其花衰老的一个重要原因。用外源乙烯(10 μL/L)处理切花香石竹,DcEIN2在花瓣中第12~24 h表达量有所增加[14]。Shibuya等[13]通过共抑制和RNAi的方法获得PhEIN2基因表达水平低的转基因植株,其花的衰老明显延迟,不定根的生成受到抑制,由此可见EIN2在植物生长发育和乙烯的反应中有重要作用。
不同植物中EIN2基因的发挥的作用不尽相同。EIN2 基因的表达量在盐胁迫作用下会被下调,ein2 拟南芥突变体在盐胁迫作用下生长受到的抑制要比野生型更显著,表明EIN2参与了植物的胁迫响应途径,其表达量的降低可能是植物适应胁迫的表现[20-21]。甜瓜Cm-EIN2在幼叶和花瓣组织中的表达量相似,约为根中表达量的2倍,茎中表达最低,子房中最高[12],说明EIN2参与了植物的营养生长。LeEIN2基因被抑制的植株其果实成熟明显延长[22]。Chen等[23]研究发现LeEIN2基因下调的番茄植株的果实表现为成熟抑制。在桃的花蕾期到盛花期Pp-EIN2基因的表达量一直都在上升;在采收后,随着果实的成熟软化,Pp-EIN2的表达量和乙烯的释放速率的变化表现出相同的趋势,说明EIN2基因影响果实的成熟发育过程[9]。智军海等[24]研究表明桃花完成授粉受精以后PpEIN2基因的表达量明显高于其在花蕾期和盛花期的表达量,且当果实和种仁中乙烯达到最大释放量时,PpEIN2表达量也相应的表现出一个明显地高峰。据此推测EIN2与果实发育和成熟密切相关。本研究为后续进一步研究文心兰EIN2蛋白的功能及其和花的衰老之间的联系提供一定的依据。后续可以通过转基因或其他方法抑制该基因的表达进而使花形成对乙烯的不敏感,这还有待进一步的实验证明。

