三种多糖降解复合物体外抑制HeLa细胞的增殖作用
钟思恩,刘杨,曹纯洁,陈美珍
(汕头大学理学院,广东汕头 515063)
毛头鬼伞(Coprinus comatus)俗称鸡腿菇,其子实体含有4.11%多糖,且多糖主要由D-葡萄糖、D-半乳糖、L-岩藻糖、D-甘露糖和少量葡萄糖醛酸组成[1]。龙须菜(Gracilaria Lemaneiformis)和坛紫菜(Porphyra haitanensis)均属红藻类,都富含由D-半乳糖和3,6-内醚-L-半乳糖组成的琼胶型多糖,分别占其藻体干重的31.05%[2]和20%~40%[3]。其中,龙须菜多糖的平均分子量较大。研究发现,这三种多糖均有多种生理功能,如免疫调节[4~6]、抗氧化[7~10]、抗肿瘤[11~13]、降血糖[14,15]等。
多糖具有多种生物活性,但一种多糖的功效一般侧重于某一方面,有一定的局限性;将多糖按一定比例配伍后,其生理活性能起到协同增效作用[16,17]。如谢好贵等[16]将龙须菜多糖、坛紫菜多糖和毛头鬼伞多糖以质量配比为6:6:3组合的1000 μg/mL复合多糖作用于HeLa细胞,其增殖抑制率达76.30%,远高于3种同剂量单味多糖的最高抑制率59.63%。梁金强等[18]将五种真菌多糖按一定比例组成复合多糖作用于免疫抑制小鼠,发现复合多糖的免疫增强作用比各单一多糖好。多糖的生物活性也受其分子大小的影响,大分子多糖适度降解后活性增强。如Liao等[19]将龙须菜多糖GLP及其多糖降解组分GLP-1和GLP-2(分子量分别为121.89、57.02和14.29 ku)分别灌胃糖尿病小鼠,发现GLP、GLP-1、GLP-2都能降低糖尿病小鼠血糖水平,其中GLP-1降低作用最显著;Sun等[20]将蜈蚣藻多糖GFP(220 ku)降解得到多种降解物LGFPs,发现LGFP-3(8.7 ku)抗病毒活性最强。然而,这些报道仅限于对未降解的复合多糖和降解后的单一多糖的研究,对于降解后的海藻复合多糖尚未见国内外有任何报道。
为了提高海藻多糖的抗肿瘤活性,本实验在前期工作的基础上,将毛头鬼伞多糖、龙须菜多糖和坛紫菜多糖进行降解,并比较降解前、后的多糖对 HeLa细胞生长抑制影响;利用正交实验优选三种降解物的最佳复配比例,探究复配的三种多糖降解物体外抑制HeLa细胞增殖的协同效应及其作用机制,以期为多糖的高效利用提供前期研究基础。
1 材料与方法
1.1 材料与试剂
毛头鬼伞子实体购于福建;龙须菜、末水坛紫菜:来自汕头南澳海区,由汕头大学海洋生物研究所南澳试验站陈伟洲教授鉴定。
肿瘤细胞:人宫颈癌HeLa细胞,由汕头大学多学科研究中心提供。
正常细胞:人胚胎肾细胞 293T细胞,由汕头大学多学科研究中心提供。
木瓜蛋白酶,sigma公司;DMEM高糖培养基,美国Hyclone公司;胎牛血清,杭州四季青科技有限公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO),美国Amresco公司;5-氟尿嘧啶(5-FU),上海源叶生物科技有限公司;胰酶细胞消化液、青霉素-链霉素溶液、N-乙酰-L-半胱氨酸(NAC)、活性氧(ROS)检测试剂盒,碧云天生物技术研究所;三氯乙酸(TCA)、过氧化氢(H2O2)和抗坏血酸(Vc)等均为国产试剂分析纯。
1.2 仪器与设备
UNICO UV2100型分光光度计,尤尼柯(上海)仪器有限公司;AdVantage 2.0 BenchTop Freeze Dryer,美国 VIRTIS公司;BT124S型电子分析天平,德国Sartorius公司;倒置荧光显微镜,日本Nikon公司;普通光学显微镜,Olympus公司;离心机,Eppendorf公司;超低温冰箱,Thremo公司;全波段扫描型酶标仪,TECAN公司;3111型CO2培养箱,Thremo公司;BCM-13WA超净工作台,苏净安泰公司;CK30-F200型倒置显微镜,Olympus公司。
1.3 方法
1.3.1 三种多糖的提取
将原料烘干、粉碎后,按以下条件进行提取[16]:(1)毛头鬼伞多糖:料液比1:15,94.5 ℃浸提4 h;(2)龙须菜多糖:料液比 1:100,90 ℃浸提5 h;(3)末水坛紫菜多糖:料液比1:50,80 ℃浸提6 h。
多糖提取后过滤收集多糖液,进行除蛋白处理。(1)毛头鬼伞多糖除蛋白采用木瓜蛋白酶-TCA法联用:在多糖液中加入0.5 mg/mL木瓜蛋白酶,60 ℃反应50 min,再加入TCA使其终浓度为4.6%,22.5 ℃反应30 min后离心,收集上清液;(2)龙须菜多糖采用TCA法除蛋白:在多糖液中加入终浓度为4% TCA溶液,过夜后,离心,收集上清液;(3)末水坛紫菜多糖采用木瓜蛋白酶-TCA法联合除蛋白,按文献[9]方法进行。各上清液经流水透析2 d,蒸馏水透析1 d后,冷冻干燥得相应的多糖样品:毛头鬼伞多糖CCP、龙须菜多糖GLP和末水坛紫菜多糖PHP。
1.3.2 三种多糖降解物的制备
根据前期建立的条件[19],采用维生素 C(Vc)和H2O2降解体系,按照Vc:H2O2=1:1的质量浓度比配制浓度为3、5、7 mmol/L降解剂分别降解三种多糖。三种多糖液浓度均为2.5 mg/mL,其中,以降解剂浓度为3 mmol/L降解CCP、5 mmol/L降解PHP、7 mmol/L降解GLP,作用2 h后,然后用超滤方法收集分子量在10~50 Ku的降解物,以分子量为8000~12000 u的透析袋蒸馏水透析1 d,分别收集相应的多糖降解液,冷冻干燥后得多糖降解物:毛头鬼伞多糖降解物D-CCP、坛紫菜多糖降解物D-PHP、龙须菜多糖降解物D-GLP。
1.3.3 多糖含量测定
采用苯酚-硫酸比色法[21],以D-半乳糖为标准品,吸光值为纵坐标,D-半乳糖微克数(µg)为横坐标,绘制标准曲线;得到线性回归方程:Y=0.0071X+0.0037,Y为吸光度,X为多糖含量,相关系数 R2=0.9991;求得 D-CCP、D-GLP和 D-PHP的多糖含量分别为93.63±0.98%、95.64±1.83%和97.65±2.07%。
1.3.4 多糖降解物蛋白含量测定
根据考马斯亮蓝法[9,22]测得牛血清蛋白含量与吸光度的关系,绘制标准曲线,得出回归方程为Y=0.0046X-0.0058,R2=0.9993,X表示蛋白质含量,Y表示吸光值。测得D-CCP、D-GLP和D-PHP蛋白质含量分别为1.83±0.20%、1.24±0.12%和0.92±0.08%。
1.3.5 多糖降解物重均分子量测定
采用凝胶过滤层析法测定各多糖降解物的重均分子量[23,24]。
绘制标准曲线:在Sephadex G-150层析柱中加入3 mL浓度为1 mg/mL Dextran blue 2000,采用0.1 mmol/L NaCl洗脱,每管收集1 mL。收集后,采用苯酚-浓硫酸法检测外水体积 V0。在相同条件下,测定已知分子量的T-500、T-70、T-40、T-20、T-10标准葡聚糖洗脱体积Ve,根据Kav=(Ve-V0)/(Vt-V0)对分子量对数值绘制分子量标准曲线,Vt为内水体积。
按上述处理,测定各多糖降解物洗脱体积Ve,根据标准曲线回归方程求出重均分子量。
1.3.6 多糖及其降解物抑制HeLa细胞增殖作用单因素实验
取对数生长期HeLa细胞配成1×105个/mL的细胞悬液接种于96孔板,每孔100 μL,于5% CO2、饱和湿度培养箱中37 ℃培养18 h。随机分6组:CCP、GLP、PHP组和D-CCP、D-GLP、D-PHP组,其中,CCP、GLP、PHP组分别加入由完全培养基(含10%胎牛血清和1%双抗的DMEM 培养基)稀释的浓度梯度为200、400、600、800、1000、1200 μg/mL的各多糖液;D-CCP、D-GLP、D-PHP组分别加入由完全培养基稀释的浓度梯度为20、40、60、80、100 μg/mL的各多糖降解物,作用48 h后除去上清液,加入MTT反应4 h,弃上清,加入DMSO,室温振摇10 min,用全自动酶标仪作双波长检测,检测波长490 nm、参考波长570 nm,测定其OD值,按式(1)计算各组别的细胞增殖抑制率。
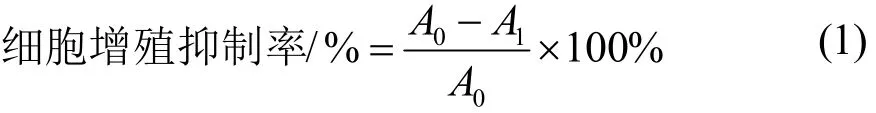
注:A0为对阴性对照组OD值;A1为给药组OD值。
1.3.7 正交实验优化三种多糖降解物最适配比
复合多糖降解物(简称CDP)由D-CCP、D-GLP、D-PHP组成。在单因素实验基础上,以对HeLa细胞的增殖抑制率为考察指标,设计三因素三水平正交实验优化复合多糖降解物的最适配比,实验因素水平安排如表1所示。给药剂量均以单因素实验得到的最高抑制率的作用浓度80 μg/mL进行处理。

表1 因素水平表Table 1 Factor levels table
1.3.8 CDP抑制HeLa细胞增殖的测定
取HeLa细胞和293T细胞分别配成1×105个/mL的细胞悬液,接种于96孔板,每孔100 μL,培养18 h。实验设空白组、阳性组和实验组,其中空白组加入完全培养基;阳性组加入25 μg/mL 5-FU;实验组分别加入 40、60、80、100、120、160、200 μg/mL CDP作用液,按分组情况对培养的HeLa细胞和293T细胞分别进行处理。作用48 h后移除上清液,MTT法测其OD值,计算各组的细胞增殖抑制率,方法同1.3.6。
1.3.9 细胞内ROS水平的测定
采用细胞活性氧检测试剂盒测定,检测方法按照试剂盒说明书进行,酶标仪测定其荧光值,并于倒置荧光显微镜下观察、拍照。实验重复3次。具体操作如下:
取密度1×105个/mL HeLa细胞悬液接种于6孔板,1 mL/孔,培养18 h。随机分组:空白组、活性氧阳性对照(Rosup)组和 40、100、160 μg/mL CDP 给药组。空白组、Rosup组分别加完全培养基,CDP组分别加入各浓度CDP作用液,培养48 h。在装载探针前,Rosup组加入50 μg/mL Rosup,孵育30 min,立即装载探针。
细胞内ROS含量测定:选择原位装载探针,每孔加1 mL终浓度为10 µmol/L DCFH-DA,于培养箱内孵育30 min,用PBS洗涤细胞3次,充分洗去未进入细胞内的DCFH-DA探针,并用胰酶消化,离心收集细胞,重悬于PBS中,通过细胞计数器获取5×106个/mL细胞悬液,在96孔板中每孔加入100 µL,用荧光酶标仪于488 nm激发波长和525 nm发射波长下检测刺激后荧光的强弱作为评价指标。
1.3.10 NAC对CDP抑制HeLa细胞增殖的检测
实验设空白组、阳性组、实验组,其中,空白组加入完全培养基、阳性组加入25 μg/mL 5-FU、实验组分别加入 40、60、80、100、120、160、200 μg/mL CDP作用液。空白组和阳性组均加入新鲜培养基、实验组加入10 mmol/L NAC,孵育6 h,移除上清液,PBS洗涤3次。
按分组情况进行处理,培养48 h后移除上清液,MTT法测其OD值,计算各组的细胞增殖抑制率[25,26],方法同1.3.6。
1.3.11 细胞线粒体膜电位检测
实验随机分3组:空白组、CCCP阳性对照组和CDP给药组。空白组、CCCP阳性对照组分别加完全培养基,其中CCCP组在装载JC-1前加入10 µmol/L CCCP处理20 min,CDP组分别加入40、100、160 μg/mL CDP作用液,培养48 h。
吸除培养液,用PBS洗涤1次,加入细胞培养液1 mL。参照试剂盒方法,加入JC-1染色工作液1 mL,充分混匀,于培养箱中孵育20 min。吸除上清,用JC-1染色缓冲液洗涤2次,加入细胞培养液2 mL,在荧光显微镜下观察。
1.4 统计方法
实验结果采用SPSS 17.0统计软件分析。用单因素方差分析组间差异的显著性,结果采用平均值±标准差表示(±s),p<0.05为差异具有统计学意义。
2 结果与分析
2.1 多糖降解物平均分子量
根据凝胶过滤层析法测得的标准葡聚糖洗脱体积,以Kav对分子量对数值绘制分子量标准曲线,求得回归方程为Y=-4.6117X+5.7678,R2=0.9989,Y表示分子量对数值,X表示Kav。
在相同条件下,测定不同降解剂浓度下相应多糖降解物的洗脱体积,根据回归方程,求得各多糖降解物的重均分子量如表2所示。以下实验所用三种多糖降解物即为表2中的D-CCP、D-PHP、D-GLP,其重均分子量分别为18.1、15.7、18.9 ku。

表2 多糖降解物重均分子量Table 2 Molecular weight content of polysaccharides degradation products
2.2 三种多糖及其降解物抑制HeLa细胞增殖作用比较
MTT法检测三种多糖及其降解物对HeLa细胞增殖抑制作用,结果见图1、2。
与未降解的多糖比较,一定浓度的多糖降解物对HeLa细胞的增殖抑制率成倍提高,其中在浓度 80 μg/mL时,D-CCP、D-GLP、D-PHP对HeLa细胞的抑制率最大,分别为 56.09±3.20、42.97±1.73、47.35±3.06%,其中 D-CCP的半数抑制浓度 IC50为84.68 μg/mL;而对应的未降解多糖要达到最大的抑制率 41.13±1.45、52.47±2.28、35.52±1.93%,则需作用剂量为1000 μg/mL的浓度,结果说明对三种多糖适度降解可有效提高其生理活性,其中毛头鬼伞多糖降解物效果最为显著,其次是坛紫菜多糖降解物。
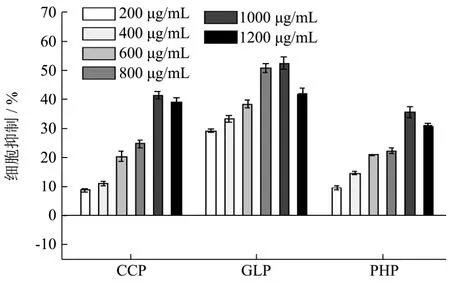
图1 CCP、GLP、PHP对HeLa细胞增殖抑制率Fig.1 The inhibition rate of CCP, GLP, PHP on HeLa cells

图2 D-CCP、D-GLP、D-PHP对HeLa细胞增殖抑制率Fig.2 The inhibition rate of D-CCP, D-GLP, D-PHP on HeLa cells
2.3 正交实验确定CDP组方配比
正交实验优化D-CCP、D-GLP和D-PHP组合配比的结果及方差分析见表3、4。
由表3可见,D-CCP、D-GLP和D-PHP对HeLa细胞增殖抑制的影响大小为D-PHP>D-CCP>D-GLP,CDP的最佳配方为A2B2C3,即D-CCP:D-GLP:D-PHP=4:4:5,在表4方差分析中,D-CCP和D-PHP对CDP作用有显著性影响。对该最佳配比形成的CDP作用HeLa细胞进行验证实验(n=3),得到的抑制率为
70.79±0.57%,显著高于三种多糖降解物单独作用时的最高抑制率56.09±3.20%,抑制率提高了26%,说明三种多糖降解物复合后对HeLa细胞的抑制作用存在协同效应。因此,确定CDP的最适组合为
D-CCP:D-GLP:D-PHP=4:4:5。

表3 正交实验结果Table 3 The result of orthogonal experiment

表4 方差分析Table 4 Analysis is of variance
2.4 CDP对HeLa细胞的增殖抑制作用
由表5可见CDP对HeLa细胞作用48 h的增殖抑制率,在低浓度时,随浓度增加而增加,但当浓度为100 μg/mL 时,抑制率达最大值75.72%(p<0.01),之后随浓度增加而显著下降,其IC50值为67.07 μg/mL。而谢好贵[16]的研究发现,将未降解的龙须菜、坛紫菜和毛头鬼伞三种多糖以最优配比构成的复合多糖,对HeLa细胞作用 48 h的增殖抑制率是在剂量为 1000 μg/mL时达最高值76.30%。相比之下,本实验通过将该三种多糖分别降解后再进行配伍,可有效提高其对HeLa细胞增殖抑制活性,具有显著的增效作用。其作用效果与小分子阳性药物5-FU在浓度为25 μg/mL时的抑制率接近。但5-FU对正常细胞293T有较强毒副作用,而CDP对293T细胞不仅无毒,还具有促生长作用。表明多糖通过降解再复配可有效提高其生理活性,是一种安全有效的提高多糖功效的修饰方法,CDP具有进一步研究开发价值。
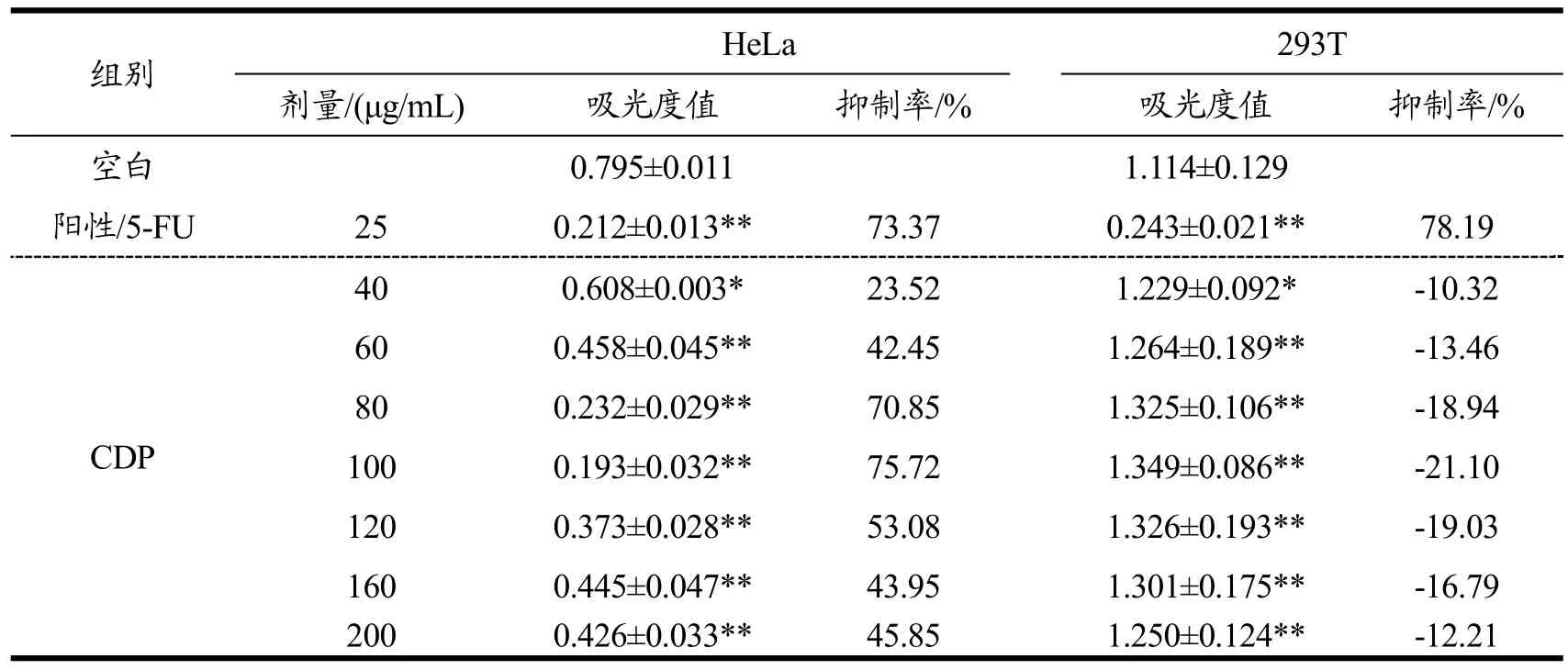
表5 CDP对HeLa细胞增殖的影响Table 5 The effect on proliferation of HeLa cells
2.5 CDP对细胞内ROS水平的影响
由图3可知,CDP处理组(图中的c、d、e)的荧光强度明显高于空白组,说明经CDP处理后HeLa细胞内ROS含量增加,其中作用剂量100 μg/mL的荧光强度最强,这与其对HeLa细胞增殖抑制率最高相对应。
图4表明,CDP可诱导细胞内ROS产生,结合表5可知:
当CDP浓度为40~160 μg/mL时,CDP对HeLa细胞增殖抑制能力和细胞内ROS含量呈正相关,说明CDP对 HeLa细胞的抑制作用可能与其升高细胞内ROS水平有关。
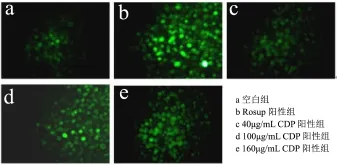
图3 DCFH-DA染色观察CDP处理48 h后HeLa细胞内ROS水平Fig.3 ROS level in HeLa cells after CDP treading 48 h by DCFH-DA staining (400×)
2.6 NAC对CDP抑制HeLa细胞增殖的影响

图5 NAC对CDP抑制HeLa细胞增殖活性的影响Fig.5 The effect of NAC for CDP suppressing HeLa cells proliferation
NAC是常用的细胞ROS清除剂,其作用是通过促进GSH的产生来清除ROS[26]。本实验利用NAC的干预,以证实CDP对HeLa细胞的增殖抑制作用与其升高细胞内ROS有关,结果见表6。根据表5和表6的数据,得图5。由图5可知,经NAC处理后,CDP对HeLa细胞的增殖抑制作用明显减弱,证实了CDP是通过提高HeLa细胞内ROS含量来抑制HeLa细胞增殖的。并且已有研究表明,5-FU对肿瘤细胞的毒性作用也与ROS生成相关[27]。
表6 NAC对CDP抑制HeLa细胞增殖的影响Table 6 The effect of NAC on CDP suppressing HeLa cells proliferation
2.7 CDP对HeLa细胞线粒体膜电位的影响
JC-1是一种检测线粒体膜电位(mitochondrial membrane potential)的理想荧光探针。当细胞线粒体膜电位比较高时,JC-1聚集于线粒体基质中,形成产生红色荧光的聚合物;当膜电位比较低时,JC-1不能聚集于线粒体的基质中,以单体形式存在,呈绿色荧光。
由图6可见,空白组中HeLa细胞呈现红色荧光;CCCP阳性对照组中,细胞线粒体膜电位几乎完全丧失呈现绿色荧光;经CDP处理后,d、e、f中细胞染色大多数呈现绿色荧光,红色荧光减少,表明 CDP可诱导HeLa细胞线粒体膜电位降低。
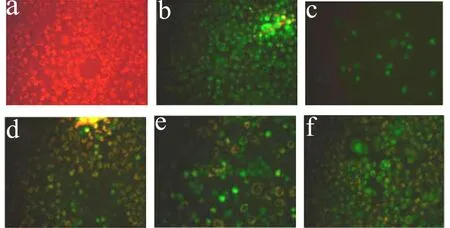
图6 CDP对HeLa细胞线粒体膜电位的影响(400×)Fig.6 The effect of mitochondrial membrane potential MMP
3 结论
3.1 分子量是多糖的重要指标,研究表明,一定大小的分子量是多糖具备生物活性的必要条件,分子量大小的改变将直接影响到其理化性质和生理活性[28]。史大华等[29]研究发现酸水解1 min后得到的低分子量岩藻多糖,其在浓度为1000 µg/mL时对KB细胞作用48 h后的抑制率为74.2%,显著高于未降解的岩藻多糖在相同条件下的抑制率43.0%。Dong等[30]采用H2O2降解海参多糖 HOP(135.80 ku),得到的降解物o-HOP(7.90 ku),对人胃腺癌细胞SGC-7901细胞处理48 h,其IC50为7.21 µM显著低于HOP的IC50(为14.01µM)。邓六勤等[31]利用Vc和H2O2体系降解黄芪多糖,发现黄芪多糖体外抗氧化和抗肿瘤作用会随着降解片段相对分子质量的降低而活性增强,其中浓度为 800µg/mL的黄芪多糖降解片段1的作用效果最好,其对HepG2细胞作用48 h后的抑制率达到57%(未降解黄芪多糖的抑制率在 40%~50%之间)。而本文利用优化的降解条件对毛头鬼伞、龙须菜和坛紫菜多糖分别进行适度降解,获得的降解产物对HeLa细胞的抑制作用显著增强。如对HeLa细胞,毛头鬼伞多糖在1000µg/mL时达到最高抑制率为41.13%,而其降解产物仅在80 μg/mL时即可达到最高抑制率56.09%,IC50为84.68 μg/mL。可见,本实验中多糖适度降解后活性增强与前人实验结果相似。这可能是大分子多糖,其分子量达到几十万到数百万不等,导致多糖分子粘度高、溶解度低,不利于生物吸收[32,33]。而经适度降解后,多糖分子量降低,可改善其黏度、溶解性等,还能改善生物利用度,从而提高多糖分子生物活性[34]。
3.2 多糖的协同作用并不是单一多糖简单地混合一起,而是受到包括多糖结构、分子量、溶解度和立体构象等诸多因素影响[35]。研究表明,复合多糖中各单一多糖的结构与活性之间具有互效性,其药理和营养作用方面存在协调性和增效性,可以使单一多糖的作用得到发挥,并克服其作用的局限性[36]。实验以毛头鬼伞、龙须菜和坛紫菜三种多糖降解物复配成复合多糖降解物,发现在浓度为100 μg/mL时,复合多糖降解物对HeLa细胞的抑制率最大达到75.72%,IC50为67.67 μg/mL,均显著高于单一多糖。证实了毛头鬼伞、龙须菜和坛紫菜三种多糖或其降解物以一定比例复配成复合多糖[16]或复合多糖降解物,均可进一步提高复合物对HeLa细胞的毒性作用,说明了复合多糖确实存在协同增效性。目前,复合多糖已在临床应用,其活性研究也取得一定进展,但其作用机理尚不明确,仍需进一步探讨。
3.3 线粒体是细胞内ROS生成的重要部位,同时也是ROS的攻击目标。在正常情况下,呼吸链在氧化磷酸化过程中不断释放ROS[37],然而,当线粒体受到损伤时,会有大量的ROS被释放出来[38]。低浓度的ROS参与了细胞的增殖过程,可以促进细胞有丝分裂与细胞增殖,但随着ROS不断增加,氧化-还原系统将出现失衡,随之造成氧化应激反应,最终诱导细胞凋亡和引起细胞坏死。肿瘤细胞对ROS引起的氧化应激反应比正常细胞更为敏感,因此ROS对肿瘤细胞有选择性杀伤力。Maillet等[39]以含锇有机金属化合物作用于结肠癌鼠类模型后,发现结肠癌鼠中的线粒体形态和功能发生改变,肿瘤细胞发生凋亡、肿瘤生长得到抑制,而这一过程是依赖ROS途径实现的。此外ROS含量迅速提升,能够导致线粒体膜电位下降。一旦线粒体膜电位发生变化,细胞凋亡将不可逆[40]。而NAC是一种抗氧化剂,具有清除细胞内ROS的作用,从而可以抑制细胞凋亡[41]和细胞坏死。游如旭等[42]研究发现,香菇多糖刺激鼠肝癌细胞H22后,可以诱导细胞内 ROS含量升高,从而引起细胞凋亡。王小军等[43]研究发现红芪多糖-1能抑制人肺腺癌A549细胞增殖、诱导细胞凋亡,并且存在剂量依赖性,这一作用机制可能是红芪多糖-1能够调控A549细胞氧化/抗氧化能力比例。Li等[44]发现石榴皮多糖抗肿瘤的作用机制与线粒体途径有关,其能引起线粒体膜电位下降,释放细胞色素C,激活caspase 3、9蛋白。本研究发现,CDP可以提高HeLa细胞内的ROS含量,同时可以降低细胞线粒体膜电位。而当加入NAC与CDP共同作用时,CDP对HeLa细胞的抑制作用显著降低。表明CDP可以通过提高ROS含量直接抑制HeLa细胞增殖;而CDP是否通过诱导细胞内ROS产生,导致过多的ROS攻击线粒体,引起线粒体膜电位下降,从而通过线粒体途径启动细胞内凋亡程序,造成细胞凋亡,这一机制尚待研究。

