糖尿病患者感染产ESBLs肠杆菌科细菌的耐药性及危险因素分析
严海忠,王 娟,卢兰芬,冯雪琴
(中山大学附属中山医院检验医学中心,广东中山 528403)
糖尿病是由病原微生物感染及毒素、遗传因素、免疫功能紊乱、精神因素等各种原因导致胰岛功能减退、胰岛素抵抗从而引发一系列代谢紊乱的综合征,与急性并发症相比,慢性并发症发生率越来越高,已成为糖尿病患者致残、致死的首要因素。据世界卫生组织报告,每年约有几百万人死于糖尿病导致的并发症[1]。关于糖尿病并发感染及其危险因素的分析全球均有所报道,但对于中山市糖尿病患者并发感染,尤其是感染产ESBLs肠杆菌科细菌的研究,目前鲜有报道。为了解中山市糖尿病患者感染产ESBLs肠杆菌科细菌的耐药性及危险因素,有效控制与预防糖尿病患者感染的发生,提高糖尿病患者生存质量,本研究通过回顾性分析中山大学附属中山医院2014年1月~2016年6月120例确诊为糖尿病并发感染肠杆菌科细菌的患者的临床资料,收集从120例糖尿病患者各类临床标本中(包括中段尿、全血、痰液、胆汁、伤口分泌物、导管尖端和胆汁等体液标本)分离出的132株细菌(排除同一病人的重复菌株),分析中山市糖尿病患者感染产ESBLs肠杆菌科细菌的耐药性及危险因素,旨在为临床防治糖尿病患者感染产ESBLs肠杆菌科细菌提供理论依据。
1 材料与方法
1.1 研究对象 收集2014年1月~2016年6月中山大学附属中山医院收治的120例确诊为糖尿病并发感染肠杆菌科的患者的临床资料,其中男性35例,女性85例,年龄34~80岁,平均年龄65岁,糖尿病病程0~23年。从120例糖尿病患者各类标本中分离得到132株细菌(排除同一病人的重复菌株),根据是否ESBLs,将研究对象分为ESBLs-positive组和ESBLs-negative组。质控菌株:大肠埃希菌(ATCC25922)。
1.2 仪器及试剂 菌种鉴定和药物敏感试验使用法国梅里埃的VTIEK-2 COMPCT自动化微生物鉴定系统,使用配套鉴定卡片GN和AST-GN13;利用VTIEK 2 COMPCT高级专家系统判定细菌的耐药表型和耐药模式。
1.3 方法
1.3.1 菌株鉴定及药敏试验:所有菌株均遵照《全国临床检验操作规程》(第三版)进行分离培养和初步鉴定,采用法国生物梅里埃公司VITEK 2 COMPCT全自动微生物鉴定系统进行鉴定和药敏试验,并用标准菌株进行质控。
1.3.2 耐药表型分析:通过VITEK 2 COMPCT高级专家系统判定132株肠杆菌科细菌对氨基糖苷类药物,β-内酰胺类药物、呋喃类药物、喹诺酮类药物和甲氧苄啶类/复方磺胺类药物的耐药表型,将相应数据以文本格式导出转化成Excel格式并分析耐药表型及耐药模式。
1.3.3 产ESBLs菌感染的危险因素分析:根据大肠埃希菌是否产ESBLs,将研究对象分为ESBLs-positive组和ESBLs-negative组,设计调查表对以下指标进行回顾性统计,根据病史收集以下信息:①临床资料:姓名、性别、年龄、糖尿病的病程、收缩压、并发症、住院的次数、入院前使用抗生素史、感染前的治疗情况、类固醇药物应用、外科手术、侵入性操作(设备);②实验室检查:糖化血红蛋白。
1.4 统计学分析 采用SPSS19.0统计软件包整理录入资料;多因素分析中采用logistic回归法;资料率的比较采用一般卡方检验或校正的卡方检验或Fisher精确概率法;P<0.05为差异有统计学意义。
2 结果
2.1 132株肠杆菌科细菌的分布及来源构成 132株肠杆菌科细菌中大肠埃希菌95株,肺炎克雷伯菌30株,产酸克雷伯菌3株,奇异变形杆菌4株;中段尿占61.36% 全血占23.48%,痰液占2.27%,胆汁占1.52%,伤口分泌物占9.85%,导管尖端占0.76%,脓汁占0.76%。
2.2 主要病原菌药敏试验结果 132株肠杆菌科细菌主要的病原菌是大肠埃希菌,其对18种抗生素的药敏试验结果见表1。本研究显示大肠埃希菌对厄他培南、亚胺培南、头孢替坦和哌拉西林/他唑巴坦的敏感度大于98%,对磺胺类药物甲氧苄氨嘧啶/新诺明均耐药。ESBLs-positive组对氨苄西林、氨曲南、头孢他啶、头孢曲松、头孢唑啉、头孢吡肟和氨苄西林/舒巴坦的敏感度均低于ESBLs-negative组,两组的差异具有统计学意义(P<0.05)。而对于其它药物二组之间差异无统计学意义(P>0.05)。
2.3 大肠埃希菌耐药模式分析 95株大肠埃希菌对氨基糖苷类药物、β-内酰胺类药物、呋喃类药物、喹诺酮类药物和甲氧苄啶类/复方磺胺类药物的耐药模式见表2。ESBLs-positive组和ESBLs-negative组在获得性青霉素酶、β-内酰胺类抗生素野生型、其他超广谱β内酰胺酶和CTX-M型ESBLs四种耐药模式中差异具有统计学意义(P<0.05)。而在其它耐药模式中差异均无统计学意义(P>0.05)。
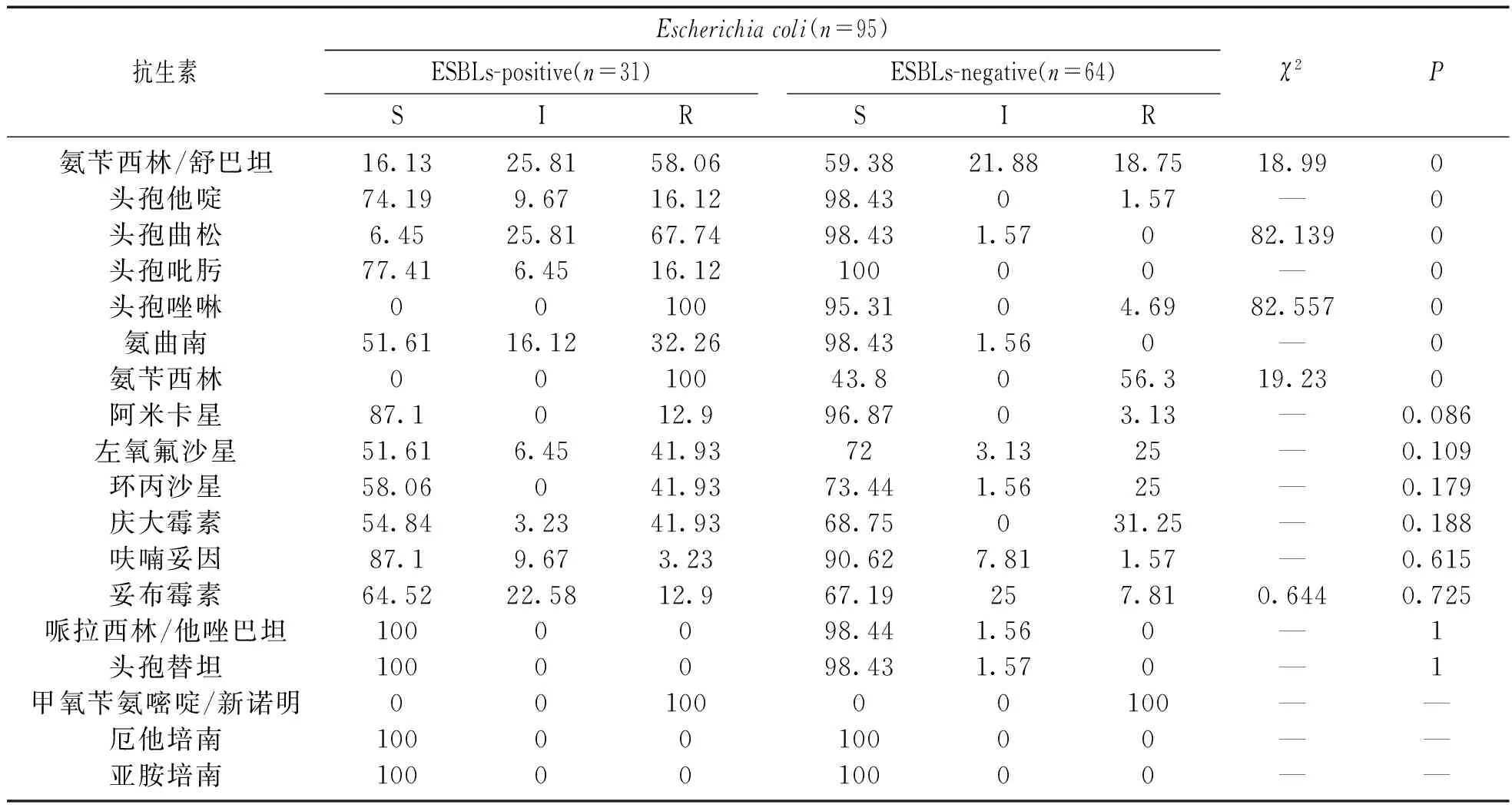
表1 18种抗生素药敏试验结果(%)
注:S:敏感;I:中介;R:耐药。
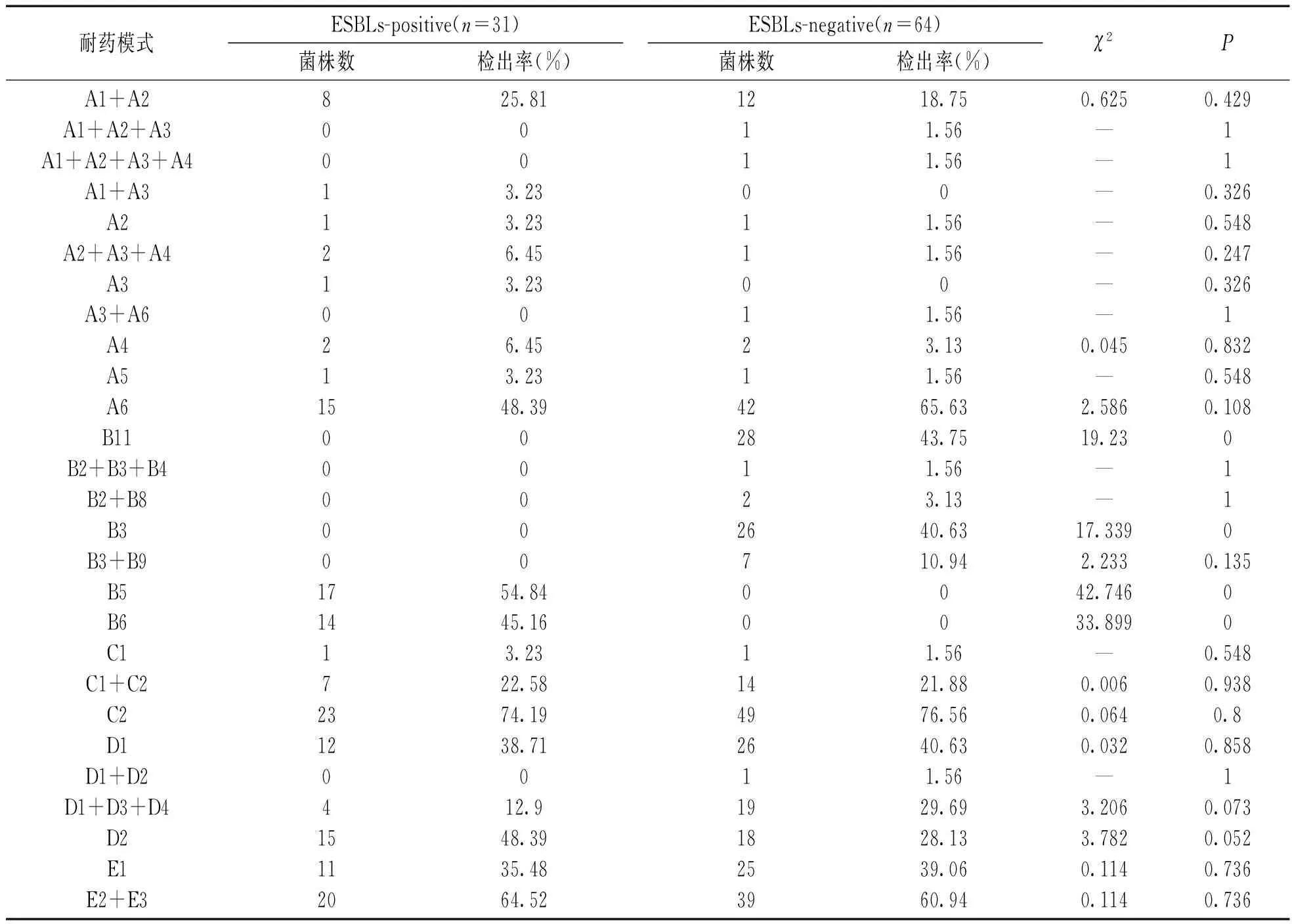
表2 95株大肠埃希菌耐药模式分析
注:A1 含水解酶[ANT(2″)]的耐药;B4 CEPHALOSPORINASE(AmpC);C2 呋喃类野生型;A2 含水解酶[AAC(3)-II]的耐药;B5 ESBLs(CTX-M LIKE);D1 部分耐药;A3 含水解酶[AAC(3)-IV]的耐药;B6 其他类型ESBLs D2耐药;A4 含水解酶[AAC(6′)]的耐药;B7 高产天然的青霉素酶D3对1代耐药;A5 含水解酶[AAC(6′)]的耐药;B8 高产头孢菌素酶;D4 喹诺酮类野生型;A6 氨基糖苷类野生型;B9 对抑制剂耐药的青霉素酶(IRT OR OXA)E1耐药;B2 获得性青霉素酶+头孢菌素酶;B11 β-内酰胺类抗生素野生型;E2 甲氧苄啶耐药;B3 获得性青霉素酶;C1 耐药;E3 甲氧苄啶类/复方磺胺野生型。
2.4 产ESBLs肠杆菌科细菌感染的危险因素分析 见表3。经单因素logistic回归分析,年龄、住院次数、性别、抗生素使用情况、感染前的治疗情况、类固醇药物应用、外科手术、侵入性操作、并发症等因素尚不能进入回归模型,即上述因素尚不是ESBLs感染的影响因素。由于单因素logistic回归未发现ESBLs的危险因素,故未能进行多因素logistic回归。
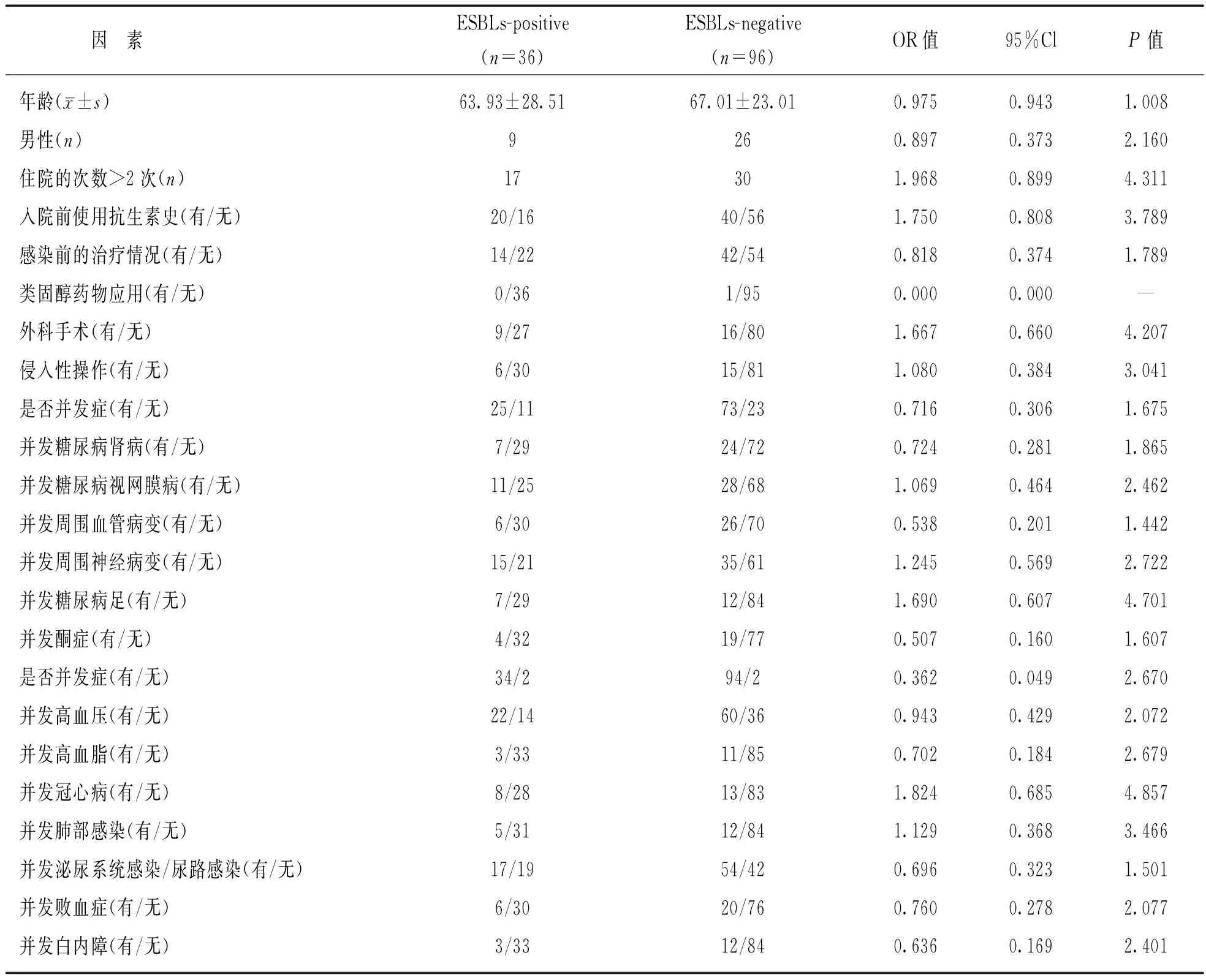
表3产ESBLs肠杆菌科细菌感染的危险因素分析
3 讨论
高血糖是糖尿病患者代谢改变从而造成机体免疫功能下降,并且组织修复能力减弱,极易发生感染。感染是引起糖尿病患者死亡的首要原因,因此及时了解糖尿病患者细菌感染的病原菌分布、耐药性、耐药模式及危险因素对临床及时治疗并选择有效的抗生素至关重要。
本研究中主要病原菌是大肠埃希菌和肺炎克雷伯菌,主要来自泌尿道感染,与常青等[2,3]的研究报道相符。分析其原因可能是糖尿病患者的免疫力下降,使肠道菌群转移到泌尿道定植,从而造成机体发生内源性感染[4~6]。对主要病原菌大肠埃希菌的耐药度监测分析显示,95株大肠埃希菌均对厄他培南、亚胺培南、头孢替坦和哌拉西林/他唑巴坦的敏感度大于98%,对甲氧苄氨嘧啶/新诺明均耐药,与徐学静等[7]的研究相符,所以厄他培南、亚胺培南是产ESBLs菌的首选药物。头孢替坦和哌拉西林/他唑巴坦可作为大肠埃希菌感染的有效药物,特别是产ESBLs的细菌。本资料显示,在95株大肠埃希菌中,产ESBLs大肠埃希菌检出率为32.6%,低于相关文献报道[8~10]。可能与大肠埃希菌感染的标本来源不同及地域性差异有关。
ESBLs是一类能水解一系列β-内酰胺类抗生素的酶,可被舒巴坦等抑制剂所抑制,经质粒介导可在不同细菌间传递,引起医院暴发感染[11,12]。本文中大肠埃希菌是主要的病原菌,其对氨基糖苷类药物的耐药表型有6种,耐药模式11种;对β-内酰胺酶类药物的耐药表型8种,耐药模式7种;对呋喃类药物耐药表型2种,耐药模式3种;对喹诺酮类药物耐药表型4种,耐药模式4种;对甲氧苄啶类/复方磺胺类药物耐药表型3种,耐药模式2种,ESBLs-positive组和ESBLs-negative组主要体现在四种耐药模式上的差异。
本研究发现经单因素logistic回归分析,年龄、住院次数、性别、抗生素使用情况、感染前的治疗情况、类固醇药物应用、外科手术、侵入性操作和并发症等因素不是产ESBLs肠杆菌科细菌感染的影响因素(P>0.05)。ESBLs-positive组和ESBLs-negative组研究对象其性别、平均年龄、糖尿病病程、收缩压和糖化血红蛋白水平差异无统计学意义(P>0.05)。这恰恰印证了糖尿病病人发生感染的原因是多方面的[13]。
综上所述,糖尿病病人发生感染的原因是多方面的,泌尿系统感染较为常见,肠杆菌科细菌感染中又以大肠埃希菌和肺炎克雷伯菌为主。ESBLs-positive组和ESBLs-negative组耐药差异主要表现为四种耐药基因模式的差异。针对细菌耐药度不断增加的严峻形式,应加强和提高感染标本的检出率及药敏监测率,根据药敏结果合理使用抗生素,减少和控制耐药菌的传播和二次感染。

